La proteína reguladora de la transcripción que contiene el dominio WW 1 (WWTR1 [5] ), también conocida como coactivador transcripcional con motivo de unión a PDZ (TAZ), es una proteína que en los humanos está codificada por el gen WWTR1 . WWTR1 actúa como un corregulador transcripcional y no tiene efecto sobre la transcripción sola. [5] Cuando está en complejo con socios de unión de factores de transcripción , WWTR1 ayuda a promover la expresión génica en vías asociadas con el desarrollo , el crecimiento y la supervivencia celular y la inhibición de la apoptosis . [6] La función aberrante de WWTR1 se ha implicado por su papel en el impulso de los cánceres . [7] [8] [9] WWTR1 a menudo se conoce como TAZ debido a su caracterización inicial con el nombre TAZ. Sin embargo, WWTR1 (TAZ) no debe confundirse con la proteína tafazzin , que originalmente tenía el símbolo genético oficial TAZ, y ahora es TAFAZZIN.


WWTR1 contiene una región rica en prolina , motivo de unión TEAD , dominio WW , región de bobina enrollada y un dominio de transactivación (TAD) que contiene el motivo de unión del dominio PDZ . WWTR1 (TAZ) carece de un dominio de unión al ADN , por lo que no puede impulsar directamente la transcripción. WWTR1 exhibe homología estructural conservada con otro corregulador transcripcional, la proteína asociada a yes 1 (YAP) . [5] Tanto YAP como TAZ pueden formar homodímeros y heterodímeros entre sí a través de interacciones en el dominio de bobina enrollada. [12] YAP y TAZ cooperan con factores de transcripción para promover la formación de tejido . WWTR1 (TAZ) interactúa con una variedad de socios transcripcionales, incluidos los cuatro miembros de la familia del dominio TEA ( TEAD1 /2/ 3/ 4 ) a través del motivo de unión a TEAD y varios otros factores que contienen el motivo PPXY, que consiste en una secuencia Prolina - Prolina -X (cualquier aminoácido ) - Tirosina . Entre los ejemplos de dichos socios se incluyen Runx/PEBP2, AP2 , C/EBP, c-Jun , Krox-20 , Krox-24 , MEF2B , NF-E2 , Oct-4 y p73 , que interactúan con WWTR1 a través del dominio WW. [6] Se ha demostrado que el dominio de transactivación en el extremo C-terminal (aminoácidos 165-395) es importante para producir efectos transcripcionales. [6]
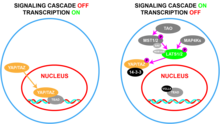
WWTR1 (TAZ) desempeña un papel importante en la embriogénesis y el desarrollo , [13] [14] que incluyen la regulación del tamaño de los órganos, [15] [16] [17] la renovación de células madre , [18] la regeneración tisular , [19] [18] la osteogénesis , [20] y la angiogénesis . [21] Estas funciones se efectúan a través de la coactivación de factores de transcripción que promueven el crecimiento, la migración y la diferenciación celular, [15] [16] [17] como los cuatro miembros de la familia de factores de transcripción TEAD, el gen Paired box 3 (PAX3) y los factores de transcripción relacionados con Runt (RUNX1/) 2 ). [11] Las funciones proliferativas de WWTR1 (TAZ) y su parálogo, YAP, están restringidas por la vía de señalización de Hippo . [22] [23] [24] Esta vía supresora consiste en una cascada de señalización de quinasas, cuyo núcleo está formado por las quinasas serina-treonina , STK3 / MST2 y STK4 / MST1 , que cuando están activas y forman complejos con la proteína reguladora , SAV1 , fosforilan y activan las quinasas LATS1 /2 , que en complejo con la proteína reguladora, MOB1 , fosforilan e inactivan YAP/TAZ. [14] [15] [25] De esta manera, la activación de Hippo detiene el crecimiento celular al disminuir la expresión de genes proliferativos, lo que conduce a una disminución de la muerte celular por ferroptosis [26] [27] y un aumento de la muerte celular por apoptosis . [14] [15]
WWTR1 (TAZ) tiene una secuencia estructural y motivos de unión similares a la proteína asociada a sí 1 (YAP) . [11] YAP y TAZ a menudo se consideran funcionalmente redundantes en la literatura existente. [11] Ambos desempeñan funciones en el desarrollo del tamaño de los órganos, así como en la migración celular , la cicatrización de heridas , la angiogénesis y el metabolismo , particularmente en la lipogénesis . [11] [28] La inactivación de YAP y TAZ ocurre a través de la fosforilación por quinasas en la vía Hippo, a saber, LATS1 y LATS2. [11] Esto recluta la unión de la proteína reguladora, 14-3-3 , que evita que YAP/TAZ se localice en el núcleo y lo marca para la ubiquitinación , lo que permite que sea reconocido para la degradación posterior por los proteasomas . [11]
TAZ es capaz de formar heterodímeros y heterotetrámeros con TEAD para iniciar la transcripción (TAZ-TEAD y TAZ-TEAD-TAZ-TEAD), mientras que YAP solo puede formar heterodímeros YAP-TEAD . [11] Estas diferencias imparten funciones únicas a TAZ, como en la regulación de la diferenciación de adipocitos a través de interacciones con el receptor activado por el proliferador de peroxisomas (PPARγ) , así como la osteogénesis a través de la coactivación transcripcional de factores de transcripción específicos del hueso, como RUNX2 (también conocido como Cbfa1 ). [11] Además, TAZ interactúa de forma independiente con el factor nuclear de células T activadas 5 (NFATC5) para reprimir la transcripción en células renales que están sufriendo estrés osmótico . [11] Tanto YAP como TAZ se asocian con complejos de factores de transcripción de la familia Mothers contra decapentapléjicos (SMAD) para promover la señalización de TGF-beta e impulsar la diferenciación y el desarrollo, pero la regulación positiva de solo TAZ ocurre tras la transducción de esta cascada. [11] TAZ solo puede formar complejos con SMAD2 , SMAD3 o SMAD4 para promover el transporte nuclear y la transcripción, pero YAP también puede interactuar con SMAD1 y SMAD7 además. [11] Estudios murinos in vivo han demostrado que los animales que carecen de TAZ funcional son más viables que los animales que carecen de expresión de YAP. [11] Por el contrario, el silenciamiento de YAP contribuyó a un efecto más dramático en la expansión celular, la captación de glucosa y el arresto del ciclo celular que TAZ. [11] Cuando se analizó en líneas celulares de cáncer de pulmón de células no pequeñas (CPCNP) , WWTR1 mantuvo la organización y adhesión de la matriz extracelular (ECM) , y controló la migración más que YAP, que regulaba más de cerca los genes de la división celular y la progresión del ciclo celular. [11]


WWTR1 se ha relacionado con muchas enfermedades inflamatorias, incluido el cáncer.
WWTR1 (TAZ) está implicado en una amplia variedad de cánceres, incluidos el melanoma, el carcinoma de células escamosas de cabeza y cuello, el cáncer de mama, el cáncer de pulmón de células no pequeñas y otros debido a su alta expresión genética e histológica, así como a la correlación con una mayor metástasis y una peor supervivencia en estudios con animales y datos de pacientes. [9] Junto con el corregulador estructuralmente similar YAP, muchos estudios han descrito su papel en la promoción de la oncogénesis, la alteración del metabolismo neoplásico y la generación de resistencia a la intervención terapéutica. [8] [9] [33] [34] En particular, la sobreexpresión de TAZ confirió resistencia a la quimioterapia con cisplatino , así como al tratamiento de inmunoterapia con un anticuerpo PD-1 . [33]

La función de YAP y TAZ se ha abordado en varios métodos terapéuticos en el tratamiento del cáncer.
El agonista de señalización de Hippo , C19, aumenta la fosforilación de MST1/2 y LATS1/2, lo que resulta en una mayor inactivación descendente de YAP/TAZ. La modulación de la rigidez y la tensión de la matriz extracelular utilizando tiazovivina , cucurbitacina I , dasatinib , fluvastatina y pazopanib , mostró resultados positivos en líneas celulares de cáncer de mama al prevenir la translocación de YAP/WWTR1 al núcleo. [35] También se ha demostrado que los factores hormonales endógenos que se sintetizan para funciones fisiológicas normales, como la epinefrina y el glucagón, tienen efectos inhibidores similares sobre la función de YAP/TAZ al promover la activación de la vía Hippo. [35] Se ha demostrado que la clase de inhibidores del colesterol , las estatinas , inhiben la familia Rho de GTP-asas (Rho-GTPasa) , que son enzimas que señalan la inhibición ascendente de la vía Hippo, y mostraron efectos similares en la atenuación del crecimiento de células de cáncer de mama y adenocarcinoma de pulmón humano. [35] Las estatinas inhiben la 3-hidroxi-3-metil-glutaril-coenzima A reductasa (HMG-CoA reductasa) , que es el precursor del mevalonato en la vía del mevalonato que sintetiza los bloques de construcción de lípidos que forman los colesteroles y las cadenas lipídicas responsables de anclar las Rho-GTPasas a la membrana celular. [9] La Rho-GTPasa, Ras Family Homolog A (RhoA) , se activa por prenilación (la modificación postraduccional a través de la adición de grupos hidrofóbicos ), y es responsable en parte de modular los elementos del citoesqueleto que reducen la actividad de la vía Hippo. [9] Al dirigirse a las quinasas Rho con tiazovivina, o la síntesis de lípidos a través de la vía del mevalonato, con estatinas, se inhibe la RhoA y el aumento de la actividad de la quinasa Hippo puede limitar la proliferación impulsada por YAP/TAZ. [9] [35] Las quinasas de tirosina envían señales en vías proliferativas, algunas de las cuales promueven la función YAP/TAZ, como las quinasas de la familia Src e incluyen la quinasa de tirosina Yes, que está asociada con la función YAP. Dirigir las quinasas de tirosina con inhibidores como dasatinib y pazopanib ha demostrado algún efecto en los cánceres. [9]
También se ha estudiado la inhibición de la función de YAP/TAZ al apuntar a sus interacciones con sus socios transcripcionales en la familia TEAD. [35] [36] Esto incluye el uso de verteporfina , que se investigó en el tratamiento de cánceres de piel, particularmente melanoma, aunque no se llevó más allá de los estudios preclínicos. [35]