
Los fagocitos son células que protegen al cuerpo ingiriendo partículas extrañas dañinas, bacterias y células muertas o moribundas . Su nombre proviene del griego phagein , "comer" o "devorar", y "-cito", el sufijo en biología que denota "célula", del griego kutos, "vaso hueco". Son esenciales para combatir infecciones y para la inmunidad posterior . Los fagocitos son importantes en todo el reino animal [1] y están muy desarrollados en los vertebrados. [2] Un litro de sangre humana contiene alrededor de seis mil millones de fagocitos. [3] Fueron descubiertos en 1882 por Ilya Ilyich Mechnikov mientras estudiaba larvas de estrellas de mar . [4] Mechnikov recibió el Premio Nobel de Fisiología o Medicina de 1908 por su descubrimiento. [5] Los fagocitos se encuentran en muchas especies; algunas amebas se comportan como fagocitos de macrófagos, lo que sugiere que los fagocitos aparecieron temprano en la evolución de la vida. [6]
Los fagocitos de los seres humanos y otros animales se denominan "profesionales" o "no profesionales" según su eficacia en la fagocitosis . [7] Los fagocitos profesionales incluyen muchos tipos de glóbulos blancos (como neutrófilos , monocitos , macrófagos , mastocitos y células dendríticas ). [8] La principal diferencia entre los fagocitos profesionales y los no profesionales es que los fagocitos profesionales tienen moléculas llamadas receptores en sus superficies que pueden detectar objetos dañinos, como bacterias, que normalmente no se encuentran en el cuerpo. Los fagocitos no profesionales no tienen receptores fagocíticos eficientes, como los de las opsoninas . [9] Los fagocitos son cruciales para combatir las infecciones, así como para mantener los tejidos sanos eliminando las células muertas y moribundas que han llegado al final de su vida útil. [10]
Durante una infección, las señales químicas atraen a los fagocitos a los lugares donde el patógeno ha invadido el cuerpo. Estos químicos pueden provenir de bacterias o de otros fagocitos ya presentes. Los fagocitos se mueven mediante un método llamado quimiotaxis . Cuando los fagocitos entran en contacto con las bacterias, los receptores en la superficie del fagocito se unirán a ellas. Esta unión conducirá a la engullición de la bacteria por el fagocito. [11] Algunos fagocitos matan al patógeno ingerido con oxidantes y óxido nítrico . [12] Después de la fagocitosis, los macrófagos y las células dendríticas también pueden participar en la presentación de antígenos , un proceso en el que un fagocito mueve partes del material ingerido de regreso a su superficie. Este material luego se muestra a otras células del sistema inmunológico. Algunos fagocitos luego viajan a los ganglios linfáticos del cuerpo y muestran el material a los glóbulos blancos llamados linfocitos . Este proceso es importante para desarrollar inmunidad, [13] y muchos patógenos han desarrollado métodos para evadir los ataques de los fagocitos. [14]

El zoólogo ruso Ilya Ilyich Mechnikov (1845-1916) fue el primero en reconocer que las células especializadas participaban en la defensa contra las infecciones microbianas. [15] En 1882, estudió células móviles (que se mueven libremente) en las larvas de estrellas de mar , creyendo que eran importantes para las defensas inmunológicas de los animales. Para probar su idea, insertó pequeñas espinas de un árbol de mandarina en las larvas. Después de unas horas, notó que las células móviles habían rodeado las espinas. [15] Mechnikov viajó a Viena y compartió sus ideas con Carl Friedrich Claus , quien sugirió el nombre "fagocito" (de las palabras griegas phagein , que significa "comer o devorar", y kutos , que significa "vasija hueca" [16] ) para las células que Mechnikov había observado. [17]
Un año después, Mechnikov estudió un crustáceo de agua dulce llamado Daphnia , un animal diminuto y transparente que puede examinarse directamente con un microscopio. Descubrió que las esporas de hongos que atacaban al animal eran destruidas por los fagocitos. Luego extendió sus observaciones a los glóbulos blancos de los mamíferos y descubrió que la bacteria Bacillus anthracis podía ser engullida y eliminada por los fagocitos, un proceso que llamó fagocitosis . [18] Mechnikov propuso que los fagocitos eran una defensa primaria contra los organismos invasores. [15]
En 1903, Almroth Wright descubrió que la fagocitosis era reforzada por anticuerpos específicos que llamó opsoninas , del griego opson , "un aderezo o condimento". [19] Mechnikov fue galardonado (junto con Paul Ehrlich ) con el Premio Nobel de Fisiología o Medicina de 1908 por su trabajo sobre los fagocitos y la fagocitosis. [5]
Aunque la importancia de estos descubrimientos fue ganando aceptación lentamente a principios del siglo XX, las intrincadas relaciones entre los fagocitos y todos los demás componentes del sistema inmunológico no se conocieron hasta la década de 1980. [20]
![Dibujo animado: 1. La partícula está representada por un óvalo y la superficie del fagocito por una línea recta. Diferentes formas más pequeñas se encuentran sobre la línea y el óvalo. 2. Las partículas más pequeñas en cada superficie se unen. 3. La línea ahora es cóncava y envuelve parcialmente el óvalo.[21]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Phagocytosis_in_three_steps.png/220px-Phagocytosis_in_three_steps.png)
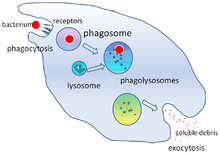
La fagocitosis es el proceso de absorción de partículas como bacterias, hongos invasores , parásitos, células huésped muertas y desechos celulares y extraños por una célula. [22] Implica una cadena de procesos moleculares. [23] [24] La fagocitosis ocurre después de que el cuerpo extraño, una célula bacteriana, por ejemplo, se ha unido a moléculas llamadas "receptores" que están en la superficie del fagocito. El fagocito luego se estira alrededor de la bacteria y la envuelve. La fagocitosis de bacterias por neutrófilos humanos toma en promedio nueve minutos. [25] Una vez dentro de este fagocito, la bacteria queda atrapada en un compartimento llamado fagosoma . En un minuto, el fagosoma se fusiona con un lisosoma o un gránulo para formar un fagolisosoma . Luego, la bacteria se somete a una abrumadora variedad de mecanismos de muerte [26] y muere unos minutos después. [25] Las células dendríticas y los macrófagos no son tan rápidos, y la fagocitosis puede llevar muchas horas en estas células. Los macrófagos son comedores lentos y desordenados; engullen enormes cantidades de material y con frecuencia liberan parte sin digerir de nuevo a los tejidos. Estos desechos sirven como señal para reclutar más fagocitos de la sangre. [27] Los fagocitos tienen apetitos voraces; los científicos incluso han alimentado a los macrófagos con limaduras de hierro y luego han utilizado un pequeño imán para separarlos de otras células. [28]

Un fagocito tiene muchos tipos de receptores en su superficie que se utilizan para unir material. [14] Incluyen receptores de opsonina , receptores carroñeros y receptores tipo Toll . Los receptores de opsonina aumentan la fagocitosis de las bacterias que han sido recubiertas con anticuerpos de inmunoglobulina G (IgG) o con complemento . "Complemento" es el nombre que se le da a una serie compleja de moléculas de proteína que se encuentran en la sangre y que destruyen células o las marcan para su destrucción. [29] Los receptores carroñeros se unen a una amplia gama de moléculas en la superficie de las células bacterianas, y los receptores tipo Toll, llamados así por su similitud con los receptores bien estudiados en las moscas de la fruta que están codificados por el gen Toll, se unen a moléculas más específicas, incluido el ADN y el ARN extraños. [30] La unión a los receptores tipo Toll aumenta la fagocitosis y hace que el fagocito libere un grupo de hormonas que causan inflamación . [14]
La eliminación de microbios es una función crítica de los fagocitos que se realiza dentro del fagocito ( eliminación intracelular ) o fuera del fagocito ( eliminación extracelular ). [31]
Cuando un fagocito ingiere bacterias (o cualquier material), su consumo de oxígeno aumenta. El aumento en el consumo de oxígeno, llamado estallido respiratorio , produce moléculas reactivas que contienen oxígeno y que son antimicrobianas. [32] Los compuestos de oxígeno son tóxicos tanto para el invasor como para la propia célula, por lo que se mantienen en compartimentos dentro de la célula. Este método de matar microbios invasores mediante el uso de moléculas reactivas que contienen oxígeno se conoce como muerte intracelular dependiente del oxígeno, de la cual existen dos tipos. [12]
El primer tipo es la producción dependiente del oxígeno de un superóxido , [14] que es una sustancia rica en oxígeno que mata bacterias. [33] El superóxido se convierte en peróxido de hidrógeno y oxígeno singlete por una enzima llamada superóxido dismutasa . Los superóxidos también reaccionan con el peróxido de hidrógeno para producir radicales hidroxilo , que ayudan a matar al microbio invasor. [14]
El segundo tipo implica el uso de la enzima mieloperoxidasa de los gránulos de neutrófilos. [34] Cuando los gránulos se fusionan con un fagosoma, la mieloperoxidasa se libera en el fagolisosoma, y esta enzima utiliza peróxido de hidrógeno y cloro para crear hipoclorito , una sustancia utilizada en la lejía doméstica . El hipoclorito es extremadamente tóxico para las bacterias. [14] La mieloperoxidasa contiene un pigmento hemo , que explica el color verde de las secreciones ricas en neutrófilos, como el pus y el esputo infectado . [35]

Los fagocitos también pueden matar microbios mediante métodos independientes del oxígeno, pero estos no son tan efectivos como los que dependen del oxígeno. Hay cuatro tipos principales. El primero utiliza proteínas cargadas eléctricamente que dañan la membrana de la bacteria . El segundo tipo utiliza lisozimas; estas enzimas descomponen la pared celular bacteriana . El tercer tipo utiliza lactoferrinas , que están presentes en los gránulos de los neutrófilos y eliminan el hierro esencial de las bacterias. [36] El cuarto tipo utiliza proteasas y enzimas hidrolíticas ; estas enzimas se utilizan para digerir las proteínas de las bacterias destruidas. [37]
El interferón gamma , que antes se denominaba factor activador de los macrófagos, estimula a los macrófagos para que produzcan óxido nítrico . La fuente de interferón gamma pueden ser las células T CD4 + , las células T CD8 + , las células asesinas naturales , las células B , las células T asesinas naturales , los monocitos, otros macrófagos o las células dendríticas. [38] A continuación, el macrófago libera óxido nítrico y, debido a su toxicidad, mata a los microbios cerca del macrófago. [14] Los macrófagos activados producen y secretan factor de necrosis tumoral . Esta citocina , una clase de molécula de señalización [39], mata las células cancerosas y las células infectadas por virus, y ayuda a activar las demás células del sistema inmunitario. [40]
En algunas enfermedades, por ejemplo, la rara enfermedad granulomatosa crónica , la eficiencia de los fagocitos se ve afectada y las infecciones bacterianas recurrentes son un problema. [41] En esta enfermedad hay una anomalía que afecta a diferentes elementos de la eliminación dependiente del oxígeno. Otras anomalías congénitas raras, como el síndrome de Chédiak-Higashi , también se asocian con una eliminación defectuosa de los microbios ingeridos. [42]
Los virus sólo pueden reproducirse dentro de las células y pueden entrar utilizando muchos de los receptores implicados en la inmunidad. Una vez dentro de la célula, los virus utilizan la maquinaria biológica de la célula en su propio beneficio, obligando a la célula a hacer cientos de copias idénticas de sí mismos. Aunque los fagocitos y otros componentes del sistema inmunitario innato pueden, hasta cierto punto, controlar los virus, una vez que un virus está dentro de una célula, las respuestas inmunitarias adaptativas, en particular los linfocitos, son más importantes para la defensa. [43] En los sitios de infecciones virales, los linfocitos a menudo superan en número a todas las demás células del sistema inmunitario; esto es común en la meningitis viral . [44] Las células infectadas por virus que han sido eliminadas por los linfocitos son eliminadas del cuerpo por los fagocitos. [45]
En un animal, las células mueren constantemente. Un equilibrio entre la división celular y la muerte celular mantiene el número de células relativamente constante en los adultos. [10] Hay dos formas diferentes en que una célula puede morir: por necrosis o por apoptosis. A diferencia de la necrosis, que a menudo es consecuencia de una enfermedad o un traumatismo, la apoptosis (o muerte celular programada ) es una función normal y saludable de las células. El cuerpo tiene que deshacerse de millones de células muertas o moribundas todos los días, y los fagocitos desempeñan un papel crucial en este proceso. [46]
Las células moribundas que pasan por las etapas finales de la apoptosis [47] muestran moléculas, como la fosfatidilserina , en su superficie celular para atraer a los fagocitos. [48] La fosfatidilserina se encuentra normalmente en la superficie citosólica de la membrana plasmática, pero se redistribuye durante la apoptosis a la superficie extracelular por una proteína conocida como scramblase . [49] [50] Estas moléculas marcan la célula para la fagocitosis por células que poseen los receptores apropiados, como los macrófagos. [51] La eliminación de células moribundas por los fagocitos se produce de forma ordenada sin provocar una respuesta inflamatoria y es una función importante de los fagocitos. [52]
Los fagocitos no suelen estar ligados a ningún órgano en particular , sino que se desplazan por el cuerpo interactuando con otras células fagocíticas y no fagocíticas del sistema inmunitario. Pueden comunicarse con otras células produciendo sustancias químicas llamadas citocinas , que reclutan a otros fagocitos al lugar de las infecciones o estimulan a los linfocitos latentes . [53] Los fagocitos forman parte del sistema inmunitario innato , con el que nacen los animales, incluidos los humanos. La inmunidad innata es muy eficaz, pero no específica, ya que no discrimina entre diferentes tipos de invasores. Por otro lado, el sistema inmunitario adaptativo de los vertebrados con mandíbulas (la base de la inmunidad adquirida) está altamente especializado y puede proteger contra casi cualquier tipo de invasor. [54] El sistema inmunitario adaptativo no depende de los fagocitos, sino de los linfocitos, que producen proteínas protectoras llamadas anticuerpos , que marcan a los invasores para destruirlos y evitan que los virus infecten las células. [55] Los fagocitos, en particular las células dendríticas y los macrófagos, estimulan a los linfocitos a producir anticuerpos mediante un proceso importante llamado presentación de antígenos . [56]

La presentación de antígenos es un proceso en el que algunos fagocitos mueven partes de los materiales engullidos de vuelta a la superficie de sus células y los "presentan" a otras células del sistema inmunológico. [57] Hay dos células presentadoras de antígenos "profesionales": los macrófagos y las células dendríticas. [58] Después de la engullido, las proteínas extrañas (los antígenos ) se descomponen en péptidos dentro de las células dendríticas y los macrófagos. Estos péptidos se unen a las glicoproteínas del complejo principal de histocompatibilidad (MHC) de la célula, que llevan los péptidos de vuelta a la superficie del fagocito donde pueden ser "presentados" a los linfocitos. [13] Los macrófagos maduros no viajan lejos del sitio de la infección, pero las células dendríticas pueden llegar a los ganglios linfáticos del cuerpo , donde hay millones de linfocitos. [59] Esto mejora la inmunidad porque los linfocitos responden a los antígenos presentados por las células dendríticas tal como lo harían en el sitio de la infección original. [60] Pero las células dendríticas también pueden destruir o apaciguar a los linfocitos si reconocen componentes del organismo huésped; esto es necesario para prevenir reacciones autoinmunes. Este proceso se denomina tolerancia. [61]
Las células dendríticas también promueven la tolerancia inmunológica, [62] que evita que el cuerpo se ataque a sí mismo. El primer tipo de tolerancia es la tolerancia central , que se produce en el timo. Las células T que se unen (a través de su receptor de células T) al antígeno propio (presentado por las células dendríticas en las moléculas del CMH) con demasiada fuerza son inducidas a morir. El segundo tipo de tolerancia inmunológica es la tolerancia periférica . Algunas células T autorreactivas escapan del timo por diversas razones, principalmente debido a la falta de expresión de algunos antígenos propios en el timo. Otro tipo de célula T; las células T reguladoras pueden regular a la baja las células T autorreactivas en la periferia. [63] Cuando la tolerancia inmunológica falla, pueden aparecer enfermedades autoinmunes . [64]

Los fagocitos de los humanos y otros vertebrados con mandíbulas se dividen en grupos "profesionales" y "no profesionales" según la eficiencia con la que participan en la fagocitosis. [7] Los fagocitos profesionales son las células mieloides , que incluyen monocitos , macrófagos , neutrófilos , células dendríticas tisulares y mastocitos . [8] Un litro de sangre humana contiene alrededor de seis mil millones de fagocitos. [3]
Todos los fagocitos, y especialmente los macrófagos, existen en distintos grados de preparación. Los macrófagos suelen estar relativamente inactivos en los tejidos y proliferan lentamente. En este estado de semidescanso, eliminan las células huésped muertas y otros restos no infecciosos y rara vez participan en la presentación de antígenos. Pero, durante una infección, reciben señales químicas (normalmente interferón gamma ) que aumentan su producción de moléculas MHC II y los preparan para presentar antígenos. En este estado, los macrófagos son buenos presentadores y asesinos de antígenos. Si reciben una señal directamente de un invasor, se vuelven "hiperactivados", dejan de proliferar y se concentran en matar. Su tamaño y tasa de fagocitosis aumentan; algunos se vuelven lo suficientemente grandes como para engullir protozoos invasores . [65]
En la sangre, los neutrófilos están inactivos, pero son arrastrados a gran velocidad. Cuando reciben señales de los macrófagos en los sitios de inflamación, disminuyen su velocidad y abandonan la sangre. En los tejidos, son activados por las citocinas y llegan al lugar de la batalla dispuestos a matar. [66]

Cuando se produce una infección, se emite una señal química de "SOS" para atraer a los fagocitos al sitio. [67] Estas señales químicas pueden incluir proteínas de bacterias invasoras, péptidos del sistema de coagulación , productos del complemento y citocinas que han sido emitidas por macrófagos ubicados en el tejido cerca del sitio de la infección. [14] Otro grupo de atrayentes químicos son las citocinas que reclutan neutrófilos y monocitos de la sangre. [11]
Para llegar al lugar de la infección, los fagocitos abandonan el torrente sanguíneo y entran en los tejidos afectados. Las señales de la infección hacen que las células endoteliales que recubren los vasos sanguíneos produzcan una proteína llamada selectina , a la que se adhieren los neutrófilos al pasar por allí. Otras señales llamadas vasodilatadores aflojan las uniones que conectan las células endoteliales, lo que permite que los fagocitos atraviesen la pared. La quimiotaxis es el proceso por el cual los fagocitos siguen el "olor" de las citocinas hasta el lugar infectado. [14] Los neutrófilos viajan a través de los órganos revestidos de células epiteliales hasta los lugares de la infección y, aunque este es un componente importante para combatir la infección, la migración en sí misma puede provocar síntomas similares a los de la enfermedad. [68] Durante una infección, se reclutan millones de neutrófilos de la sangre, pero mueren después de unos días. [69]
.jpg/440px-Monocytes,_a_type_of_white_blood_cell_(Giemsa_stained).jpg)
Los monocitos se desarrollan en la médula ósea y alcanzan la madurez en la sangre. Los monocitos maduros tienen núcleos grandes, lisos y lobulados y un citoplasma abundante que contiene gránulos. Los monocitos ingieren sustancias extrañas o peligrosas y presentan antígenos a otras células del sistema inmunitario. Los monocitos forman dos grupos: un grupo circulante y un grupo marginal que permanece en otros tejidos (aproximadamente el 70% se encuentra en el grupo marginal). La mayoría de los monocitos abandonan el torrente sanguíneo después de 20 a 40 horas para viajar a los tejidos y órganos y, al hacerlo, se transforman en macrófagos [70] o células dendríticas según las señales que reciben [ 71] . Hay alrededor de 500 millones de monocitos en un litro de sangre humana [3] .

Los macrófagos maduros no viajan lejos, pero vigilan las áreas del cuerpo que están expuestas al mundo exterior. Allí actúan como recolectores de basura, células presentadoras de antígenos o asesinos feroces, según las señales que reciben. [72] Derivan de monocitos, células madre de granulocitos o de la división celular de macrófagos preexistentes. [73] Los macrófagos humanos miden aproximadamente 21 micrómetros de diámetro. [74]

Este tipo de fagocito no tiene gránulos pero contiene muchos lisosomas . Los macrófagos se encuentran en todo el cuerpo en casi todos los tejidos y órganos (por ejemplo, células microgliales en el cerebro y macrófagos alveolares en los pulmones ), donde acechan silenciosamente. La ubicación de un macrófago puede determinar su tamaño y apariencia. Los macrófagos causan inflamación a través de la producción de interleucina-1 , interleucina-6 y TNF-alfa . [75] Los macrófagos generalmente solo se encuentran en el tejido y rara vez se ven en la circulación sanguínea. Se ha estimado que la vida útil de los macrófagos tisulares varía de cuatro a quince días. [76]
Los macrófagos pueden activarse para realizar funciones que un monocito en reposo no puede. [75] Las células T colaboradoras (también conocidas como células T efectoras o células Th ), un subgrupo de linfocitos, son responsables de la activación de los macrófagos. Las células Th 1 activan los macrófagos mediante la señalización con IFN-gamma y mostrando el ligando de la proteína CD40 . [77] Otras señales incluyen TNF-alfa y lipopolisacáridos de las bacterias. [75] Las células Th 1 pueden reclutar otros fagocitos al sitio de la infección de varias maneras. Secretan citocinas que actúan sobre la médula ósea para estimular la producción de monocitos y neutrófilos, y secretan algunas de las citocinas que son responsables de la migración de monocitos y neutrófilos fuera del torrente sanguíneo. [78] Las células Th 1 provienen de la diferenciación de las células T CD4 + una vez que han respondido al antígeno en los tejidos linfoides secundarios . [75] Los macrófagos activados desempeñan un papel importante en la destrucción de tumores al producir TNF-alfa, IFN-gamma, óxido nítrico, compuestos reactivos de oxígeno, proteínas catiónicas y enzimas hidrolíticas. [75]

Los neutrófilos se encuentran normalmente en el torrente sanguíneo y son el tipo de fagocito más abundante, constituyendo del 50% al 60% del total de glóbulos blancos circulantes. [79] Un litro de sangre humana contiene alrededor de cinco mil millones de neutrófilos, [3] que tienen alrededor de 10 micrómetros de diámetro [80] y viven solo unos cinco días. [40] Una vez que han recibido las señales apropiadas, les toma alrededor de treinta minutos salir de la sangre y llegar al sitio de una infección. [81] Son comedores feroces y rápidamente engullen a los invasores recubiertos con anticuerpos y complemento , y células dañadas o restos celulares. Los neutrófilos no regresan a la sangre; se convierten en células de pus y mueren. [81] Los neutrófilos maduros son más pequeños que los monocitos y tienen un núcleo segmentado con varias secciones; cada sección está conectada por filamentos de cromatina : los neutrófilos pueden tener de 2 a 5 segmentos. Los neutrófilos normalmente no salen de la médula ósea hasta la madurez, pero durante una infección se liberan precursores de neutrófilos llamados metamielocitos , mielocitos y promielocitos . [82]
Los gránulos intracelulares de los neutrófilos humanos han sido reconocidos desde hace mucho tiempo por sus propiedades bactericidas y destructoras de proteínas. [83] Los neutrófilos pueden secretar productos que estimulan a los monocitos y macrófagos. Las secreciones de los neutrófilos aumentan la fagocitosis y la formación de compuestos reactivos de oxígeno involucrados en la muerte intracelular. [84] Las secreciones de los gránulos primarios de los neutrófilos estimulan la fagocitosis de las bacterias recubiertas de anticuerpos IgG . [85] Cuando entran en contacto con bacterias, hongos o plaquetas activadas, producen estructuras de cromatina en forma de red conocidas como trampas extracelulares de neutrófilos (NET). Compuestas principalmente de ADN, las NET causan la muerte mediante un proceso llamado netosis: después de que los patógenos quedan atrapados en las NET, mueren mediante mecanismos oxidativos y no oxidativos. [86]

Las células dendríticas son células especializadas presentadoras de antígenos que tienen largas excrecencias llamadas dendritas, [87] que ayudan a engullir microbios y otros invasores. [88] [89] Las células dendríticas están presentes en los tejidos que están en contacto con el ambiente externo, principalmente la piel, el revestimiento interno de la nariz, los pulmones, el estómago y los intestinos. [90] Una vez activadas, maduran y migran a los tejidos linfoides donde interactúan con las células T y las células B para iniciar y orquestar la respuesta inmune adaptativa. [91] Las células dendríticas maduras activan las células T auxiliares y las células T citotóxicas . [92] Las células T auxiliares activadas interactúan con los macrófagos y las células B para activarlas a su vez. Además, las células dendríticas pueden influir en el tipo de respuesta inmune producida; cuando viajan a las áreas linfoides donde se encuentran las células T, pueden activar las células T, que luego se diferencian en células T citotóxicas o células T auxiliares. [88]
Los mastocitos tienen receptores tipo Toll e interactúan con células dendríticas, células B y células T para ayudar a mediar funciones inmunes adaptativas. [93] Los mastocitos expresan moléculas MHC de clase II y pueden participar en la presentación de antígenos; sin embargo, el papel del mastocitos en la presentación de antígenos no se entiende muy bien. [94] Los mastocitos pueden consumir y matar bacterias gramnegativas (p. ej., salmonela ) y procesar sus antígenos. [95] Se especializan en procesar las proteínas fimbriales en la superficie de las bacterias, que están involucradas en la adhesión a los tejidos. [96] [97] Además de estas funciones, los mastocitos producen citocinas que inducen una respuesta inflamatoria. [98] Esta es una parte vital de la destrucción de microbios porque las citocinas atraen más fagocitos al sitio de la infección. [95] [99]
Las células moribundas y los organismos extraños son consumidos por células distintas a los fagocitos "profesionales". [101] Estas células incluyen células epiteliales , células endoteliales , fibroblastos , melanocitos y células mesenquimales. Se les llama fagocitos no profesionales, para enfatizar que, a diferencia de los fagocitos profesionales, la fagocitosis no es su función principal. [102] Los fibroblastos, por ejemplo, que pueden fagocitar colágeno en el proceso de remodelación de cicatrices, también harán algún intento de ingerir partículas extrañas. [103]
Los fagocitos no profesionales tienen más limitaciones que los profesionales en cuanto al tipo de partículas que pueden captar. Esto se debe a su falta de receptores fagocíticos eficientes, en particular las opsoninas , que son anticuerpos y complementos que el sistema inmunitario une a los invasores. [9] Además, la mayoría de los fagocitos no profesionales no producen moléculas reactivas que contengan oxígeno en respuesta a la fagocitosis. [104]

Un patógeno sólo puede infectar a un organismo si logra superar sus defensas. Las bacterias y los protozoos patógenos han desarrollado una variedad de métodos para resistir los ataques de los fagocitos, y muchos de ellos sobreviven y se replican dentro de las células fagocíticas. [107] [108]
Existen varias formas en las que las bacterias evitan el contacto con los fagocitos. En primer lugar, pueden crecer en sitios a los que los fagocitos no son capaces de viajar (por ejemplo, la superficie de la piel intacta). En segundo lugar, las bacterias pueden suprimir la respuesta inflamatoria ; sin esta respuesta a la infección, los fagocitos no pueden responder adecuadamente. En tercer lugar, algunas especies de bacterias pueden inhibir la capacidad de los fagocitos de viajar al sitio de la infección al interferir con la quimiotaxis. [107 ] En cuarto lugar, algunas bacterias pueden evitar el contacto con los fagocitos engañando al sistema inmunológico para que "piense" que las bacterias son "propias". Treponema pallidum , la bacteria que causa la sífilis , se esconde de los fagocitos recubriendo su superficie con fibronectina , [109] que el cuerpo produce de forma natural y desempeña un papel crucial en la cicatrización de heridas . [110]
Las bacterias a menudo producen cápsulas hechas de proteínas o azúcares que recubren sus células e interfieren con la fagocitosis. [107] Algunos ejemplos son la cápsula K5 y el antígeno O75 O que se encuentran en la superficie de Escherichia coli , [111] y las cápsulas de exopolisacáridos de Staphylococcus epidermidis . [112] Streptococcus pneumoniae produce varios tipos de cápsula que proporcionan diferentes niveles de protección, [113] y los estreptococos del grupo A producen proteínas como la proteína M y las proteínas fimbriales para bloquear la fagocitosis. Algunas proteínas impiden la ingestión relacionada con la opsonina; Staphylococcus aureus produce proteína A para bloquear los receptores de anticuerpos, lo que disminuye la eficacia de las opsoninas. [114] Las especies enteropatógenas del género Yersinia se unen con el uso del factor de virulencia YopH a los receptores de los fagocitos desde los cuales influyen en la capacidad de las células para ejercer la fagocitosis. [115]

Las bacterias han desarrollado formas de sobrevivir dentro de los fagocitos, donde continúan evadiendo el sistema inmunológico. [116] Para llegar de forma segura al interior del fagocito, expresan proteínas llamadas invasinas . Cuando están dentro de la célula, permanecen en el citoplasma y evitan los productos químicos tóxicos contenidos en los fagolisosomas. [117] Algunas bacterias impiden la fusión de un fagosoma y un lisosoma para formar el fagolisosoma. [107] Otros patógenos, como Leishmania , crean una vacuola altamente modificada dentro del fagocito, que les ayuda a persistir y replicarse. [118] Algunas bacterias son capaces de vivir dentro del fagolisosoma. Staphylococcus aureus , por ejemplo, produce las enzimas catalasa y superóxido dismutasa , que descomponen los productos químicos (como el peróxido de hidrógeno) producidos por los fagocitos para matar las bacterias. [119] Las bacterias pueden escapar del fagosoma antes de la formación del fagolisosoma: Listeria monocytogenes puede hacer un agujero en la pared del fagosoma utilizando enzimas llamadas listeriolisina O y fosfolipasa C. [ 120] M. tuberculosis infecta a los neutrófilos que a su vez son ingeridos por los macrófagos y, por lo tanto, también infectan a estos últimos. [121] M. leprae infecta a los macrófagos , las células de Schwann y los neutrófilos . [121]
Las bacterias han desarrollado varias formas de matar a los fagocitos. [114] Estas incluyen citolisinas , que forman poros en las membranas celulares del fagocito, estreptolisinas y leucocidinas , que hacen que los gránulos de los neutrófilos se rompan y liberen sustancias tóxicas, [122] [123] y exotoxinas que reducen el suministro de ATP de un fagocito , necesario para la fagocitosis. Después de que se ingiere una bacteria, puede matar al fagocito liberando toxinas que viajan a través del fagosoma o la membrana del fagolisosoma para dirigirse a otras partes de la célula. [107]
Algunas estrategias de supervivencia a menudo implican la interrupción de las citocinas y otros métodos de señalización celular para evitar que el fagocito responda a la invasión. [124] Los parásitos protozoarios Toxoplasma gondii , Trypanosoma cruzi y Leishmania infectan a los macrófagos, y cada uno tiene una forma única de domesticarlos. [124] Algunas especies de Leishmania alteran la señalización del macrófago infectado, reprimen la producción de citocinas y moléculas microbicidas (óxido nítrico y especies reactivas de oxígeno) y comprometen la presentación de antígenos. [125]
Los macrófagos y los neutrófilos, en particular, desempeñan un papel central en el proceso inflamatorio al liberar proteínas y mediadores inflamatorios de moléculas pequeñas que controlan la infección pero pueden dañar el tejido del huésped. En general, los fagocitos tienen como objetivo destruir los patógenos envolviéndolos y sometiéndolos a una batería de sustancias químicas tóxicas dentro de un fagolisosoma . Si un fagocito no logra engullir su objetivo, estos agentes tóxicos pueden liberarse al medio ambiente (una acción conocida como "fagocitosis frustrada"). Como estos agentes también son tóxicos para las células del huésped, pueden causar daños importantes a las células y tejidos sanos. [126]
Cuando los neutrófilos liberan el contenido de sus gránulos en el riñón , el contenido del gránulo (compuestos reactivos de oxígeno y proteasas) degrada la matriz extracelular de las células huésped y puede causar daño a las células glomerulares , afectando su capacidad para filtrar la sangre y causando cambios en la forma. Además, los productos de la fosfolipasa (p. ej., leucotrienos ) intensifican el daño. Esta liberación de sustancias promueve la quimiotaxis de más neutrófilos al sitio de la infección, y las células glomerulares pueden resultar dañadas aún más por las moléculas de adhesión durante la migración de los neutrófilos. La lesión causada a las células glomerulares puede causar insuficiencia renal . [127]
Los neutrófilos también juegan un papel clave en el desarrollo de la mayoría de las formas de lesión pulmonar aguda . [128] Aquí, los neutrófilos activados liberan el contenido de sus gránulos tóxicos en el entorno pulmonar. [129] Los experimentos han demostrado que una reducción en el número de neutrófilos disminuye los efectos de la lesión pulmonar aguda, [130] pero el tratamiento mediante la inhibición de los neutrófilos no es clínicamente realista, ya que dejaría al huésped vulnerable a la infección. [129] En el hígado , el daño causado por los neutrófilos puede contribuir a la disfunción y la lesión en respuesta a la liberación de endotoxinas producidas por bacterias, sepsis , trauma, hepatitis alcohólica , isquemia y shock hipovolémico resultante de una hemorragia aguda . [131]
Las sustancias químicas liberadas por los macrófagos también pueden dañar el tejido del huésped. El TNF-α es una sustancia química importante que liberan los macrófagos y que hace que la sangre de los vasos pequeños se coagule para evitar que se propague una infección. [132] Si una infección bacteriana se propaga a la sangre, el TNF-α se libera en los órganos vitales, lo que puede causar vasodilatación y una disminución del volumen plasmático ; estos a su vez pueden ir seguidos de un choque séptico . Durante el choque séptico, la liberación de TNF-α provoca un bloqueo de los vasos pequeños que suministran sangre a los órganos vitales, y los órganos pueden fallar. El choque séptico puede provocar la muerte. [11]
_(52606801786).jpg/440px-Streptococcus_Pyogenes_(Group_A_Strep)_(52606801786).jpg)
La fagocitosis es común y probablemente apareció temprano en la evolución , [133] evolucionando primero en eucariotas unicelulares. [134] Las amebas son protistas unicelulares que se separaron del árbol dando lugar a metazoos poco después de la divergencia de las plantas, y comparten muchas funciones específicas con las células fagocíticas de los mamíferos. [134] Dictyostelium discoideum , por ejemplo, es una ameba que vive en el suelo y se alimenta de bacterias. Al igual que los fagocitos animales, engulle bacterias por fagocitosis principalmente a través de receptores tipo Toll, y tiene otras funciones biológicas en común con los macrófagos. [135] Dictyostelium discoideum es social; se agrega cuando está hambriento para formar un pseudoplasmodio o babosa migratoria . Este organismo multicelular eventualmente producirá un cuerpo fructífero con esporas que son resistentes a los peligros ambientales. Antes de la formación de los cuerpos fructíferos, las células migrarán como un organismo similar a una babosa durante varios días. Durante este tiempo, la exposición a toxinas o patógenos bacterianos tiene el potencial de comprometer la supervivencia de la especie al limitar la producción de esporas. Algunas de las amebas engullen bacterias y absorben toxinas mientras circulan dentro de la babosa, y estas amebas eventualmente mueren. Son genéticamente idénticas a las otras amebas en la babosa; su autosacrificio para proteger a las otras amebas de las bacterias es similar al autosacrificio de los fagocitos observado en el sistema inmunológico de los vertebrados superiores. Esta antigua función inmunológica en las amebas sociales sugiere un mecanismo de búsqueda de alimento celular conservado evolutivamente que podría haber sido adaptado a funciones de defensa mucho antes de la diversificación de las amebas en formas superiores. [136] Los fagocitos se encuentran en todo el reino animal, [1] desde las esponjas marinas hasta los insectos y los vertebrados inferiores y superiores. [137] [138] La capacidad de las amebas de distinguir entre lo propio y lo ajeno es fundamental y constituye la raíz del sistema inmunológico de muchas especies de amebas. [6]