Los receptores tipo Toll ( TLR ) son una clase de proteínas que desempeñan un papel clave en el sistema inmunológico innato . Son receptores de un solo segmento que generalmente se expresan en células centinela, como macrófagos y células dendríticas , que reconocen moléculas estructuralmente conservadas derivadas de microbios . Una vez que estos microbios han alcanzado barreras físicas como la piel o la mucosa del tracto intestinal , son reconocidos por los TLR, que activan las respuestas de las células inmunes . Los TLR incluyen TLR1 , TLR2 , TLR3 , TLR4 , TLR5 , TLR6 , TLR7 , TLR8 , TLR9 , TLR10 , TLR11 , TLR12 y TLR13. Los humanos carecen de genes para TLR11, TLR12 y TLR13 [1] y los ratones carecen de un gen funcional para TLR10. [2] Los receptores TLR1, TLR2, TLR4, TLR5, TLR6 y TLR10 se encuentran en la membrana celular , mientras que TLR3, TLR7, TLR8 y TLR9 se encuentran en vesículas intracelulares (porque son sensores de ácidos nucleicos ). [3]
Los TLR recibieron su nombre por su similitud con la proteína codificada por el gen toll . [4]
La capacidad del sistema inmunológico para reconocer moléculas que son ampliamente compartidas por patógenos se debe, en parte, a la presencia de receptores inmunes llamados receptores tipo Toll (TLR) que se expresan en las membranas de los leucocitos , incluidas las células dendríticas , los macrófagos , las células asesinas naturales , las células de la inmunidad adaptativa ( células T y B ) y las células no inmunes ( células epiteliales y endoteliales y fibroblastos ). [5]
La unión de ligandos (ya sea en forma de adyuvante utilizado en vacunaciones o en forma de fracciones invasivas durante períodos de infección natural) al TLR marca los eventos moleculares clave que finalmente conducen a respuestas inmunes innatas y al desarrollo de inmunidad adquirida específica para el antígeno. [6] [7]
Tras la activación, los TLR reclutan proteínas adaptadoras (proteínas que median otras interacciones proteína-proteína) dentro del citosol de la célula inmunitaria para propagar la vía de transducción de señales inducida por antígenos . Estas proteínas reclutadas son entonces responsables de la activación posterior de otras proteínas posteriores , incluidas las proteína quinasas (IKKi, IRAK1 , IRAK4 y TBK1 ) que amplifican aún más la señal y, en última instancia, conducen a la regulación positiva o la supresión de los genes que orquestan las respuestas inflamatorias y otros eventos transcripcionales . Algunos de estos eventos conducen a la producción, proliferación y supervivencia de citocinas , mientras que otros conducen a una mayor inmunidad adaptativa. [7] Si el ligando es un factor bacteriano, el patógeno podría ser fagocitado y digerido, y sus antígenos presentados a las células T CD4+ . En el caso de un factor viral, la célula infectada puede detener su síntesis de proteínas y puede sufrir muerte celular programada ( apoptosis ). Las células inmunes que han detectado un virus también pueden liberar factores antivirales como los interferones .
También se ha demostrado que los receptores tipo Toll son un vínculo importante entre la inmunidad innata y adaptativa a través de su presencia en las células dendríticas . [8] La flagelina , un ligando de TLR5, induce la secreción de citocinas al interactuar con TLR5 en las células T humanas. [8]

Los TLR son un tipo de receptor de reconocimiento de patrones (PRR) y reconocen moléculas que son ampliamente compartidas por patógenos pero que se pueden distinguir de las moléculas del huésped, denominadas colectivamente patrones moleculares asociados a patógenos (PAMP). Además del reconocimiento de PAMP exógenos, los TLR también pueden unirse a patrones moleculares asociados a daños (DAMP) endógenos, como proteínas de choque térmico (HSP) o componentes de la membrana plasmática. [9] Los TLR junto con los receptores de interleucina-1 forman una superfamilia de receptores , conocida como la "superfamilia del receptor de interleucina-1 / receptor tipo Toll"; todos los miembros de esta familia tienen en común un dominio denominado TIR (receptor Toll-IL-1).
Existen tres subgrupos de dominios TIR. Las proteínas con dominios TIR del subgrupo 1 son receptores de interleucinas producidas por macrófagos , monocitos y células dendríticas y todas tienen dominios de inmunoglobulina (Ig) extracelulares. Las proteínas con dominios TIR del subgrupo 2 son TLR clásicos y se unen directa o indirectamente a moléculas de origen microbiano. Un tercer subgrupo de proteínas que contienen dominios TIR consiste en proteínas adaptadoras que son exclusivamente citosólicas y median la señalización de las proteínas de los subgrupos 1 y 2.
Los TLR están presentes tanto en vertebrados como en invertebrados . Los componentes básicos moleculares de los TLR están presentes en bacterias y plantas, y se sabe que los receptores de reconocimiento de patrones de las plantas son necesarios para la defensa del huésped contra las infecciones. Por lo tanto, los TLR parecen ser uno de los componentes más antiguos y conservados del sistema inmunitario .
En los últimos años, los TLR también se han identificado en el sistema nervioso de los mamíferos. Se han detectado miembros de la familia TLR en la glía, las neuronas y las células progenitoras neuronales, en las que regulan la decisión sobre el destino celular. [10]
Se ha estimado que la mayoría de las especies de mamíferos tienen entre diez y quince tipos de receptores tipo Toll. Se han identificado trece TLR (denominados simplemente TLR1 a TLR13) en humanos y ratones juntos, y se han encontrado formas equivalentes de muchos de estos en otras especies de mamíferos. [11] [12] [13] Sin embargo, los equivalentes de ciertos TLR encontrados en humanos no están presentes en todos los mamíferos. Por ejemplo, un gen que codifica una proteína análoga a TLR10 en humanos está presente en ratones , pero parece haber sido dañado en algún momento en el pasado por un retrovirus . Por otro lado, los ratones expresan TLR 11, 12 y 13, ninguno de los cuales está representado en humanos. Otros mamíferos pueden expresar TLR que no se encuentran en humanos. Otras especies no mamíferas pueden tener TLR distintos de los mamíferos, como lo demuestra el TLR14 anti-pared celular, que se encuentra en el pez globo Takifugu . [14] Esto puede complicar el proceso de utilizar animales experimentales como modelos de inmunidad innata humana.
Los TLR de vertebrados se dividen por similitud en las familias TLR 1/2/6/10/14/15, TLR 3, TLR 4, TLR 5, TLR 7/8/9 y TLR 11/12/13/16/21/22/23. [14]

La participación de la señalización toll en la inmunidad se demostró por primera vez en la mosca de la fruta, Drosophila melanogaster . [19] Las moscas de la fruta solo tienen respuestas inmunes innatas, lo que permite que los estudios eviten la interferencia de los mecanismos inmunes adaptativos en la transducción de señales. La respuesta de la mosca a una infección fúngica o bacteriana se produce a través de dos cascadas de señalización distintas, una de las cuales es la vía toll y la otra es la vía de inmunodeficiencia . La vía toll es similar a la señalización TLR de mamíferos, pero a diferencia de los TLR de mamíferos, toll no se activa directamente por patrones moleculares asociados a patógenos ( PAMP ). Su ectodominio receptor reconoce la forma escindida de la citocina spätzle, que se secreta en la hemolinfa como un precursor dimérico inactivo. El receptor toll comparte el dominio TIR citoplasmático con los TLR de mamíferos, pero el ectodominio y la cola intracitoplasmática son diferentes. Esta diferencia podría reflejar una función de estos receptores como receptores de citocinas en lugar de PRR .
La vía toll se activa por diferentes estímulos, como bacterias grampositivas , hongos y factores de virulencia . [17] [20] Primero, la enzima procesadora de Spätzle (SPE) se activa en respuesta a la infección y escinde el spätzle ( spz ). El spätzle escindido luego se une al receptor toll y reticula sus ectodominios. Esto desencadena cambios conformacionales en el receptor que resultan en señalización a través de toll. A partir de este punto, la cascada de señalización es muy similar a la señalización de mamíferos a través de TLR. El complejo de señalización inducida por toll (TICS) está compuesto por MyD88 , Tube y Pelle (el ortólogo de IRAK de mamíferos). La señal de TICS luego se transduce a Cactus (homólogo del IκB de mamífero ), el Cactus fosforilado se poliubiquitina y se degrada, lo que permite la translocación nuclear de DIF (factor de inmunidad relacionado con el dorso; un homólogo del NF-κB de mamífero ) y la inducción de la transcripción de genes para péptidos antimicrobianos (AMP) como la drosomicina . [21]
La Drosophila tiene un total de 9 genes de la familia Toll y 6 de la familia Spz que interactúan entre sí en diferentes grados. [22]
TLR2 también ha sido designado como CD282 (grupo de diferenciación 282).
TLR3 no utiliza la vía dependiente de MyD88. Su ligando es el ARN bicatenario retroviral ( dsRNA ), que activa la vía de señalización dependiente de TRIF . Para explorar el papel de esta vía en la reprogramación retroviral, se prepararon técnicas de knock down de TLR3 o TRIF, y los resultados mostraron que solo se requiere la vía TLR3 para la inducción completa de la expresión del gen objetivo por el vector de expresión del retrovirus. Esta expresión retroviral de cuatro factores de transcripción ( Oct4 , Sox2 , Klf4 y c-Myc ; OSKM) induce pluripotencia en células somáticas. Esto está respaldado por un estudio que muestra que la eficiencia y la cantidad de generación de iPSC humanas, utilizando vectores retrovirales, se reduce por el knockdown de la vía con inhibidores peptídicos o el knockdown de shRNA de TLR3 o su proteína adaptadora TRIF. En conjunto, la estimulación de TLR3 provoca grandes cambios en la remodelación de la cromatina y la reprogramación nuclear, y la activación de vías inflamatorias es necesaria para estos cambios, la inducción de genes de pluripotencia y la generación de colonias de células madre pluripotentes inducidas humanas (iPSC). [23]
Como se señaló anteriormente, las células humanas no expresan TLR11 , pero las células de ratones sí. El TLR11 específico de ratón reconoce E. coli uropatógeno y el parásito apicomplejo Toxoplasma gondii . Con Toxoplasma su ligando es la proteína profilina y el ligando para E. coli es la flagelina . La flagelina del enteropatógeno Salmonella también es reconocida por TLR11. [24]
Como el TLR11 del ratón es capaz de reconocer eficazmente a la Salmonella , los ratones normales no se infectan con la Salmonella Typhi oral , que causa gastroenteritis transmitida por los alimentos y el agua y fiebre tifoidea en los seres humanos. Los ratones knock out deficientes en TLR11 , por otro lado, se infectan de manera eficiente. Como resultado, este ratón knock out puede actuar como un modelo de enfermedad de la fiebre tifoidea humana. [25]
Los receptores tipo Toll se unen y se activan mediante diferentes ligandos, que, a su vez, se encuentran en diferentes tipos de organismos o estructuras. También tienen diferentes adaptadores para responder a la activación y se encuentran a veces en la superficie celular y a veces en compartimentos celulares internos . [26] Además, se expresan en diferentes tipos de leucocitos u otros tipos de células :
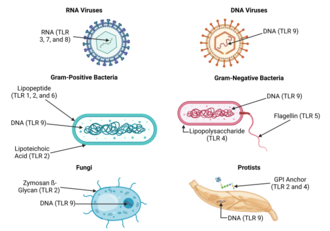
Debido a la especificidad de los receptores tipo toll (y otros receptores inmunes innatos), no se pueden cambiar fácilmente en el curso de la evolución, estos receptores reconocen moléculas que están constantemente asociadas con amenazas (es decir, patógenos o estrés celular) y son altamente específicos para estas amenazas (es decir, no se pueden confundir con moléculas propias que normalmente se expresan en condiciones fisiológicas). Se cree que las moléculas asociadas a patógenos que cumplen con este requisito son fundamentales para la función del patógeno y difíciles de cambiar a través de la mutación; se dice que están conservadas evolutivamente. Las características algo conservadas en los patógenos incluyen lipopolisacáridos de superficie celular bacteriana (LPS), lipoproteínas , lipopéptidos y lipoarabinomanano ; proteínas como la flagelina de los flagelos bacterianos; ARN bicatenario de virus; o las islas CpG no metiladas del ADN bacteriano y viral ; y también de las islas CpG encontradas en los promotores del ADN eucariota; así como ciertas otras moléculas de ARN y ADN. Como los ligandos TLR están presentes en la mayoría de los patógenos, también pueden estar presentes en las vacunas derivadas de patógenos (por ejemplo, vacunas MMR, influenza, polio); la mayoría de las vacunas disponibles comercialmente se han evaluado por la capacidad inherente de sus ligandos TLR para activar distintos subconjuntos de células inmunes. [46] [47] Para la mayoría de los TLR, la especificidad del reconocimiento del ligando ahora se ha establecido mediante la selección de genes (también conocida como "inactivación de genes"): una técnica por la cual se pueden eliminar genes individuales de forma selectiva en ratones. [48] [49] Consulte la tabla anterior para obtener un resumen de los ligandos TLR conocidos.
La respuesta inflamatoria estereotipada provocada por la activación del receptor tipo Toll ha dado lugar a la especulación de que los activadores endógenos de los receptores tipo Toll podrían participar en las enfermedades autoinmunes. Se ha sospechado que los TLR se unen a las moléculas del huésped, incluido el fibrinógeno (que interviene en la coagulación sanguínea ), las proteínas de choque térmico (HSP), HMGB1 , los componentes de la matriz extracelular y el ADN propio (normalmente se degrada por nucleasas, pero en condiciones inflamatorias y autoinmunes puede formar un complejo con proteínas endógenas, volverse resistente a estas nucleasas y obtener acceso a los TLR endosómicos como TLR7 o TLR9). Estos ligandos endógenos suelen producirse como resultado de la muerte celular no fisiológica. [50]

Se cree que los TLR funcionan como dímeros . Aunque la mayoría de los TLR parecen funcionar como homodímeros , TLR2 forma heterodímeros con TLR1 o TLR6, cada dímero tiene una especificidad de ligando diferente. Los TLR también pueden depender de otros correceptores para una sensibilidad completa al ligando, como en el caso del reconocimiento de LPS por parte de TLR4 , que requiere MD-2. Se sabe que CD14 y la proteína de unión a LPS ( LBP ) facilitan la presentación de LPS a MD-2.
Un conjunto de TLR endosómicos que comprende TLR3, TLR7, TLR8 y TLR9 reconocen ácidos nucleicos derivados de virus, así como ácidos nucleicos endógenos en el contexto de eventos patogénicos. La activación de estos receptores conduce a la producción de citocinas inflamatorias , así como de interferones de tipo I ( interferón tipo I ) para ayudar a combatir la infección viral.
También se han identificado las proteínas adaptadoras y las quinasas que median la señalización de TLR. Además, se ha utilizado la mutagénesis de línea germinal aleatoria con ENU para descifrar las vías de señalización de TLR. Cuando se activan, los TLR reclutan moléculas adaptadoras dentro del citoplasma de las células para propagar una señal. Se sabe que cuatro moléculas adaptadoras están involucradas en la señalización. Estas proteínas se conocen como MyD88 , TIRAP (también llamada Mal), TRIF y TRAM (molécula adaptadora relacionada con TRIF). [51] [52] [53]
La señalización de TLR se divide en dos vías de señalización distintas, la vía dependiente de MyD88 y la vía dependiente de TRIF.
La respuesta dependiente de MyD88 ocurre en la dimerización de los TLR y es utilizada por todos los TLR excepto TLR3. Su efecto principal es la activación de NFκB y la proteína quinasa activada por mitógenos . La unión del ligando y el cambio conformacional que ocurre en el receptor reclutan la proteína adaptadora MyD88, un miembro de la familia TIR . MyD88 luego recluta IRAK4 , IRAK1 e IRAK2 . Las quinasas IRAK luego fosforilan y activan la proteína TRAF6 , que a su vez poliubiquina la proteína TAK1, así como a sí misma para facilitar la unión a IKK-β . Al unirse, TAK1 fosforila IKK-β, que luego fosforila IκB causando su degradación y permitiendo que NFκB se difunda en el núcleo celular y active la transcripción y la consiguiente inducción de citocinas inflamatorias. [50]
Tanto TLR3 como TLR4 utilizan la vía dependiente de TRIF, que se activa mediante dsRNA y LPS, respectivamente. En el caso de TLR3, dsRNA activa el receptor, reclutando el adaptador TRIF . TRIF activa las quinasas TBK1 y RIPK1 , lo que crea una ramificación en la vía de señalización. El complejo de señalización TRIF/TBK1 fosforila IRF3, lo que permite su translocación al núcleo y la producción de interferón tipo I. Mientras tanto, la activación de RIPK1 provoca la poliubiquitinación y la activación de la transcripción de TAK1 y NFκB de la misma manera que la vía dependiente de MyD88. [50]
La señalización de TLR conduce en última instancia a la inducción o supresión de genes que orquestan la respuesta inflamatoria. En total, miles de genes son activados por la señalización de TLR y, en conjunto, los TLR constituyen una de las vías de acceso más pleiotrópicas y, al mismo tiempo, más reguladas para la modulación genética.
TLR4 es el único TLR que utiliza los cuatro adaptadores. El complejo formado por TLR4, MD2 y LPS recluta los adaptadores TIRAP y MyD88 que contienen el dominio TIR y, por lo tanto, inicia la activación de NFκB (fase temprana) y MAPK. El complejo TLR4-MD2-LPS luego experimenta endocitosis y en el endosoma forma un complejo de señalización con los adaptadores TRAM y TRIF. Esta vía dependiente de TRIF nuevamente conduce a la activación de IRF3 y la producción de interferones de tipo I, pero también activa la activación de NFκB en fase tardía. Tanto la activación de fase temprana como la tardía de NFκB son necesarias para la producción de citocinas inflamatorias. [50]
El imiquimod (utilizado principalmente en dermatología ) es un agonista de TLR7, y su sucesor, el resiquimod , es un agonista de TLR7 y TLR8. [54] Recientemente, se ha explorado el resiquimod como agente para la inmunoterapia contra el cáncer, [55] actuando a través de la estimulación de los macrófagos asociados a los tumores.
Varios ligandos TLR se encuentran en desarrollo clínico o se están probando en modelos animales como adyuvantes de vacunas , [56] con el primer uso clínico en humanos en una vacuna recombinante contra el herpes zóster en 2017, que contiene un componente de lípido A monofosforilado.
Se han informado los niveles de expresión del ARN mensajero TLR7 en animales lecheros en un brote natural de fiebre aftosa. [57]
Se ha demostrado que TLR4 es importante para los efectos secundarios a largo plazo de los opioides . Su activación conduce a la liberación descendente de moduladores inflamatorios, incluidos TNF-α e IL-1β , y se cree que la liberación constante de bajo nivel de estos moduladores reduce la eficacia del tratamiento con fármacos opioides con el tiempo, y está involucrada en la tolerancia a los opioides, [58] [59] hiperalgesia y alodinia . [60] [61] La activación de TLR4 inducida por morfina atenúa la supresión del dolor por opioides y mejora el desarrollo de tolerancia y adicción a opioides , abuso de drogas y otros efectos secundarios negativos como depresión respiratoria e hiperalgesia. [62] Se ha demostrado que los medicamentos que bloquean la acción de TNF-α o IL-1β aumentan los efectos analgésicos de los opioides y reducen el desarrollo de tolerancia y otros efectos secundarios, [63] [64] y esto también se ha demostrado con medicamentos que bloquean TLR4 en sí.
Los enantiómeros "no naturales" de los fármacos opiáceos, como la (+)-morfina y la (+)-naloxona, carecen de afinidad por los receptores opiáceos, pero aún así producen la misma actividad en TLR4 que sus enantiómeros "normales". [65] [66] Por lo tanto, los enantiómeros "no naturales" de los opiáceos, como la (+)-naloxona, se pueden utilizar para bloquear la actividad TLR4 de los fármacos analgésicos opiáceos sin tener ninguna afinidad por el receptor μ-opioide [67] [66] [68]
Cuando se reconoció por primera vez a los microbios como la causa de las enfermedades infecciosas, quedó inmediatamente claro que los organismos multicelulares debían ser capaces de reconocerlos cuando se infectaban y, por lo tanto, capaces de reconocer moléculas exclusivas de los microbios. Una gran cantidad de literatura, que abarca la mayor parte del siglo pasado, da fe de la búsqueda de las moléculas clave y sus receptores. Hace más de 100 años, Richard Pfeiffer , un estudiante de Robert Koch , acuñó el término " endotoxina " para describir una sustancia producida por bacterias gramnegativas que podía provocar fiebre y shock en animales de experimentación . En las décadas siguientes, la endotoxina se caracterizó químicamente y se identificó como un lipopolisacárido (LPS) producido por la mayoría de las bacterias gramnegativas. Este lipopolisacárido es una parte integral de la membrana gramnegativa y se libera tras la destrucción de la bacteria. Se demostró a su vez que otras moléculas ( lipopéptidos bacterianos , flagelina y ADN no metilado ) provocan respuestas del huésped que normalmente son protectoras. Sin embargo, estas respuestas pueden ser perjudiciales si son excesivamente prolongadas o intensas. Lógicamente, se deducía que debían existir receptores para dichas moléculas, capaces de alertar al huésped de la presencia de una infección, pero estos no se encontraron durante muchos años. Los receptores tipo Toll se cuentan ahora entre las moléculas clave que alertan al sistema inmunitario de la presencia de infecciones microbianas.
El miembro prototípico de la familia, el receptor toll ( P08953 ; Tl) en la mosca de la fruta Drosophila melanogaster , fue descubierto en 1985 por los premios Nobel de 1995 Christiane Nüsslein-Volhard y Eric Wieschaus y colegas. Era conocido por su función de desarrollo en la embriogénesis al establecer el eje dorsal - ventral . Recibió su nombre de la exclamación de 1985 de Christiane Nüsslein-Volhard, " Das ist ja toll! " ("¡Eso es increíble!"), en referencia a la porción ventral subdesarrollada de una larva de mosca de la fruta. [4] Fue clonado por el laboratorio de Kathryn Anderson en 1988. [69] En 1996, Jules A. Hoffmann y sus colegas descubrieron que toll tenía un papel esencial en la inmunidad de la mosca a la infección por hongos , que lograba activando la síntesis de péptidos antimicrobianos. [19]
El primer receptor tipo toll humano del que se tiene conocimiento fue descrito por Nomura y sus colegas en 1994 [70] , y Taguchi y sus colegas lo mapearon en un cromosoma en 1996 [71]. Como en ese momento no se conocía la función inmunitaria del toll en Drosophila , se asumió que el TIL (ahora conocido como TLR1) podría participar en el desarrollo de los mamíferos. Sin embargo, en 1991 (antes del descubrimiento del TIL) se observó que una molécula con un papel claro en la función inmunitaria de los mamíferos, el receptor de interleucina-1 (IL-1), también tenía homología con el toll de Drosophila; las porciones citoplasmáticas de ambas moléculas eran similares [72] .
En 1997, Charles Janeway y Ruslan Medzhitov demostraron que un receptor tipo Toll, ahora conocido como TLR4, podría, cuando se liga artificialmente utilizando anticuerpos, inducir la activación de ciertos genes necesarios para iniciar una respuesta inmune adaptativa . [7] La función de TLR 4 como receptor sensor de LPS fue descubierta por Bruce A. Beutler y colegas. [73] Estos trabajadores utilizaron la clonación posicional para demostrar que los ratones que no podían responder al LPS tenían mutaciones que abolían la función de TLR4. Esto identificó a TLR4 como uno de los componentes clave del receptor de LPS.

A su vez, los demás genes TLR fueron eliminados en ratones mediante técnicas de selección de genes, en gran medida en el laboratorio de Shizuo Akira y sus colegas. Ahora se cree que cada TLR detecta un conjunto discreto de moléculas (algunas de origen microbiano y otras productos de daño celular) y señala la presencia de infecciones. [74]
Los homólogos vegetales de toll fueron descubiertos por Pamela Ronald en 1995 (arroz XA21) [75] y Thomas Boller en 2000 ( Arabidopsis FLS2). [76]
En 2011, Beutler y Hoffmann recibieron el Premio Nobel de Medicina o Fisiología por su trabajo. [77] Hoffmann y Akira recibieron el Premio Internacional Gairdner de Canadá en 2011. [78]
los TLR 1, 2, 4 a 6 y 10 se expresan en la membrana plasmática, y los TLR 3, 7 a 9 y 11 a 13 se confinan a los endosomas.