Glyptotherium (del griego para 'bestia acanalada o tallada') es un género de gliptodonte (un grupo extinto de grandes armadillos herbívoros) de la familia Chlamyphoridae (una familia de armadillos sudamericanos) que vivió desde el Plioceno temprano , hace unos 3,6 millones de años, hasta el Pleistoceno tardío, hace unos 15.000 años. Tuvo una amplia distribución, viviendo en Estados Unidos , México , Guatemala , Costa Rica , Honduras , El Salvador , Panamá , Venezuela y Brasil . El género fue descrito por primera vez en 1903 por el paleontólogo estadounidense Henry Fairfield Osborn con la especie tipo , G. texanum , basándose en fósiles que se habían encontrado en los lechos Blancanos del Plioceno en Llano Estacado , Texas , EE. UU. Desde entonces, se han desenterrado fósiles de Glyptotherium en muchos más yacimientos fósiles, desde Florida hasta Colombia. Otra especie, G. cylindricum , fue nombrada en 1912 por el cazador de fósiles Barnum Brown sobre la base de un esqueleto parcial que había sido desenterrado de losdepósitos del Pleistoceno en Jalisco, México . Las dos especies difieren en varios aspectos, incluida la edad, ya que G. texanum pertenece a losestratos más antiguos del Plioceno temprano al Pleistoceno temprano , mientras que G. cylindricum es exclusiva del Pleistoceno tardío .
Glyptotherium era un armadillo herbívoro grande, cuadrúpedo (de cuatro patas), con un caparazón blindado (capa superior) que estaba hecho de cientos de osteodermos interconectados (estructuras en la dermis compuestas de hueso). Otras piezas de armadura cubrían la cola y el techo del cráneo , siendo el cráneo alto con dientes hipsodontes (de corona alta). En cuanto a la anatomía postcraneal, las pelvis fusionadas al caparazón, una columna vertebral amalgamada, extremidades cortas y dígitos pequeños son características de Glyptotherium y sus parientes. Glyptotherium alcanzó hasta 2 metros (6,56 pies) de largo y 400 kilogramos (880 libras) de peso, lo que lo convierte en uno de los gliptodontes más grandes, pero no tan grande como su pariente cercano Glyptodon o Doedicurus , el gliptodonte más grande conocido. Glyptotherium es morfológicamente y filogenéticamente más similar a Glyptodon, sin embargo, difieren en varios aspectos. El Glyptotherium es más pequeño en promedio, con un caparazón más corto, una cola relativamente más larga y un cigoma o pómulo delgado.
Los gliptodontes evolucionaron por primera vez durante el Eoceno , pero se diversificaron en gran medida en el Mioceno y el Plioceno , principalmente en los sitios santacrucianos de Argentina . Sin embargo, su diversidad disminuyó en el Pleistoceno, aunque alcanzaron su máximo tamaño durante este período. Glyptotherium se considera un ejemplo de megafauna de América del Norte , de la cual la mayoría se ha extinguido y puede haber sido aniquilada por el cambio climático o la interferencia humana. Glyptotherium era principalmente un herbívoro , pero también tenía una dieta mixta de frutas y otras plantas, que vivía en pastizales abiertos. La armadura podría proteger al animal de los depredadores, de los cuales muchos coexistieron con Glyptotherium durante su existencia, incluido el "gato dientes de sable" Smilodon , el "perro triturador de huesos" Borophagus y los "osos de cara corta" ( Tremarctinae ).
Se han encontrado fósiles atribuibles a Glyptotherium ya en la década de 1870, cuando los ingenieros civiles JN Cuatáparo y Santiago Ramírez recolectaron un cráneo, un caparazón casi completo y un esqueleto postcraneal asociado de un gliptodonte de un canal de drenaje cerca de Tequixquiac , México , los fósiles provienen de la era Rancholabreana del Pleistoceno . [1] [2] [3] Este fue el primer descubrimiento de un gliptodonte en América del Norte. [2] [3] Cuatáparo y Ramírez nombraron a los fósiles Glyptodon mexicanum en 1875, pero los fósiles se han perdido . [1] [4] Otra especie de Glyptodon de México fue descrita en 1889, G. nathoristi, por paleontólogos alemanes basados en restos de caparazón de localidades del Pleistoceno en Ejutla , Oaxaca . [5] [6] Ambas especies han sido desde entonces sinonimizadas con G. cylindricum. [2] [3]
Los primeros fósiles de Glyptotherium descritos en Estados Unidos fueron descritos en 1888 por el paleontólogo Edward Drinker Cope y consistían solo en un único osteodermo de caparazón que había sido recolectado de los " lechos Equus " del Pleistoceno inferior del condado de Nueces , Texas . [7] [2] Cope nombró a su osteodermo Glyptodon peltaliferus , [8] pero Cope no le dio a la especie una descripción adecuada que siguiera las reglas de ICZN , lo que lo convirtió en un nomen nudum y desde entonces ha sido sinónimo de G. cylindricum . [2] [3] Al año siguiente, Joseph Leidy nombró a Glyptodon floridanus basándose en osteodermos de caparazón aislados y piezas de armadura caudal, aunque algunos también fueron referidos a G. peltaliferus , [9] que fueron recolectados de depósitos del Pleistoceno en el condado de DeSoto , Florida . [10] [11] Esta especie ahora se considera un nomen vanum y un sinónimo menor de Glyptotherium cylindricum según una revisión del género realizada por los paleontólogos estadounidenses David Gillette y Clayton Ray (1981). [12] [2]
_(20485352308).jpg/440px-Compte-rendu_des_séances_du_sixième_Congrès_international_de_zoologie,_tenu_à_Berne_du_14_au_19_août_1904_(1905)_(20485352308).jpg)
El propio Glyptotherium recibió su nombre en 1903 cuando los fósiles recolectados por una expedición del Museo Americano de Historia Natural dirigida por JW Gidley a los estratos del Plioceno Temprano de la Formación Blanco de Llano Estacado , Texas, fueron descritos por Henry Fairfield Osborn como un nuevo género y especie de gliptodonte, Glyptotherium texanum . [7] Los fósiles fueron depositados en el AMNH y consisten en un caparazón y elementos postcraneales asociados, uno de los pocos esqueletos de G. texanum conocidos. [7] [2] El nombre genérico Glyptotherium proviene de las raíces griegas glyph que significa "tallado" o "ranurado", en honor a su pariente Glyptodon , y therion que significa "bestia", un sufijo comúnmente utilizado para los mamíferos prehistóricos. El nombre de la especie tipo, G. texanum, es posterior al descubrimiento del holotipo en Texas. [7]
Otro hallazgo se produjo en 1910 cuando, mientras viajaba por Jalisco , México, el cazador de fósiles Barnum Brown recolectó un caparazón dorsal completo y varios fósiles adicionales, incluidos dientes, de un solo individuo de los estratos del Pleistoceno de la zona. [3] [13] El espécimen también fue enviado al Museo Americano de Historia Natural, donde fue descrito por Brown en 1912 como un nuevo género y especie de gliptodonte, Brachyostracon cylindricum . [13] El nombre de la especie cylindricum que significa "cilíndrico" se debe a la anatomía cilindroide de los premolares en el holotipo de G. cylindricum. [13] Brown también recombinó Glyptodon mexicanum en Brachyostracon mexicanum. [13] Brachyostracon ahora se considera sinónimo de Glyptotherium a nivel de género, pero G. cylindricum es una especie válida. [2] [14] En 1923, Oliver Perry Hay nombró una nueva especie de Glyptodon , G. rivipacis , basándose en los fósiles descritos por Leidy del condado de DeSoto , Florida. [15] Esta especie ahora se considera un nomen nudum y sinónimo de Glyptotherium cylindricum . [2] [16] Hay también describió fósiles bien conservados, incluidos elementos del cráneo y dientes, que se recolectaron de estratos de Rancholabrean en Wolf City y Sinton, Texas , que se denominaron Glyptodon peltaliferus de Cope . [14] Desde entonces, estos fósiles se han denominado G. cylindricum. [2] [14]
Un tercer género de gliptodonte norteamericano, Boreostracon floridanum , fue establecido por George Gaylord Simpson en 1929 basándose en varios especímenes aislados desenterrados por el AMNH de localidades de la era Rancholabreana en Florida, siendo el espécimen holotipo la porción trasera de un caparazón recuperado de la localidad de Seminole Field en el condado de Pinellas , Florida. [12] [17] Simpson refirió todos los fósiles previamente descritos de Florida a B. floridanum y creyó que todos los fósiles de gliptodontes desenterrados de América del Norte no eran de Glyptodon . [17] Sin embargo, Simpson eligió no designar un nuevo género o especie para Glyptodon peltaliferus , pero todavía creía que eran de una forma separada de gliptodonte. [17] Boreostracon floridanum ha sido sinónimo de Glyptotherium cylindricum. [2]
La investigación sobre los gliptodontes norteamericanos disminuyó después de las investigaciones de Gidley, Hay, Simpson y otros, pero algunos paleontólogos todavía referían incorrectamente los fósiles del continente a Glyptodon . [14]
En 1927, la Universidad de Oklahoma recolectó muchos fósiles del Pleistoceno Temprano de una localidad en Frederick, Oklahoma , incluidos varios fósiles fragmentarios de gliptodontes, équidos , gonfotéridos y camélidos . [18] Los fósiles de gliptodontes fueron originalmente referidos a Glyptodon en 1928, [19] [20] pero no fueron descritos apropiadamente hasta 1953. [18] Fueron descritos como un nuevo género y especie, Xenoglyptodon fredericensis , en 1953 sobre la base de una mandíbula inferior parcial y varios dientes. [18] La especie ahora se considera un sinónimo menor de Glyptotherium texanum . [2] [14] Después de que todos estos géneros fueron nombrados, una gran reevaluación no se realizó hasta 1981, David Gillette y Clayton Ray publicaron una monografía sobre los gliptodontes norteamericanos. En su monografía, recombinaron todos los géneros y especies nombrados previamente en Glyptotherium, sinonimizaron algunas especies y también investigaron la ecología, anatomía y distribución del género. [14] Sin embargo, G. arizonae, G. floridanum y G. mexicanum se mantuvieron como especies válidas, [14] todas las cuales fueron posteriormente sinonimizadas con G. texanum y G. cylindricum después del descubrimiento de esqueletos más completos que probaron su sinonimia. [2] [21] Después de una revisión posterior, la primera especie fue declarada sinónimo menor de G. texanum [2] [21] y las dos últimas sinónimos de G. cylindricum . [2]
Desde la década de 2000 hasta la de 2020, cientos de fósiles adicionales fueron referidos al género de América Central y Brasil. [22] [23] Estos incluyen fósiles previamente referidos a Glyptodon y Hoplophorus , ya que muchos fósiles fueron asignados apresuradamente a ambos por paleontólogos del siglo XIX. [22] [24] Uno de los especímenes reasignados a Glyptotherium , un osteodermo aislado del caparazón dorsal, fue recolectado de cuevas carbonatadas del Pleistoceno en Lagoa Santa , Minas Gerais , Brasil por Friedrich von Sellow a principios del siglo XIX. [22] Más tarde fue descrito como una nueva especie de Hoplophorus , H. meyeri , en 1845 por el paleontólogo danés Peter Wilhelm Lund . [25] [24] [22] Sin embargo, Lund nombró incorrectamente al taxón, convirtiéndolo en un nomen nudum . [22] El osteodermo fue referido a Glyptotherium en 2010, convirtiéndolo en el primer espécimen conocido de Glyptotherium . [22] En 2022, se describió una gran cantidad de fósiles de Glyptotherium cylindricum , incluidos cráneos, algunos de los cuales conservan patologías causadas por humanos, que habían sido recolectados de varios sitios en Falcón , norte de Venezuela, que databan del Pleistoceno tardío. [26]

Glyptotherium es un género de la subfamilia Glyptodontinae, un clado extinto de armadillos grandes y completamente acorazados que evolucionaron por primera vez a finales del Eoceno (hace unos 33,5 millones de años) y se extinguieron en las extinciones del Pleistoceno tardío y el Holoceno temprano . [27] Glyptodontinae estuvo clasificado en su propia familia o incluso superfamilia hasta 2016, cuando se extrajo ADN antiguo del caparazón de un espécimen de Doedicurus (un gliptodonte grande con maza) de 12 000 años de antigüedad , y se reconstruyó un genoma mitocondrial casi completo ( cobertura de 76x ). Las comparaciones con el ADN de los armadillos modernos revelaron que los gliptodontes divergieron de los armadillos tolipeutinos y clamiforinos hace aproximadamente 33,5 millones de años a finales del Eoceno . [27] [28] Esto impulsó a moverlos de su propia familia, Glyptodontidae, dentro de la actual Chlamyphoridae como una subfamilia, rebautizada como Glyptodontinae. [28] Siguiendo estos datos genéticos y el registro fósil, los gliptodontes desarrollaron rápidamente su anatomía característica y tamaños enormes (también conocido como gigantismo), posiblemente debido al enfriamiento de las temperaturas, los climas más secos, la expansión de las sabanas y el tamaño de carnívoros como Arctotherium y Smilodon . [27] Chylamyphoridae es un grupo en el orden Cingulata, que incluye todos los armadillos existentes además de otros grupos fósiles como Pachyarmatheriidae y Pampatheridae . Cingulata está dentro del grupo basal de mamíferos Xenarthra, que incluye una variedad de grupos de mamíferos americanos como Vermilingua (osos hormigueros) y Folivora (perezosos y perezosos terrestres ) en el orden Pilosa . El siguiente análisis filogenético fue realizado por Frédéric Delsuc y sus colegas en 2016 y representa la filogenia de Cingulata utilizando ADN antiguo de Doedicurus para determinar su posición y la de otros gliptodontes: [27] [29]
_(cropped).jpg/440px-Pink_Fairy_Armadillo_(Chlamyphorus_truncatus)_(cropped).jpg)
La filogenia interna de Glyptodontinae es complicada y cambiante, con muchas especies y familias erigidas sobre la base de material fragmentario o no diagnóstico que carece de una revisión exhaustiva. [30] [24] [2] Generalmente se considera su propia familia, pero los análisis de ADN la han reducido a una subfamilia con tribus en lugar de subfamilias. Una tribu, Glyptodontini (normalmente etiquetada como Glyptodontinae) es un grupo de gliptodontes más jóvenes y grandes que evolucionaron en el Mioceno medio (ca. 13 millones de años) con Boreostemma , [31] pero se dividieron en 2 géneros, Glyptodon en el sur y Glyptotherium en el norte, [2] aunque Glyptodon también vivió en el norte de Sudamérica en Colombia . [2] [32] Glyptodontini a menudo se recupera como más basal que la mayoría de los otros gliptodontes como Doedicurus , Hoplophorus y Panochthus . Glyptodontini se distingue de otros grupos, por ejemplo, en que tiene osteodermos tuberculosos cónicos grandes ausentes o solo presentes en la muesca caudal (hacia la cola) en el extremo posterior del caparazón y una ornamentación diferente de la armadura en el caparazón que la cola. [33] El taxón hermano, o pariente(s) más cercano(s) de otro taxón, a Glyptotherium es el género Glyptodon , que evolucionó en el Pleistoceno medio en Argentina. [33] [30] Glyptotherium es casi idéntico a Glyptodon en muchos aspectos, tanto que los primeros fósiles de Glyptotherium que se describieron fueron identificados erróneamente como los de Glyptodon . [14] [1]
Cuando Glyptotherium fue descrito por primera vez por Henry Fairfield Osborn en 1903, lo colocó en el nivel de familia Glyptodontidae y aunque similar a Glyptodon , Osborn afirmó que era más cercano en apariencia y clasificación a Panochthus y Neosclerocalyptus (entonces Sclerocalyptus ). [7] Barnum Brown creía que su género Brachyostracon y sus 2 especies, B. cylindricum y B. mexicanum , estaban en su propia familia de gliptodontes basándose en la elongación del cráneo de la última especie y el ancho del caparazón en comparación con su longitud. [13] Sin embargo, Brown no acuñó ningún nombre nuevo para esta familia, y en su lugar clasificó el género dentro de Sclerocalyptidae junto con gliptodontes sudamericanos como Panochthus , Neosclerocalyptus y Plohophorus . [13] George Gaylord Simpson clasificó su género Boreostracon como un pariente cercano de Glyptodon , pero aún creía que había múltiples géneros de gliptodontes norteamericanos. [17] Meade (1953) colocó a Xenoglyptodon como un gliptodonte cercano a los otros géneros norteamericanos, pero no indicó su relación con los géneros sudamericanos. [18] A continuación se muestra el análisis filogenético realizado por Cuadrelli et al ., 2020 de Glyptodontinae, con Glyptodontidae como familia en lugar de subfamilia, que se centra en los gliptodontes avanzados: [33]

Al igual que su pariente vivo, el armadillo, Glyptotherium tenía un caparazón que cubría todo su torso, con una armadura más pequeña que también cubría el techo del cráneo de la cabeza, similar a una tortuga . Sin embargo, a diferencia del caparazón (caparazón superior) de una tortuga, el caparazón de Glyptotherium estaba formado por cientos de pequeñas escamas hexagonales, y Glyptotherium conservaba hasta 1800 osteodermos (estructuras óseas en la dermis) o más en cada individuo. [34] El esqueleto axial de los gliptodontes muestra una extensa fusión en la columna vertebral y la pelvis (hueso de la cadera) está fusionada al caparazón, lo que hace que la pelvis sea completamente inmóvil. [14] Glyptotherium era muy graviportal y tenía extremidades cortas que son muy similares a las de otros gliptodontes. Las grandes colas de los gliptodontes probablemente sirvieron como contrapeso al resto del cuerpo y la armadura caudal de Glyptotherium terminaba en un tubo romo que estaba compuesto de 2-3 tubos fusionados, [2] en contraste con los de los gliptodontes sudamericanos con cola de maza. [35] Los dígitos de Glyptotherium son muy robustos y están adaptados para soportar peso, aunque algunos conservan grandes vainas de garras que tenían una morfología intermedia entre garras y pezuñas. [14] Durante el Pleistoceno, los gliptodontes disminuyeron en diversidad filogenética pero aumentaron en tamaño. [26] [2] Los pesos y tamaños de Glyptotherium varían, pero G. texanum era más pequeño y liviano que la especie posterior, G. cylindricum. Un espécimen de G. cylindricum se estimó en 350-380 kilogramos, en comparación con los 457 kg de su pariente Glyptodon reticulatus. [26] Las estimaciones más grandes de la masa de Glyptotherium se basan en especímenes adultos de Brasil y Arizona, con una estimación de un espécimen de G. cylindricum que lo ubica en 710 kilogramos (1,570 lb) y un individuo de G. texanum en 1,165 kilogramos (2,568 lb). [36] Un espécimen de G. cylindricum , AMNH 15548, preservó una longitud de caparazón de 1690 centímetros en comparación con solo 1400 cm para MSM P4464, un espécimen de G. texanum . [2]

Glyptotherium texanum se diferencia de G. cylindricum en la configuración de la escultura externa de osteodermos hexagonales simétricos en el caparazón dorsal. En los osteodermos de G. texanum adulto, las figuras centrales de los osteodermos son planas o débilmente convexas y muy grandes, mientras que las de G. cylindricum son planas o cóncavas y mucho más pequeñas. [2] [37] En ambas especies, las figuras centrales de los osteodermos se hacen más grandes hacia los márgenes del caparazón. [2] [21] Aunque se creía que G. texanum era más grande que G. cylindricum , se cree que el género fue uniformemente grande durante todo el Plioceno y el Pleistoceno. [2]
La dentición de los gliptodontes tiene todos los molariformes hipsodontes (dientes de corona alta adaptados para pastar), los dientes de las mejillas, que son algunos de los hipsodontes más conocidos de los mamíferos terrestres. [38] Los cráneos de los gliptodontes tienen varias características únicas; el maxilar y el palatino se agrandan verticalmente para hacer espacio para los molariformes, mientras que la caja craneana es braquicéfala , corta y plana. [39] La armadura dérmica no estaba restringida al caparazón y la cola, ya que el techo del cráneo estaba protegido por un "escudo cefálico" hecho de osteodermos. [26] [40] Algunos paleontólogos han propuesto que Glyptotherium y algunos gliptodontes también tenían una probóscide o un hocico grande similar a los de los elefantes y los tapires, [41] pero pocos han aceptado esta hipótesis. [2] [26] Solo se conoce un cráneo completo de Glyptotherium texanum , mientras que parientes como Glyptodon y Neosclerocalyptus se conocen de muchos cráneos, lo que da una perspectiva limitada sobre su anatomía. [42] [43] El cigoma de Glyptotherium es estrecho, delgado, casi paralelo y cercano al plano sagital en vista frontal; en Glyptodon , esta estructura es más amplia, robusta, divergente en lugar de paralela y colocada más lateralmente. Glyptotherium y otros gliptodontes conservan grandes conductos nasales y senos nasales que pueden haber tenido fosas nasales adaptadas para respirar en los climas fríos y áridos de las Américas durante el Pleistoceno . [44] A su vez, los agujeros infraorbitales son estrechos y no visibles en vista anterior en Glyptotherium , pero en Glyptodon son anchos y claramente visibles en vista anterior. En vista lateral, la altura dorsoventral entre el techo del cráneo y el plano palatino en Glyptodon disminuye anteriormente, al contrario que en Glyptotherium ; la punta nasal está en un plano inferior con respecto al arco cigomático en Glyptodon , pero en Glyptotherium es más alta que el plano del arco cigomático. En Glyptotherium , el perfil lateral oclusal es ligeramente curvado, mientras que es fuertemente curvado en Glyptodon . En Glyptodon , el primer molariforme (abreviado como mf1) es claramente trilobado.(trilobulado) tanto lingual como labialmente, casi tan trilobado como el mf2; por el contrario, Glyptotherium muestra una trilobación muy baja de mf1, que es elíptica en sección transversal, el mf2 es débilmente trilobado y el mf3 es trilobado. En ambos géneros, los mf4 a mf8 son completamente trilobados y serialmente idénticos. [2]
Las mandíbulas de Glyptotherium y Glyptodon son muy similares, pero la mandíbula de Glyptotherium es más pequeña en aproximadamente un 10%. El ángulo entre el plano oclusal y el margen anterior de la rama ascendente es de aproximadamente 60 en Glyptotherium, mientras que es de 65° en Glyptodon. El margen ventral de la rama horizontal es más cóncavo en Glyptodon que en Glyptotherium . El área de la sínfisis se extiende mucho en Glyptotherium anteroposteriormente en comparación con Glyptodon . El mf1 es elipsoidal en Glyptotherium y el mf2 es submolariforme , mientras que en Glyptodon ambos dientes son trilobulados. [2]

Glyptotherium, y todos los demás gliptodontes , tenían un gran caparazón dorsal que cubría gran parte del dorso y que estaba formado por osteodermos interconectados. El caparazón de Glyptotherium era más corto que el de su pariente Glyptodon , pero mucho más alargado que el de Boreostemma . El punto más alto del caparazón estaba en el centro de la línea media, mientras que el de Glyptodon estaba ligeramente desplazado. El caparazón de Glyptotherium era fuertemente arqueado, con un preilíaco convexo y un postilíaco cóncavo, lo que le daba un saliente en forma de silla de montar sobre la cola. [2] [31] En Glyptodon, la altura superior e inferior del caparazón representa el 60% de su longitud total, mientras que en Glyptotherium es más alto, aproximadamente un 70%. Los márgenes ventrales del caparazón en Glyptotherium son mucho más rectangulares y menos convexos que en Glyptodon. En Glyptotherium , los osteodermos en las áreas anterolaterales del caparazón están menos anquilosados que en Glyptodon , lo que sugiere que las regiones anterolaterales del caparazón del primero tenían más flexibilidad. Los osteodermos de la abertura caudal son más cónicos en Glyptodon y más redondeados en Glyptotherium , aunque en este último la anatomía de los osteodermos de la abertura caudal varía según el sexo [21] mientras que en Glyptodon varía según la edad. [45] Aunque se utiliza con frecuencia para diferenciar los dos taxones, Glyptotherium y Glyptodon tienen morfologías de osteodermos muy similares que difieren solo en varias áreas. Ambos géneros tienen osteodermos muy gruesos en comparación con los de muchos gliptodontes sudamericanos como Hoplophorus y Neosclerocalyptus , pero Glyptotherium siempre conserva un patrón de "roseta", donde la figura central del osteodermo está rodeada por una fila de figuras periféricas. Algunos especímenes de Glyptodon conservan estas "rosetas", pero otros carecen de ellas. Los surcos central y radial son más profundos y anchos en Glyptodon (aproximadamente 4-6 mm) que en Glyptotherium (aproximadamente 1-2,4 mm). [2] [21] Cabe destacar que los osteodermos de Glyptotherium conservan pequeños espacios para los folículos pilosos en los surcos que indican que GlyptotheriumTenía un caparazón "velloso" del que sobresalía pelo. La cantidad de folículos varía según la edad y el área del caparazón; los juveniles tienen más folículos que los adultos, y se conocen menos folículos en las partes lateral, caudal y trasera del caparazón. [46] [21]
.jpg/440px-Glyptodon_tail_-_Cleveland_Museum_of_Natural_History_(34414489880).jpg)
Glyptotherium es un gliptodonte, lo que significa que su armadura caudal está formada por una serie de anillos caudales que terminan en un tubo caudal corto, en contraste con los extremos en forma de maza en otros gliptodontes, pero la morfología difiere entre Glyptotherium, Glyptodon y Boreostemma . En general, Boreostemma conserva una armadura caudal más similar a Glyptotherium que a Glyptodon . [31] La armadura caudal es más larga en Glyptotherium que en Glyptodon , con un espécimen de G. texanum (UMMP 34 826) preservando un conjunto de armadura caudal de un metro de largo. En Glyptotherium , la longitud de la armadura caudal representa alrededor del 50% de la longitud total del caparazón dorsal, mientras que en Glyptodon , este valor es menor, alrededor del 30-40%. Glyptodon tiene 8-9 anillos caudales completos más un tubo caudal, pero Glyptotherium conserva 1 anillo caudal incompleto además de los 8-9 anillos caudales completos y el tubo caudal. En ambos géneros, cada anillo caudal está compuesto por dos o tres filas transversales de osteodermos anquilosados, donde la fila más distal de osteodermos muestra una morfología cónica más o menos desarrollada. En Glyptotherium , en algunos especímenes (p. ej., AMNH 95,737) un bajo número de osteodermos cónicos (generalmente dos). Esto es diferente de Glyptodon , en el que la mayoría de los osteodermos de la fila distal (hasta 12) presentan una morfología cónica clara. El tubo caudal terminal es más corto en Glyptodon . En Glyptotherium , el tubo terminal está compuesto por 2-3 anillos anquilosados, mientras que, en Glyptodon , tiene solo dos anillos anquilosados. En Glyptotherium , este tubo caudal representa ca. 20% de la longitud total de la armadura caudal, mientras que en Glyptodon , esta estructura representa el 13% de la longitud total. [2]
Se han hecho varias interpretaciones de la postura del gliptodonte, [47] inicialmente por el paleontólogo británico Richard Owen en 1841 usando anatomía comparada. [48] Owen teorizó que las falanges soportaban peso debido a su fisiología corta y ancha, además de la evidencia proporcionada en el esqueleto postcraneal. [48] También se propuso que una postura erguida era posible para los gliptodontes , primero por Sénéchal (1865) quien afirmó que la cola podría ser un equilibrio para la mitad delantera del cuerpo, así como un método de apoyo para las piernas. [49] [47] Posteriormente se tomaron mediciones lineales que proporcionaron información sobre esta hipótesis, encontrando que el bipedalismo sería posible. [50] [51] La articulación patelar con el fémur sugiere la rotación del crus durante la extensión de la rodilla y potencialmente incluso el bloqueo de la rodilla eran factibles. [52]

Se cree tradicionalmente que Glyptotherium consumía hierbas húmedas y ribereñas . [53] El género era principalmente un herbívoro, pero también tenía una dieta mixta de plantas C3 y C4 según los análisis de isótopos de especímenes dentales recuperados de la localidad de Cedral del Pleistoceno tardío en San Luis Potosí , México. [54] La localidad conserva plantas C4 de las familias Poacea , Amaranthacea y Quenopodiacea, [55] lo que significa que eran posibles fuentes de alimento para Glyptotherium . [54] Cedral específicamente era un área con aguas termales y pastizales abiertos junto a ellos, lo que sugiere que Glyptotherium se alimentaba en pastizales cerca de fuentes de agua, como los hábitos alimentarios de los capibaras modernos . [41] [54] Análisis isotópicos adicionales de Glyptotherium y el perezoso terrestre gigante Eremotherium encontraron que ambos tenían niveles isotópicos similares a los del anfibio existente Hippopotamus , lo que indica que eran herbívoros semiacuáticos que se alimentaban de plantas acuáticas. Estudios adicionales de especímenes dentales del este de Brasil sugieren que los Glyptotherium eran herbívoros en hábitats húmedos, de tierras bajas tropicales a subtropicales a lo largo de ríos o fuentes de agua, lo que respalda la hipótesis semiacuática de Glyptotherium . [36] [23] [56] Evidencia isotópica adicional de Brasil sugiere que las frutas también eran parte de las dietas de Glyptotherium , aunque solo alrededor del 20% del total. [57] Glyptotherium y todos los demás gliptodontes tenían dientes hipsodontes, dientes de corona alta con superficies ásperas y planas adaptadas para moler y triturar, que estaban adaptados para descomponer material arenoso y fibroso como las hierbas. [58] [41] Esta dieta para Glyptotherium contrasta con las supuestas para sus parientes Pampatheres , que han sido considerados insectívoros o herbívoros. [54] [59] Como la mayoría de los otros xenartros, los gliptodontes tenían menores requerimientos de energía que la mayoría de los otros mamíferos. Podían sobrevivir con tasas de ingesta más bajas que otros herbívoros con una masa similar. [60]
Muchas especies actuales de armadillo tienen la capacidad de excavar, con grandes garras adaptadas para raspar la tierra y hacer madrigueras o buscar comida bajo tierra. [61] [62] Además, gran parte de su dieta consiste en insectos y otros invertebrados que viven bajo tierra, [63] en contraste con las dietas herbívoras de Glyptotherium . [64] Al pertenecer a la familia del armadillo, las capacidades fosoriales de los gliptodontes se han investigado en varias ocasiones. [47] Owen (1841) se opuso a esta idea, aunque Nodot (1856) y Sénéchal (1865) se opusieron a esta idea, ya que creían que el género podía excavar. [47] [48] Sin embargo, la evolución de un caparazón rígido en lugar de uno flexible en los armadillos actuales, así como una cresta deltoidea poco desarrollada en el húmero (hueso del brazo superior), proporcionaron evidencia en contra de las hipótesis fosoriales. El codo tenía un gran rango de movimiento, al igual que los cingulados excavadores, pero es más probable que esto se deba a adaptaciones de tamaño. [65] [47]
Los ejemplares juveniles y adultos de Glyptotherium texanum encontrados en localidades de Blancan en Arizona conservan una serie de crecimiento casi completa, una de las pocas conocidas en gliptodontes. [21] Los dientes de Glyptotherium conservan la hipsodoncia, donde los dientes no dejan de crecer. [21] En los juveniles, ya se conoce el contacto osteodermo-osteodermo completamente articulado, incluso a su edad. [21] El crecimiento de los osteodermos continuó desde juveniles hasta subadultos y cesó cuando los osteodermos se anquilosaron (se fusionaron). [17] [21] El perfil lateral de los caparazones juveniles es suavemente convexo en los caparazones de arco alto de los adultos. Otro cambio ontogenético está en los surcos y figuras periféricas de los osteodermos; las figuras centrales son las más grandes en relación con los surcos en los recién nacidos y juveniles, pero esta relación se vuelve menor en los adultos. En G. cylindricum, sin embargo, los osteodermos crecen mucho más rápido y los surcos son mucho más pequeños. Los osteodermos también son relativamente más gruesos en los individuos juveniles de Glyptotherium en comparación con los adultos. [21]
Los individuos de Glyptotherium texanum encontrados en localidades de Blancan en Arizona conservan dimorfismo sexual entre individuos machos y hembras. La abertura caudal, los grandes osteodermos cónicos que protegen la base de la cola, de machos y hembras difieren en que los osteodermos marginales de los machos son mucho más cónicos y convexos que los de las hembras. Incluso en los caparazones de los Glyptotherium recién nacidos , los osteodermos marginales son cónicos o planos, lo que permite determinar su sexo. [21]

Los osteodermos de Glyptotherium están formados por un núcleo trabecular esponjoso entre dos capas compactas. Cada osteodermo hexagonal está unido a los osteodermos adyacentes con suturas, creando un caparazón grande y robusto similar al de los animales modernos. Sin embargo, los caparazones de gliptodontes como Glyptotherium eran mucho menos flexibles que los de los armadillos modernos. [66] El núcleo trabecular estaba formado por puntales utilizados como soporte con un grosor medio de 0,25 mm, estos puntales formaban el soporte central del osteodermo. Los análisis mecánicos revelaron que las áreas de carga más pequeñas, que representan objetos más afilados, provocan tensiones más altas que las causadas por objetos grandes y contundentes. Esto puede entenderse como que la estructura natural evolucionó para soportar el impacto contundente de objetos grandes como las mazas de cola y no como protección contra objetos afilados como los dientes. [37] Esto presenta más evidencia de la teoría de que los gliptodontes utilizaban sus caparazones para el combate intraespecífico utilizando mazas de cola, así como para la defensa. [37]
Un esqueleto postcraneal parcial de Glyptotherium cylindricum encontrado en el noreste de Brasil que incluía extremidades parciales conservaba 3 tipos diferentes de artritis: un tipo de artritis inflamatoria ( espondiloartropatía ), un tipo de artritis cristalina ( enfermedad por depósito de pirofosfato de calcio ) y una artritis proliferativa ( osteoartritis ). La espondiloartropatía fue la más prevalente, con erosión ósea en el cúbito derecho, radios derecho e izquierdo, un fémur izquierdo y tibias y peroné derechos e izquierdos y está asociada con esclerosis ósea en el cúbito y el radio derechos. La enfermedad por depósito de pirofosfato de calcio está presente en la superficie articular de la rótula izquierda y la osteoartritis está representada por osteofitos en algunas de las extremidades traseras izquierdas. [67] En varios osteodermos que también se encontraron en Brasil, se encontraron ectoparasitismo, lesiones y crecimientos, algunas de estas infecciones probablemente fueron causadas por pulgas. [68]
Glyptotherium era principalmente un herbívoro en pastizales boscosos y sabanas arbóreas, aunque es posible que haya preferido pastizales cerca de fuentes de agua según las localidades de fósiles de México. [54] Debido a su amplia distribución, la paleoecología de Glyptotherium puede haber variado según las regiones y sus 2 especies. [23] [54]

En América del Norte, Glyptotherium se conoce a partir de 2 especies diferentes que vivieron en 3 intervalos diferentes, el Blancano , el Irvingtoniano y el Rancholabreano , en varios estados de EE. UU. y México. [2] Sin embargo, Glyptotherium no se ha encontrado en las cuencas del Pacífico en los Estados Unidos o al oeste del río Colorado , [2] estando presente en gran parte en la llanura atlántica y las llanuras interiores . [69] Durante el Blancano, Glyptotherium texanum coexistió con muchos géneros endémicos de América del Norte, ya que Beringia aún no se había formado. Debido a esto, la fauna del Blancano contrastó marcadamente con la fauna del Pleistoceno precedente . Los estratos de la edad Blancano del oeste de Texas, Nuevo México y Arizona preservan los proboscídeos gonfotéricos Stegomastodon y Cuvieronius , équidos representados por herbívoros como Nannipus y Equus . También se conocen otros xenartros, como el perezoso terrestre megalóniquido Megalonyx y el milodontido Paramylodon . También se han desenterrado fósiles de pequeños mamíferos, como los insectívoros Hesperoscalops y Sorex . También se conoce una ardilla terrestre fósil gigante, Paenemarmota , del Blancan. [70] Los carnívoros incluyen al inusual pariente perro "aplastador de huesos" Borophagus y la "hiena corredora" Chasmaporthetes , [71] además del gato "dientes de sable" Smilodon gracilis . [72] También se han encontrado algunos fósiles de aves aisladas que consisten en buitres, halcones y posiblemente córvidos. [71] [73] [74] Los fósiles de Guatemala se encontraron en grandes altitudes, lo que demuestra que Glyptotherium era muy adaptable y podía vivir en una variedad de entornos. [75] Esto se ve respaldado por la dieta generalista de Glyptotherium y los descubrimientos de fósiles en ambientes tropicales, subtropicales, boscosos e incluso semiacuáticos. En el estado mexicano de Yucatán, se conocen fósiles de Glyptotherium y del perezoso terrestre Paramylodon en áreas ricas en agua, como bosques riparios y pantanos, en lugar de pastizales abiertos. [76]
En la Región Intertropical Brasileña (RIB) en el este de Brasil, Glyptotherium era un herbívoro mixto en sabanas arbóreas, pastizales tropicales y otras áreas herbáceas cerca de fuentes de agua. Los grandes mamíferos mesoherbívoros en la RIB estaban muy extendidos y eran diversos, incluidos los toxodóntidos parecidos a vacas Toxodon platensis y Piauhytherium , el litopterno macrauchenido Xenorhinotherium y équidos como Hippidion principale y Equus neogaeus . Los toxodóntidos también eran grandes herbívoros mixtos y vivían en áreas boscosas, mientras que los équidos eran casi exclusivamente herbívoros. También hay otros fósiles de xenartros en el área de varias familias diferentes, como el perezoso terrestre megatérido gigante Eremotherium , los escelidotéridos Catonyx y Valgipes , los milodontidos Glossotherium , Ocnotherium y Mylodonopsis . También se han encontrado en la zona perezosos terrestres más pequeños, como los megalóníquidos Ahytherium y Australonyx y el notrotérido Nothrotherium . Eremotherium era un generalista, mientras que Nothrotherium era un especialista en árboles en bosques de baja densidad, y Valgipes era un intermedio de los dos que vivían en sabanas arbóreas. Otros gliptodontes y cingulados, como el gliptodonte de pastoreo Panochthus y los pampaterios omnívoros Pampatherium y Holmesina , estaban presentes en los pastizales abiertos. También se ha encontrado una especie de proboscídeo en el BIR, Notiomastodon platensis , que también estaba presente y era un pastoreador mixto en los pastizales abiertos. Los carnívoros incluían algunos de los carnívoros mamíferos más grandes conocidos, como el félido gigante Smilodon populator y el oso Arctotherium wingei . [55] [56] También se conocen varios taxones existentes del BIR, como guanacos , osos hormigueros gigantes , pecaríes de collar y zorrillos de nariz de cerdo rayados . [77] También se conocen dos tipos de mamíferos cangrejeros existentes del BIR, el mapache cangrejero y el zorro cangrejero , lo que indica que los cangrejos también estaban presentes en la región. [77] El entorno del BIR no está claro, ya que había varias especies que eran herbívoras, pero el antecedente de los monos fósiles arbóreos Protopithecus y Caipora en el área causa confusión sobre el paleoambiente del área. Se pensaba que la mayor parte de Brasil estaba cubierta de vegetación tropical abierta de cerrado durante el Pleistoceno tardío, pero si Protopithecus y Caipora eran arbóreos, su presencia sugiere que la región puede haber albergado un bosque denso y cerrado durante el Pleistoceno tardío. [77] [78] Es posible que la región alternara entre sabana abierta seca y bosque húmedo cerrado a lo largo del cambio climático del Pleistoceno tardío. [79]

Sudamérica, el continente donde se originaron los gliptodontes, quedó aislada después de la ruptura de la masa continental de Gondwana al final de la era Mesozoica . [80] Este período de separación del resto de los continentes de la Tierra condujo a una era de evolución única de los mamíferos, con el predominio de grupos como los marsupiales , los xenartros y los notoungulados en contraste con la fauna de mamíferos de América del Norte. Los marsupiales probablemente llegaron a Sudamérica antes de su separación del resto de Gondwana en el Cretácico Superior o el Paleógeno , aunque los orígenes de los órdenes de mamíferos como Xenarthra y Notoungulata que terminaron en el continente siguen siendo un misterio. [81] Hubo varios movimientos de mamíferos externos a Sudamérica antes de la formación del istmo de Panamá , como los primates y roedores que pueden haber llegado en balsa al continente desde África y el movimiento de murciélagos a través del vuelo. [82] [83] En cuanto a la fauna de América del Norte, grupos contemporáneos como cánidos, félidos, úrsidos , tapíridos , antilocápridos y équidos poblaron la región además de familias extintas como gonfotéridos, anficiónidos y mamutidos . [84] [80] El Gran Intercambio Americano no entró en su etapa más grande hasta que se formó el Istmo de Panamá hace 2,7 millones de años durante la etapa Blancan del Plioceno. [85] [86] [87] Esto intensificó el movimiento de gliptodontes, perezosos terrestres, capibaras, pampatizos, pájaros del terror y marsupiales a América del Norte a través de la ruta de América Central y una migración inversa de ungulados, proboscídeos, félidos, cánidos y muchos otros grupos de megafauna a América del Sur. [88] El período posterior a la fundación del Istmo fue testigo de la extinción o extirpación de muchos grupos, incluidos los pájaros del terror sudamericanos, los toxodontes, los macraucheniids , los pampaterios, los perezosos terrestres y los gliptodontes. [89] [90]
El propio Glyptotherium fue parte de este intercambio, evolucionando en el Blancano de México y los EE. UU. después de la formación del Istmo y su inmigración. [2] [88] El aislamiento geográfico de Glyptotherium en combinación con las adaptaciones a los diferentes entornos de América del Norte llevaron a que Glyptotherium se separara de otros gliptodontinos. [2]
Aunque G. texanum evolucionó en América del Norte a G. cylindricum en el Rancholabreano, emigró hacia el sur a América Central y partes del norte de América del Sur alrededor de 15.000-20.000 BP. [26] [22] [91] Esto también está relacionado con la segregación ecológica, con barreras montañosas en Colombia posiblemente separando a Glyptodon y Glyptotherium . [32] Posteriormente, Glyptodon vivió principalmente en sitios andinos y costeros, y Glyptotherium se conocía de pastizales y depósitos de tierras bajas ligeramente boscosas cerca de áreas acuáticas, lo que motivó su dispersión a las regiones tropicales de Venezuela y el este de Brasil. [87] [23] [92] También se ha observado el reingreso de un grupo a Sudamérica desde América del Norte en la familia cingulada relacionada Pampatheriidae, [86] posiblemente ayudado por amplias tierras bajas costeras descubiertas durante períodos glaciares en las costas del Caribe y el Atlántico, lo que permitió la migración entre Florida, México, América Central y/o el norte de Sudamérica. [87] [93]
Es posible que Smilodon haya atacado ocasionalmente a Glyptotherium , basándose en un cráneo de un individuo de Glyptotherium texanum recuperado de depósitos del Pleistoceno en Arizona que presenta las distintivas marcas de punción elípticas que mejor coinciden con las del felino machairodonte , lo que indica que el depredador mordió con éxito el cráneo a través del escudo cefálico blindado. [94] El Glyptotherium en cuestión era un juvenil, con un escudo en la cabeza aún en desarrollo, lo que lo hacía mucho más vulnerable al ataque del felino. [95] Aunque George Brandes teorizó originalmente que era posible en 1900, [96] los caninos de Smilodon no podían perforar los gruesos osteodermos del caparazón de los gliptodontes. [97]
Brandes planteó la hipótesis de que la evolución de la gruesa armadura de los gliptodontes y los largos caninos de los machairodontes era un ejemplo de coevolución, [96] pero Birger Bohlin argumentó en 1940 que los caninos eran demasiado frágiles para causar daño contra la armadura de los gliptodontes. [97] [45] Sin embargo, la evolución de las estructuras de protección accesorias puede haber sido en respuesta a la llegada de Smilodon y Arctotherium al Ensenadan . [45]
En 2017, se describió un cúbito derecho de un Glyptotherium adulto que había sido recolectado de estratos del Pleistoceno tardío en el estado de Rio Grande do Norte, Brasil, que tenía varios rastros de roeduras de una nueva icnoespecie de Machichnus , M. fatimae , que pueden haber sido causadas por un juvenil de la especie de cánido Protocyon troglodytes o un individuo adulto de Cerdocyon thous . [98]
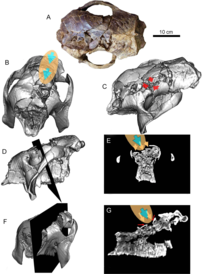
El primer informe de un posible consumo humano o interacción con Glyptotherium o sus fósiles llegó en 1958, donde se describieron varios osteodermos que posiblemente fueron consumidos por humanos del sitio Clovis en Lewisville , Texas. [99] [100] Sin embargo, esta idea del consumo humano tiene poca evidencia que la respalde. [26] En 2022, se describió una gran cantidad de fósiles de Glyptotherium cylindricum, incluidos cráneos, que habían sido recolectados de varios sitios en Falcón , norte de Venezuela, que databan del Pleistoceno tardío . [26] Estos descubrimientos fueron notables no solo porque preservaron cráneos, sino que cuatro de ellos exhibieron roturas en la región frontoparietal, un patrón en todos los cráneos. La evidencia visual y de TC indica que probablemente fueron causadas por un efecto mecánico por percusión directa, muy probablemente un golpe con un picador de piedra o un garrote, que provocó que los huesos de la región se fragmentaran en los tejidos internos blandos del cráneo. A pesar de que los cráneos estaban completos y no mostraban signos de distorsión tafonómica o transporte, a menudo carecían de mandíbulas. Es posible que las mandíbulas hayan sido removidas para que los "cazadores" accedieran y consumieran los músculos masticatorios y la lengua. La coexistencia de los primeros humanos cazadores-recolectores y los gliptodontes en América del Sur se planteó por primera vez en 1881 con base en descubrimientos fósiles de las Pampas argentinas , [101] y desde entonces se han desenterrado muchos descubrimientos fósiles del Pleistoceno tardío que exhiben depredación humana sobre los gliptodontes. Durante este período, una amplia gama de xenartros que habitaban las Pampas fueron cazados por humanos, con evidencia que demuestra que el pequeño (300-450 kg) gliptodonte Neosclerocalyptus , [102] el armadillo Eutatus y el gigantesco (2 toneladas) gliptodonte Doedicurus , el gliptodonte más grande conocido, fueron cazados. [103] El único otro registro de depredación humana fuera de las Pampas fue un caparazón parcial, encontrado también en Venezuela, que fue eviscerado por humanos. Los descubrimientos en las localidades de Falcón mostraron los primeros signos de caza humana en los cráneos de gliptodontes, pero Glyptotherium también era más indefenso que gliptodontes como Doedicurus . [26] [104]
Glyptotherium es el único gliptodonte conocido de América del Norte y se lo conoce de varias regiones del continente en diferentes períodos. Durante la etapa Blancanense del Plioceno Temprano , Glyptotherium texanum habitó solo el centro de México según el descubrimiento de un solo osteodermo de Glyptotherium texanum de los estratos del Plioceno Temprano de Guanajuato , centro de México, que data de hace aprox. 3,6 millones de años. [2] [105] En las etapas Blancanense- Irvingtonianas del Pleistoceno Temprano , se conocen fósiles de G. texanum en la mayor parte de México, así como en los estados estadounidenses de Arizona , Texas , Oklahoma , Florida y posiblemente Carolina del Sur . [2] [105] En el Rancholabreano del Pleistoceno tardío , G. cylindricum evolucionó de G. texanum y sus fósiles han sido desenterrados en el norte de Venezuela , el este de Brasil , América Central , México y los estados estadounidenses de Texas, Luisiana , Florida y Carolina del Sur. [2] [105] [106] [53] No se han encontrado fósiles de Glyptotherium del Plioceno temprano en América Central, pero es probable que G. texanum habitara el área durante el Gran Intercambio Biótico Americano . No se conocen fósiles de gliptodontes del Irvingtoniano medio-tardío en los EE. UU., lo que crea una "brecha de gliptodontes" en el registro fósil estadounidense. [2] Sin embargo, se registra Glyptotherium durante esta "pausa" en América Central, lo que sugiere una posible retracción de Glyptotherium a las áreas del sur durante las épocas glaciales. [91]

Se han recolectado fósiles de Glyptotherium de América Central en Guatemala , [75] Costa Rica , [107] Honduras , [108] El Salvador , [109] y Panamá . [110] Los fósiles de América Central suelen ser aislados y fragmentarios, y la mayoría son osteodermos o molariformes aislados. [2] [111] En 2023, se describió un esqueleto asociado de G. cylindricum , que incluye elementos de cráneo y extremidades, de Guatemala, el espécimen más completo de la región. [112] Es muy probable que las primeras poblaciones de Glyptotherium comenzaran en América Central durante el Gran Intercambio Biótico Americano en el Plioceno Tardío con base en su paleobiogeografía. [2] [21] Los fósiles de Glyptotherium de América Central a veces se ubican como una especie indeterminada, [23] [22] pero la mayoría se ubican en Glyptotherium cylindricum o sus sinónimos. [75] [107] Esta referencia también se basa en la edad de los fósiles, ya que la edad de los fósiles de G. texanum se mide desde el Plioceno hasta el Pleistoceno temprano, mientras que la edad de los fósiles de G. cylindricum se limita al Pleistoceno tardío. [2] [113]
Aunque comúnmente se considera un género exclusivamente norteamericano, [113] [22] [2] se han descubierto fósiles de Glyptotherium del norte de Sudamérica en áreas como Brasil y Venezuela . [22] [26] Los fósiles de Sudamérica suelen ser solo osteodermos o anillos caudales y, a veces, son indeterminados a nivel de especie, pero lo más probable es que sean de Glyptotherium cylindricum . [2] [22] [26]
La cronología de las extinciones de megafauna (como Glyptotherium ) en las extinciones del Pleistoceno tardío ha sido discutida. [69] En los Estados Unidos, la última fecha de radiocarbono directa confiable para Glyptotherium es 23,230 ± 490 BP, de Laubach Cave No. 3 , Texas. [114] [69] Glyptotherium se agrupa junto con Eremotherium , Holmesina y Paramylodon como teniendo fechas finales confiables antes del final del Último Máximo Glacial de América del Norte. [115] Sin embargo, los análisis estadísticos sugieren que es posible una supervivencia posterior hasta el Pleistoceno terminal de los Estados Unidos, basándose en sesgos de muestreo asociados con una fauna poco común y una falta de fechas confiables de la llanura atlántica húmeda debido a una mala conservación. [69]
En América del Sur, los restos quemados de Glyptotherium han sido fechados de manera imprecisa entre 16.375 ± 400 AP y 14.300 ± 500 AP en Muaco, Venezuela, [26] con técnicas similares que datan un espécimen de Glyptotherium de Taima-Taima a 12.580 ± 60 AP, [116] [117] aunque una fecha mínima de todo el conjunto (~15.780 cal. AP, 12.980 ± 85 AP) es más reciente. [26] Al igual que con otra megafauna extinta del Pleistoceno, las posibles causas de extinción incluyen la caza humana y el cambio climático asociado con el intervalo frío del Dryas Reciente . [69]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )