El helio (del griego ἥλιος , romanizado : helios , lit. ' sol') es un elemento químico ; tiene símbolo He y número atómico 2. Es un gas incoloro, inodoro, no tóxico, inerte , monoatómico y el primero en el grupo de los gases nobles en la tabla periódica . [a] Su punto de ebullición es el más bajo entre todos los elementos , y no tiene punto de fusión a presiones estándar. Es el segundo elemento más ligero y el segundo más abundante en el universo observable , después del hidrógeno . Está presente en aproximadamente el 24% de la masa elemental total, que es más de 12 veces la masa de todos los elementos más pesados combinados. Su abundancia es similar a esta tanto en el Sol como en Júpiter , debido a la muy alta energía de enlace nuclear (por nucleón ) del helio-4 , con respecto a los siguientes tres elementos después del helio. Esta energía de enlace del helio-4 también explica por qué es un producto tanto de la fusión nuclear como de la desintegración radiactiva . El isótopo más común del helio en el universo es el helio-4, cuya gran mayoría se formó durante el Big Bang . Grandes cantidades de helio nuevo se crean por la fusión nuclear del hidrógeno en las estrellas .
El helio fue detectado por primera vez como una línea espectral amarilla desconocida en la luz del sol durante un eclipse solar en 1868 por Georges Rayet , [14] el capitán CT Haig, [15] Norman R. Pogson , [16] y el teniente John Herschel, [17] y fue confirmado posteriormente por el astrónomo francés Jules Janssen . [18] A menudo se le atribuye a Janssen la detección del elemento, junto con Norman Lockyer . Janssen registró la línea espectral de helio durante el eclipse solar de 1868, mientras que Lockyer la observó desde Gran Bretaña. Sin embargo, solo Lockyer propuso que la línea se debía a un nuevo elemento, al que nombró en honor al Sol. El descubrimiento formal del elemento fue realizado en 1895 por los químicos Sir William Ramsay , Per Teodor Cleve y Nils Abraham Langlet , quienes encontraron helio emanando del mineral de uranio cleveíta , que ahora no se considera una especie mineral separada, sino una variedad de uraninita . [19] [20] En 1903, se encontraron grandes reservas de helio en campos de gas natural en partes de los Estados Unidos, con mucho el mayor proveedor de gas en la actualidad.
El helio líquido se utiliza en criogenia (su mayor uso individual, consumiendo aproximadamente una cuarta parte de la producción) y en la refrigeración de imanes superconductores , con su principal aplicación comercial en los escáneres de resonancia magnética . Otros usos industriales del helio (como gas de presurización y purga, como atmósfera protectora para soldadura por arco y en procesos como el crecimiento de cristales para hacer obleas de silicio ) representan la mitad del gas producido. Un uso pequeño pero bien conocido es como gas de elevación en globos y dirigibles . [21] Como ocurre con cualquier gas cuya densidad difiere de la del aire, inhalar un pequeño volumen de helio cambia temporalmente el timbre y la calidad de la voz humana . En la investigación científica, el comportamiento de las dos fases fluidas del helio-4 (helio I y helio II) es importante para los investigadores que estudian la mecánica cuántica (en particular la propiedad de la superfluidez ) y para quienes observan los fenómenos, como la superconductividad , producidos en la materia cerca del cero absoluto .
En la Tierra, es relativamente raro: 5,2 ppm por volumen en la atmósfera . La mayor parte del helio terrestre presente en la actualidad se crea por la desintegración radiactiva natural de elementos radiactivos pesados ( torio y uranio , aunque hay otros ejemplos), ya que las partículas alfa emitidas por dichas desintegraciones consisten en núcleos de helio-4 . Este helio radiogénico está atrapado con gas natural en concentraciones de hasta el 7% en volumen, del que se extrae comercialmente mediante un proceso de separación a baja temperatura llamado destilación fraccionada . El helio terrestre es un recurso no renovable porque una vez liberado a la atmósfera, escapa rápidamente al espacio . Se cree que su suministro está disminuyendo rápidamente. [22] [23] Sin embargo, algunos estudios sugieren que el helio producido en las profundidades de la Tierra por desintegración radiactiva puede acumularse en reservas de gas natural en cantidades mayores de lo esperado, [24] en algunos casos habiendo sido liberado por la actividad volcánica. [25]
La primera evidencia de helio fue observada el 18 de agosto de 1868, como una línea amarilla brillante con una longitud de onda de 587,49 nanómetros en el espectro de la cromosfera del Sol . La línea fue detectada por el astrónomo francés Jules Janssen durante un eclipse solar total en Guntur , India. [26] [27] Inicialmente se asumió que esta línea era sodio . El 20 de octubre del mismo año, el astrónomo inglés Norman Lockyer observó una línea amarilla en el espectro solar, a la que llamó D 3 porque estaba cerca de las conocidas líneas de Fraunhofer D 1 y D 2 del sodio. [28] [29] Concluyó que era causada por un elemento en el Sol desconocido en la Tierra. Lockyer nombró al elemento con la palabra griega para el Sol, ἥλιος ( helios ). [30] [31] A veces se dice que el químico inglés Edward Frankland también estuvo involucrado en la denominación, pero esto es poco probable ya que dudaba de la existencia de este nuevo elemento. La terminación "-ium" es inusual, ya que normalmente se aplica solo a elementos metálicos; probablemente Lockyer, siendo astrónomo, desconocía las convenciones químicas. [32]
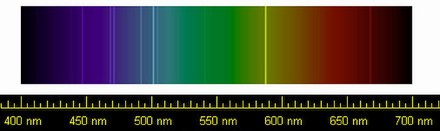
En 1881, el físico italiano Luigi Palmieri detectó helio en la Tierra por primera vez a través de su línea espectral D 3 , cuando analizó un material que había sido sublimado durante una erupción reciente del Monte Vesubio . [33]

.jpg/440px-Clevite_sample_(35321726345).jpg)
El 26 de marzo de 1895, el químico escocés Sir William Ramsay aisló helio en la Tierra al tratar el mineral cleveíta (una variedad de uraninita con al menos un 10% de elementos de tierras raras ) con ácidos minerales . Ramsay buscaba argón pero, después de separar el nitrógeno y el oxígeno del gas, liberado por el ácido sulfúrico , notó una línea amarilla brillante que coincidía con la línea D 3 observada en el espectro del Sol. [29] [35] [36] [37] Estas muestras fueron identificadas como helio por Lockyer y el físico británico William Crookes . [38] [39] Fue aislado independientemente de la cleveíta en el mismo año por los químicos Per Teodor Cleve y Abraham Langlet en Uppsala , Suecia, quienes recolectaron suficiente gas para determinar con precisión su peso atómico . [40] [41] [27] [42] El geoquímico estadounidense William Francis Hillebrand también aisló helio antes del descubrimiento de Ramsay, cuando notó líneas espectrales inusuales mientras probaba una muestra del mineral uraninita. Hillebrand, sin embargo, atribuyó las líneas al nitrógeno . [43] Su carta de felicitación a Ramsay ofrece un caso interesante de descubrimiento, y casi descubrimiento, en la ciencia. [44]
En 1907, Ernest Rutherford y Thomas Royds demostraron que las partículas alfa son núcleos de helio al permitir que las partículas penetraran la delgada pared de vidrio de un tubo de vacío , creando luego una descarga en el tubo, para estudiar el espectro del nuevo gas en su interior. [45] En 1908, el helio fue licuado por primera vez por el físico holandés Heike Kamerlingh Onnes al enfriar el gas a menos de 5 K (−268,15 °C; −450,67 °F). [46] [47] Intentó solidificarlo reduciendo aún más la temperatura, pero fracasó, porque el helio no se solidifica a presión atmosférica. El estudiante de Onnes, Willem Hendrik Keesom, finalmente pudo solidificar 1 cm 3 de helio en 1926 aplicando presión externa adicional. [48] [49]
En 1913, Niels Bohr publicó su "trilogía" [50] [51] sobre la estructura atómica que incluía una reconsideración de la serie de Pickering-Fowler como evidencia central en apoyo de su modelo del átomo . [52] [53] Esta serie lleva el nombre de Edward Charles Pickering , quien en 1896 publicó observaciones de líneas previamente desconocidas en el espectro de la estrella ζ Puppis [54] (ahora se sabe que ocurren con Wolf-Rayet y otras estrellas calientes). [55] Pickering atribuyó la observación (líneas en 4551, 5411 y 10123 Å ) a una nueva forma de hidrógeno con niveles de transición de medio entero. [56] [57] En 1912, Alfred Fowler [58] logró producir líneas similares a partir de una mezcla de hidrógeno y helio, y apoyó la conclusión de Pickering en cuanto a su origen. [59] El modelo de Bohr no permite transiciones de semienteros (ni tampoco la mecánica cuántica) y Bohr concluyó que Pickering y Fowler estaban equivocados, y en su lugar asignó estas líneas espectrales al helio ionizado, He + . [60] Fowler fue inicialmente escéptico [61] pero finalmente se convenció [62] de que Bohr estaba en lo cierto, [50] y en 1915 "los espectroscopistas habían transferido [la serie Pickering-Fowler] definitivamente [del hidrógeno] al helio". [53] [63] El trabajo teórico de Bohr sobre la serie de Pickering había demostrado la necesidad de "un reexamen de los problemas que parecían ya haber sido resueltos dentro de las teorías clásicas" y proporcionó una confirmación importante para su teoría atómica. [53]
En 1938, el físico ruso Pyotr Leonidovich Kapitsa descubrió que el helio-4 casi no tiene viscosidad a temperaturas cercanas al cero absoluto , un fenómeno ahora llamado superfluidez . [64] Este fenómeno está relacionado con la condensación de Bose-Einstein . En 1972, los físicos estadounidenses Douglas D. Osheroff , David M. Lee y Robert C. Richardson observaron el mismo fenómeno en el helio-3 , pero a temperaturas mucho más cercanas al cero absoluto. Se cree que el fenómeno en el helio-3 está relacionado con el apareamiento de fermiones de helio-3 para formar bosones , en analogía con los pares de electrones de Cooper que producen superconductividad . [65]
En 1961, Vignos y Fairbank informaron de la existencia de una fase diferente del helio-4 sólido, denominada fase gamma, que existe en un estrecho intervalo de presiones entre 1,45 y 1,78 K. [66]

Después de una operación de perforación de petróleo en 1903 en Dexter, Kansas , que produjo un géiser de gas que no ardía, el geólogo estatal de Kansas Erasmus Haworth recolectó muestras del gas que escapaba y las llevó de regreso a la Universidad de Kansas en Lawrence, donde, con la ayuda de los químicos Hamilton Cady y David McFarland, descubrió que el gas consistía, en volumen, en un 72% de nitrógeno, un 15% de metano (un porcentaje combustible solo con suficiente oxígeno), un 1% de hidrógeno y un 12% de un gas no identificable. [27] [67] Con un análisis más profundo, Cady y McFarland descubrieron que el 1,84% de la muestra de gas era helio. [68] [69] Esto demostró que, a pesar de su rareza general en la Tierra, el helio se concentraba en grandes cantidades bajo las Grandes Llanuras estadounidenses , disponible para su extracción como subproducto del gas natural . [70]
Siguiendo una sugerencia de Sir Richard Threlfall , la Armada de los Estados Unidos patrocinó tres pequeñas plantas experimentales de helio durante la Primera Guerra Mundial. El objetivo era abastecer globos de barrera con el gas no inflamable y más ligero que el aire. En el programa se produjo un total de 5700 m3 ( 200 000 pies cúbicos) de helio al 92%, aunque anteriormente se había obtenido menos de un metro cúbico del gas. [29] Parte de este gas se utilizó en el primer dirigible lleno de helio del mundo, el dirigible de clase C C-7 de la Armada de los Estados Unidos, que realizó su viaje inaugural desde Hampton Roads, Virginia , hasta Bolling Field en Washington, DC, el 1 de diciembre de 1921, [71] casi dos años antes de que el primer dirigible rígido lleno de helio de la Armada , el USS Shenandoah construido por la Naval Aircraft Factory , volara en septiembre de 1923.
Aunque el proceso de extracción mediante licuefacción de gas a baja temperatura no se desarrolló a tiempo para ser significativo durante la Primera Guerra Mundial, la producción continuó. El helio se utilizó principalmente como gas de elevación en naves más ligeras que el aire. Durante la Segunda Guerra Mundial, aumentó la demanda de helio para gas de elevación y para soldadura con arco protegido . El espectrómetro de masas de helio también fue vital en el Proyecto Manhattan de la bomba atómica . [72]
El gobierno de los Estados Unidos estableció la Reserva Nacional de Helio en 1925 en Amarillo, Texas , con el objetivo de abastecer a los dirigibles militares en tiempos de guerra y a los dirigibles comerciales en tiempos de paz. [29] Debido a la Ley de Helio de 1925 , que prohibía la exportación del escaso helio sobre el que Estados Unidos tenía entonces un monopolio de producción, junto con el coste prohibitivo del gas, los zepelines alemanes se vieron obligados a utilizar hidrógeno como gas de elevación, que ganaría infamia en el desastre del Hindenburg . El mercado del helio después de la Segunda Guerra Mundial estaba deprimido, pero la reserva se amplió en la década de 1950 para garantizar un suministro de helio líquido como refrigerante para crear combustible de cohetes de oxígeno/hidrógeno (entre otros usos) durante la carrera espacial y la Guerra Fría . El uso de helio en los Estados Unidos en 1965 fue más de ocho veces el consumo máximo en tiempos de guerra. [73]
Después de las Enmiendas a la Ley de Helio de 1960 (Ley Pública 86-777), la Oficina de Minas de los Estados Unidos organizó cinco plantas privadas para recuperar helio del gas natural. Para este programa de conservación de helio, la Oficina construyó un gasoducto de 425 millas (684 km) desde Bushton, Kansas , para conectar esas plantas con el campo de gas de Cliffside parcialmente agotado del gobierno cerca de Amarillo, Texas. Esta mezcla de helio y nitrógeno se inyectó y almacenó en el campo de gas de Cliffside hasta que se necesitó, momento en el que se purificó aún más. [74]
En 1995, se habían recolectado mil millones de metros cúbicos de gas y la reserva tenía una deuda de 1.400 millones de dólares, lo que impulsó al Congreso de los Estados Unidos en 1996 a descontinuar la reserva. [27] [75] La Ley de Privatización del Helio de 1996 [76] (Ley Pública 104-273) ordenó al Departamento del Interior de los Estados Unidos vaciar la reserva, y las ventas comenzarían en 2005. [77]
El helio producido entre 1930 y 1945 tenía una pureza de aproximadamente el 98,3 % (2 % de nitrógeno), lo que era adecuado para los dirigibles. En 1945, se produjo una pequeña cantidad de helio al 99,9 % para uso en soldadura. En 1949, ya se disponía de cantidades comerciales de helio de grado A al 99,95 %. [78]
Durante muchos años, Estados Unidos produjo más del 90% del helio comercialmente utilizable en el mundo, mientras que las plantas de extracción en Canadá, Polonia, Rusia y otras naciones produjeron el resto. A mediados de la década de 1990, comenzó a funcionar una nueva planta en Arzew , Argelia, que produce 17 millones de metros cúbicos (600 millones de pies cúbicos), con suficiente producción para cubrir toda la demanda de Europa. Mientras tanto, en 2000, el consumo de helio dentro de los EE. UU. había aumentado a más de 15 millones de kg por año. [79] En 2004-2006, se construyeron plantas adicionales en Ras Laffan , Qatar , y Skikda , Argelia. Argelia se convirtió rápidamente en el segundo productor líder de helio. [80] Durante este tiempo, tanto el consumo de helio como los costos de producción de helio aumentaron. [81] De 2002 a 2007, los precios del helio se duplicaron. [82]
En 2012 [actualizar], la Reserva Nacional de Helio de los Estados Unidos representaba el 30 por ciento del helio del mundo. [83] Se esperaba que la reserva se quedara sin helio en 2018. [83] A pesar de eso, un proyecto de ley propuesto en el Senado de los Estados Unidos permitiría que la reserva continuara vendiendo el gas. Otras grandes reservas estaban en Hugoton en Kansas , Estados Unidos, y en los campos de gas cercanos de Kansas y las zonas del Panhandle de Texas y Oklahoma . Se programó la apertura de nuevas plantas de helio en 2012 en Qatar , Rusia y el estado estadounidense de Wyoming , pero no se esperaba que aliviaran la escasez. [83]
En 2013, Qatar puso en marcha la unidad de helio más grande del mundo, [84] aunque la crisis diplomática de Qatar de 2017 afectó gravemente la producción de helio allí. [85] Se reconoció ampliamente que 2014 fue un año de exceso de oferta en el negocio del helio, luego de años de escasez notoria. [86] Nasdaq informó (2015) que para Air Products , una corporación internacional que vende gases para uso industrial, los volúmenes de helio siguen bajo presión económica debido a las limitaciones de suministro de materia prima. [87]

En la perspectiva de la mecánica cuántica , el helio es el segundo átomo más simple de modelar, después del átomo de hidrógeno . El helio está compuesto de dos electrones en orbitales atómicos que rodean un núcleo que contiene dos protones y (generalmente) dos neutrones. Como en la mecánica newtoniana, ningún sistema que consta de más de dos partículas puede resolverse con un enfoque matemático analítico exacto (ver problema de los 3 cuerpos ) y el helio no es una excepción. Por lo tanto, se requieren métodos matemáticos numéricos, incluso para resolver el sistema de un núcleo y dos electrones. Tales métodos de química computacional se han utilizado para crear una imagen mecánica cuántica de la unión de electrones de helio que es precisa dentro de < 2% del valor correcto, en unos pocos pasos computacionales. [88] Tales modelos muestran que cada electrón en helio apantalla parcialmente el núcleo del otro, de modo que la carga nuclear efectiva Z eff que cada electrón ve es de aproximadamente 1,69 unidades, no las 2 cargas de un núcleo de helio "desnudo" clásico.
El núcleo del átomo de helio-4 es idéntico a una partícula alfa . Los experimentos de dispersión de electrones de alta energía muestran que su carga disminuye exponencialmente desde un máximo en un punto central, exactamente como lo hace la densidad de carga de la propia nube de electrones del helio . Esta simetría refleja una física subyacente similar: el par de neutrones y el par de protones en el núcleo del helio obedecen las mismas reglas de mecánica cuántica que el par de electrones del helio (aunque las partículas nucleares están sujetas a un potencial de enlace nuclear diferente), de modo que todos estos fermiones ocupan completamente orbitales 1s en pares, ninguno de ellos posee momento angular orbital y cada uno cancela el espín intrínseco del otro. Esta disposición es, por lo tanto, energéticamente extremadamente estable para todas estas partículas y tiene implicaciones astrofísicas . [89] Es decir, agregar otra partícula (protón, neutrón o partícula alfa) consumiría energía en lugar de liberarla; todos los sistemas con número de masa 5, así como el berilio-8 (que comprende dos partículas alfa), no están ligados. [90]
Por ejemplo, la estabilidad y la baja energía del estado de nube de electrones en el helio explican la inercia química del elemento, y también la falta de interacción de los átomos de helio entre sí, lo que produce los puntos de fusión y ebullición más bajos de todos los elementos. De manera similar, la estabilidad energética particular del núcleo de helio-4, producida por efectos similares, explica la facilidad de producción de helio-4 en reacciones atómicas que involucran emisión de partículas pesadas o fusión. Se produce algo de helio-3 estable (dos protones y un neutrón) en reacciones de fusión a partir del hidrógeno, aunque su abundancia estimada en el universo es de aproximadamente10 −5 en relación con el helio-4. [91]

La inusual estabilidad del núcleo de helio-4 también es importante cosmológicamente : explica el hecho de que en los primeros minutos después del Big Bang , cuando la "sopa" de protones y neutrones libres que se había creado inicialmente en una proporción de aproximadamente 6:1 se enfrió hasta el punto de que la unión nuclear era posible, casi todos los primeros núcleos atómicos compuestos que se formaron fueron núcleos de helio-4. Debido a la unión relativamente fuerte de los núcleos de helio-4, su producción consumió casi todos los neutrones libres en unos pocos minutos, antes de que pudieran desintegrarse en beta, y por lo tanto quedaron pocos neutrones disponibles para formar átomos más pesados, como el litio, el berilio o el boro. La unión nuclear del helio-4 por nucleón es más fuerte que en cualquiera de estos elementos (ver nucleogénesis y energía de enlace ) y, por lo tanto, una vez que se había formado el helio, no había impulso energético disponible para crear los elementos 3, 4 y 5. [92] Es apenas favorable energéticamente para el helio fusionarse en el siguiente elemento con una energía por nucleón más baja , el carbono. Sin embargo, debido a la corta vida útil del intermedio berilio-8, este proceso requiere que tres núcleos de helio choquen entre sí casi simultáneamente (ver proceso triple-alfa ). [90] Por lo tanto, no hubo tiempo para que se formara carbono significativo en los pocos minutos posteriores al Big Bang, antes de que el universo en expansión primitivo se enfriara hasta el punto de temperatura y presión donde la fusión del helio con el carbono ya no era posible. Esto dejó al universo primitivo con una proporción muy similar de hidrógeno/helio como la que se observa hoy (3 partes de hidrógeno por 1 parte de helio-4 en masa), con casi todos los neutrones del universo atrapados en helio-4.
Todos los elementos más pesados (incluidos los necesarios para los planetas rocosos como la Tierra y para la vida basada en el carbono u otros) se han creado desde el Big Bang en estrellas que estaban lo suficientemente calientes como para fusionar el propio helio. Todos los elementos distintos del hidrógeno y el helio representan hoy solo el 2% de la masa de la materia atómica del universo. El helio-4, en cambio, comprende alrededor del 24% de la masa de la materia ordinaria del universo, casi toda la materia ordinaria que no es hidrógeno. [91] [93]

El helio es el segundo gas noble menos reactivo después del neón y, por lo tanto, el segundo menos reactivo de todos los elementos. [94] Es químicamente inerte y monoatómico en todas las condiciones estándar. Debido a la masa molar (atómica) relativamente baja del helio, su conductividad térmica , calor específico y velocidad del sonido en la fase gaseosa son mayores que las de cualquier otro gas excepto el hidrógeno . Por estas razones y el pequeño tamaño de las moléculas monoatómicas de helio, el helio se difunde a través de los sólidos a una velocidad tres veces mayor que la del aire y alrededor del 65% de la del hidrógeno. [29]
El helio es el gas monoatómico menos soluble en agua, [95] y uno de los menos solubles en agua de todos los gases ( CF 4 , SF 6 y C 4 F 8 tienen solubilidades en fracción molar más bajas: 0,3802, 0,4394 y 0,2372 x 2 /10 −5 , respectivamente, frente a 0,70797 x 2 /10 −5 del helio ), [96] y el índice de refracción del helio es más cercano a la unidad que el de cualquier otro gas. [97] El helio tiene un coeficiente de Joule-Thomson negativo a temperaturas ambiente normales, lo que significa que se calienta cuando se le permite expandirse libremente. Solo por debajo de su temperatura de inversión de Joule-Thomson (de aproximadamente 32 a 50 K a 1 atmósfera) se enfría durante la expansión libre. [29] Una vez preenfriado por debajo de esta temperatura, el helio se puede licuar a través del enfriamiento por expansión.
La mayor parte del helio extraterrestre es plasma en estrellas, con propiedades bastante diferentes a las del helio atómico. En un plasma, los electrones del helio no están ligados a su núcleo, lo que da lugar a una conductividad eléctrica muy alta, incluso cuando el gas está solo parcialmente ionizado. Las partículas cargadas están muy influenciadas por los campos magnéticos y eléctricos. Por ejemplo, en el viento solar junto con el hidrógeno ionizado, las partículas interactúan con la magnetosfera de la Tierra , dando lugar a las corrientes de Birkeland y a la aurora . [98]
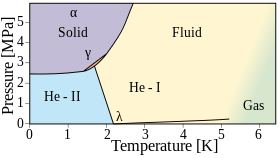

El helio se vuelve líquido cuando se enfría por debajo de los 4,2 K a presión atmosférica. Sin embargo, a diferencia de cualquier otro elemento, el helio permanece líquido hasta una temperatura de cero absoluto . Esto es un efecto directo de la mecánica cuántica: en concreto, la energía del punto cero del sistema es demasiado alta para permitir la congelación. Se requieren presiones superiores a unas 25 atmósferas para congelarlo. Hay dos fases líquidas: el helio I es un líquido convencional y el helio II, que se produce a una temperatura más baja, es un superfluido .
Por debajo de su punto de ebullición de 4,22 K (−268,93 °C; −452,07 °F) y por encima del punto lambda de 2,1768 K (−270,9732 °C; −455,7518 °F), el isótopo helio-4 existe en un estado líquido incoloro normal, llamado helio I. [ 29] Al igual que otros líquidos criogénicos , el helio I hierve cuando se calienta y se contrae cuando se reduce su temperatura. Sin embargo, por debajo del punto lambda, el helio no hierve y se expande a medida que la temperatura se reduce aún más.
El helio I tiene un índice de refracción similar al gas de 1,026, lo que hace que su superficie sea tan difícil de ver que a menudo se utilizan flotadores de poliestireno para mostrar dónde está la superficie. [29] Este líquido incoloro tiene una viscosidad muy baja y una densidad de 0,145-0,125 g/mL (entre aproximadamente 0 y 4 K), [99] que es solo una cuarta parte del valor esperado de la física clásica . [29] Se necesita la mecánica cuántica para explicar esta propiedad y, por lo tanto, ambos estados del helio líquido (helio I y helio II) se denominan fluidos cuánticos , lo que significa que muestran propiedades atómicas a escala macroscópica. Esto puede ser un efecto de su punto de ebullición, que está tan cerca del cero absoluto, lo que evita que el movimiento molecular aleatorio ( energía térmica ) enmascare las propiedades atómicas. [29]
El helio líquido por debajo de su punto lambda (denominado helio II ) presenta características muy inusuales. Debido a su alta conductividad térmica , cuando hierve, no burbujea sino que se evapora directamente de su superficie. El helio-3 también tiene una fase superfluida , pero solo a temperaturas mucho más bajas; como resultado, se sabe menos sobre las propiedades del isótopo. [29]

El helio II es un superfluido, un estado mecánico cuántico de la materia con propiedades extrañas. Por ejemplo, cuando fluye a través de capilares tan delgados como 10 a 100 nm no tiene una viscosidad medible . [27] Sin embargo, cuando se realizaron mediciones entre dos discos en movimiento, se observó una viscosidad comparable a la del helio gaseoso. La teoría existente explica esto utilizando el modelo de dos fluidos para el helio II. En este modelo, se considera que el helio líquido por debajo del punto lambda contiene una proporción de átomos de helio en un estado fundamental , que son superfluidos y fluyen con una viscosidad exactamente cero, y una proporción de átomos de helio en un estado excitado, que se comportan más como un fluido ordinario. [100]
En el efecto fuente , se construye una cámara que está conectada a un depósito de helio II mediante un disco sinterizado a través del cual el helio superfluido se filtra fácilmente pero a través del cual el helio no superfluido no puede pasar. Si se calienta el interior del recipiente, el helio superfluido se transforma en helio no superfluido. Para mantener la fracción de equilibrio del helio superfluido, el helio superfluido se filtra y aumenta la presión, lo que hace que el líquido salga del recipiente. [101]
La conductividad térmica del helio II es mayor que la de cualquier otra sustancia conocida, un millón de veces la del helio I y varios cientos de veces la del cobre . [29] Esto se debe a que la conducción de calor se produce mediante un mecanismo cuántico excepcional. La mayoría de los materiales que conducen bien el calor tienen una banda de valencia de electrones libres que sirven para transferir el calor. El helio II no tiene esa banda de valencia, pero sin embargo conduce bien el calor. El flujo de calor está regido por ecuaciones que son similares a la ecuación de onda utilizada para caracterizar la propagación del sonido en el aire. Cuando se introduce calor, se mueve a 20 metros por segundo a 1,8 K a través del helio II en forma de ondas en un fenómeno conocido como segundo sonido . [29]
El helio II también exhibe un efecto de arrastre. Cuando una superficie se extiende más allá del nivel del helio II, el helio II se mueve a lo largo de la superficie, contra la fuerza de la gravedad . El helio II escapará de un recipiente que no esté sellado arrastrándose por los lados hasta que alcance una región más cálida donde se evapora. Se mueve en una película de 30 nm de espesor independientemente del material de la superficie. Esta película se llama película de Rollin y lleva el nombre del hombre que caracterizó por primera vez este rasgo, Bernard V. Rollin. [29] [102] [103] Como resultado de este comportamiento de arrastre y la capacidad del helio II de filtrarse rápidamente a través de pequeñas aberturas, es muy difícil de confinar. A menos que el contenedor esté construido cuidadosamente, el helio II se arrastrará a lo largo de las superficies y a través de válvulas hasta que llegue a un lugar más cálido, donde se evaporará. Las ondas que se propagan a través de una película de Rollin están gobernadas por la misma ecuación que las ondas de gravedad en aguas poco profundas, pero en lugar de la gravedad, la fuerza restauradora es la fuerza de van der Waals . [104] Estas ondas se conocen como tercer sonido . [105]
El helio permanece líquido hasta el cero absoluto a presión atmosférica, pero se congela a alta presión. El helio sólido requiere una temperatura de 1–1,5 K (aproximadamente −272 °C o −457 °F) a aproximadamente 25 bar (2,5 MPa) de presión. [106] A menudo es difícil distinguir el helio sólido del líquido ya que el índice de refracción de las dos fases es casi el mismo. El sólido tiene un punto de fusión preciso y una estructura cristalina , pero es muy compresible ; la aplicación de presión en un laboratorio puede reducir su volumen en más del 30%. [107] Con un módulo volumétrico de aproximadamente 27 MPa [108] es ~100 veces más compresible que el agua. El helio sólido tiene una densidad de0,214 ± 0,006 g/cm 3 a 1,15 K y 66 atm; la densidad proyectada a 0 K y 25 bar (2,5 MPa) es0,187 ± 0,009 g/cm 3 . [109] A temperaturas más altas, el helio se solidificará con suficiente presión. A temperatura ambiente, esto requiere aproximadamente 114.000 atm. [110]
Tanto el helio-4 como el helio-3 forman varias fases sólidas cristalinas, todas las cuales requieren al menos 25 bares. Ambos forman una fase α, que tiene una estructura cristalina hexagonal compacta (hcp), una fase β, que es cúbica centrada en las caras (fcc), y una fase γ, que es cúbica centrada en el cuerpo (bcc). [111]
Existen nueve isótopos conocidos de helio, de los cuales dos, helio-3 y helio-4 , son estables . En la atmósfera terrestre, un átomo es3
Él por cada millón que hay4
[27] A diferencia de la mayoría de los elementos, la abundancia isotópica del helio varía mucho según el origen, debido a los diferentes procesos de formación. El isótopo más común, el helio-4, se produce en la Tierra por desintegración alfa de elementos radiactivos más pesados; las partículas alfa que emergen son núcleos de helio-4 completamente ionizados. El helio-4 es un núcleo inusualmente estable porque sus nucleones están dispuestos en capas completas . También se formó en enormes cantidades durante la nucleosíntesis del Big Bang . [112]
El helio-3 está presente en la Tierra solo en cantidades mínimas. La mayor parte ha estado presente desde la formación de la Tierra, aunque una parte cae a la Tierra atrapada en el polvo cósmico . [113] También se producen cantidades mínimas por la desintegración beta del tritio . [114] Las rocas de la corteza terrestre tienen proporciones isotópicas que varían hasta en un factor de diez, y estas proporciones se pueden utilizar para investigar el origen de las rocas y la composición del manto terrestre . [113] 3
Es mucho más abundante en las estrellas como producto de la fusión nuclear. Así, en el medio interestelar , la proporción de3
Él también4
Es aproximadamente 100 veces más alto que en la Tierra. [115] El material extraplanetario, como el regolito lunar y de asteroides , tiene trazas de helio-3 por ser bombardeado por los vientos solares . La superficie de la Luna contiene helio-3 en concentraciones del orden de 10 ppb , mucho más altas que las aproximadamente 5 ppt encontradas en la atmósfera de la Tierra. [116] [117] Varias personas, comenzando con Gerald Kulcinski en 1986, [118] han propuesto explorar la Luna, extraer regolito lunar y usar el helio-3 para la fusión .
El helio-4 líquido se puede enfriar a aproximadamente 1 K (−272,15 °C; −457,87 °F) mediante enfriamiento por evaporación en un recipiente de 1 K. Un enfriamiento similar del helio-3, que tiene un punto de ebullición más bajo, puede alcanzar aproximadamente0,2 kelvin en un refrigerador de helio-3 . Mezclas iguales de líquidos3
Él y4
Él abajo0,8 K se separan en dos fases inmiscibles debido a su disimilitud (siguen diferentes estadísticas cuánticas : los átomos de helio-4 son bosones mientras que los átomos de helio-3 son fermiones ). [29] Los refrigeradores de dilución utilizan esta inmiscibilidad para alcanzar temperaturas de unos pocos milikelvins. [119]
Es posible producir isótopos exóticos de helio , que se desintegran rápidamente en otras sustancias. El isótopo pesado de helio de vida más corta es el helio-10 no ligado, con una vida media de2,6(4) × 10 −22 s . [6] El helio-6 se desintegra emitiendo una partícula beta y tiene una vida media de 0,8 segundos. El helio-7 y el helio-8 se crean en ciertas reacciones nucleares . [29] Se sabe que el helio-6 y el helio-8 presentan un halo nuclear . [29]
Tabla de propiedades térmicas y físicas del gas helio a presión atmosférica: [120] [121]


El helio tiene una valencia de cero y es químicamente no reactivo en todas las condiciones normales. [107] Es un aislante eléctrico a menos que esté ionizado . Al igual que con los otros gases nobles, el helio tiene niveles de energía metaestables que le permiten permanecer ionizado en una descarga eléctrica con un voltaje por debajo de su potencial de ionización . [29] El helio puede formar compuestos inestables , conocidos como excímeros , con tungsteno, yodo, flúor, azufre y fósforo cuando se somete a una descarga luminiscente , a un bombardeo de electrones o se reduce a plasma por otros medios. Los compuestos moleculares HeNe, HgHe 10 y WHe 2 y los iones moleculares He+
2, Él2+
2, jeje+
, y HeD+
Se han creado de esta manera. [122] HeH + también es estable en su estado fundamental, pero es extremadamente reactivo: es el ácido de Brønsted más fuerte conocido y, por lo tanto, solo puede existir de forma aislada, ya que protonará cualquier molécula o contraanión con el que entre en contacto. Esta técnica también ha producido la molécula neutra He 2 , que tiene una gran cantidad de sistemas de bandas , y HgHe, que aparentemente se mantiene unida solo por fuerzas de polarización. [29]
Los compuestos de van der Waals de helio también se pueden formar con gas helio criogénico y átomos de alguna otra sustancia, como LiHe y He 2 . [123]
En teoría, otros compuestos verdaderos pueden ser posibles, como el fluorohidruro de helio (HHeF), que sería análogo a HArF , descubierto en 2000. [124] Los cálculos muestran que dos nuevos compuestos que contienen un enlace helio-oxígeno podrían ser estables. [125] Dos nuevas especies moleculares, predichas usando la teoría, CsFHeO y N(CH 3 ) 4 FHeO, son derivados de un anión metaestable FHeO − teorizado por primera vez en 2005 por un grupo de Taiwán. [126]
Los átomos de helio se han insertado en las moléculas de la jaula hueca de carbono (los fulerenos ) calentándolos a alta presión. Las moléculas de fulerenos endoédricos formados son estables a altas temperaturas. Cuando se forman derivados químicos de estos fulerenos, el helio permanece en el interior. [127] Si se utiliza helio-3 , se puede observar fácilmente mediante espectroscopia de resonancia magnética nuclear de helio . [128] Se han descrito muchos fulerenos que contienen helio-3. Aunque los átomos de helio no están unidos por enlaces covalentes o iónicos, estas sustancias tienen propiedades distintas y una composición definida, como todos los compuestos químicos estequiométricos.
El helio puede formar compuestos con otros elementos a altas presiones. Se han cultivado cristales de clatrato de helio y nitrógeno (He(N 2 ) 11 ) a temperatura ambiente y a presiones de aproximadamente 10 GPa en una celda de yunque de diamante . [129] Se ha demostrado que el electruro aislante Na 2 He es termodinámicamente estable a presiones superiores a 113 GPa. Tiene una estructura de fluorita . [130]
Aunque es raro en la Tierra, el helio es el segundo elemento más abundante en el Universo conocido, constituyendo el 23% de su masa bariónica . Solo el hidrógeno es más abundante. [27] La gran mayoría del helio se formó por nucleosíntesis del Big Bang uno a tres minutos después del Big Bang. Como tal, las mediciones de su abundancia contribuyen a los modelos cosmológicos. En las estrellas , se forma por la fusión nuclear de hidrógeno en reacciones en cadena protón-protón y el ciclo CNO , parte de la nucleosíntesis estelar . [112]
En la atmósfera de la Tierra , la concentración de helio por volumen es de sólo 5,2 partes por millón. [131] [132] La concentración es baja y bastante constante a pesar de la producción continua de nuevo helio porque la mayor parte del helio en la atmósfera de la Tierra escapa al espacio mediante varios procesos. [133] [134] [135] En la heteroesfera de la Tierra , una parte de la atmósfera superior, el helio y el hidrógeno son los elementos más abundantes.
La mayor parte del helio en la Tierra es resultado de la desintegración radiactiva . El helio se encuentra en grandes cantidades en minerales de uranio y torio , incluyendo la uraninita y sus variedades cleveíta y pechblenda , [19] [136] carnotita y monacita (un nombre de grupo; "monacita" generalmente se refiere a monacita-(Ce) ), [137] [138] porque emiten partículas alfa (núcleos de helio, He 2+ ) a las que los electrones se combinan inmediatamente tan pronto como la partícula es detenida por la roca. De esta manera se generan unas 3000 toneladas métricas de helio por año en toda la litosfera . [139] [140] [141] En la corteza terrestre, la concentración de helio es de 8 partes por billón. En el agua de mar, la concentración es de solo 4 partes por billón. También hay pequeñas cantidades en manantiales minerales , gas volcánico y hierro meteórico . Debido a que el helio queda atrapado en el subsuelo en condiciones que también atrapan al gas natural, las mayores concentraciones naturales de helio del planeta se encuentran en el gas natural, del que se extrae la mayor parte del helio comercial. La concentración varía en un amplio rango, desde unas pocas ppm hasta más del 7% en un pequeño yacimiento de gas en el condado de San Juan, Nuevo México . [142] [143]
En 2021 [actualizar], las reservas mundiales de helio se estimaron en 31 mil millones de metros cúbicos, de los cuales un tercio se encuentra en Qatar . [144] En 2015 y 2016 se anunció que había reservas probables adicionales bajo las Montañas Rocosas en América del Norte [145] y en el Rift de África Oriental . [25]
Para su uso a gran escala, el helio se extrae mediante destilación fraccionada del gas natural, que puede contener hasta un 7% de helio. [146] Dado que el helio tiene un punto de ebullición más bajo que cualquier otro elemento, se utilizan bajas temperaturas y alta presión para licuar casi todos los demás gases (principalmente nitrógeno y metano ). El gas de helio crudo resultante se purifica mediante exposiciones sucesivas a temperaturas decrecientes, en las que casi todo el nitrógeno restante y otros gases se precipitan de la mezcla gaseosa. El carbón activado se utiliza como paso final de purificación, lo que generalmente da como resultado helio de grado A con una pureza del 99,995%. [29] La principal impureza del helio de grado A es el neón . En un paso final de producción, la mayor parte del helio que se produce se licúa mediante un proceso criogénico . Esto es necesario para aplicaciones que requieren helio líquido y también permite a los proveedores de helio reducir el costo del transporte a larga distancia, ya que los contenedores de helio líquido más grandes tienen más de cinco veces la capacidad de los remolques de tubos de helio gaseoso más grandes. [80] [147]
En 2008, aproximadamente 169 millones de metros cúbicos estándar (SCM) de helio se extrajeron del gas natural o se retiraron de las reservas de helio, con aproximadamente el 78% de los Estados Unidos, el 10% de Argelia y la mayor parte del resto de Rusia, Polonia y Qatar. [148] Para 2013, los aumentos en la producción de helio en Qatar (bajo la empresa Qatargas administrada por Air Liquide ) habían aumentado la fracción de Qatar de la producción mundial de helio al 25%, convirtiéndolo en el segundo mayor exportador después de los Estados Unidos. [149] Se estima que un depósito de helio de 54 mil millones de pies cúbicos (1,5 × 10 9 m 3 ) se encontró en Tanzania en 2016. [150] Se inauguró una planta de helio a gran escala en Ningxia , China en 2020. [151]
En los Estados Unidos, la mayor parte del helio se extrae del gas natural de Hugoton y de los yacimientos de gas cercanos en Kansas, Oklahoma y el yacimiento Panhandle en Texas. [80] [152] Gran parte de este gas se enviaba alguna vez por gasoducto a la Reserva Nacional de Helio , pero desde 2005, esta reserva se ha agotado y vendido, y se espera que se agote en gran medida para 2021 [149] según la Ley de Administración y Gestión Responsable del Helio (HR 527) de octubre de 2013. [153] Los yacimientos de helio del oeste de los Estados Unidos están surgiendo como una fuente alternativa de suministro de helio, en particular los de la región de las " Cuatro Esquinas " (los estados de Arizona, Colorado, Nuevo México y Utah). [154]
La difusión de gas natural crudo a través de membranas semipermeables especiales y otras barreras es otro método para recuperar y purificar helio. [155] En 1996, Estados Unidos tenía reservas probadas de helio en complejos de pozos de gas de alrededor de 147 mil millones de pies cúbicos estándar (4,2 mil millones de SCM). [156] A los ritmos de uso en ese momento (72 millones de SCM por año en Estados Unidos; ver el gráfico circular a continuación) esto habría sido suficiente helio para alrededor de 58 años de uso en Estados Unidos, y menos que esto (quizás el 80% del tiempo) a los ritmos de uso mundial, aunque los factores de ahorro y procesamiento afectan las cifras de reservas efectivas.
El helio se extrae generalmente del gas natural porque está presente en el aire en una proporción que es solo una fracción de la del neón, pero su demanda es mucho mayor. Se estima que si toda la producción de neón se reestructurara para ahorrar helio, se cubriría el 0,1% de la demanda mundial de helio. De manera similar, solo el 1% de la demanda mundial de helio podría satisfacerse reestructurando todas las plantas de destilación de aire. [157] El helio se puede sintetizar mediante el bombardeo de litio o boro con protones de alta velocidad, o mediante el bombardeo de litio con deuterones , pero estos procesos son un método de producción completamente antieconómico. [158]
El helio se comercializa en forma líquida o gaseosa. En estado líquido, se puede suministrar en pequeños contenedores aislados llamados dewars que contienen hasta 1.000 litros de helio, o en grandes contenedores ISO, que tienen capacidades nominales de hasta 42 m3 ( alrededor de 11.000 galones estadounidenses ). En forma gaseosa, pequeñas cantidades de helio se suministran en cilindros de alta presión que contienen hasta 8 m3 ( aproximadamente 0,282 pies cúbicos estándar), mientras que grandes cantidades de gas a alta presión se suministran en remolques tubulares, que tienen capacidades de hasta 4.860 m3 ( aproximadamente 172.000 pies cúbicos estándar).
Según los conservacionistas del helio, como el físico Robert Coleman Richardson , premio Nobel , en un artículo de 2010, el precio de libre mercado del helio ha contribuido a su uso "despilfarrador" (por ejemplo, para los globos de helio ). Los precios en la década de 2000 se habían reducido por la decisión del Congreso de los Estados Unidos de vender las grandes reservas de helio del país en 2015. [22] Según Richardson, el precio debía multiplicarse por 20 para eliminar el desperdicio excesivo de helio. En el artículo de Nuttall et al. de 2012 titulado "Detengan el despilfarro de helio", también se propuso crear una Agencia Internacional del Helio que crearía un mercado sostenible para "este preciado producto". [159]

Estimación del consumo fraccional de helio en Estados Unidos en 2014 por categoría. El consumo total es de 34 millones de metros cúbicos. [160]
Aunque los globos son quizás el uso más conocido del helio, son una parte menor de todo el uso del helio. [75] El helio se utiliza para muchos propósitos que requieren algunas de sus propiedades únicas, como su bajo punto de ebullición , baja densidad , baja solubilidad , alta conductividad térmica o inercia . De la producción total mundial de helio de 2014 de aproximadamente 32 millones de kg (180 millones de metros cúbicos estándar) de helio por año, el uso más grande (alrededor del 32% del total en 2014) es en aplicaciones criogénicas, la mayoría de las cuales implica enfriar los imanes superconductores en escáneres de resonancia magnética médica y espectrómetros de RMN . [161] Otros usos importantes fueron los sistemas de presurización y purga, la soldadura, el mantenimiento de atmósferas controladas y la detección de fugas. Otros usos por categoría fueron fracciones relativamente menores. [160]
El helio se utiliza como gas protector en el crecimiento de cristales de silicio y germanio , en la producción de titanio y circonio y en la cromatografía de gases [ 107] porque es inerte. Debido a su inercia, su naturaleza térmica y calóricamente perfecta , su alta velocidad del sonido y su alto valor de la relación de capacidad térmica , también es útil en túneles de viento supersónicos [162] e instalaciones de impulso [163] .
El helio se utiliza como gas de protección en procesos de soldadura por arco en materiales que, a temperaturas de soldadura, están contaminados y debilitados por el aire o el nitrógeno. [27] Se utilizan varios gases de protección inertes en la soldadura por arco de tungsteno con gas, pero se utiliza helio en lugar del argón más barato , especialmente para soldar materiales que tienen una mayor conductividad térmica , como el aluminio o el cobre .

Una aplicación industrial del helio es la detección de fugas . Debido a que el helio se difunde a través de los sólidos tres veces más rápido que el aire, se utiliza como gas trazador para detectar fugas en equipos de alto vacío (como tanques criogénicos) y contenedores de alta presión. [164] El objeto probado se coloca en una cámara, que luego se evacua y se llena con helio. El helio que se escapa a través de las fugas es detectado por un dispositivo sensible ( espectrómetro de masas de helio ), incluso a tasas de fuga tan pequeñas como 10 −9 mbar·L/s (10 −10 Pa·m 3 /s). El procedimiento de medición normalmente es automático y se llama prueba integral de helio. Un procedimiento más simple es llenar el objeto probado con helio y buscar fugas manualmente con un dispositivo portátil. [165]
Las fugas de helio a través de grietas no deben confundirse con la permeación de gas a través de un material a granel. Si bien el helio tiene constantes de permeación documentadas (por lo tanto, una tasa de permeación calculable) a través de vidrios, cerámicas y materiales sintéticos, los gases inertes como el helio no permean la mayoría de los metales a granel. [166]

Debido a que es más ligero que el aire , los dirigibles y los globos se inflan con helio para elevarse . Si bien el gas hidrógeno es más flotante y escapa permeando a través de una membrana a una velocidad menor, el helio tiene la ventaja de ser no inflamable y, de hecho, retardante del fuego . Otro uso menor es en cohetería , donde el helio se utiliza como medio de relleno para rellenar los tanques de propulsor de cohetes en vuelo y para condensar hidrógeno y oxígeno para fabricar combustible para cohetes . También se utiliza para purgar el combustible y el oxidante del equipo de apoyo en tierra antes del lanzamiento y para preenfriar el hidrógeno líquido en los vehículos espaciales . Por ejemplo, el cohete Saturno V utilizado en el programa Apolo necesitaba unos 370.000 metros cúbicos (13 millones de pies cúbicos) de helio para su lanzamiento. [107]
El helio como gas respirable no tiene propiedades narcóticas , por lo que se utilizan mezclas de helio como trimix , heliox y heliair para el buceo profundo para reducir los efectos de la narcosis, que empeoran con el aumento de la profundidad. [167] [168] A medida que la presión aumenta con la profundidad, la densidad del gas respirable también aumenta, y se ha descubierto que el bajo peso molecular del helio reduce considerablemente el esfuerzo de respirar al reducir la densidad de la mezcla. Esto reduce el número de Reynolds del flujo, lo que conduce a una reducción del flujo turbulento y un aumento del flujo laminar , que requiere menos respiración. [169] [170] A profundidades inferiores a 150 metros (490 pies), los buceadores que respiran mezclas de helio y oxígeno comienzan a experimentar temblores y una disminución de la función psicomotora, síntomas del síndrome nervioso de alta presión . [171] Este efecto puede contrarrestarse hasta cierto punto añadiendo una cantidad de gas narcótico como hidrógeno o nitrógeno a una mezcla de helio y oxígeno. [172]
Los láseres de helio-neón , un tipo de láser de gas de baja potencia que produce un haz rojo, tuvieron varias aplicaciones prácticas que incluyeron lectores de códigos de barras y punteros láser , antes de que fueran reemplazados casi universalmente por láseres de diodo más económicos . [27]
Por su inercia y alta conductividad térmica , transparencia neutrónica y porque no forma isótopos radiactivos en condiciones de reactor, el helio se utiliza como medio de transferencia de calor en algunos reactores nucleares refrigerados por gas . [164]
El helio, mezclado con un gas más pesado como el xenón, es útil para la refrigeración termoacústica debido a la alta relación de capacidad térmica resultante y al bajo número de Prandtl . [173] La inercia del helio tiene ventajas ambientales sobre los sistemas de refrigeración convencionales que contribuyen al agotamiento del ozono o al calentamiento global. [174]
El helio también se utiliza en algunas unidades de disco duro . [175]
El uso de helio reduce los efectos distorsionadores de las variaciones de temperatura en el espacio entre las lentes de algunos telescopios debido a su índice de refracción extremadamente bajo . [29] Este método se utiliza especialmente en telescopios solares donde un tubo de telescopio hermético al vacío sería demasiado pesado. [176] [177]
El helio es un gas portador comúnmente utilizado para la cromatografía de gases .
La edad de las rocas y minerales que contienen uranio y torio se puede estimar midiendo el nivel de helio con un proceso conocido como datación por helio . [27] [29]
El helio a bajas temperaturas se utiliza en criogenia y en ciertas aplicaciones criogénicas. Como ejemplos de aplicaciones, el helio líquido se utiliza para enfriar ciertos metales a las temperaturas extremadamente bajas requeridas para la superconductividad , como en los imanes superconductores para la obtención de imágenes por resonancia magnética . El Gran Colisionador de Hadrones del CERN utiliza 96 toneladas métricas de helio líquido para mantener la temperatura a 1,9 K (−271,25 °C; −456,25 °F). [178]
El helio fue aprobado para uso médico en los Estados Unidos en abril de 2020 para humanos y animales. [179] [180]
Si bien es químicamente inerte, la contaminación con helio perjudica el funcionamiento de los sistemas microelectromecánicos (MEMS), de modo que los iPhones pueden fallar. [181]
El helio neutro en condiciones estándar no es tóxico, no desempeña ninguna función biológica y se encuentra en cantidades mínimas en la sangre humana.
La velocidad del sonido en helio es casi tres veces la velocidad del sonido en el aire. Debido a que la frecuencia de resonancia natural de una cavidad llena de gas es proporcional a la velocidad del sonido en el gas, cuando se inhala helio, se produce un aumento correspondiente en las frecuencias de resonancia del tracto vocal , que es el amplificador del sonido vocal. [27] [182] Este aumento en la frecuencia de resonancia del amplificador (el tracto vocal) proporciona una mayor amplificación a los componentes de alta frecuencia de la onda sonora producida por la vibración directa de las cuerdas vocales, en comparación con el caso en que la laringe está llena de aire. Cuando una persona habla después de inhalar gas helio, los músculos que controlan la laringe todavía se mueven de la misma manera que cuando la laringe está llena de aire; por lo tanto, la frecuencia fundamental (a veces llamada tono ) producida por la vibración directa de las cuerdas vocales no cambia. [183] Sin embargo, la amplificación preferida de alta frecuencia provoca un cambio en el timbre del sonido amplificado, lo que da como resultado una calidad vocal aflautada, similar a la de un pato. El efecto opuesto, la reducción de las frecuencias resonantes, se puede obtener inhalando un gas denso como el hexafluoruro de azufre o el xenón .
La inhalación de helio puede ser peligrosa si se hace en exceso, ya que el helio es un asfixiante simple y, por lo tanto, desplaza el oxígeno necesario para la respiración normal. [27] [184] Se han registrado muertes, incluido un joven que se asfixió en Vancouver en 2003 y dos adultos que se asfixiaron en el sur de Florida en 2006. [185] [186] En 1998, una niña australiana de Victoria cayó inconsciente y se puso azul temporalmente después de inhalar todo el contenido de un globo de fiesta. [187] [188] [189] La inhalación de helio directamente de cilindros presurizados o incluso válvulas de llenado de globos es extremadamente peligrosa, ya que el alto caudal y la presión pueden provocar barotrauma , rompiendo fatalmente el tejido pulmonar. [184] [190]
La muerte causada por helio es poco frecuente. El primer caso registrado por los medios fue el de una joven de 15 años de Texas que murió en 1998 por inhalación de helio en la fiesta de una amiga; no se ha identificado el tipo exacto de muerte por helio. [187] [188] [189]
En los Estados Unidos, solo se reportaron dos muertes entre 2000 y 2004, incluido un hombre que murió en Carolina del Norte de barotrauma en 2002. [185] [190] Un joven se asfixió en Vancouver durante 2003, y un hombre de 27 años en Australia tuvo una embolia después de respirar de un cilindro en 2000. [185] Desde entonces, dos adultos se asfixiaron en el sur de Florida en 2006, [185] [186] [191] y hubo casos en 2009 y 2010, uno de los cuales fue un joven californiano que fue encontrado con una bolsa sobre su cabeza, atada a un tanque de helio, [192] y otro adolescente en Irlanda del Norte murió de asfixia. [193] En Eagle Point, Oregon, una adolescente murió en 2012 de barotrauma en una fiesta. [194] [195] [196] Una niña de Michigan murió de hipoxia más tarde ese año. [197]
El 4 de febrero de 2015, se reveló que, durante la grabación de su programa principal de televisión el 28 de enero, una integrante de 12 años (nombre omitido) del grupo japonés de canto femenino 3B Junior sufrió una embolia gaseosa , perdiendo el conocimiento y cayendo en coma como resultado de burbujas de aire que bloqueaban el flujo de sangre al cerebro después de inhalar enormes cantidades de helio como parte de un juego. El incidente no se hizo público hasta una semana después. [198] [199] El personal de TV Asahi realizó una conferencia de prensa de emergencia para comunicar que la integrante había sido llevada al hospital y está mostrando signos de rehabilitación, como mover los ojos y las extremidades, pero su conciencia aún no se ha recuperado lo suficiente. La policía ha iniciado una investigación debido a una negligencia en las medidas de seguridad. [200] [201]
Los problemas de seguridad del helio criogénico son similares a los del nitrógeno líquido : sus temperaturas extremadamente bajas pueden provocar quemaduras por frío y la relación de expansión líquido-gas puede causar explosiones si no se instalan dispositivos de alivio de presión. Los contenedores de gas helio a una temperatura de entre 5 y 10 K deben manipularse como si contuvieran helio líquido debido a la rápida y significativa expansión térmica que se produce cuando el gas helio a menos de 10 K se calienta a temperatura ambiente . [107]
A altas presiones (más de 20 atm o 2 MPa ), una mezcla de helio y oxígeno ( heliox ) puede provocar un síndrome nervioso de alta presión , una especie de efecto anestésico inverso; agregar una pequeña cantidad de nitrógeno a la mezcla puede aliviar el problema. [202] [171]
Frankland y Lockyer encuentran que las prominencias amarillas dan una línea brillante muy marcada no lejos de D, pero hasta ahora no identificada con ninguna llama terrestre. Parece indicar una nueva sustancia, que proponen llamar helio
Raccolsi alcun tempo fa una sostanza amorfa di consistentenza butirracea e di colore giallo sbiadato sublimata sull'orlo di una fumarola prossima alla bocca di eruzione. Saggiata esta sublimazione allo spettroscopio, ho ravvisato le righe del sodio e del potassio ed una lineare ben distinta che corrisponde esattamente alla D
3
che è quella dell'Helium. Do per ora il semplice annunzio del fatto, proponendomi di ritornare sopra questo argomento, dopo di aver sottoposta la sublimazione ad una analisi chimica.
(Hace algún tiempo recogí una sustancia amorfa de consistencia mantecosa y color amarillo descolorido que se había sublimado en el borde de una fumarola cerca de la boca de la erupción. Habiendo analizado esta sustancia sublimada con un espectroscopio, reconocí las líneas de sodio y potasio y una línea lineal muy marcada que corresponde exactamente a D
3
, que es la del helio. Por ahora, hago un simple anuncio del hecho, propongo volver sobre este tema después de haber sometido el sublimado a un análisis químico. .)
En el origen del método de detección de fugas de helio se encontraba el Proyecto Manhattan y los requisitos de estanqueidad sin precedentes que necesitaban las plantas de enriquecimiento de uranio. La sensibilidad requerida para la comprobación de fugas condujo a la elección de un espectrómetro de masas diseñado por el Dr. AOC Nier, ajustado a la masa de helio.
{{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace ){{cite journal}}: CS1 maint: URL no apta ( enlace )General
Más detalles
Misceláneas
Escasez de helio