
Los cocolitóforos , o cocolitofóridos , son organismos unicelulares que forman parte del fitoplancton , el componente autótrofo (autoalimentado) de la comunidad planctónica . Forman un grupo de unas 200 especies y pertenecen al reino Protista , según el sistema de cinco reinos de Robert Whittaker , o al clado Hacrobia , según un sistema de clasificación biológica más nuevo. Dentro de la Hacrobia, los cocolitóforos se encuentran en el filo o división Haptophyta , clase Prymnesiophyceae (o Coccolithophyceae ). Los cocolitóforos son casi exclusivamente marinos , son fotosintéticos y existen en grandes cantidades en toda la zona de luz solar del océano .
Los cocolitóforos son los organismos calcificantes más productivos del planeta y se recubren con una capa de carbonato de calcio llamada cocosfera . Sin embargo, las razones por las que se calcifican siguen siendo difíciles de entender. Una función clave puede ser que la cocosfera ofrezca protección contra la depredación del microzooplancton , que es una de las principales causas de la muerte del fitoplancton en el océano. [1]
Los cocolitóforos son ecológicamente importantes y biogeoquímicamente desempeñan funciones importantes en la bomba biológica marina y el ciclo del carbono . [2] [1] Dependiendo del hábitat, pueden producir hasta el 40 por ciento de la producción primaria marina local . [3] Son de particular interés para quienes estudian el cambio climático global porque, a medida que aumenta la acidez de los océanos , sus cocolitos pueden volverse aún más importantes como sumidero de carbono . [4] Se están empleando estrategias de gestión para prevenir las floraciones de cocolitóforos relacionadas con la eutrofización , ya que estas floraciones conducen a una disminución del flujo de nutrientes a niveles más bajos del océano. [5]
La especie más abundante de cocolitóforo, Emiliania huxleyi , pertenece al orden Isochrysidales y a la familia Noëlaerhabdaceae . [6] Se encuentra en océanos templados , subtropicales y tropicales . [7] Esto convierte a E. huxleyi en una parte importante de la base planctónica de una gran proporción de redes alimentarias marinas . También es el cocolitóforo de más rápido crecimiento en cultivos de laboratorio. [8] Se estudia por las extensas floraciones que forma en aguas agotadas en nutrientes después de la reforma de la termoclina de verano . [9] [10] y por su producción de moléculas conocidas como alquenonas que los científicos terrestres utilizan comúnmente como medio para estimar las temperaturas pasadas de la superficie del mar . [11]
Los cocolitóforos (o cocolitofóridos, del adjetivo [12] ) forman un grupo de unas 200 especies de fitoplancton. [13] Pertenecen al reino Protista , según la clasificación de los cinco reinos de Robert Whittaker , o al clado Hacrobia , según el sistema de clasificación biológica más nuevo. Dentro de la Hacrobia, los cocolitóforos se encuentran en el filo o división Haptophyta , clase Prymnesiophyceae (o Coccolithophyceae ). [6] Los cocolitóforos se distinguen por placas (o escamas) especiales de carbonato de calcio de función incierta llamadas cocolitos , que también son microfósiles importantes . Sin embargo, hay especies de Prymnesiophyceae que carecen de cocolitos (por ejemplo, en el género Prymnesium ), por lo que no todos los miembros de Prymnesiophyceae son cocolitóforos. [14]
Los cocolitóforos son fitoplancton unicelulares que producen pequeñas escamas de carbonato de calcio (CaCO 3 ) ( cocolitos ) que cubren la superficie celular en forma de una capa esférica, llamada cocosfera . Han sido parte integral de las comunidades de plancton marino desde el Jurásico . [15] [16] Hoy en día, los cocolitóforos contribuyen entre 1% y 10% a la fijación de carbono inorgánico (calcificación) a la fijación total de carbono (calcificación más fotosíntesis) en la superficie del océano [17] y ~50% a los sedimentos pelágicos de CaCO3 . [18] Su capa calcárea aumenta la velocidad de hundimiento del CO 2 fijado fotosintéticamente en las profundidades del océano al lastrar la materia orgánica. [19] [20] Al mismo tiempo, la precipitación biogénica de carbonato de calcio durante la formación de cocolitos reduce la alcalinidad total del agua de mar y libera CO 2 . [21] [22] Por lo tanto, los cocolitóforos desempeñan un papel importante en el ciclo del carbono marino al influir en la eficiencia de la bomba biológica de carbono y la absorción oceánica de CO 2 atmosférico . [1]
A partir de 2021, no se sabe por qué los cocolitóforos se calcifican y cómo su capacidad para producir cocolitos se asocia con su éxito ecológico. [23] [24] [25] [26] [27] El beneficio más plausible de tener una cocosfera parece ser la protección contra depredadores o virus. [28] [26] La infección viral es una causa importante de muerte del fitoplancton en los océanos, [29] y recientemente se ha demostrado que la calcificación puede influir en la interacción entre un cocolitóforo y su virus. [30] [31] Los principales depredadores del fitoplancton marino son los ciliados y dinoflagelados similares al microzooplancton . Se estima que consumen alrededor de dos tercios de la producción primaria en el océano [32] y el microzooplancton puede ejercer una fuerte presión de pastoreo sobre las poblaciones de cocolitóforos. [33] Aunque la calcificación no previene la depredación, se ha argumentado que la cocosfera reduce la eficiencia del pastoreo al hacer más difícil para el depredador utilizar el contenido orgánico de los cocolitóforos. [34] Los protistas heterótrofos pueden elegir presas selectivamente en función de su tamaño o forma y a través de señales químicas [35] [36] y, por lo tanto, pueden favorecer otras presas que estén disponibles y no protegidas por cocolitos. [1]

Los cocolitóforos son células esféricas de entre 5 y 100 micrómetros de ancho, encerradas por placas calcáreas llamadas cocolitos , que miden entre 2 y 25 micrómetros de ancho. Cada célula contiene dos cloroplastos marrones que rodean el núcleo . [39]
Encerrada en cada cocosfera hay una sola célula con orgánulos unidos a una membrana . Dos grandes cloroplastos con pigmento marrón se encuentran a cada lado de la célula y rodean el núcleo , las mitocondrias , el aparato de Golgi , el retículo endoplásmico y otros orgánulos. Cada célula posee además dos estructuras flagelantes , que intervienen no sólo en la motilidad, sino también en la mitosis y la formación del citoesqueleto . [40] En algunas especies, también está presente un haptonema funcional o vestigial . [41] Esta estructura, que es exclusiva de los haptofitos , se enrolla y desenrosca en respuesta a estímulos ambientales. Aunque no se comprende bien, se ha propuesto su participación en la captura de presas. [40]
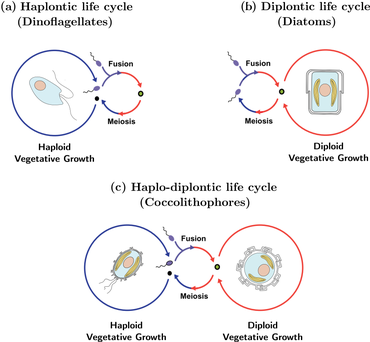
El complejo ciclo de vida de los cocolitóforos se conoce como ciclo de vida haplodiplontico y se caracteriza por una alternancia de fases tanto asexuales como sexuales. La fase asexual se conoce como fase haploide , mientras que la fase sexual se conoce como fase diploide . Durante la fase haploide, los cocolitóforos producen células haploides mediante mitosis . Estas células haploides pueden luego dividirse aún más mediante mitosis o experimentar reproducción sexual con otras células haploides. La célula diploide resultante pasa por la meiosis para producir células haploides nuevamente, comenzando de nuevo el ciclo. Con los cocolitóforos, la reproducción asexual por mitosis es posible en ambas fases del ciclo de vida, lo que contrasta con la mayoría de los otros organismos que tienen ciclos de vida alternos. [42] Tanto los factores abióticos como los bióticos pueden afectar la frecuencia con la que ocurre cada fase. [43]
Los cocolitóforos se reproducen asexualmente mediante fisión binaria. En este proceso los cocolitos de la célula madre se dividen entre las dos células hijas. Ha habido sugerencias que señalan la posible presencia de un proceso de reproducción sexual debido a las etapas diploides de los cocolitóforos, pero este proceso nunca ha sido observado. [44]
Las estrategias seleccionadas de K o r de los cocolitóforos dependen de la etapa de su ciclo de vida. Cuando los cocolitóforos son diploides, se seleccionan en forma r. En esta fase toleran una gama más amplia de composiciones de nutrientes. Cuando son haploides, se seleccionan por K y, a menudo, son más competitivos en ambientes estables con bajos nutrientes. [44] La mayoría de los cocolitóforos son estrategas de K y generalmente se encuentran en aguas superficiales pobres en nutrientes. Son malos competidores en comparación con otros fitoplancton y prosperan en hábitats donde otros fitoplancton no sobrevivirían. [45] Estas dos etapas en el ciclo de vida de los cocolitóforos ocurren estacionalmente, donde hay más nutrientes disponibles en las estaciones más cálidas y menos en las estaciones más frías. Este tipo de ciclo de vida se conoce como ciclo de vida heteromórfico complejo. [44]

Los cocolitóforos se encuentran en todos los océanos del mundo. Su distribución varía verticalmente por capas estratificadas en el océano y geográficamente por diferentes zonas temporales. [46] Si bien la mayoría de los cocolitóforos modernos pueden ubicarse en sus condiciones oligotróficas estratificadas asociadas , las áreas más abundantes de cocolitóforos donde existe la mayor diversidad de especies se encuentran en zonas subtropicales con un clima templado. [47] Si bien la temperatura del agua y la cantidad de intensidad de la luz que ingresa a la superficie del agua son los factores más influyentes para determinar dónde se encuentran las especies, las corrientes oceánicas también pueden determinar la ubicación donde se encuentran ciertas especies de cocolitóforos. [48]
Aunque la motilidad y la formación de colonias varían según el ciclo de vida de las diferentes especies de cocolitóforos, a menudo hay una alternancia entre una fase móvil haploide y una fase diploide no móvil. En ambas fases, la dispersión del organismo se debe en gran medida a las corrientes oceánicas y los patrones de circulación. [49]
Dentro del Océano Pacífico, se han identificado aproximadamente 90 especies con seis zonas separadas relacionadas con diferentes corrientes del Pacífico que contienen agrupaciones únicas de diferentes especies de cocolitóforos. [50] La mayor diversidad de cocolitóforos en el Océano Pacífico se encontraba en un área del océano considerada la Zona Centro Norte que es un área entre 30 o N y 5 o N, compuesta por la Corriente Ecuatorial Norte y la Contracorriente Ecuatorial. Estas dos corrientes se mueven en direcciones opuestas, este y oeste, lo que permite una fuerte mezcla de aguas y permite que una gran variedad de especies pueble la zona. [50]
En el Océano Atlántico las especies más abundantes son E. huxleyi y Florisphaera profunda con menores concentraciones de las especies Umbellosphaera irregularis , Umbellosphaera tenuis y diferentes especies de Gephyrocapsa . [50] La abundancia de especies de cocolitóforos que habitan en las profundidades se ve muy afectada por las profundidades de la nutriclina y la termoclina . Estos cocolitóforos aumentan en abundancia cuando la nutriclina y la termoclina son profundas y disminuyen cuando son poco profundas. [51]

Actualmente se desconoce la distribución completa de los cocolitóforos y algunas regiones, como el Océano Índico, no están tan bien estudiadas como otros lugares de los océanos Pacífico y Atlántico. También es muy difícil explicar las distribuciones debido a múltiples factores en constante cambio que involucran las propiedades del océano, como las surgencias costeras y ecuatoriales , los sistemas frontales, los ambientes bentónicos , la topografía oceánica única y los focos aislados de temperaturas altas o bajas del agua. [53]
La zona fótica superior tiene baja concentración de nutrientes, alta intensidad y penetración de luz y, por lo general, mayor temperatura. La zona fótica inferior tiene una alta concentración de nutrientes, baja intensidad y penetración de luz y relativamente fría. La zona fótica media es un área que contiene los mismos valores entre las zonas fóticas inferior y superior. [47]
El Gran Cinturón de Calcita del Océano Austral es una región de elevada concentración de calcita en la parte superior del océano durante el verano derivada de cocolitóforos, a pesar de que la región es conocida por su predominio de diatomeas . La superposición de dos grupos principales de fitoplancton, cocolitóforos y diatomeas, en los sistemas frontales dinámicos característicos de esta región proporciona un escenario ideal para estudiar las influencias ambientales en la distribución de diferentes especies dentro de estos grupos taxonómicos. [56]
El Gran Cinturón de Calcita, definido como una característica elevada de carbono inorgánico particulado (PIC) que se presenta junto con clorofila a estacionalmente elevada en la primavera y el verano australes en el Océano Austral, [57] juega un papel importante en las fluctuaciones climáticas, [58] [59] en más del 60% del área del Océano Austral (30–60° S). [60] La región entre 30° y 50° S tiene la mayor absorción de dióxido de carbono (CO 2 ) antropogénico junto con los océanos Atlántico Norte y Pacífico Norte. [61]
Estudios recientes muestran que el cambio climático tiene impactos directos e indirectos en la distribución y productividad de los cocolitóforos. Inevitablemente se verán afectados por el aumento de las temperaturas y la estratificación térmica de la capa superior del océano, ya que estos son controles principales de su ecología, aunque no está claro si el calentamiento global resultaría en un aumento o disminución neta de cocolitóforos. Como son organismos calcificantes, se ha sugerido que la acidificación de los océanos debido al aumento de dióxido de carbono podría afectar gravemente a los cocolitóforos. [51] Los recientes aumentos de CO 2 han visto un fuerte aumento en la población de cocolitóforos. [62]


Los cocolitóforos son uno de los productores primarios más abundantes del océano. Como tales, contribuyen en gran medida a la productividad primaria de los océanos tropicales y subtropicales; sin embargo, aún no se ha registrado exactamente cuánto. [66]
La relación entre las concentraciones de nitrógeno , fósforo y silicato en áreas particulares del océano dicta el dominio competitivo dentro de las comunidades de fitoplancton. Básicamente, cada proporción inclina las probabilidades a favor de las diatomeas u otros grupos de fitoplancton, como los cocolitóforos. Una proporción baja de silicato a nitrógeno y fósforo permite a los cocolitóforos superar a otras especies de fitoplancton; sin embargo, cuando las proporciones de silicato, fósforo y nitrógeno son altas, los cocolitóforos son superados por las diatomeas. El aumento de los procesos agrícolas conduce a la eutrofización de las aguas y, por lo tanto, la floración de cocolitóforos en estos ambientes ricos en nitrógeno y fósforo y bajos en silicatos. [5]
La calcita en el carbonato de calcio permite que los cocolitos dispersen más luz de la que absorben. Esto tiene dos consecuencias importantes: 1) las aguas superficiales se vuelven más brillantes, lo que significa que tienen un mayor albedo , y 2) se induce una fotoinhibición , es decir, la producción fotosintética disminuye debido a un exceso de luz. En el caso 1), una alta concentración de cocolitos conduce a un aumento simultáneo de la temperatura del agua superficial y una disminución de la temperatura de las aguas más profundas. Esto da como resultado una mayor estratificación en la columna de agua y una disminución en la mezcla vertical de nutrientes. Sin embargo, un estudio de 2012 estimó que el efecto general de los cocolitóforos sobre el aumento del forzamiento radiativo del océano es menor que el de los factores antropogénicos. [67] Por lo tanto, el resultado general de grandes floraciones de cocolitóforos es una disminución en la productividad de la columna de agua, en lugar de una contribución al calentamiento global.
Sus depredadores incluyen los depredadores comunes de todo el fitoplancton, incluidos los peces pequeños, el zooplancton y las larvas de mariscos. [45] [68] Se han aislado virus específicos de esta especie en varios lugares del mundo y parecen desempeñar un papel importante en la dinámica de la floración primaveral.
No se ha informado evidencia ambiental de toxicidad de cocolitóforos, pero pertenecen a la clase Prymnesiophyceae que contiene órdenes con especies tóxicas. Se han encontrado especies tóxicas en los géneros Prymnesium Massart y Chrysochromulina Lackey. Se ha descubierto que los miembros del género Prymnesium producen compuestos hemolíticos, el agente responsable de la toxicidad. Algunas de estas especies tóxicas son responsables de la mortandad de grandes peces y pueden acumularse en organismos como los mariscos; transfiriéndolo a través de la cadena alimentaria. En pruebas de laboratorio de toxicidad, se demostró que los miembros de los géneros de cocolitóforos oceánicos Emiliania, Gephyrocapsa, Calcidiscus y Coccolithus no eran tóxicos, al igual que las especies del género costero Hymenomonas ; sin embargo, varias especies de Pleurochrysis y Jomonlithus , ambos géneros costeros, fueron tóxicos para Artemia . [68]
Los cocolitofóridos se encuentran predominantemente como células haploides o diploides individuales que flotan libremente. [46]
La mayoría del fitoplancton necesita luz solar y nutrientes del océano para sobrevivir, por lo que prospera en áreas con grandes aportes de agua rica en nutrientes que surge de los niveles más bajos del océano. La mayoría de los cocolitóforos requieren luz solar sólo para la producción de energía y tienen una mayor proporción de absorción de nitrato que de amonio (el nitrógeno es necesario para el crecimiento y se puede utilizar directamente a partir del nitrato, pero no del amonio). Debido a esto, prosperan en ambientes tranquilos y pobres en nutrientes donde otros fitoplancton mueren de hambre. [69] Las compensaciones asociadas con estas tasas de crecimiento más rápidas incluyen un radio celular más pequeño y un volumen celular más bajo que otros tipos de fitoplancton.
Se sabe que los virus gigantes que contienen ADN infectan líticamente a los cocolitóforos, particularmente a E. huxleyi . Estos virus, conocidos como virus E. huxleyi (EhV), parecen infectar casi exclusivamente la fase diploide recubierta de la cocosfera del ciclo de vida. Se ha propuesto que como el organismo haploide no está infectado y por lo tanto no se ve afectado por el virus, la " carrera armamentista " coevolutiva entre los cocolitóforos y estos virus no sigue el marco evolutivo clásico de la Reina Roja , sino un "gato de Cheshire". dinámica ecológica. [70] Un trabajo más reciente ha sugerido que la síntesis viral de esfingolípidos y la inducción de la muerte celular programada proporciona un vínculo más directo para estudiar una carrera armamentista coevolutiva similar a la de la Reina Roja , al menos entre los cocolitovirus y los organismos diploides. [43]
Los cocolitóforos son miembros del clado Haptophyta , que es un clado hermano de Centrohelida , ambos en haptista . [71] Los cocolitóforos más antiguos conocidos se conocen del Triásico Tardío, alrededor del límite noriano - rético . [72] La diversidad aumentó constantemente a lo largo del Mesozoico, alcanzando su apogeo durante el Cretácico Superior . Sin embargo, hubo una fuerte caída durante el evento de extinción Cretácico-Paleógeno , cuando más del 90% de las especies de cocolitóforos se extinguieron. Los cocolitos alcanzaron otro pico de diversidad más bajo durante el máximo térmico del Paleoceno-Eoceno , pero posteriormente han disminuido desde el Oligoceno debido a la disminución de las temperaturas globales, siendo las especies que produjeron cocolitos grandes y muy calcificados las más afectadas. [26]


Cada cocolitóforo se encierra en una capa protectora de cocolitos , escamas calcificadas que forman su exoesqueleto o cocosfera . [73] Los cocolitos se crean dentro de la célula cocolitófora y, mientras que algunas especies mantienen una sola capa durante toda la vida y solo producen nuevos cocolitos a medida que la célula crece, otras producen y arrojan cocolitos continuamente.
El constituyente principal de los cocolitos es el carbonato de calcio o tiza . El carbonato de calcio es transparente, por lo que la actividad fotosintética de los organismos no se ve comprometida por la encapsulación en una cocosfera. [45]
Los cocolitos se producen mediante un proceso de biomineralización conocido como cocolitogénesis. [39] Generalmente, la calcificación de los cocolitos ocurre en presencia de luz, y estas escamas se producen mucho más durante la fase exponencial de crecimiento que en la fase estacionaria. [74] Aunque aún no se comprende del todo, el proceso de biomineralización está estrechamente regulado por la señalización del calcio . La formación de calcita comienza en el complejo de Golgi, donde las plantillas de proteínas nuclearan la formación de cristales de CaCO 3 y los polisacáridos ácidos complejos controlan la forma y el crecimiento de estos cristales. [49] A medida que se produce cada escama, se exporta en una vesícula derivada de Golgi y se agrega a la superficie interna de la cocosfera. Esto significa que los cocolitos producidos más recientemente pueden estar debajo de cocolitos más antiguos. [42] Dependiendo de la etapa del fitoplancton en el ciclo de vida, se pueden formar dos tipos diferentes de cocolitos. Los holococolitos se producen sólo en la fase haploide, carecen de simetría radial y están compuestos por cientos o miles de cristales rómbicos de calcita diminutos (aproximadamente 0,1 μm) similares . Se cree que estos cristales se forman al menos parcialmente fuera de la célula. Los heterococolitos ocurren sólo en la fase diploide, tienen simetría radial y están compuestos de relativamente pocas unidades cristalinas complejas (menos de 100). Aunque son raras, se han observado cocosferas combinadas, que contienen tanto holococolitos como heterococolitos, en el plancton que registran transiciones del ciclo de vida de los cocolitóforos. Finalmente, las cocosferas de algunas especies están muy modificadas con varios apéndices formados por cocolitos especializados. [53]
Si bien la función exacta de la cocosfera no está clara, se han propuesto muchas funciones potenciales. Lo más obvio es que los cocolitos pueden proteger al fitoplancton de los depredadores. También parece que les ayuda a crear un pH más estable . Durante la fotosíntesis se elimina el dióxido de carbono del agua, haciéndola más básica. Además, la calcificación elimina el dióxido de carbono, pero la química detrás de ella conduce a la reacción de pH opuesta; hace que el agua sea más ácida. Por lo tanto, la combinación de fotosíntesis y calcificación se equilibra entre sí en cuanto a los cambios de pH. [75] Además, estos exoesqueletos pueden conferir una ventaja en la producción de energía, ya que la cocolitogénesis parece estar altamente acoplada con la fotosíntesis. La precipitación orgánica de carbonato de calcio a partir de una solución de bicarbonato produce dióxido de carbono libre directamente dentro del cuerpo celular del alga; esta fuente adicional de gas luego está disponible para el cocolitóforo para la fotosíntesis. Se ha sugerido que pueden proporcionar una barrera similar a una pared celular para aislar la química intracelular del entorno marino. [76] Las propiedades defensivas más específicas de los cocolitos pueden incluir protección contra cambios osmóticos, golpes químicos o mecánicos y luz de longitud de onda corta. [41] También se ha propuesto que el peso agregado de múltiples capas de cocolitos permite que el organismo se hunda a capas de agua más bajas y más ricas en nutrientes y, a la inversa, que los cocolitos agregan flotabilidad, evitando que la célula se hunda a profundidades peligrosas. [77] También se ha propuesto que los apéndices de cocolitos cumplan varias funciones, como inhibir el pastoreo del zooplancton. [53]
Los cocolitos son el componente principal de Chalk , una formación rocosa del Cretácico Superior que aflora ampliamente en el sur de Inglaterra y forma los Acantilados Blancos de Dover , y de otras rocas similares en muchas otras partes del mundo. [10] En la actualidad, los cocolitos sedimentados son un componente importante de los exudados calcáreos que cubren hasta el 35% del fondo del océano y que en algunos lugares tienen kilómetros de espesor. [49] Debido a su abundancia y amplia distribución geográfica, los cocolitos que forman las capas de este exudado y el sedimento calcáreo que se forma a medida que se compacta sirven como microfósiles valiosos .

La calcificación , la producción biológica de carbonato de calcio (CaCO 3 ), es un proceso clave en el ciclo del carbono marino . Los cocolitóforos son el principal grupo planctónico responsable de la producción pelágica de CaCO 3 . [78] [79] El diagrama de la derecha muestra los costos energéticos de la calcificación de cocolitóforos:

El diagrama de la izquierda muestra los beneficios de la calcificación de cocolitóforos. (A) La fotosíntesis acelerada incluye CCM (1) y una mayor absorción de luz mediante la dispersión de fotones escasos para especies que habitan en las profundidades (2). (B) La protección contra el fotodaño incluye protección solar contra la luz ultravioleta (UV) y la radiación fotosintética activa (PAR) (1) y la disipación de energía en condiciones de mucha luz (2). (C) La protección de la armadura incluye protección contra infecciones virales/bacterianas (1) y pastoreo por parte de pastores selectivos (2) y no selectivos (3). [26]
Actualmente se desconoce hasta qué punto la calcificación puede adaptarse a la acidificación de los océanos . Los exámenes fisiológicos celulares encontraron que el eflujo esencial de H + (derivado del uso de HCO 3 - para la calcificación intracelular) se vuelve más costoso con la acidificación continua de los océanos a medida que se reduce el gradiente electroquímico de H + de adentro hacia afuera y se impide la salida pasiva de protones. [80] Las células adaptadas tendrían que activar los canales de protones con más frecuencia, ajustar su potencial de membrana y/o reducir su pH interno . [81] La reducción del pH intracelular afectaría gravemente a toda la maquinaria celular y requeriría otros procesos (por ejemplo, la fotosíntesis ) para coadaptarse a fin de mantener vivo el flujo de salida de H + . [82] [83] La salida obligatoria de H + asociada con la calcificación puede, por lo tanto, plantear una limitación fundamental a la adaptación que potencialmente puede explicar por qué las "crisis de calcificación" fueron posibles durante eventos de perturbación de CO 2 de larga duración (miles de años) [84] [ 85] a pesar de que la adaptación evolutiva a las condiciones cambiantes de la química de los carbonatos es posible en un año. [84] [85] Desentrañar estas limitaciones fundamentales y los límites de la adaptación debería ser un enfoque en futuros estudios de cocolitóforos porque conocerlos es la información clave requerida para comprender hasta qué punto la respuesta de calcificación a las perturbaciones de la química de los carbonatos puede ser compensada por la evolución. [86]
Los grupos funcionales blindados con silicato o celulosa, como las diatomeas y los dinoflagelados, no necesitan sostener el flujo de salida de H + relacionado con la calcificación . Por lo tanto, probablemente no necesiten adaptarse para mantener bajos los costos de producción de elementos estructurales. Por el contrario, los dinoflagelados (excepto las especies calcificantes; [87] con enzimas RuBisCO fijadoras de CO 2 generalmente ineficientes [88] pueden incluso beneficiarse de los cambios químicos, ya que debería facilitarse la fijación fotosintética de carbono como fuente de elementos estructurales en forma de celulosa. por la fertilización con CO 2 asociada a la acidificación del océano . [89] [90] Bajo el supuesto de que cualquier forma de caparazón/exoesqueleto protege al fitoplancton contra la depredación [28] las armaduras no calcáreas pueden ser la solución preferible para lograr la protección en un océano futuro. [86]
El diagrama de la derecha es una representación de cómo parece operar el esfuerzo energético comparativo para la construcción de armaduras en diatomeas, dinoflagelados y cocolitóforos. La frústula (caparazón de diatomeas) parece ser la armadura más económica en todas las circunstancias porque las diatomeas suelen superar a todos los demás grupos cuando hay silicato disponible. La cocosfera es relativamente económica con suficiente [CO 2 ], alto [HCO 3 − ] y bajo [H + ] porque el sustrato se está saturando y los protones se liberan fácilmente en el agua de mar. [80] Por el contrario, la construcción de elementos tecales , que son placas orgánicas ( celulosa ) que constituyen la capa de dinoflagelado, debería favorecerse en altas concentraciones de H + porque éstas suelen coincidir con altas [CO 2 ]. En estas condiciones, los dinoflagelados podrían regular a la baja el funcionamiento de los mecanismos de concentración de carbono, que consumen energía, para alimentar la producción de material orgánico para su caparazón. Por lo tanto, un cambio en las condiciones químicas de los carbonatos hacia niveles altos de [CO 2 ] puede promover su competitividad en relación con los cocolitóforos. Sin embargo, tal hipotético aumento de competitividad debido a condiciones químicas alteradas de los carbonatos no conduciría automáticamente a la dominancia de los dinoflagelados porque una gran cantidad de factores distintos de la química de los carbonatos también influyen en la composición de las especies . [86] [91]
Actualmente, la evidencia que apoya o refuta la función protectora de la cocosfera contra la depredación es limitada. Algunos investigadores encontraron que las tasas generales de depredación del microzooplancton se redujeron durante las floraciones del cocolitóforo Emiliania huxleyi , [92] [93] mientras que otros encontraron altas tasas de pastoreo de microzooplancton en comunidades naturales de cocolitóforos. [94] En 2020, los investigadores descubrieron que las tasas de ingestión in situ de microzooplancton en E. huxleyi no diferían significativamente de las de fitoplancton no calcificante de tamaño similar. [95] En experimentos de laboratorio, el dinoflagelado heterótrofo Oxyrrhis marina prefirió las células calcificadas a las no calcificadas de E. huxleyi , lo que se supuso que se debía al comportamiento de alimentación selectiva por tamaño, ya que las células calcificadas son más grandes que las no calcificadas de E. huxleyi . [96] En 2015, Harvey et al. investigaron la depredación por parte del dinoflagelado O. marina en diferentes genotipos de E. huxleyi no calcificantes, así como en cepas calcificadas que diferían en el grado de calcificación. [97] Descubrieron que la tasa de ingestión de O. marina dependía del genotipo de E. huxleyi que se ofrecía, más que de su grado de calcificación. Sin embargo, en el mismo estudio los autores descubrieron que los depredadores que se alimentaban de genotipos no calcificantes crecían más rápidamente que aquellos alimentados con células calcificadas. [97] En 2018, Strom et al. compararon las tasas de depredación del dinoflagelado Amphidinium longum en presas calcificadas en comparación con presas desnudas de E. huxleyi y no encontraron evidencia de que la cocosfera impida la ingestión por parte del herbívoro. [98] En cambio, las tasas de ingestión dependían del genotipo ofrecido de E. huxleyi. [98] En conjunto, estos dos estudios sugieren que el genotipo tiene una fuerte influencia en la ingestión por parte de las especies de microzooplancton, pero no se pudo aclarar completamente si la calcificación protege a los cocolitóforos de la depredación del microzooplancton y cómo. [1]
Los cocolitóforos tienen efectos tanto a corto como a largo plazo en el ciclo del carbono . La producción de cocolitos requiere la absorción de carbono y calcio inorgánicos disueltos . El carbonato de calcio y el dióxido de carbono se producen a partir de calcio y bicarbonato mediante la siguiente reacción química: [99]
Debido a que los cocolitóforos son organismos fotosintéticos, pueden utilizar parte del CO 2 liberado en la reacción de calcificación para la fotosíntesis . [100]
Sin embargo, la producción de carbonato de calcio reduce la alcalinidad de la superficie y, en condiciones de baja alcalinidad, el CO 2 se libera de nuevo a la atmósfera. [101] Como resultado de esto, los investigadores han postulado que grandes floraciones de cocolitóforos pueden contribuir al calentamiento global en el corto plazo. [102] Sin embargo, una idea más ampliamente aceptada es que, a largo plazo, los cocolitóforos contribuyen a una disminución general de las concentraciones de CO 2 atmosférico . Durante la calcificación se absorben dos átomos de carbono y uno de ellos queda atrapado como carbonato de calcio. Este carbonato de calcio se hunde hasta el fondo del océano en forma de cocolitos y pasa a formar parte del sedimento; por tanto, los cocolitóforos proporcionan un sumidero del carbono emitido, mediando los efectos de las emisiones de gases de efecto invernadero. [102]
Las investigaciones también sugieren que la acidificación de los océanos debido al aumento de las concentraciones de CO 2 en la atmósfera puede afectar la maquinaria de calcificación de los cocolitóforos. Esto no sólo puede afectar eventos inmediatos como aumentos en la población o la producción de cocolitos, sino que también puede inducir una adaptación evolutiva de las especies de cocolitóforos durante períodos de tiempo más largos. Por ejemplo, los cocolitóforos utilizan canales de iones H + para bombear constantemente iones H + fuera de la célula durante la producción de cocolitos. Esto les permite evitar la acidosis , ya que de lo contrario la producción de cocolitos produciría un exceso tóxico de iones H + . Cuando se altera la función de estos canales iónicos, los cocolitóforos detienen el proceso de calcificación para evitar la acidosis, formando así un circuito de retroalimentación . [103] La baja alcalinidad del océano afecta la función del canal iónico y, por lo tanto, ejerce una presión selectiva evolutiva sobre los cocolitóforos y los hace (y otros calcificadores del océano) vulnerables a la acidificación del océano. [104] En 2008, la evidencia de campo que indicaba un aumento en la calcificación de los sedimentos oceánicos recién formados que contienen cocolitóforos reforzó los primeros datos experimentales que muestran que un aumento en la concentración de CO 2 del océano resulta en un aumento en la calcificación de estos organismos. La disminución de la masa de cocolitos está relacionada tanto con el aumento de las concentraciones de CO 2 como con la disminución de las concentraciones de CO.2-3en los océanos del mundo. Se supone que esta menor calcificación pone a los cocolitóforos en desventaja ecológica. Sin embargo, algunas especies como Calcidiscus leptoporus no se ven afectadas de esta manera, mientras que las especies de cocolitóforos más abundantes, E. huxleyi, podrían verse afectadas (los resultados de los estudios son mixtos). [103] [105] Además, se han encontrado cocolitofóridos altamente calcificados en condiciones de baja saturación de CaCO 3 , contrariamente a las predicciones. [4] Comprender los efectos del aumento de la acidificación de los océanos en las especies de cocolitóforos es absolutamente esencial para predecir la composición química futura del océano, particularmente su química de carbonatos. Las medidas viables de conservación y gestión surgirán de futuras investigaciones en esta área. Grupos como CALMARO [106] , con sede en Europa , están monitoreando las respuestas de las poblaciones de cocolitóforos a diferentes pH y trabajando para determinar medidas de control ambientalmente racionales.
Los fósiles de cocolitos son microfósiles calcáreos destacados y valiosos . Son la mayor fuente mundial de carbonato de calcio biogénico y contribuyen significativamente al ciclo global del carbono . [107] Son el componente principal de los depósitos de tiza, como los acantilados blancos de Dover .
De particular interés son los fósiles que datan del Máximo Térmico Paleoceno-Eoceno, hace 55 millones de años. Se cree que este período corresponde más directamente a los niveles actuales de CO 2 en el océano. [108] Finalmente, se utilizó evidencia de campo de fósiles de cocolitóforos en roca para demostrar que el registro fósil de aguas profundas tiene un sesgo de registro de roca similar al que se acepta ampliamente que afecta el registro fósil terrestre . [109]
Los cocolitofóridos ayudan a regular la temperatura de los océanos. Prosperan en mares cálidos y liberan sulfuro de dimetilo (DMS) al aire, cuyos núcleos ayudan a producir nubes más espesas para bloquear el sol. [110] Cuando los océanos se enfrían, la cantidad de cocolitofóridos disminuye y la cantidad de nubes también disminuye. Cuando hay menos nubes que bloqueen el sol, la temperatura también aumenta. Esto, por tanto, mantiene el equilibrio y el equilibrio de la naturaleza. [111] [112]
Fuentes de información detallada
Introducciones a los cocolitóforos