ARN no codificante
El término small ARN ( sRNA) se utiliza a menudo por sus siglas en las bacterias ncRNAs.
[1][2] Los ácidos nucleicos fueron descubiertos por primera vez en 1868 por Friedrich Miescher, para 1939 el ARN había sido implicado en la síntesis de proteínas.
El ARN ribosomal fue el siguiente en ser descubierto, seguido por el UARN a principios de los años 80.
Desde entonces el descubrimiento de nuevos ARNs no codificantes ha continuado con los snoRNAs, Xist, CRISPR y muchos más.
Los ARNs no codificantes pertenecen a diversos grupos y participan en muchos procesos celulares.
Las partículas de ribonucleoproteina (RNP) o ribosomas son llamadas "fabricas" donde la traducción tiene lugar en la célula.
Los snoARNs guían modificaciones covalentes de rARN, tARN y nARNs, la ARNasa MRP rompe el primer espaciador interno trascrito entre 18S u 5,8S rARNs.
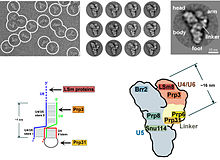
El spliceosome es un empalmador RNP a menudo también conocido como snRNP o tri-snRNP.
En mamíferos, se ha descubierto que los snoARNs pueden regular el empalme alternativo del ARNm.
En el núcleo humano, la RNasa P es necesaria para la trascripción normal y eficiente de diversos ncARNs transcritos por el ARN polimerasa III.
El OxyS ARN es producido como respuesta al estrés oxidativo en Escherichia coli.
La cromatina adopta progresivamente una configuración abierta, así es como diversas especies de ncARN son transcritos.
Por ejemplo, un riboswitch puede unir directamente una molécula objetivo pequeña y esta unión afecta la actividad genética.
Cuando hay una deficiencia de tARN cargado del aminoácido regulador, el ribosoma actúa formando la estructura no-degradativa.
El IRE se encuentra en UTRs de diferentes mARNs producidos que participan en el metabolismo del hierro.
La mayoría de los ARNs bifuncionales conocidos son mARNs que codifican una proteína y ncARNs.
[14] Al igual que con las proteínas, las mutaciones o los desequilibrios en el repertorio ncRNA en el cuerpo pueden causar una variedad de enfermedades.
Estos incluyen miARNs, mARN-like ncARNs largos, GAS5 SNORD 50, ARN telomerasa y YARNs.
[15] Se ha demostrado que las mutaciones en ARNses MRP causan hipoplasia cartílago cabello, una enfermedad asociada a un grupo de síntomas tales como baja estatura, escasez de cabello, anormalidades esqueléticas y una supresión del sistema inmune que se produce frecuentemente entre los Amish y los Filandeses.
De todas maneras, muchas otras mutaciones entre ARNasa MRP también causan hipoplasia cartílago cabello.
El antisense RNA BACE1-AS está trascrito desde la banda opuesta del BACE1 y una regulación progresiva en los pacientes con Alzheimer.
Las concentraciones BACE1-AS son elevadas en individuos con la enfermedad de Alzheimer y en ratones transgènicos con la proteína precursora del amiloide.
En los ratones homocigotos mutantes se descubrió que eran profundamente sordos, no mostrando respuestas cocleares.
Muchas publicaciones han comenzado a utilizar el término fARN, en comparación al ncARN, para describir regiones funcionales a nivel del ARN que podrían o no mantener separados los ARN transcriptos.
Sin embargo fARN también podría incluir mARN ya que este ARN codifica para proteínas y, por tanto, es funcional.