Alótropos del fósforo
El fósforo elemental puede existir en varios alótropos; los más comunes de ellos son sólidos blancos y rojos.
La forma α, la cual es estable bajo condiciones estándar, tiene una estructura cristalina de cuerpo cúbico centrado en las caras.
[1] El fósforo blanco es una cera translúcida y sólida que rápidamente se convierte en amarilla cuando es expuesta a la luz.
Brilla de manera verdosa en la oscuridad (cuando es expuesto a oxígeno), es altamente inflamable y pirofórico (se prende por sí solo) al contacto con el aire así como tóxico (causando un severo daño hepático si se ingiere y fosfonecrosis por ingestión crónica o inhalación).
Calentar fósforo rojo en presencia de humedad crea gas fosfano, el cual es tanto altamente inflamable como tóxico.
[4][5] En 1865, Johann Wilhelm Hittorf calentó fósforo rojo en un tubo sellado a 530 °C.
Si es calentado en una atmósfera de gas inerte, por ejemplo nitrógeno o dióxido de carbono se sublima y el vapor condensa a fósforo blanco.
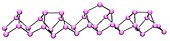
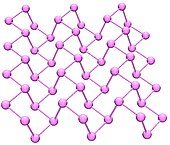
Al ser enfriado, este normalmente dimeriza para dar lugar a moléculas P4 (por ejemplo fósforo blanco), pero al vacío se conectan de nuevo para formar el alótropo polimérico violeta.
Se obtiene al calentar fósforo blanco a presiones altas (12,000 atmósferas).
[8][9] Se ha reportado una síntesis reciente de fósforo negro utilizando sales metálicas como catalizadores.
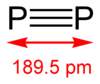
[14] El alótropo difósforo (P2) puede obtenerse normalmente bajo condiciones extremas (por ejemplo, del P4 a 1100 kelvin).
Sin embargo algunos avances se obtuvieron en generar una molécula diatómica en una solución homogénea bajo condiciones normales con el uso de un metal de transición complejo (basado en, por ejemplo, tungsteno y niobio).
[16] La fase roja-café difiere del fósforo rojo y es también estable en el aire por semanas.