
Un oncovirus o virus oncogénico es un virus que puede causar cáncer . [4] Este término se originó a partir de estudios de retrovirus de transformación aguda en la década de 1950-60, [5] cuando se utilizó el término oncornavirus para denotar su origen viral de ARN . [6] Con las letras ARN eliminadas, ahora se refiere a cualquier virus con un genoma de ADN o ARN que causa cáncer y es sinónimo de virus tumoral o virus del cáncer . La gran mayoría de los virus humanos y animales no causan cáncer, probablemente debido a la coevolución de larga data entre el virus y su huésped. Los oncovirus han sido importantes no solo en epidemiología , sino también en investigaciones de mecanismos de control del ciclo celular como la proteína del retinoblastoma .
La Agencia Internacional para la Investigación sobre el Cáncer de la Organización Mundial de la Salud estimó que en 2002, la infección causó el 17,8% de los cánceres humanos, y el 11,9% fue causado por uno de siete virus. [7] Un estudio de 2020 de 2658 muestras de 38 tipos diferentes de cáncer encontró que el 16% estaba asociado con un virus. [8] Estos cánceres podrían prevenirse fácilmente mediante la vacunación (por ejemplo, las vacunas contra el virus del papiloma ), diagnosticarse con análisis de sangre simples y tratarse con compuestos antivirales menos tóxicos.
En general, los virus tumorales causan poca o ninguna enfermedad después de la infección en sus huéspedes, o causan enfermedades no neoplásicas como hepatitis aguda para el virus de la hepatitis B o mononucleosis para el virus de Epstein-Barr . Una minoría de personas (o animales) desarrollarán cánceres después de la infección. Esto ha complicado los esfuerzos para determinar si un virus dado causa cáncer o no. Los conocidos postulados de Koch , construcciones del siglo XIX desarrolladas por Robert Koch para establecer la probabilidad de que Bacillus anthracis cause enfermedad de ántrax , no son aplicables a las enfermedades virales. En primer lugar, esto se debe a que los virus no pueden aislarse verdaderamente en cultivo puro: incluso las técnicas de aislamiento rigurosas no pueden excluir virus contaminantes no detectados con características de densidad similares, y los virus deben cultivarse en células. En segundo lugar, la infección y el transporte asintomáticos del virus son la norma para la mayoría de los virus tumorales, lo que viola el tercer principio de Koch. Relman y Fredericks han descrito las dificultades para aplicar los postulados de Koch a los cánceres inducidos por virus. [9] Por último, la restricción del hospedador para los virus humanos hace que no sea ético transmitir experimentalmente un virus sospechoso de cáncer. Otras medidas, como los criterios de AB Hill [10] , son más relevantes para la virología del cáncer, pero también tienen algunas limitaciones para determinar la causalidad.
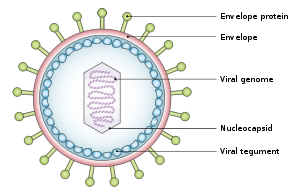
Los virus tumorales se presentan en una variedad de formas: los virus con un genoma de ADN , como el adenovirus , y los virus con un genoma de ARN, como el virus de la hepatitis C (VHC), pueden causar cánceres, al igual que los retrovirus que tienen genomas de ADN y ARN ( virus linfotrópico T humano y virus de la hepatitis B , que normalmente se replica como un virus de ADN mixto de cadena doble y simple, pero también tiene un componente de replicación retroviral). En muchos casos, los virus tumorales no causan cáncer en sus huéspedes nativos, sino solo en especies muertas. Por ejemplo, los adenovirus no causan cáncer en humanos, sino que son responsables de resfriados, conjuntivitis y otras enfermedades agudas. Solo se vuelven tumorigénicos cuando se infectan en ciertas especies de roedores, como los hámsteres sirios. Algunos virus son tumorigénicos cuando infectan una célula y persisten como episomas circulares o plásmidos, replicándose por separado del ADN de la célula huésped ( virus de Epstein-Barr y herpesvirus asociado al sarcoma de Kaposi ). Otros virus sólo son cancerígenos cuando se integran en el genoma de la célula huésped como parte de un accidente biológico, como los poliomavirus y los papilomavirus. [ cita requerida ]

Un mecanismo viral oncogénico directo [11] implica la inserción de genes oncogénicos virales adicionales en la célula huésped o la mejora de los genes oncogénicos ya existentes ( protooncogenes ) en el genoma. Por ejemplo, se ha demostrado que vFLIP y vCyclin interfieren con la vía de señalización de TGF-β indirectamente al inducir el grupo mir17-92 del huésped oncogénico. [12]
La oncogenicidad viral indirecta implica una inflamación crónica no específica que se produce a lo largo de décadas de infección, como es el caso del cáncer de hígado inducido por el VHC. Estos dos mecanismos difieren en su biología y epidemiología: los virus tumorales directos deben tener al menos una copia del virus en cada célula tumoral que exprese al menos una proteína o ARN que haga que la célula se vuelva cancerosa. Debido a que los antígenos del virus extraño se expresan en estos tumores, las personas inmunodeprimidas, como los pacientes con SIDA o trasplantados, tienen un mayor riesgo de sufrir estos tipos de cánceres. [ cita requerida ]
Por otra parte, los virus tumorales indirectos crónicos pueden perderse (al menos en teoría) a partir de un tumor maduro que ha acumulado suficientes mutaciones y condiciones de crecimiento (hiperplasia) a partir de la inflamación crónica de la infección viral. En este último caso, es controvertido, pero al menos en teoría posible, que un virus tumoral indirecto pueda sufrir una "fuga de contagio" y, por lo tanto, perderse del tumor diagnosticado clínicamente. En términos prácticos, esto es un hecho poco común si ocurre. [ cita requerida ]

Los oncovirus de ADN suelen afectar a dos familias de proteínas supresoras de tumores: las proteínas tumorales p53 y las proteínas del retinoblastoma (Rb). Es evolutivamente ventajoso para los virus inactivar la p53 porque puede provocar la detención del ciclo celular o la apoptosis en las células infectadas cuando el virus intenta replicar su ADN. [13] De manera similar, las proteínas Rb regulan muchas funciones celulares esenciales, incluido, entre otras, un punto de control crucial del ciclo celular, lo que las convierte en un objetivo para los virus que intentan interrumpir la función celular normal. [14]
Aunque se han descubierto varios oncovirus de ADN, tres se han estudiado ampliamente. Los adenovirus pueden provocar tumores en modelos de roedores, pero no causan cáncer en humanos; sin embargo, se han explotado como vehículos de administración en terapia génica para enfermedades como la fibrosis quística y el cáncer. [15] El virus de los simios 40 (SV40), un poliomavirus , puede causar tumores en modelos de roedores, pero no es oncogénico en humanos. [16] Este fenómeno ha sido una de las principales controversias de la oncogénesis en el siglo XX porque se estima que 100 millones de personas estuvieron expuestas inadvertidamente al SV40 a través de las vacunas contra la polio. [16] Se ha demostrado que el virus del papiloma humano -16 (HPV-16) provoca cáncer de cuello uterino y otros cánceres, incluido el cáncer de cabeza y cuello. [17] Estos tres virus tienen mecanismos de acción paralelos, lo que forma un arquetipo para los oncovirus de ADN. Los tres oncovirus de ADN son capaces de integrar su ADN en la célula huésped y utilizarlo para transcribirlo y transformar las células eludiendo el punto de control G1/S del ciclo celular. [ cita requerida ]
Los oncovirus de ADN transforman las células infectadas al integrar su ADN en el genoma de la célula huésped. [18] Se cree que el ADN se inserta durante la transcripción o replicación, cuando las dos cadenas hibridadas se separan. [18] Este evento es relativamente raro y generalmente impredecible; no parece haber un predictor determinista del sitio de integración. [18] Después de la integración, el ciclo celular del huésped pierde la regulación de Rb y p53, y la célula comienza a clonarse para formar un tumor. [19]
Rb y p53 regulan la transición entre la fase G1 y la fase S , deteniendo el ciclo celular antes de la replicación del ADN hasta que se completen las entradas del punto de control apropiadas, como la reparación del daño del ADN. [20] p53 regula el gen p21, que produce una proteína que se une al complejo Ciclina D-Cdk4/6. [21] Esto previene la fosforilación de Rb y evita que la célula entre en la fase S. [21] En los mamíferos, cuando Rb está activo (no fosforilado), inhibe la familia E2F de factores de transcripción, que regulan el complejo Ciclina E - Cdk2 , que inhibe a Rb, formando un ciclo de retroalimentación positiva, manteniendo la célula en G1 hasta que la entrada cruza un umbral. [20] Para llevar a la célula a la fase S prematuramente, los virus deben inactivar p53, que juega un papel central en el punto de control G1/S, así como Rb, que, aunque aguas abajo de él, generalmente se mantiene activo por un ciclo de retroalimentación positiva. [ cita requerida ]
Los virus emplean varios métodos para inactivar p53. La proteína E1B del adenovirus (55K) evita que p53 regule los genes al unirse al sitio de p53 que se une al genoma. [13] En SV40, el antígeno T grande (LT) es un análogo; LT también se une a varias otras proteínas celulares, como p107 y p130 , en los mismos residuos. [22] LT se une al dominio de unión de p53 en el ADN (en lugar de en la proteína), lo que nuevamente evita que p53 regule adecuadamente los genes. [13] En cambio, el VPH degrada p53: la proteína E6 del VPH se une a una proteína celular llamada proteína asociada a E6 (E6-AP, también conocida como UBE3A ), formando un complejo que causa la ubiquitinación rápida y específica de p53. [23]
Rb se inactiva (permitiendo así que la transición G1/S progrese sin impedimentos) por oncoproteínas virales diferentes pero análogas. La región temprana 1A (E1A) del adenovirus es una oncoproteína que se une a Rb y puede estimular la transcripción y transformar las células. [13] SV40 utiliza la misma proteína para inactivar Rb, LT, para inactivar p53. [21] HPV contiene una proteína, E7, que puede unirse a Rb de la misma manera. [24] Rb puede inactivarse por fosforilación, o al unirse a una oncoproteína viral, o por mutaciones (las mutaciones que impiden la unión de la oncoproteína también están asociadas con el cáncer). [22]
Los oncovirus de ADN suelen causar cáncer al inactivar p53 y Rb, lo que permite una división celular descontrolada y la creación de tumores. Puede haber muchos mecanismos diferentes que han evolucionado por separado; además de los descritos anteriormente, por ejemplo, el virus del papiloma humano inactiva p53 secuestrándolo en el citoplasma. [13]
El SV40 ha sido bien estudiado y no causa cáncer en humanos, pero un análogo descubierto recientemente llamado poliomavirus de células de Merkel se ha asociado con el carcinoma de células de Merkel , una forma de cáncer de piel. [25] Se cree que la característica de unión de Rb es la misma entre los dos virus. [25]
En la década de 1960, se creía que el proceso de replicación del virus ARN era similar al de otros ARN monocatenarios. La replicación del ARN monocatenario implica la síntesis de ARN dependiente del ARN, lo que significa que las enzimas codificantes del virus producirían ARN bicatenario parcial. Se demostró que esta creencia era incorrecta porque no se encontró ARN bicatenario en la célula del retrovirus. En 1964, Howard Temin propuso una hipótesis de provirus, pero poco después se descubrió la transcripción inversa en el genoma del retrovirus.
Todos los retrovirus tienen tres dominios codificantes principales: gag , pol y env . En la región gag del virus se mantiene la síntesis de las proteínas internas del virión que conforman las proteínas de la matriz, la cápside y la nucleocápside. En pol se almacena la información para las enzimas de transcripción inversa e integración. En env se deriva de la superficie y transmembrana para la proteína de la envoltura viral. Existe un cuarto dominio codificante que es más pequeño, pero existe en todos los retrovirus. Pol es el dominio que codifica la proteasa del virión.
El retrovirus comienza su viaje hacia la célula huésped uniendo una glicoproteína de superficie al receptor de la membrana plasmática de la célula. Una vez dentro de la célula, el retrovirus pasa por una transcripción inversa en el citoplasma y genera una copia de ADN de doble cadena del genoma de ARN. La transcripción inversa también produce estructuras idénticas conocidas como repeticiones terminales largas (LTR). Las repeticiones terminales largas se encuentran en los extremos de las cadenas de ADN y regulan la expresión génica viral. El ADN viral se transloca luego al núcleo, donde una cadena del genoma retroviral se coloca en el ADN cromosómico con la ayuda de la integrasa del virión. En este punto, el retrovirus se conoce como provirus. Una vez en el ADN cromosómico, el provirus es transcrito por la ARN polimerasa II celular. La transcripción conduce al empalme y a los ARNm de longitud completa y a la progenie de ARN virión de longitud completa. La proteína del virión y el ARN progenie se ensamblan en el citoplasma y abandonan la célula, mientras que las otras copias envían mensajes virales traducidos en el citoplasma.

No todos los oncovirus son virus de ADN . También se han asociado algunos virus de ARN , como el virus de la hepatitis C , así como ciertos retrovirus, como el virus linfotrópico T humano (HTLV-1) y el virus del sarcoma de Rous (VSR).
Porcentaje estimado de nuevos cánceres atribuibles al virus en todo el mundo en 2002. [7] NA indica que no está disponible. La asociación de otros virus con el cáncer humano está en constante investigación.

Los principales virus asociados con cánceres humanos son el virus del papiloma humano , los virus de la hepatitis B y la hepatitis C , el virus de Epstein-Barr , el virus linfotrópico T humano , el virus del herpes asociado al sarcoma de Kaposi (KSHV) y el poliomavirus de células de Merkel . Los datos experimentales y epidemiológicos implican un papel causal para los virus y parecen ser el segundo factor de riesgo más importante para el desarrollo de cáncer en humanos, superado solo por el uso de tabaco. [41] El modo de tumores inducidos por virus se puede dividir en dos, de transformación aguda o de transformación lenta . En los virus de transformación aguda, las partículas virales llevan un gen que codifica un oncogén hiperactivo llamado oncogén viral (v-onc), y la célula infectada se transforma tan pronto como se expresa v-onc. Por el contrario, en los virus de transformación lenta, el genoma del virus se inserta, especialmente porque la inserción del genoma viral es una parte obligatoria de los retrovirus , cerca de un protooncogén en el genoma del huésped. El promotor viral u otros elementos de regulación de la transcripción a su vez provocan la sobreexpresión de ese protooncogen, lo que a su vez induce una proliferación celular descontrolada. Debido a que la inserción del genoma viral no es específica de los protooncogenes y la probabilidad de inserción cerca de ese protooncogen es baja, los virus de transformación lenta tienen una latencia tumoral muy larga en comparación con los virus de transformación aguda, que ya portan el oncogen viral. [ cita requerida ]
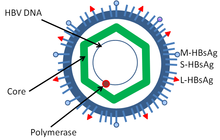
Los virus de la hepatitis, incluidos los de la hepatitis B y la hepatitis C , pueden inducir una infección viral crónica que conduce al cáncer de hígado en el 0,47 % de los pacientes con hepatitis B por año (especialmente en Asia, en menor medida en América del Norte) y en el 1,4 % de los portadores de hepatitis C por año. La cirrosis hepática, ya sea por infección de hepatitis viral crónica o alcoholismo, se asocia con el desarrollo de cáncer de hígado, y la combinación de cirrosis y hepatitis viral presenta el mayor riesgo de desarrollo de cáncer de hígado. En todo el mundo, el cáncer de hígado es uno de los cánceres más comunes y más mortales debido a una enorme carga de transmisión y enfermedad de hepatitis viral . [ cita requerida ]
Gracias a los avances en la investigación del cáncer, se han creado vacunas diseñadas para prevenirlo. La vacuna contra la hepatitis B es la primera vacuna que se ha establecido para prevenir el cáncer ( carcinoma hepatocelular ) al evitar la infección con el virus causante. En 2006, la Administración de Alimentos y Medicamentos de los Estados Unidos aprobó una vacuna contra el virus del papiloma humano , llamada Gardasil . La vacuna protege contra cuatro tipos de VPH, que juntos causan el 70% de los cánceres de cuello uterino y el 90% de las verrugas genitales. En marzo de 2007, el Comité Asesor sobre Prácticas de Inmunización (ACIP) de los Centros para el Control y la Prevención de Enfermedades (CDC) de los Estados Unidos recomendó oficialmente que las niñas de 11 a 12 años recibieran la vacuna, e indicó que las niñas de tan solo 9 años y de hasta 26 años también son candidatas para la inmunización. [ cita requerida ]
La historia del descubrimiento del virus del cáncer está entrelazada con la historia de la investigación sobre el cáncer y la historia de la virología . El registro más antiguo que sobrevive de un cáncer humano es el Código babilónico de Hammurabi (fechado ca. 1754 a. C.), pero la oncología científica solo pudo surgir en el siglo XIX, cuando los tumores se estudiaron a nivel microscópico con la ayuda del microscopio compuesto y lentes acromáticas . La microbiología del siglo XIX acumuló evidencia que implicaba a bacterias, levaduras , hongos y protozoos en el desarrollo del cáncer. En 1926 se otorgó el Premio Nobel por documentar que un gusano nematodo podía provocar cáncer de estómago en ratas. Pero no se reconoció que el cáncer pudiera tener orígenes infecciosos hasta mucho más tarde, ya que el virus había sido descubierto por primera vez por Dmitri Ivanovsky y Martinus Beijerinck a fines del siglo XIX. [42]

La teoría de que el cáncer podría ser causado por un virus comenzó con los experimentos de Oluf Bang y Vilhelm Ellerman en 1908 en la Universidad de Copenhague . Bang y Ellerman demostraron que el virus de la leucosis del sarcoma aviar podía transmitirse entre pollos después de la filtración acelular y posteriormente causar leucemia. [43] [44] Esto fue confirmado posteriormente para tumores sólidos en pollos en 1910-1911 por Peyton Rous . [45] [46] Rous en la Universidad Rockefeller amplió los experimentos de Bang y Ellerman para mostrar la transmisión acelular de un sarcoma de tumor sólido a pollos (ahora conocido como sarcoma de Rous ). Las razones por las que los pollos son tan receptivos a dicha transmisión pueden involucrar características inusuales de estabilidad o inestabilidad en relación con los retrovirus endógenos . [46] [47] Charlotte Friend confirmó los hallazgos de Bang y Ellerman para el tumor líquido en ratones por. [48] En 1933, Richard Shope y Edward Weston Hurst demostraron que las verrugas de los conejos silvestres contenían el virus del papiloma de Shope . [42] En 1936, John Joseph Bittner identificó el virus del tumor mamario del ratón , un "factor extracromosómico" (es decir, virus) que podía transmitirse entre cepas de ratones de laboratorio a través de la lactancia materna. [49]
A principios de la década de 1950, se sabía que los virus podían eliminar e incorporar genes y material genético en las células. Se sugirió que estos tipos de virus podrían causar cáncer al introducir nuevos genes en el genoma. El análisis genético de ratones infectados con el virus Friend confirmó que la integración retroviral podría alterar los genes supresores de tumores, causando cáncer. [50] Posteriormente se descubrieron e identificaron oncogenes virales que causaban cáncer. [ cita requerida ] Ludwik Gross identificó el primer virus de leucemia de ratón ( virus de leucemia murina ) en 1951 [42] y en 1953 informó sobre un componente del extracto de leucemia de ratón capaz de causar tumores sólidos en ratones. [51] Este compuesto fue posteriormente identificado como un virus por Sarah Stewart y Bernice Eddy en el Instituto Nacional del Cáncer , en cuyo honor se lo llamó una vez "polioma SE". [52] [53] [54] En 1957, Charlotte Friend descubrió el virus Friend , una cepa del virus de leucemia murina capaz de causar cánceres en ratones inmunocompetentes. [48] Aunque sus hallazgos recibieron una reacción negativa significativa, finalmente fueron aceptados por el campo y consolidaron la validez de la oncogénesis viral. [55]
En 1961, Eddy descubrió el virus vacuolante simio 40 ( SV40 ). El laboratorio Merck también confirmó la existencia de un virus del macaco rhesus que contaminaba las células utilizadas para fabricar las vacunas antipoliomielíticas Salk y Sabin . Varios años después, se demostró que causaba cáncer en hámsteres sirios , lo que generó preocupación sobre las posibles implicaciones para la salud humana. El consenso científico ahora coincide firmemente en que no es probable que esto cause cáncer humano. [56] [57]
En 1964, Anthony Epstein , Bert Achong e Yvonne Barr identificaron el primer oncovirus humano a partir de células de linfoma de Burkitt . Este virus, un herpesvirus, se conoce formalmente como herpesvirus humano 4, pero se lo llama más comúnmente virus de Epstein-Barr o VEB. [58] A mediados de la década de 1960, Baruch Blumberg aisló y caracterizó físicamente por primera vez la hepatitis B mientras trabajaba en el Instituto Nacional de Salud (NIH) y más tarde en el Centro Oncológico Fox Chase . [59] Aunque este agente era la causa clara de la hepatitis y podría contribuir al cáncer de hígado ( carcinoma hepatocelular) , este vínculo no se estableció firmemente hasta que R. Palmer Beasley y otros realizaron estudios epidemiológicos en la década de 1980. [60]
En 1980, Bernard Poiesz y Robert Gallo, del NIH, descubrieron el primer retrovirus humano, el virus linfotrópico de células T humanas 1 (HTLV-I), [61] [62] y Mitsuaki Yoshida y colaboradores lo descubrieron de forma independiente en Japón. [63] Pero no se sabía con certeza si el HTLV-I promovía la leucemia. En 1981, Yorio Hinuma y sus colegas de la Universidad de Kioto informaron sobre la visualización de partículas retrovirales producidas por una línea celular de leucemia derivada de pacientes con leucemia/linfoma de células T adultas . Este virus resultó ser el HTLV-1 y la investigación estableció el papel causal del virus HTLV-1 en la LTA. [42]

Entre 1984 y 1986 Harald zur Hausen y Lutz Gissmann descubrieron el HPV16 y el HPV18, que juntos son los virus Papillomaviridae (HPV) responsables de aproximadamente el 70% de las infecciones por el virus del papiloma humano que causan cánceres de cuello uterino . Por el descubrimiento de que el HPV causa cáncer humano se otorgó el Premio Nobel de 2008. [64] En 1987 se descubrió el virus de la hepatitis C (HCV) mediante la selección de una biblioteca de ADNc hecha de tejidos enfermos en busca de antígenos extraños reconocidos por sueros de pacientes. Este trabajo fue realizado por Michael Houghton en Chiron , una empresa de biotecnología, y Daniel W. Bradley en los Centros para el Control y la Prevención de Enfermedades (CDC). [65] Posteriormente se demostró que el HCV era un importante contribuyente al carcinoma hepatocelular (cáncer de hígado) en todo el mundo. [42]
En 1994, Patrick S. Moore y Yuan Chang de la Universidad de Columbia , en colaboración con Ethel Cesarman, [66] [67] aislaron el virus del herpes asociado al sarcoma de Kaposi (KSHV o HHV8) mediante el análisis de diferencias representacionales . Esta búsqueda fue motivada por el trabajo de Valerie Beral y sus colegas, quienes dedujeron a partir de la epidemia de sarcoma de Kaposi entre pacientes con SIDA que este cáncer debía ser causado por otro agente infeccioso además del VIH, y que era probable que se tratara de un segundo virus. [68] Estudios posteriores revelaron que el KSHV es el "agente del sarcoma de Kaposi" y es responsable de los patrones epidemiológicos del sarcoma de Kaposi y de otros cánceres relacionados. [69]
En 2008, Yuan Chang y Patrick S. Moore desarrollaron un nuevo método para identificar virus cancerosos basado en la sustracción informática de secuencias humanas de un transcriptoma tumoral , llamada sustracción digital del transcriptoma (DTS). [70] La DTS se utilizó para aislar fragmentos de ADN del poliomavirus de células de Merkel de un carcinoma de células de Merkel y ahora se cree que este virus causa el 70-80% de estos cánceres. [25]
Los virus conocidos como virus ARN oncogénicos u oncornavirus se han descrito en una amplia variedad de especies de vertebrados [...] ha habido muy pocos ejemplos, si es que hay alguno, completamente convincentes de aislamiento de oncornavirus humanos.
{{cite book}}: |work=ignorado ( ayuda )