
La recombinación homóloga es un tipo de recombinación genética en la que se intercambia información genética entre dos moléculas similares o idénticas de ácidos nucleicos bicatenarios o monocatenarios (normalmente ADN, como en los organismos celulares, pero también puede ser ARN, como en los virus ).
Las células utilizan ampliamente la recombinación homóloga para reparar con precisión las roturas dañinas del ADN que se producen en ambas cadenas de ADN, conocidas como roturas de doble cadena (DSB), en un proceso llamado reparación recombinacional homóloga (HRR). [1]
La recombinación homóloga también produce nuevas combinaciones de secuencias de ADN durante la meiosis , el proceso mediante el cual los eucariotas forman células gameto , como los espermatozoides y los óvulos en los animales. Estas nuevas combinaciones de ADN representan variación genética en la descendencia, lo que a su vez permite que las poblaciones se adapten durante el curso de la evolución . [2]
La recombinación homóloga también se utiliza en la transferencia horizontal de genes para intercambiar material genético entre diferentes cepas y especies de bacterias y virus. La transferencia horizontal de genes es el principal mecanismo de propagación de la resistencia a los antibióticos en las bacterias.
Aunque la recombinación homóloga varía ampliamente entre diferentes organismos y tipos de células, para el ADN bicatenario ( dsDNA ) la mayoría de las formas implican los mismos pasos básicos. Después de que se produce una rotura de doble cadena, las secciones de ADN alrededor de los extremos 5' de la rotura se cortan en un proceso llamado resección . En el paso de invasión de cadena que sigue, un extremo 3' sobresaliente de la molécula de ADN rota "invade" una molécula de ADN similar o idéntica que no está rota. Después de la invasión de cadena, la secuencia posterior de eventos puede seguir cualquiera de las dos vías principales que se analizan a continuación (ver Modelos); la vía DSBR (reparación de rotura de doble cadena) o la vía SDSA (recocido de cadena dependiente de síntesis). La recombinación homóloga que ocurre durante la reparación del ADN tiende a dar como resultado productos que no son de entrecruzamiento, restaurando en efecto la molécula de ADN dañada como existía antes de la rotura de doble cadena.
La recombinación homóloga se conserva en los tres dominios de la vida, así como en los virus de ADN y ARN , lo que sugiere que es un mecanismo biológico casi universal. El descubrimiento de genes para la recombinación homóloga en protistos —un grupo diverso de microorganismos eucariotas— se ha interpretado como evidencia de que la recombinación homóloga surgió temprano en la evolución de los eucariotas. Dado que su disfunción se ha asociado fuertemente con una mayor susceptibilidad a varios tipos de cáncer , las proteínas que facilitan la recombinación homóloga son temas de investigación activa. La recombinación homóloga también se utiliza en la orientación genética , una técnica para introducir cambios genéticos en organismos objetivo. Por el desarrollo de esta técnica, Mario Capecchi , Martin Evans y Oliver Smithies fueron galardonados con el Premio Nobel de Fisiología o Medicina de 2007 ; Capecchi [3] y Smithies [4] descubrieron de forma independiente aplicaciones en células madre embrionarias de ratón, sin embargo, los mecanismos altamente conservados que subyacen al modelo de reparación de DSB, incluida la integración homóloga uniforme del ADN transformado (terapia génica), se demostraron por primera vez en experimentos con plásmidos por Orr-Weaver, Szostak y Rothstein. [5] [6] [7] La investigación de la DSB inducida por plásmidos, utilizando irradiación γ [8] en los años 1970 y 1980, condujo a experimentos posteriores que utilizaban endonucleasas (por ejemplo, I-SceI) para cortar cromosomas para la ingeniería genética de células de mamíferos, donde la recombinación no homóloga es más frecuente que en la levadura. [9]

A principios de la década de 1900, William Bateson y Reginald Punnett encontraron una excepción a uno de los principios de herencia descritos originalmente por Gregor Mendel en la década de 1860. En contraste con la noción de Mendel de que los rasgos se distribuyen independientemente cuando se transmiten de padres a hijos (por ejemplo, que el color del pelo de un gato y la longitud de su cola se heredan independientemente unos de otros), Bateson y Punnett demostraron que ciertos genes asociados con rasgos físicos pueden heredarse juntos o estar genéticamente vinculados . [10] [11] En 1911, después de observar que los rasgos vinculados en ocasiones podían heredarse por separado, Thomas Hunt Morgan sugirió que pueden producirse " cruces " entre genes vinculados, [12] donde uno de los genes vinculados se cruza físicamente a un cromosoma diferente . Dos décadas después, Barbara McClintock y Harriet Creighton demostraron que el cruce cromosómico ocurre durante la meiosis , [13] [14] el proceso de división celular por el que se forman los espermatozoides y los óvulos . En el mismo año del descubrimiento de McClintock, Curt Stern demostró que el entrecruzamiento (más tarde llamado "recombinación") también podía ocurrir en células somáticas como los glóbulos blancos y las células de la piel que se dividen a través de la mitosis . [13] [15]
En 1947, el microbiólogo Joshua Lederberg demostró que las bacterias, que se suponía que solo se reproducían asexualmente a través de la fisión binaria , son capaces de recombinación genética, que es más similar a la reproducción sexual. Este trabajo estableció a E. coli como un organismo modelo en genética, [16] y ayudó a Lederberg a ganar el Premio Nobel de Fisiología o Medicina de 1958. [17] Basándose en estudios en hongos , en 1964 Robin Holliday propuso un modelo para la recombinación en la meiosis que introdujo detalles clave de cómo puede funcionar el proceso, incluido el intercambio de material entre cromosomas a través de las uniones de Holliday . [18] En 1983, Jack Szostak y sus colegas presentaron un modelo ahora conocido como la vía DSBR, que explicaba las observaciones no explicadas por el modelo de Holliday. [18] [7] Durante la década siguiente, los experimentos en Drosophila , levaduras en ciernes y células de mamíferos condujeron al surgimiento de otros modelos de recombinación homóloga, llamados vías SDSA, que no siempre dependen de las uniones de Holliday. [18]
Gran parte del trabajo posterior para identificar las proteínas involucradas en el proceso y determinar sus mecanismos fue realizado por varias personas, entre ellas James Haber , Patrick Sung , Stephen Kowalczykowski y otros.
La recombinación homóloga (RH) es esencial para la división celular en eucariotas como plantas, animales, hongos y protistos. La recombinación homóloga repara las roturas de doble cadena del ADN causadas por la radiación ionizante o por sustancias químicas que dañan el ADN. [19] Si no se reparan, estas roturas de doble cadena pueden causar una reorganización a gran escala de los cromosomas en las células somáticas , [20] lo que a su vez puede provocar cáncer. [21]
Además de reparar el ADN, la recombinación homóloga también ayuda a producir diversidad genética cuando las células se dividen en la meiosis para convertirse en células gameto especializadas: espermatozoides u óvulos en animales, polen u óvulos en plantas y esporas en hongos . Lo hace facilitando el entrecruzamiento cromosómico , en el que se intercambian regiones de ADN similar pero no idéntico entre cromosomas homólogos . [22] [23] Esto crea nuevas combinaciones de genes posiblemente beneficiosas, que pueden dar a la descendencia una ventaja evolutiva. [24] El entrecruzamiento cromosómico a menudo comienza cuando una proteína llamada Spo11 hace una ruptura de doble cadena dirigida en el ADN. [25] Estos sitios no están ubicados aleatoriamente en los cromosomas; generalmente en regiones promotoras intergénicas y preferentemente en dominios ricos en GC [26] Estos sitios de ruptura de doble cadena a menudo ocurren en puntos calientes de recombinación , regiones en cromosomas que tienen alrededor de 1000 a 2000 pares de bases de longitud y tienen altas tasas de recombinación. La ausencia de un punto de recombinación entre dos genes del mismo cromosoma suele significar que esos genes serán heredados por generaciones futuras en igual proporción. Esto representa un vínculo entre los dos genes mayor del que se esperaría de genes que se seleccionan de forma independiente durante la meiosis. [27]
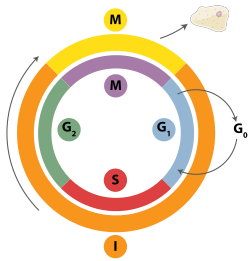
Las roturas de doble cadena se pueden reparar mediante recombinación homóloga, unión de extremos mediada por la polimerasa theta (TMEJ) o mediante unión de extremos no homólogos (NHEJ). [28] La NHEJ es un mecanismo de reparación del ADN que, a diferencia de la recombinación homóloga, no requiere una secuencia homóloga larga para guiar la reparación. El uso de recombinación homóloga o NHEJ para reparar roturas de doble cadena está determinado en gran medida por la fase del ciclo celular . La recombinación homóloga repara el ADN antes de que la célula entre en mitosis (fase M). Ocurre durante y poco después de la replicación del ADN , en las fases S y G 2 del ciclo celular, cuando las cromátidas hermanas están más fácilmente disponibles. [29] En comparación con los cromosomas homólogos, que son similares a otro cromosoma pero a menudo tienen alelos diferentes , las cromátidas hermanas son una plantilla ideal para la recombinación homóloga porque son una copia idéntica de un cromosoma determinado. Cuando no se dispone de una plantilla homóloga o cuando no se puede acceder a ella debido a un defecto en la recombinación homóloga, la rotura se repara mediante la unión de la membrana homocítica en las fases S y G 2 del ciclo celular. A diferencia de la recombinación homóloga y la unión de la membrana homocítica, la unión de la membrana homocítica es predominante en la fase G 1 del ciclo celular, cuando la célula está creciendo pero aún no está lista para dividirse. Ocurre con menos frecuencia después de la fase G 1 , pero mantiene al menos cierta actividad durante todo el ciclo celular. Los mecanismos que regulan la recombinación homóloga y la unión de la membrana homocítica a lo largo del ciclo celular varían ampliamente entre especies. [30]
Las quinasas dependientes de ciclina (CDK), que modifican la actividad de otras proteínas añadiéndoles grupos fosfato (es decir, fosforilándolas ), son importantes reguladores de la recombinación homóloga en eucariotas. [30] Cuando comienza la replicación del ADN en la levadura en ciernes, la quinasa dependiente de ciclina Cdc28 comienza la recombinación homóloga fosforilando la proteína Sae2 . [31] Después de ser activada de esta manera mediante la adición de un fosfato, Sae2 hace que se realice un corte limpio cerca de una rotura de doble cadena en el ADN. No está claro si la endonucleasa responsable de este corte es la propia Sae2 u otra proteína, Mre11 . [32] Esto permite que un complejo proteico que incluye Mre11, conocido como complejo MRX , se una al ADN y comience una serie de reacciones impulsadas por proteínas que intercambian material entre dos moléculas de ADN. [33]
El empaquetamiento del ADN eucariota en cromatina presenta una barrera para todos los procesos basados en ADN que requieren el reclutamiento de enzimas a sus sitios de acción. Para permitir la reparación del ADN por recombinación homóloga (HR), la cromatina debe ser remodelada. En eucariotas, los complejos de remodelación de cromatina dependientes de ATP y las enzimas modificadoras de histonas son dos factores predominantes empleados para lograr este proceso de remodelación. [34]
La relajación de la cromatina ocurre rápidamente en el sitio de un daño del ADN. [35] En uno de los primeros pasos, la proteína quinasa activada por estrés, c-Jun N-terminal kinase (JNK) , fosforila SIRT6 en la serina 10 en respuesta a roturas de doble cadena u otro daño del ADN. [36] Esta modificación postraduccional facilita la movilización de SIRT6 a los sitios de daño del ADN, y es necesaria para el reclutamiento eficiente de la poli (ADP-ribosa) polimerasa 1 (PARP1) a los sitios de rotura del ADN y para la reparación eficiente de DSB. [36] La proteína PARP1 comienza a aparecer en los sitios de daño del ADN en menos de un segundo, con la mitad de la acumulación máxima dentro de los 1,6 segundos después de que ocurre el daño. [37] Luego, el remodelador de cromatina Alc1 se une rápidamente al producto de la acción de PARP1, una cadena de poli-ADP ribosa, y Alc1 completa la llegada al daño del ADN dentro de los 10 segundos de la ocurrencia del daño. [35] Aproximadamente la mitad de la relajación máxima de la cromatina, presumiblemente debido a la acción de Alc1, ocurre a los 10 segundos. [35] Esto permite el reclutamiento de la enzima reparadora de ADN MRE11 , para iniciar la reparación del ADN, dentro de los 13 segundos. [37]
γH2AX, la forma fosforilada de H2AX, también está involucrada en los primeros pasos que conducen a la descondensación de la cromatina después de las roturas de doble cadena de ADN. La variante de histona H2AX constituye aproximadamente el 10% de las histonas H2A en la cromatina humana. [38] γH2AX (H2AX fosforilada en la serina 139) puede detectarse tan pronto como 20 segundos después de la irradiación de las células (con formación de rotura de doble cadena de ADN), y la mitad de la acumulación máxima de γH2AX ocurre en un minuto. [38] La extensión de la cromatina con γH2AX fosforilada es de aproximadamente dos millones de pares de bases en el sitio de una rotura de doble cadena de ADN. [38] γH2AX no causa, por sí misma, la descondensación de la cromatina, pero dentro de los 30 segundos posteriores a la irradiación, la proteína RNF8 puede detectarse en asociación con γH2AX. [39] RNF8 media la descondensación extensa de la cromatina, a través de su interacción posterior con CHD4 , [40] un componente del complejo de remodelación de nucleosomas y desacetilasa NuRD .
Después de sufrir una relajación posterior al daño del ADN, seguida de una reparación del ADN, la cromatina se recupera a un estado de compactación cercano a su nivel previo al daño después de aproximadamente 20 minutos. [35]
En los vertebrados, las ubicaciones en las que se produce la recombinación están determinadas por las ubicaciones de unión de PRDM9 , una proteína que reconoce un motivo de secuencia específico por su matriz de dedos de zinc. [41] En estos sitios, otra proteína, SPO11 , cataliza las roturas de doble cadena (DSB) que inician la recombinación, un subconjunto de las cuales se reparan mediante la recombinación con el cromosoma homólogo. PRDM9 deposita marcas de metilación de histonas H3K4me3 y H3K36me3 en los sitios a los que se une, y esta actividad de metiltransferasa es esencial para su papel en el posicionamiento de las DSB. Después de su formación, los sitios DSB se procesan por resección, lo que da como resultado ADN monocatenario (ssDNA) que se decora con DMC1. Desde la mitad del cigoteno hasta el paquiteno temprano, como parte del proceso de reparación recombinatoria, DMC1 se disocia del ssDNA y los recuentos disminuyen hasta que todas las roturas (excepto las de los cromosomas XY) se reparan en el paquiteno tardío. En este proceso intervienen otras proteínas, incluida ZCWPW1, la [42] primera proteína posicionada directamente por las marcas de histonas duales de PRDM9. ZCWPW1 es importante para la reparación de DSB homólogas, no para el posicionamiento.
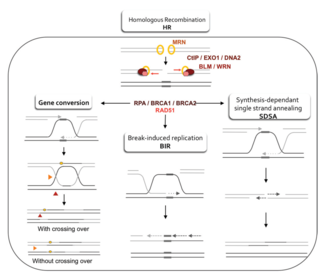
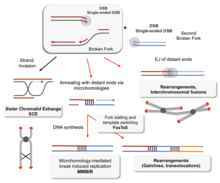
Dos modelos primarios de cómo la recombinación homóloga repara las roturas de doble cadena en el ADN son la vía de reparación de rotura de doble cadena (DSBR) (a veces llamada el modelo de doble unión de Holliday ) y la vía de recocido de cadena dependiente de síntesis (SDSA). [43] Las dos vías son similares en sus primeros pasos. Después de que se produce una rotura de doble cadena, el complejo MRX ( complejo MRN en humanos) se une al ADN en cada lado de la rotura. A continuación, se lleva a cabo una resección, en la que se corta el ADN alrededor de los extremos 5' de la rotura. Esto sucede en dos pasos distintos: primero, el complejo MRX recluta la proteína Sae2, y estas dos proteínas recortan los extremos 5' a cada lado de la rotura para crear cortos salientes 3' de ADN monocatenario; en el segundo paso, la resección 5'→3' es continuada por la helicasa Sgs1 y las nucleasas Exo1 y Dna2 . Como helicasa , Sgs1 "descomprime" el ADN de doble cadena, mientras que la actividad nucleasa de Exo1 y Dna2 les permite cortar el ADN de cadena sencilla producido por Sgs1. [31]
La proteína RPA , que tiene una alta afinidad por el ADN monocatenario, se une entonces a los salientes 3'. [44] Con la ayuda de varias otras proteínas que median el proceso, la proteína Rad51 (y Dmc1 , en la meiosis) forma entonces un filamento de ácido nucleico y proteína en la hebra sencilla de ADN recubierta con RPA. Este filamento de nucleoproteína comienza entonces a buscar secuencias de ADN similares a la del saliente 3'. Después de encontrar dicha secuencia, el filamento de nucleoproteína monocatenario se mueve hacia (invade) el dúplex de ADN receptor similar o idéntico en un proceso llamado invasión de hebra . En las células que se dividen a través de la mitosis, el dúplex de ADN receptor es generalmente una cromátida hermana, que es idéntica a la molécula de ADN dañada y proporciona una plantilla para la reparación. En la meiosis, sin embargo, el ADN receptor tiende a ser de un cromosoma homólogo similar pero no necesariamente idéntico. [43] Se forma un bucle de desplazamiento ( bucle D ) durante la invasión de la cadena entre la cadena saliente 3' invasora y el cromosoma homólogo. Después de la invasión de la cadena, una ADN polimerasa extiende el extremo de la cadena 3' invasora sintetizando ADN nuevo. Esto cambia el bucle D a una estructura en forma de cruz conocida como unión de Holliday . Después de esto, se produce más síntesis de ADN en la cadena invasora (es decir, uno de los salientes 3' originales), restaurando efectivamente la cadena en el cromosoma homólogo que fue desplazada durante la invasión de la cadena. [43]

Después de las etapas de resección, invasión de la cadena y síntesis de ADN, las vías DSBR y SDSA se vuelven distintas. [43] La vía DSBR es única en el sentido de que el segundo saliente 3' (que no estaba involucrado en la invasión de la cadena) también forma una unión Holliday con el cromosoma homólogo. Las uniones dobles Holliday luego se convierten en productos de recombinación por endonucleasas de corte , un tipo de endonucleasa de restricción que corta solo una cadena de ADN. La vía DSBR comúnmente da como resultado un cruce, aunque a veces puede dar como resultado productos que no son de cruce; la capacidad de una molécula de ADN rota para recolectar secuencias de loci donantes separados se demostró en levaduras en gemación mitótica usando plásmidos o inducción de eventos cromosómicos por endonucleasas. [45] [46] Debido a esta tendencia al cruce cromosómico, la vía DSBR es un modelo probable de cómo ocurre la recombinación homóloga de cruce durante la meiosis. [22]
El hecho de que la recombinación en la vía DSBR dé como resultado un entrecruzamiento cromosómico depende de cómo se corta o se "resuelve" la doble unión de Holliday. El entrecruzamiento cromosómico se producirá si se corta una unión de Holliday en la cadena que se cruza y la otra unión de Holliday en la cadena que no se cruza (en la Figura 5, a lo largo de las puntas de flecha horizontales de color púrpura en una unión de Holliday y a lo largo de las puntas de flecha verticales de color naranja en la otra). Alternativamente, si se cortan las dos uniones de Holliday en las cadenas que se cruzan (a lo largo de las puntas de flecha horizontales de color púrpura en ambas uniones de Holliday en la Figura 5), se producirán cromosomas sin entrecruzamiento. [47]
La recombinación homóloga a través de la vía SDSA ocurre en células que se dividen a través de mitosis y meiosis y da como resultado productos que no son de cruce. En este modelo, la hebra 3' invasora se extiende a lo largo del dúplex de ADN receptor por una ADN polimerasa, y se libera cuando la unión de Holliday entre las moléculas de ADN donante y receptora se desliza en un proceso llamado migración de ramificación . El extremo 3' recién sintetizado de la hebra invasora puede entonces anidarse con el otro saliente 3' en el cromosoma dañado a través del apareamiento de bases complementarias. Después de que las hebras se anidan, a veces puede quedar un pequeño colgajo de ADN. Cualquiera de estos colgajos se elimina, y la vía SDSA termina con el resellado, también conocido como ligadura , de cualquier espacio de cadena simple restante. [48]
Durante la mitosis, la principal vía de recombinación homóloga para reparar las roturas de doble cadena de ADN parece ser la vía SDSA (en lugar de la vía DSBR). [49] La vía SDSA produce recombinantes no cruzados (Figura 5). Durante la meiosis, los recombinantes no cruzados también ocurren con frecuencia y estos parecen surgir principalmente por la vía SDSA también. [49] [50] Los eventos de recombinación no cruzada que ocurren durante la meiosis probablemente reflejan instancias de reparación de daños de doble cadena de ADN u otros tipos de daños de ADN.

La vía de recocido de cadena sencilla (SSA) de la recombinación homóloga repara las roturas de doble cadena entre dos secuencias repetidas . La vía SSA es única en el sentido de que no requiere una molécula de ADN similar o idéntica separada, como las vías DSBR o SDSA de recombinación homóloga. En cambio, la vía SSA solo requiere un único dúplex de ADN y utiliza las secuencias repetidas como las secuencias idénticas que la recombinación homóloga necesita para la reparación. La vía es relativamente simple en concepto: después de que dos cadenas del mismo dúplex de ADN se cortan alrededor del sitio de la rotura de doble cadena, los dos salientes 3' resultantes se alinean y se recosen entre sí, restaurando el ADN como un dúplex continuo. [48] [51]
A medida que el ADN alrededor de la rotura de doble cadena se corta, los salientes 3' de cadena sencilla que se producen se recubren con la proteína RPA , que evita que los salientes 3' se adhieran a sí mismos. [52] Una proteína llamada Rad52 luego se une a cada una de las secuencias repetidas a cada lado de la rotura y las alinea para permitir que las dos secuencias repetidas complementarias se asocien. [52] Una vez que se completa el asocio, los colgajos no homólogos sobrantes de los salientes 3' son cortados por un conjunto de nucleasas, conocidas como Rad1/Rad10, que son llevadas a los colgajos por las proteínas Saw1 y Slx4 . [52] [53] La nueva síntesis de ADN llena los espacios vacíos y la ligadura restaura el dúplex de ADN como dos cadenas continuas. [54] La secuencia de ADN entre las repeticiones siempre se pierde, al igual que una de las dos repeticiones. La vía SSA se considera mutagénica ya que da como resultado tales eliminaciones de material genético. [48]
Durante la replicación del ADN , a veces se pueden encontrar roturas de doble cadena en las horquillas de replicación a medida que la helicasa del ADN abre la cadena molde. Estos defectos se reparan en la vía de replicación inducida por rotura (BIR) de la recombinación homóloga. Los mecanismos moleculares precisos de la vía BIR siguen sin estar claros. Tres mecanismos propuestos tienen la invasión de la cadena como paso inicial, pero difieren en cómo modelan la migración del bucle D y las fases posteriores de la recombinación. [55]
La vía BIR también puede ayudar a mantener la longitud de los telómeros (regiones de ADN al final de los cromosomas eucariotas) en ausencia de (o en cooperación con) la telomerasa . Sin copias funcionales de la enzima telomerasa, los telómeros normalmente se acortan con cada ciclo de mitosis, lo que finalmente bloquea la división celular y conduce a la senescencia . En células de levadura en ciernes donde la telomerasa ha sido inactivada a través de mutaciones, se ha observado que dos tipos de células "supervivientes" evitan la senescencia durante más tiempo del esperado al alargar sus telómeros a través de las vías BIR. [55]
Mantener la longitud de los telómeros es fundamental para la inmortalización celular , una característica clave del cáncer. La mayoría de los cánceres mantienen los telómeros mediante la regulación positiva de la telomerasa. Sin embargo, en varios tipos de cáncer humano, una vía similar a BIR ayuda a mantener algunos tumores al actuar como un mecanismo alternativo de mantenimiento de los telómeros. [56] Este hecho ha llevado a los científicos a investigar si dichos mecanismos basados en la recombinación de mantenimiento de los telómeros podrían frustrar los medicamentos contra el cáncer como los inhibidores de la telomerasa . [57]

La recombinación homóloga es un importante proceso de reparación del ADN en bacterias. También es importante para producir diversidad genética en poblaciones bacterianas, aunque el proceso difiere sustancialmente de la recombinación meiótica , que repara los daños en el ADN y genera diversidad en los genomas eucariotas . La recombinación homóloga ha sido la más estudiada y se entiende mejor en Escherichia coli . [59] Las roturas de ADN de doble cadena en bacterias se reparan mediante la vía RecBCD de recombinación homóloga. Se cree que las roturas que ocurren en solo una de las dos cadenas de ADN, conocidas como brechas de cadena simple, se reparan mediante la vía RecF. [60] Tanto la vía RecBCD como la RecF incluyen una serie de reacciones conocidas como migración de ramas , en la que se intercambian cadenas simples de ADN entre dos moléculas entrecruzadas de ADN dúplex, y resolución , en la que esas dos moléculas entrecruzadas de ADN se cortan y se restauran a su estado normal de doble cadena.

La vía RecBCD es la principal vía de recombinación utilizada en muchas bacterias para reparar roturas de doble cadena en el ADN, y las proteínas se encuentran en una amplia gama de bacterias. [63] [64] [65] Estas roturas de doble cadena pueden ser causadas por la luz ultravioleta y otras radiaciones , así como por mutágenos químicos . Las roturas de doble cadena también pueden surgir por la replicación del ADN a través de una muesca o espacio en una cadena sencilla. Tal situación causa lo que se conoce como una horquilla de replicación colapsada y se soluciona mediante varias vías de recombinación homóloga, incluida la vía RecBCD. [66]
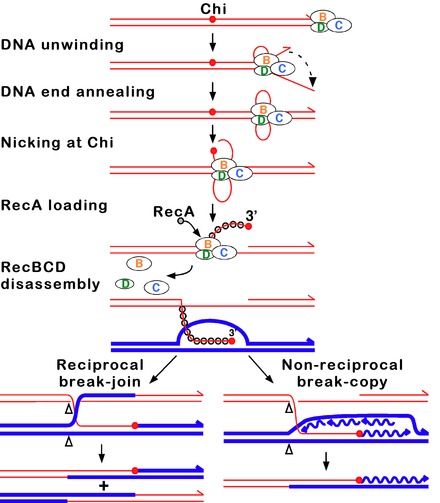
En esta vía, un complejo enzimático de tres subunidades llamado RecBCD inicia la recombinación al unirse a un extremo romo o casi romo de una rotura en el ADN de doble cadena. Después de que RecBCD se une al extremo del ADN, las subunidades RecB y RecD comienzan a descomprimir el dúplex de ADN mediante la actividad de la helicasa . La subunidad RecB también tiene un dominio de nucleasa , que corta la cadena simple de ADN que emerge del proceso de descompresión. Esta descompresión continúa hasta que RecBCD encuentra una secuencia de nucleótidos específica (5'-GCTGGTGG-3') conocida como sitio Chi . [65]
Al encontrar un sitio Chi, la actividad de la enzima RecBCD cambia drásticamente. [64] [61] [67] El desenrollado del ADN se detiene durante unos segundos y luego se reanuda aproximadamente a la mitad de la velocidad inicial. Esto probablemente se debe a que la helicasa RecB más lenta desenrolla el ADN después de Chi, en lugar de la helicasa RecD más rápida, que desenrolla el ADN antes de Chi. [68] [69] El reconocimiento del sitio Chi también cambia la enzima RecBCD de modo que corta la cadena de ADN con Chi y comienza a cargar múltiples proteínas RecA en el ADN monocatenario con el extremo 3' recién generado. El filamento de nucleoproteína recubierto de RecA resultante busca entonces secuencias similares de ADN en un cromosoma homólogo. El proceso de búsqueda induce el estiramiento del dúplex de ADN, lo que mejora el reconocimiento de homología (un mecanismo denominado corrección conformacional [70] [71] [72] ). Al encontrar dicha secuencia, el filamento de nucleoproteína monocatenaria se mueve hacia el dúplex de ADN receptor homólogo en un proceso llamado invasión de cadena . [73] El saliente 3' invasor hace que una de las cadenas del dúplex de ADN receptor se desplace, para formar un bucle D. Si se corta el bucle D, otro intercambio de cadenas forma una estructura en forma de cruz llamada unión de Holliday . [65] La resolución de la unión de Holliday por alguna combinación de RuvABC o RecG puede producir dos moléculas de ADN recombinante con tipos genéticos recíprocos, si las dos moléculas de ADN que interactúan difieren genéticamente. Alternativamente, el extremo 3' invasor cerca de Chi puede preparar la síntesis de ADN y formar una horquilla de replicación. Este tipo de resolución produce solo un tipo de recombinante (no recíproco).
Las bacterias parecen utilizar la vía RecF de recombinación homóloga para reparar los huecos de una sola hebra en el ADN. Cuando la vía RecBCD se inactiva por mutaciones y mutaciones adicionales inactivan las nucleasas SbcCD y ExoI, la vía RecF también puede reparar roturas de doble hebra del ADN. [74] En la vía RecF, la helicasa RecQ desenrolla el ADN y la nucleasa RecJ degrada la hebra con un extremo 5', dejando la hebra con el extremo 3' intacta. La proteína RecA se une a esta hebra y es ayudada por las proteínas RecF, RecO y RecR o estabilizada por ellas. El filamento de nucleoproteína RecA busca entonces un ADN homólogo e intercambia lugares con la hebra idéntica o casi idéntica en el ADN homólogo.
Aunque las proteínas y los mecanismos específicos involucrados en sus fases iniciales difieren, las dos vías son similares en que ambas requieren ADN monocatenario con un extremo 3' y la proteína RecA para la invasión de la cadena. Las vías también son similares en sus fases de migración de la rama , en la que la unión de Holliday se desliza en una dirección, y resolución , en la que las uniones de Holliday son escindidas por enzimas. [75] [76] El tipo de resolución alternativo, no recíproco, también puede ocurrir por cualquiera de las vías.
Inmediatamente después de la invasión de la hebra, la unión de Holliday se mueve a lo largo del ADN enlazado durante el proceso de migración de la rama. Es en este movimiento de la unión de Holliday que se intercambian los pares de bases entre los dos dúplex de ADN homólogos. Para catalizar la migración de la rama, la proteína RuvA primero reconoce y se une a la unión de Holliday y recluta a la proteína RuvB para formar el complejo RuvAB. Dos conjuntos de la proteína RuvB, que forman cada uno una ATPasa en forma de anillo, se cargan en lados opuestos de la unión de Holliday, donde actúan como bombas gemelas que proporcionan la fuerza para la migración de la rama. Entre esos dos anillos de RuvB, dos conjuntos de la proteína RuvA se ensamblan en el centro de la unión de Holliday de manera que el ADN en la unión queda intercalado entre cada conjunto de RuvA. Las hebras de ambos dúplex de ADN (el dúplex "donante" y el "receptor") se desenrollan en la superficie de RuvA mientras son guiadas por la proteína de un dúplex al otro. [77] [78]
En la fase de resolución de la recombinación, se cortan todas las uniones de Holliday formadas por el proceso de invasión de la hebra, restaurando así dos moléculas de ADN separadas. Esta escisión se realiza mediante la interacción del complejo RuvAB con RuvC, que juntos forman el complejo RuvABC . RuvC es una endonucleasa que corta la secuencia degenerada 5'-(A/T)TT(G/C)-3'. La secuencia se encuentra con frecuencia en el ADN, aproximadamente una vez cada 64 nucleótidos. [78] Antes de cortar, RuvC probablemente obtiene acceso a la unión de Holliday desplazando uno de los dos tetrámeros de RuvA que cubren el ADN allí. [77] La recombinación da como resultado productos de "empalme" o "parche", dependiendo de cómo RuvC escinda la unión de Holliday. [78] Los productos de empalme son productos de cruce, en los que hay una reorganización del material genético alrededor del sitio de recombinación. Los productos de parche, por otro lado, son productos no cruzados en los que no hay tal reordenamiento y solo hay un "parche" de ADN híbrido en el producto de recombinación. [79]
La recombinación homóloga es un método importante para integrar el ADN del donante en el genoma de un organismo receptor en la transferencia horizontal de genes , el proceso por el cual un organismo incorpora ADN extraño de otro organismo sin ser descendiente de ese organismo. La recombinación homóloga requiere que el ADN entrante sea muy similar al genoma del receptor, por lo que la transferencia horizontal de genes suele limitarse a bacterias similares. [80] Los estudios en varias especies de bacterias han establecido que existe una disminución logarítmica-lineal en la frecuencia de recombinación con el aumento de la diferencia en la secuencia entre el ADN del huésped y el del receptor. [81] [82] [83]
En la conjugación bacteriana , donde el ADN se transfiere entre bacterias a través del contacto directo de célula a célula, la recombinación homóloga ayuda a integrar el ADN extraño en el genoma del huésped a través de la vía RecBCD. La enzima RecBCD promueve la recombinación después de que el ADN se convierte de ADN de cadena simple (en la forma en que ingresa originalmente a la bacteria) a ADN de doble cadena durante la replicación. La vía RecBCD también es esencial para la fase final de la transducción , un tipo de transferencia horizontal de genes en la que el ADN se transfiere de una bacteria a otra por un virus . El ADN bacteriano extraño a veces se incorpora incorrectamente en la cabeza de la cápside de las partículas del virus bacteriófago a medida que el ADN se empaqueta en nuevos bacteriófagos durante la replicación viral. Cuando estos nuevos bacteriófagos infectan a otras bacterias, el ADN de la bacteria huésped anterior se inyecta en el nuevo huésped bacteriano como ADN de doble cadena. La enzima RecBCD luego incorpora este ADN de doble cadena en el genoma del nuevo huésped bacteriano. [65]
La transformación bacteriana natural implica la transferencia de ADN de una bacteria donante a una bacteria receptora, donde tanto el donante como el receptor son ordinariamente de la misma especie . La transformación, a diferencia de la conjugación y transducción bacterianas, depende de numerosos productos genéticos bacterianos que interactúan específicamente para realizar este proceso. [84] Por lo tanto, la transformación es claramente una adaptación bacteriana para la transferencia de ADN. Para que una bacteria se una, absorba e integre el ADN donante en su cromosoma residente por recombinación homóloga, primero debe entrar en un estado fisiológico especial denominado competencia . La familia de genes RecA / Rad51 / DMC1 juega un papel central en la recombinación homóloga durante la transformación bacteriana como lo hace durante la meiosis y mitosis eucariotas. Por ejemplo, la proteína RecA es esencial para la transformación en Bacillus subtilis y Streptococcus pneumoniae , [85] y la expresión del gen RecA se induce durante el desarrollo de la competencia para la transformación en estos organismos.
Como parte del proceso de transformación, la proteína RecA interactúa con el ADN monocatenario entrante (ssDNA) para formar nucleofilamentos RecA/ssDNA que escanean el cromosoma residente en busca de regiones de homología y llevan el ssDNA entrante a la región correspondiente, donde ocurre el intercambio de cadenas y la recombinación homóloga. [86] Por lo tanto, el proceso de recombinación homóloga durante la transformación bacteriana tiene similitudes fundamentales con la recombinación homóloga durante la meiosis .
La recombinación homóloga ocurre en varios grupos de virus. En los virus de ADN como el herpesvirus , la recombinación ocurre a través de un mecanismo de ruptura y unión como en las bacterias y eucariotas. [87] También hay evidencia de recombinación en algunos virus de ARN , específicamente virus ssRNA de sentido positivo como retrovirus , picornavirus y coronavirus . [88] Existe controversia sobre si la recombinación homóloga ocurre en virus ssRNA de sentido negativo como la influenza . [89]
En los virus ARN, la recombinación homóloga puede ser precisa o imprecisa. En el tipo preciso de recombinación ARN-ARN, no hay diferencia entre las dos secuencias de ARN parentales y la región de cruce de ARN resultante. Debido a esto, a menudo es difícil determinar la ubicación de los eventos de cruce entre dos secuencias de ARN recombinantes. En la recombinación homóloga de ARN imprecisa, la región de cruce tiene alguna diferencia con las secuencias de ARN parentales, causada por la adición, eliminación u otra modificación de nucleótidos. El nivel de precisión en el cruce está controlado por el contexto de secuencia de las dos cadenas recombinantes de ARN: las secuencias ricas en adenina y uracilo disminuyen la precisión del cruce. [88] [90]
La recombinación homóloga es importante para facilitar la evolución viral . [88] [91] Por ejemplo, si los genomas de dos virus con diferentes mutaciones desventajosas experimentan una recombinación, entonces pueden ser capaces de regenerar un genoma completamente funcional. Alternativamente, si dos virus similares han infectado la misma célula huésped, la recombinación homóloga puede permitir que esos dos virus intercambien genes y, de ese modo, desarrollen variaciones más potentes de sí mismos. [91]
La recombinación homóloga es el mecanismo propuesto por el cual el virus de ADN herpesvirus humano-6 se integra en los telómeros humanos. [92]
Cuando dos o más virus, cada uno con daño genómico letal, infectan la misma célula huésped, los genomas del virus a menudo pueden emparejarse entre sí y experimentar una reparación recombinatoria homóloga para producir progenie viable. Este proceso, conocido como reactivación por multiplicidad, se ha estudiado en varios bacteriófagos , incluido el fago T4 . [93] Las enzimas empleadas en la reparación recombinatoria en el fago T4 son funcionalmente homólogas a las enzimas empleadas en la reparación recombinatoria bacteriana y eucariota. [94] En particular, con respecto a un gen necesario para la reacción de intercambio de hebra, un paso clave en la reparación recombinatoria homóloga, existe homología funcional de los virus a los humanos (es decir, uvsX en el fago T4; recA en E. coli y otras bacterias, y rad51 y dmc1 en levaduras y otros eucariotas, incluidos los humanos). [95] La reactivación por multiplicidad también se ha demostrado en numerosos virus patógenos. [96]
Los coronavirus son capaces de recombinación genética cuando al menos dos genomas virales están presentes en la misma célula infectada. La recombinación de ARN parece ser una fuerza impulsora importante para determinar (1) la variabilidad genética dentro de una especie de CoV, (2) la capacidad de una especie de CoV de saltar de un huésped a otro y (3) con poca frecuencia, la aparición de nuevos CoV. [97] El mecanismo de recombinación en CoV probablemente involucra un cambio de plantilla durante la replicación del genoma. [97] La recombinación en virus de ARN parece ser una adaptación para hacer frente al daño del genoma. [98]
Todo el motivo de unión al receptor del SARS-CoV-2 pandémico parece haber sido introducido a través de la recombinación de coronavirus de pangolines . [99] Tal evento de recombinación puede haber sido un paso crítico en la evolución de la capacidad del SARS-CoV-2 para infectar a los humanos. [99] Los eventos de recombinación son probablemente pasos clave en el proceso evolutivo que conduce a la aparición de nuevos coronavirus humanos. [100]
Durante la pandemia de COVID-19 en 2020, muchas secuencias genómicas de aislamientos australianos de SARS-CoV-2 tienen deleciones o mutaciones (29742G>A o 29742G>U; "G19A" o "G19U") en el motivo similar al tallo-bucle II (s2m) del coronavirus 3' , un motivo de ARN en la región no traducida 3' del genoma viral, lo que sugiere que los eventos de recombinación de ARN pueden haber ocurrido en s2m del SARS-CoV-2. Con base en el análisis computacional de 1319 secuencias de SARS-CoV-2 de Australia utilizando el algoritmo Recco (https://recco.bioinf.mpi-inf.mpg.de/), se predijeron 29742G("G19"), 29744G("G21") y 29751G("G28") como puntos críticos de recombinación. [101]
El brote de SARS-CoV-2 en el crucero Diamond Princess probablemente se originó a partir de una sola persona infectada con una variante del virus idéntica a los aislados WIV04 de Wuhan, o simultáneamente con otro caso primario infectado con un virus que contenía la mutación 11083G > T. El análisis de desequilibrio de ligamiento confirmó que la recombinación de ARN con la mutación 11083G > T también contribuyó al aumento de mutaciones entre la progenie viral. Los hallazgos indican que la mutación 11083G > T del SARS-CoV-2 se propagó durante la cuarentena a bordo y surgió a través de una recombinación de ARN de novo bajo presión de selección positiva. Además, en tres pacientes de este crucero, dos mutaciones 29736G > T y 29751G > T ("G13" y "G28") también se localizaron en el motivo tipo tallo-bucle II del coronavirus 3' (s2m) , ya que se predijo que "G28" era un punto crítico de recombinación en mutantes australianos del SARS-CoV-2. Aunque se considera que s2m es un motivo de ARN altamente conservado entre muchas especies de coronavirus, este resultado también sugiere que s2m del SARS-CoV-2 es más bien un punto crítico de recombinación/mutación del ARN. [102]
Sin una recombinación homóloga adecuada, los cromosomas a menudo se alinean incorrectamente para la primera fase de la división celular en la meiosis . Esto hace que los cromosomas no se segreguen correctamente en un proceso llamado no disyunción . A su vez, la no disyunción puede hacer que los espermatozoides y los óvulos tengan muy pocos o demasiados cromosomas. El síndrome de Down , que es causado por una copia adicional del cromosoma 21 , es una de las muchas anomalías que resultan de tal falla de la recombinación homóloga en la meiosis. [78] [103]
Las deficiencias en la recombinación homóloga se han vinculado fuertemente con la formación de cáncer en humanos. Por ejemplo, cada una de las enfermedades relacionadas con el cáncer, el síndrome de Bloom , el síndrome de Werner y el síndrome de Rothmund-Thomson, son causadas por copias defectuosas de los genes de la helicasa RecQ involucrados en la regulación de la recombinación homóloga: BLM , WRN y RECQL4 , respectivamente. [104] En las células de los pacientes con síndrome de Bloom, que carecen de una copia funcional de la proteína BLM, hay una tasa elevada de recombinación homóloga. [105] Los experimentos en ratones deficientes en BLM han sugerido que la mutación da lugar al cáncer a través de una pérdida de heterocigosidad causada por el aumento de la recombinación homóloga. [106] Una pérdida de heterocigosidad se refiere a la pérdida de una de las dos versiones (o alelos ) de un gen. Si uno de los alelos perdidos ayuda a suprimir tumores, como el gen de la proteína del retinoblastoma, por ejemplo, entonces la pérdida de heterocigosidad puede conducir al cáncer. [107] : 1236
Las tasas reducidas de recombinación homóloga causan una reparación ineficiente del ADN, [107] : 310 que también puede conducir al cáncer. [108] Este es el caso de BRCA1 y BRCA2 , dos genes supresores de tumores similares cuyo mal funcionamiento se ha relacionado con un riesgo considerablemente mayor de cáncer de mama y de ovario . Las células que carecen de BRCA1 y BRCA2 tienen una tasa reducida de recombinación homóloga y una mayor sensibilidad a la radiación ionizante , lo que sugiere que la recombinación homóloga reducida conduce a una mayor susceptibilidad al cáncer. [108] Debido a que la única función conocida de BRCA2 es ayudar a iniciar la recombinación homóloga, los investigadores han especulado que un conocimiento más detallado del papel de BRCA2 en la recombinación homóloga puede ser la clave para comprender las causas del cáncer de mama y de ovario. [108]
Los tumores con una deficiencia de recombinación homóloga (incluidos los defectos BRCA) se describen como HRD positivos. [109]

Si bien las vías pueden variar mecánicamente, la capacidad de los organismos para realizar una recombinación homóloga se conserva universalmente en todos los dominios de la vida. [110] Con base en la similitud de sus secuencias de aminoácidos, se pueden encontrar homólogos de varias proteínas en múltiples dominios de la vida, lo que indica que evolucionaron hace mucho tiempo y desde entonces se han separado de las proteínas ancestrales comunes. [110]
Los miembros de la familia de la recombinasa RecA se encuentran en casi todos los organismos: RecA en bacterias, Rad51 y DMC1 en eucariotas, RadA en arqueas y UvsX en fagos T4 . [111]
Las proteínas de unión monocatenarias relacionadas que son importantes para la recombinación homóloga y muchos otros procesos también se encuentran en todos los dominios de la vida. [112]
Rad54, Mre11 , Rad50 y varias otras proteínas también se encuentran tanto en arqueas como en eucariotas. [110] [111] [113]
Se cree que las proteínas de la familia de proteínas de la recombinasa RecA descienden de una recombinasa ancestral común. [110] La familia de la recombinasa RecA contiene la proteína RecA de las bacterias , las proteínas Rad51 y Dmc1 de los eucariotas, y RadA de las arqueas , y las proteínas parálogas de la recombinasa. Los estudios que modelan las relaciones evolutivas entre las proteínas Rad51, Dmc1 y RadA indican que son monofiléticas , o que comparten un ancestro molecular común. [110] Dentro de esta familia de proteínas, Rad51 y Dmc1 se agrupan en un clado separado de RadA. Una de las razones para agrupar estas tres proteínas es que todas poseen un motivo hélice-giro-hélice modificado , que ayuda a las proteínas a unirse al ADN, hacia sus extremos N-terminales . [110] Se ha propuesto un antiguo evento de duplicación genética de un gen RecA eucariota y una mutación posterior como un posible origen de los genes modernos RAD51 y DMC1. [110]
Las proteínas generalmente comparten una región conservada de larga duración conocida como dominio RecA/Rad51. Dentro de este dominio proteico hay dos motivos de secuencia , el motivo Walker A y el motivo Walker B. Los motivos Walker A y B permiten que los miembros de la familia de proteínas RecA/Rad51 participen en la unión de ATP y la hidrólisis de ATP . [110] [114]
El descubrimiento de Dmc1 en varias especies de Giardia , uno de los primeros protistos en divergir como eucariota, sugiere que la recombinación homóloga meiótica (y, por lo tanto, la meiosis misma) surgió muy temprano en la evolución eucariota. [115] Además de la investigación sobre Dmc1, los estudios sobre la proteína Spo11 han proporcionado información sobre los orígenes de la recombinación meiótica. [116] Spo11, una topoisomerasa de tipo II , puede iniciar la recombinación homóloga en la meiosis al realizar rupturas dirigidas de doble cadena en el ADN. [25] Los árboles filogenéticos basados en la secuencia de genes similares a SPO11 en animales, hongos, plantas, protistos y arqueas han llevado a los científicos a creer que la versión Spo11 actualmente en eucariotas surgió en el último ancestro común de eucariotas y arqueas. [116]

Muchos métodos para introducir secuencias de ADN en organismos para crear ADN recombinante y organismos modificados genéticamente utilizan el proceso de recombinación homóloga. [117] También llamado selección de genes , el método es especialmente común en la genética de levaduras y ratones . El método de selección de genes en ratones knockout utiliza células madre embrionarias de ratón para administrar material genético artificial (en su mayoría de interés terapéutico), que reprime el gen objetivo del ratón mediante el principio de recombinación homóloga. De este modo, el ratón actúa como un modelo de trabajo para comprender los efectos de un gen mamífero específico. En reconocimiento a su descubrimiento de cómo se puede utilizar la recombinación homóloga para introducir modificaciones genéticas en ratones a través de células madre embrionarias, Mario Capecchi , Martin Evans y Oliver Smithies fueron galardonados con el Premio Nobel de Fisiología o Medicina de 2007. [118]
Los avances en las tecnologías de selección de genes que secuestran la mecánica de recombinación homóloga de las células están dando lugar al desarrollo de una nueva ola de modelos de enfermedades humanas más precisos e isogénicos . Se cree que estos modelos de células humanas diseñadas reflejan con mayor precisión la genética de las enfermedades humanas que sus predecesores, los modelos de ratón. Esto se debe en gran medida a que las mutaciones de interés se introducen en genes endógenos, tal como ocurren en los pacientes reales, y a que se basan en genomas humanos en lugar de genomas de rata. Además, ciertas tecnologías permiten la introducción de una mutación particular en lugar de solo las eliminaciones asociadas con las tecnologías de selección de genes más antiguas.
La ingeniería de proteínas con recombinación homóloga desarrolla proteínas quiméricas intercambiando fragmentos entre dos proteínas parentales. Estas técnicas explotan el hecho de que la recombinación puede introducir un alto grado de diversidad de secuencias al tiempo que preserva la capacidad de una proteína de plegarse en su estructura terciaria , o forma tridimensional. [119] Esto contrasta con otras técnicas de ingeniería de proteínas, como la mutagénesis puntual aleatoria , en la que la probabilidad de mantener la función de la proteína disminuye exponencialmente con el aumento de las sustituciones de aminoácidos . [120] Las quimeras producidas por técnicas de recombinación pueden mantener su capacidad de plegarse porque sus fragmentos parentales intercambiados están conservados estructural y evolutivamente. Estos "bloques de construcción" recombinables preservan interacciones estructuralmente importantes como puntos de contacto físico entre diferentes aminoácidos en la estructura de la proteína. Se pueden utilizar métodos computacionales como SCHEMA y el análisis de acoplamiento estadístico para identificar subunidades estructurales adecuadas para la recombinación. [121] [122] [123]
Se han utilizado técnicas que se basan en la recombinación homóloga para diseñar nuevas proteínas. [121] En un estudio publicado en 2007, los investigadores pudieron crear quimeras de dos enzimas involucradas en la biosíntesis de isoprenoides , una clase diversa de compuestos que incluyen hormonas , pigmentos visuales y ciertas feromonas . Las proteínas quiméricas adquirieron la capacidad de catalizar una reacción esencial en la biosíntesis de isoprenoides (una de las vías de biosíntesis más diversas que se encuentran en la naturaleza) que estaba ausente en las proteínas originales. [124] La ingeniería de proteínas a través de la recombinación también ha producido enzimas quiméricas con una nueva función en los miembros de un grupo de proteínas conocidas como la familia del citocromo P450 , [125] que en los humanos está involucrada en la desintoxicación de compuestos extraños como medicamentos, aditivos alimentarios y conservantes. [22]
Las células cancerosas capaces de recombinación homóloga (HRP) son capaces de reparar el daño del ADN causado por quimioterapias como el cisplatino. Por lo tanto, los cánceres HRP son difíciles de tratar. Los estudios sugieren que la recombinación homóloga puede ser dirigida a través de la inhibición de c-Abl. [126] [127] Las células cancerosas con mutaciones BRCA tienen deficiencias en la recombinación homóloga, y se han desarrollado y utilizado con éxito en ensayos clínicos medicamentos para explotar esas deficiencias. [128] [129] El olaparib , un inhibidor de PARP1, encogió o detuvo el crecimiento de tumores de cánceres de mama , ovario y próstata causados por mutaciones en los genes BRCA1 o BRCA2 , que son necesarios para la HR. Cuando BRCA1 o BRCA2 están ausentes, otros tipos de mecanismos de reparación del ADN deben compensar la deficiencia de HR, como la reparación por escisión de bases (BER) para las horquillas de replicación estancadas o la unión de extremos no homólogos (NHEJ) para las roturas de doble cadena. [128] Al inhibir la BER en una célula deficiente en HR, olaparib aplica el concepto de letalidad sintética para atacar específicamente a las células cancerosas. Si bien los inhibidores de PARP1 representan un enfoque novedoso para la terapia del cáncer, los investigadores han advertido que pueden resultar insuficientes para tratar los cánceres metastásicos en etapa avanzada . [128] Las células cancerosas pueden volverse resistentes a un inhibidor de PARP1 si sufren deleciones de mutaciones en BRCA2, lo que socava la letalidad sintética del fármaco al restaurar la capacidad de las células cancerosas para reparar el ADN mediante HR. [130]