
La tinción es una técnica que se utiliza para mejorar el contraste en muestras, generalmente a nivel microscópico . Las tinciones y colorantes se utilizan con frecuencia en histología (estudio microscópico de tejidos biológicos ), en citología (estudio microscópico de células ) y en los campos médicos de la histopatología , la hematología y la citopatología que se centran en el estudio y diagnóstico de enfermedades a nivel microscópico. Las tinciones se pueden utilizar para definir tejidos biológicos (resaltando, por ejemplo, fibras musculares o tejido conectivo ), poblaciones celulares (clasificando diferentes células sanguíneas ) u orgánulos dentro de células individuales.
En bioquímica , implica agregar un colorante específico de clase ( ADN , proteínas , lípidos , carbohidratos ) a un sustrato para calificar o cuantificar la presencia de un compuesto específico. La tinción y el marcado fluorescente pueden tener propósitos similares. La tinción biológica también se utiliza para marcar células en citometría de flujo y para marcar proteínas o ácidos nucleicos en electroforesis en gel . Los microscopios ópticos se utilizan para ver muestras teñidas con gran aumento, generalmente utilizando iluminación de campo claro o epifluorescencia.
La tinción no se limita sólo a los materiales biológicos, ya que también puede utilizarse para estudiar la estructura de otros materiales; por ejemplo, las estructuras lamelares de polímeros semicristalinos o las estructuras de dominio de copolímeros en bloque .
La tinción in vivo (también llamada tinción vital o tinción intravital) es el proceso de teñir tejidos vivos. Al hacer que ciertas células o estructuras adquieran colores contrastantes, se puede ver y estudiar fácilmente su forma ( morfología ) o posición dentro de una célula o tejido. El propósito habitual es revelar detalles citológicos que de otra manera podrían no ser evidentes; sin embargo, la tinción también puede revelar dónde se están produciendo ciertas sustancias químicas o reacciones químicas específicas dentro de las células o los tejidos.
La tinción in vitro implica colorear células o estructuras que han sido extraídas de su contexto biológico. Algunas tinciones se suelen combinar para revelar más detalles y características que una sola tinción. Combinadas con protocolos específicos para la fijación y preparación de muestras, los científicos y los médicos pueden utilizar estas técnicas estándar como herramientas de diagnóstico consistentes y repetibles. Una tinción de contraste es una tinción que hace que las células o estructuras sean más visibles, cuando no son completamente visibles con la tinción principal.
Mientras que ex vivo, muchas células continúan viviendo y metabolizando hasta que son "fijadas". Algunos métodos de tinción se basan en esta propiedad. Las tinciones excluidas por las células vivas pero absorbidas por las células ya muertas se denominan tinciones vitales (por ejemplo, azul tripán o yoduro de propidio para células eucariotas). Las que entran y tiñen las células vivas se denominan tinciones supravitales (por ejemplo, azul de metileno nuevo y azul de cresilo brillante para tinción de reticulocitos ). Sin embargo, estas tinciones son eventualmente tóxicas para el organismo, algunas más que otras. En parte debido a su interacción tóxica dentro de una célula viva, cuando las tinciones supravitales entran en una célula viva, pueden producir un patrón característico de tinción diferente de la tinción de una célula ya fijada (por ejemplo, aspecto de "reticulocitos" frente a "policromasia" difusa). Para lograr los efectos deseados, las tinciones se utilizan en soluciones muy diluidas que van desde 1 : 5 000 a 1 : 500 000 (Howey, 2000). Tenga en cuenta que muchas tinciones se pueden utilizar tanto en células vivas como fijadas.
Los pasos preparatorios necesarios dependen del tipo de análisis planificado. Es posible que se requieran algunos o todos los procedimientos siguientes.
Los montajes húmedos se utilizan para observar organismos vivos y se pueden realizar con agua y ciertas tinciones. El líquido se agrega al portaobjetos antes de agregar el organismo y se coloca un cubreobjetos sobre la muestra en el agua y la tinción para ayudar a contenerla dentro del campo de visión . [1]
La fijación , que puede constar de varios pasos, tiene como objetivo preservar la forma de las células o el tejido involucrado tanto como sea posible. A veces se utiliza la fijación por calor para matar, adherir y alterar la muestra para que acepte las tinciones. La mayoría de los fijadores químicos (sustancias químicas que provocan la fijación) generan enlaces químicos entre las proteínas y otras sustancias dentro de la muestra, lo que aumenta su rigidez. Los fijadores comunes incluyen formaldehído , etanol , metanol y/o ácido pícrico . Los trozos de tejido pueden incrustarse en cera de parafina para aumentar su resistencia mecánica y estabilidad y para que sea más fácil cortarlos en rodajas finas. [2]
Los mordientes son agentes químicos que tienen el poder de hacer que los tintes tiñen materiales que de otra manera no se teñirían.
Los mordientes se clasifican en dos categorías:
a) Mordiente básico: Reacciona con colorantes ácidos, por ejemplo, alumbre, sulfato ferroso, cloruro de cetilpiridinio, etc.
b) Mordiente ácido: reacciona con colorantes básicos, por ejemplo, ácido pícrico, ácido tánico, etc.
[2] Tinción Directa: Se realiza sin mordiente.
Tinción indirecta: Tinción con ayuda de un mordiente.
La permeabilización implica el tratamiento de las células con (normalmente) un surfactante suave . Este tratamiento disuelve las membranas celulares y permite que las moléculas de colorante más grandes ingresen al interior de la célula.
El montaje generalmente implica colocar las muestras en un portaobjetos de vidrio para su observación y análisis. En algunos casos, las células pueden cultivarse directamente en un portaobjetos. En el caso de muestras de células sueltas (como en el caso de un frotis de sangre o un frotis de Papanicolaou ), la muestra puede aplicarse directamente en un portaobjetos. En el caso de muestras de tejido más grandes, se realizan cortes delgados (rebanadas) utilizando un micrótomo ; luego, estas rebanadas pueden montarse e inspeccionarse.
La mayoría de los colorantes que se utilizan habitualmente en microscopía están disponibles como colorantes certificados por la BSC . Esto significa que las muestras del lote del fabricante han sido analizadas por un organismo independiente, la Biological Stain Commission ( BSC ), y se ha comprobado que cumplen o superan determinados estándares de pureza, contenido de colorante y rendimiento en las técnicas de tinción, lo que garantiza experimentos realizados con mayor precisión y resultados más fiables. Estos estándares se publican en la revista Biotechnic & Histochemistry de la comisión . [3] Muchos colorantes tienen una composición inconsistente de un proveedor a otro. El uso de colorantes certificados por la BSC elimina una fuente de resultados inesperados. [4]
Algunos proveedores venden colorantes "certificados" por ellos mismos en lugar de por la Comisión de Colorantes Biológicos. Estos productos pueden ser o no adecuados para diagnósticos y otras aplicaciones. [5]

Un método de tinción simple para bacterias que suele ser exitoso, incluso cuando los métodos de tinción positiva fallan, es usar una tinción negativa . Esto se puede lograr extendiendo la muestra sobre el portaobjetos y luego aplicando nigrosina (un tinte sintético negro) o tinta china (una suspensión acuosa de partículas de carbono). Después del secado, los microorganismos pueden verse en microscopía de campo claro como inclusiones más claras que contrastan bien con el entorno oscuro que los rodea. [6] La tinción negativa puede teñir el fondo en lugar de los organismos porque la pared celular de los microorganismos generalmente tiene una carga negativa que repele la tinción cargada negativamente. Los tintes utilizados en la tinción negativa son ácidos. [1] Nota: la tinción negativa es una técnica suave que puede no destruir los microorganismos y, por lo tanto, no es adecuada para estudiar patógenos.
A diferencia de la tinción negativa, la tinción positiva utiliza colorantes básicos para colorear la muestra sobre un fondo brillante. Si bien el cromóforo se utiliza tanto para la tinción negativa como para la positiva, el tipo de cromóforo utilizado en esta técnica es un ion con carga positiva en lugar de uno negativo. La pared celular con carga negativa de muchos microorganismos atrae al cromóforo con carga positiva, lo que hace que la muestra absorba la tinción, lo que le da el color de la tinción que se está utilizando. La tinción positiva se utiliza con más frecuencia que la tinción negativa en microbiología. A continuación se enumeran los diferentes tipos de tinción positiva. [1]
La tinción simple es una técnica que utiliza un solo tipo de tinción en un portaobjetos a la vez. Debido a que se utiliza solo una tinción, las muestras (para las tinciones positivas) o el fondo (para las tinciones negativas) serán de un solo color. Por lo tanto, las tinciones simples se utilizan normalmente para ver solo un organismo por portaobjetos. La tinción diferencial utiliza múltiples tinciones por portaobjetos. Según las tinciones que se utilicen, los organismos con diferentes propiedades aparecerán en diferentes colores, lo que permite la categorización de múltiples muestras. La tinción diferencial también se puede utilizar para colorear diferentes orgánulos dentro de un organismo, lo que se puede ver en la tinción de endosporas . [1]
La tinción de Gram se utiliza para determinar el estado de Gram y clasificar las bacterias en términos generales según la composición de su pared celular . La tinción de Gram utiliza violeta de cristal para teñir las paredes celulares, yodo (como mordiente) y una contratinción de fucsina o safranina para marcar todas las bacterias. El estado de Gram ayuda a dividir las muestras de bacterias en dos grupos, generalmente representativos de su filogenia subyacente. Esta característica, en combinación con otras técnicas, la convierte en una herramienta útil en los laboratorios de microbiología clínica, donde puede ser importante en la selección temprana de antibióticos apropiados . [8]
En la mayoría de las preparaciones teñidas con Gram, los organismos gramnegativos aparecen de color rojo o rosa debido a su contratinción. Debido a la presencia de un mayor contenido de lípidos, después del tratamiento con alcohol, la porosidad de la pared celular aumenta, por lo que el complejo CVI (violeta de cristal – yodo) puede atravesarla. Por lo tanto, la tinción primaria no se retiene. Además, a diferencia de la mayoría de las bacterias grampositivas, las bacterias gramnegativas tienen solo unas pocas capas de peptidoglicano y una membrana celular secundaria compuesta principalmente de lipopolisacárido.
La tinción de endosporas se utiliza para identificar la presencia o ausencia de endosporas , que hacen que las bacterias sean muy difíciles de matar. Las esporas bacterianas han demostrado ser difíciles de teñir ya que no son permeables a los reactivos de colorante acuoso. La tinción de endosporas es particularmente útil para identificar patógenos bacterianos formadores de endosporas como Clostridioides difficile . Antes del desarrollo de métodos más eficientes, esta tinción se realizaba utilizando el método de Wirtz con fijación térmica y contratinción. Mediante el uso de verde malaquita y una proporción diluida de carbol fucsina, la fijación de bacterias en ácido ósmico era una excelente manera de garantizar que no se mezclaran los colorantes. Sin embargo, los métodos de tinción recientemente revisados han disminuido significativamente el tiempo que lleva crear estas tinciones. Esta revisión incluyó la sustitución de carbol fucsina con safranina acuosa combinada con una fórmula recién diluida al 5% de verde malaquita. Esta nueva y mejorada composición de tinciones se realizó de la misma manera que antes con el uso de fijación térmica, enjuague y secado para examen posterior. Al examinarlas, todas las bacterias formadoras de endosporas se tiñerán de verde y todas las demás células aparecerán de color rojo. [9]
La tinción de Ziehl-Neelsen es una tinción ácido-alcohol resistente que se utiliza para teñir especies de Mycobacterium tuberculosis que no se tiñen con los procedimientos de tinción de laboratorio estándar, como la tinción de Gram.
Esta tinción se realiza mediante el uso de fucsina carbol de color rojo que tiñe las bacterias y un contracolorante como el azul de metileno .

La tinción con hematoxilina y eosina se utiliza con frecuencia en histología para examinar secciones delgadas de tejido. [10] La hematoxilina tiñe los núcleos celulares de azul, mientras que la eosina tiñe el citoplasma, el tejido conectivo y otras sustancias extracelulares de rosa o rojo. [10] La eosina es fuertemente absorbida por los glóbulos rojos , coloreándolos de un rojo brillante. En una preparación con hematoxilina y eosina hecha con habilidad, los glóbulos rojos son casi anaranjados, y el colágeno y el citoplasma (especialmente el músculo) adquieren diferentes tonos de rosa.
La tinción de Papanicolaou , o tinción PAP, fue desarrollada para reemplazar la citología por aspiración con aguja fina (FNAC) con la esperanza de disminuir los tiempos de tinción y el costo sin comprometer la calidad. Esta tinción es un método usado frecuentemente para examinar muestras de células de una variedad de tipos de tejidos en varios órganos. La tinción PAP ha sufrido varias modificaciones para convertirse en una "alternativa adecuada" para FNAC. Esta transición surgió de la apreciación de los frotis fijados en húmedo por parte de los científicos que preservaban las estructuras de los núcleos en oposición a la apariencia opaca de los frotis de Romanowsky secados al aire. Esto condujo a la creación de una tinción híbrida de fijado en húmedo y secado al aire conocida como tinción ultrarrápida de Papanicolaou. Esta modificación incluye el uso de solución salina nasal para rehidratar las células para aumentar la transparencia celular y se combina con el uso de formalina alcohólica para mejorar los colores de los núcleos. La tinción de Papanicolaou ahora se usa en lugar de la tinción citológica en todos los tipos de órganos debido a su aumento en la calidad morfológica, menor tiempo de tinción y menor costo. Se utiliza con frecuencia para teñir muestras de frotis de Papanicolaou . [11] Utiliza una combinación de hematoxilina , naranja G , eosina Y , verde claro SF amarillento y, a veces, marrón Bismarck Y. [ 10] [11] [12]
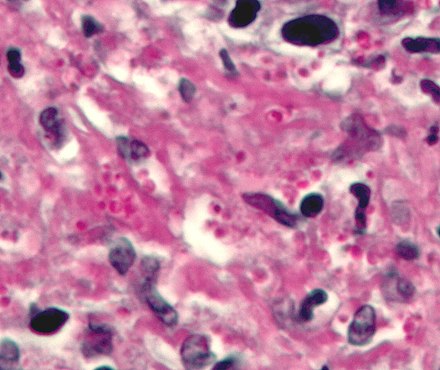
[13] El ácido peryódico de Schiff es una tinción especial de histología que se utiliza para marcar carbohidratos ( glucógeno , glucoproteína , proteoglicanos ). El PAS se utiliza comúnmente en el tejido hepático donde se forman los depósitos de glucógeno, lo que se hace en un esfuerzo por distinguir diferentes tipos de enfermedades de almacenamiento de glucógeno. El PAS es importante porque puede detectar gránulos de glucógeno que se encuentran en tumores de los ovarios y el páncreas del sistema endocrino, así como en la vejiga y los riñones del sistema renal. Las membranas basales también pueden aparecer en una tinción de PAS y pueden ser importantes al diagnosticar la enfermedad renal. Debido al alto volumen de carbohidratos dentro de la pared celular de las hifas y las formas de levadura de los hongos, la tinción de ácido peryódico de Schiff puede ayudar a localizar estas especies dentro de muestras de tejido del cuerpo humano.
El tricrómico de Masson es (como su nombre lo indica) un protocolo de tinción de tres colores. La receta ha evolucionado a partir de la técnica original de Masson para diferentes aplicaciones específicas, pero todas son adecuadas para distinguir las células del tejido conectivo circundante . La mayoría de las recetas producen tinción roja de queratina y fibras musculares, tinción azul o verde de colágeno y hueso , tinción roja clara o rosada de citoplasma y núcleos celulares negros .
La tinción de Romanowsky se considera un efecto de tinción policromo y se basa en una combinación de eosina plus ( eosina químicamente reducida ) y azul de metileno desmetilado (que contiene sus productos de oxidación azur A y azur B). Esta tinción desarrolla colores variables para todas las estructuras celulares ("efecto Romanowsky-Giemsa) y, por lo tanto, se utilizó para teñir polimorfos de neutrófilos y núcleos celulares. Las variantes comunes incluyen la tinción de Wright , la tinción de Jenner , la tinción de May-Grunwald, la tinción de Leishman y la tinción de Giemsa .
Todas ellas se utilizan para examinar muestras de sangre o médula ósea . Se prefieren a la H&E para la inspección de células sanguíneas porque se pueden distinguir fácilmente diferentes tipos de leucocitos (glóbulos blancos). Todas ellas también son adecuadas para el examen de sangre para detectar parásitos transmitidos por la sangre, como la malaria . [14]
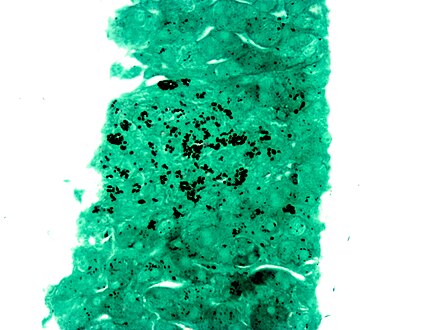
La tinción con plata es el uso de plata para teñir secciones histológicas . Este tipo de tinción es importante para la visualización de proteínas (por ejemplo, colágeno tipo III ) y ADN . Se utiliza para mostrar tanto sustancias dentro como fuera de las células . La tinción con plata también se utiliza en la electroforesis en gel con gradiente de temperatura .
Las células argentafines reducen la solución de plata a plata metálica después de la fijación con formalina . Este método fue descubierto por el italiano Camillo Golgi , mediante una reacción entre el nitrato de plata y el dicromato de potasio , precipitando así el cromato de plata en algunas células (véase el método de Golgi ). Las células argirófilas reducen la solución de plata a plata metálica después de ser expuestas al colorante que contiene un reductor . Un ejemplo de esto sería la hidroquinona o la formalina.
La tinción de Sudán utiliza colorantes de Sudán para teñir sustancias sudanófilas, que a menudo incluyen lípidos . Se utilizan a menudo Sudán III , Sudán IV , Oil Red O , tetróxido de osmio y Sudán Black B. La tinción de Sudán se utiliza a menudo para determinar el nivel de grasa fecal en el diagnóstico de la esteatorrea .
La tinción de Wirtz-Conklin es una técnica especial diseñada para teñir endosporas verdaderas con el uso del colorante verde malaquita como colorante principal y safranina como contratinción. Una vez teñidas, no se decoloran. La adición de calor durante el proceso de tinción es un factor contribuyente enorme. [15] El calor ayuda a abrir la membrana de la espora para que el colorante pueda entrar. El objetivo principal de esta tinción es mostrar la germinación de las esporas bacterianas. Si el proceso de germinación está en curso, entonces la espora se volverá de color verde debido al verde malaquita y la célula circundante será roja por la safranina. Esta tinción también puede ayudar a determinar la orientación de la espora dentro de la célula bacteriana; si es terminal (en la punta), subterminal (dentro de la célula) o central (completamente en el medio de la célula).
La tinción con péptidos hibridizantes de colágeno (CHP) permite teñir de forma sencilla y directa colágenos desnaturalizados de cualquier tipo (tipo I, II, IV, etc.) independientemente de si se dañaron o degradaron por medios enzimáticos, mecánicos, químicos o térmicos. Funcionan al replegarse en la triple hélice de colágeno con las hebras simples disponibles en el tejido. Los CHP se pueden visualizar con un microscopio de fluorescencia simple .
Diferentes colorantes reaccionan o se concentran en distintas partes de una célula o tejido, y estas propiedades se utilizan para revelar partes o áreas específicas. A continuación se enumeran algunos de los colorantes biológicos más comunes. A menos que se indique lo contrario, todos estos colorantes se pueden utilizar con células y tejidos fijados; se indican los colorantes vitales (aptos para su uso con organismos vivos).
El naranja de acridina (AO) es un colorante catiónico fluorescente selectivo de ácidos nucleicos útil para la determinación del ciclo celular. Es permeable a las células e interactúa con el ADN y el ARN por intercalación o atracciones electrostáticas. Cuando se une al ADN, es muy similar espectralmente a la fluoresceína. Al igual que la fluoresceína, también es útil como colorante no específico para la retroiluminación de células teñidas de manera convencional en la superficie de una muestra sólida de tejido (tinción con retroiluminación fluorescente [16] ).
[17] El marrón de Bismarck (también marrón de Bismarck Y o marrón de Manchester) confiere un color amarillo a las mucinas ácidas y un color marrón intenso a los mastocitos. Un defecto de esta tinción es que borra cualquier otra estructura que la rodee y hace que la calidad del contraste sea baja. Debe combinarse con otras tinciones para que sea útil. Algunas tinciones complementarias utilizadas junto con el marrón de Bismarck son la hematoxilina y el azul de toluidina, que proporcionan un mejor contraste dentro de la muestra histológica.

El carmín es un colorante rojo intenso que se utiliza para teñir el glucógeno , mientras que el carmín de alumbre es un colorante nuclear. Las tinciones de carmín requieren el uso de un mordiente, generalmente aluminio .
El azul brillante de Coomassie tiñe las proteínas de un color azul intenso de forma inespecífica. Se utiliza a menudo en la electroforesis en gel.
El violeta de cresilo tiñe de color violeta los componentes ácidos del citoplasma neuronal, en concreto los cuerpos de Nissl . Se utiliza a menudo en la investigación del cerebro.
El violeta cristal , cuando se combina con un mordiente adecuado, tiñe las paredes celulares de color púrpura. El violeta cristal es el colorante que se utiliza en la tinción de Gram.
DAPI es un colorante nuclear fluorescente , excitado por luz ultravioleta y que muestra una fuerte fluorescencia azul cuando se une al ADN . DAPI se une a repeticiones ricas en A=T de los cromosomas. DAPI tampoco es visible con microscopía de transmisión regular. Puede usarse en células vivas o fijadas. Las células teñidas con DAPI son especialmente apropiadas para el recuento celular. [18]
La eosina se utiliza con mayor frecuencia como contratinción de la hematoxilina, impartiendo un color rosa o rojo al material citoplasmático , las membranas celulares y algunas estructuras extracelulares. También imparte un color rojo intenso a los glóbulos rojos . La eosina también se puede utilizar como contratinción en algunas variantes de la tinción de Gram y en muchos otros protocolos. En realidad, hay dos compuestos muy estrechamente relacionados a los que se hace referencia comúnmente como eosina. El más utilizado es la eosina Y (también conocida como eosina Y ws o eosina amarillenta); tiene un tono muy ligeramente amarillento. El otro compuesto de eosina es la eosina B (eosina azulada o roja imperial); tiene un tono azulado muy tenue. Los dos colorantes son intercambiables, y el uso de uno u otro es más una cuestión de preferencia y tradición.
El bromuro de etidio se intercala y tiñe el ADN, proporcionando una tinción fluorescente de color rojo anaranjado. Aunque no tiñe las células sanas, se puede utilizar para identificar células que se encuentran en las etapas finales de la apoptosis (dichas células tienen membranas mucho más permeables) . En consecuencia, el bromuro de etidio se utiliza a menudo como marcador de apoptosis en poblaciones de células y para localizar bandas de ADN en la electroforesis en gel . La tinción también se puede utilizar junto con naranja de acridina (AO) en el recuento de células viables. Esta tinción combinada de EB/AO hace que las células vivas presenten fluorescencia verde, mientras que las células apoptóticas conservan la distintiva fluorescencia rojo-anaranjada.
La fucsina ácida se puede utilizar para teñir colágeno, músculo liso o mitocondrias . La fucsina ácida se utiliza como colorante nuclear y citoplasmático en el método tricrómico de Mallory. La fucsina ácida tiñe el citoplasma en algunas variantes del tricrómico de Masson. En la picrofucsina de Van Gieson, la fucsina ácida imparte su color rojo a las fibras de colágeno. La fucsina ácida también es un colorante tradicional para las mitocondrias (método de Altmann).
La hematoxilina (hematoxilina en América del Norte) es una tinción nuclear. [10] Utilizada con un mordiente, la hematoxilina tiñe los núcleos de azul violeta o marrón. [10] Se utiliza con mayor frecuencia con eosina en la tinción H&E (hematoxilina y eosina), uno de los procedimientos más comunes en histología . [10]
El Hoechst es un compuesto derivado del bis -bencimidazol que se une al surco menor del ADN . A menudo se utiliza en microscopía de fluorescencia para la tinción del ADN; las tinciones de Hoechst aparecen amarillas cuando se disuelven en soluciones acuosas y emiten luz azul bajo excitación UV. Hay dos tipos principales de Hoechst : Hoechst 33258 y Hoechst 33342. Los dos compuestos son funcionalmente similares, pero con una pequeña diferencia en la estructura. El Hoechst 33258 contiene un grupo hidroxilo terminal y, por lo tanto, es más soluble en solución acuosa; sin embargo, esta característica reduce su capacidad para penetrar la membrana plasmática . El Hoechst 33342 contiene una sustitución de etilo en el grupo hidroxilo terminal (es decir, un grupo éter etílico), lo que lo hace más hidrófobo para facilitar el paso a través de la membrana plasmática.
El yodo se utiliza en química como indicador del almidón . Cuando el almidón se mezcla con yodo en solución, se desarrolla un color azul intenso y oscuro, que representa un complejo almidón/yodo. El almidón es una sustancia común a la mayoría de las células vegetales, por lo que una solución de yodo débil tiñe el almidón presente en las células. El yodo es un componente de la técnica de tinción conocida como tinción de Gram , que se utiliza en microbiología . Utilizado como mordiente en la tinción de Gram, el yodo mejora la entrada del colorante a través de los poros presentes en la pared/membrana celular.
La solución de Lugol o yodo de Lugol (IKI) es una solución de color marrón que se vuelve negra en presencia de almidones y puede utilizarse como tinción celular, haciendo más visibles los núcleos celulares.
La solución de Lugol, que se utiliza con vinagre común (ácido acético), se utiliza para identificar cambios precancerosos y cancerosos en los tejidos cervicales y vaginales durante los exámenes de seguimiento de la prueba de Papanicolaou como preparación para la biopsia. El ácido acético hace que las células anormales se tiñan de un color blanco, mientras que los tejidos normales se tiñen de un marrón caoba debido al yodo. [19]
El verde malaquita (también conocido como verde diamante B o verde victoria B) se puede utilizar como contratinción azul verdosa de la safranina en la técnica de tinción de Giménez para bacterias. También se puede utilizar para teñir directamente las esporas .
El verde de metilo se utiliza comúnmente en microscopios de campo claro y de fluorescencia [20] para teñir la cromatina de las células para que se puedan ver más fácilmente.
El azul de metileno se utiliza para teñir células animales, como las de la mejilla humana, para que sus núcleos sean más visibles. También se utiliza para teñir frotis de sangre en citología.
El rojo neutro (o rojo de toluileno) tiñe la sustancia de rojo Nissl . Se suele utilizar como contratinción en combinación con otros colorantes.
El azul Nilo (o azul Nilo A) tiñe los núcleos de color azul. Puede utilizarse con células vivas.
El rojo Nilo (también conocido como oxazona azul Nilo) se forma al hervir el azul Nilo con ácido sulfúrico . Esto produce una mezcla de rojo Nilo y azul Nilo. El rojo Nilo es un colorante lipofílico ; se acumula en los glóbulos lipídicos dentro de las células, tiñéndolas de rojo. El rojo Nilo se puede utilizar con células vivas. Fluoresce intensamente cuando se divide en lípidos, pero prácticamente no lo hace en solución acuosa.
El tetraóxido de osmio se utiliza en microscopía óptica para teñir lípidos . Se disuelve en grasas y se reduce en presencia de materiales orgánicos hasta convertirse en osmio elemental, una sustancia negra fácilmente visible.
El yoduro de propidio es un agente intercalante fluorescente que se puede utilizar para teñir células. El yoduro de propidio se utiliza como colorante de ADN en la citometría de flujo para evaluar la viabilidad celular o el contenido de ADN en el análisis del ciclo celular, o en microscopía para visualizar el núcleo y otros orgánulos que contienen ADN. El yoduro de propidio no puede atravesar la membrana de las células vivas, lo que lo hace útil para diferenciar células necróticas, apoptóticas y sanas. El PI también se une al ARN, lo que requiere un tratamiento con nucleasas para distinguir entre la tinción de ARN y ADN.
La rodamina es una tinción fluorescente específica de proteínas que se utiliza comúnmente en microscopía de fluorescencia.
La safranina (o safranina O) es un colorante catiónico rojo. Se une a los núcleos (ADN) y a otros polianiones tisulares , incluidos los glicosaminoglicanos en el cartílago y los mastocitos, y los componentes de la lignina y los plástidos en los tejidos vegetales. [21] La safranina no debe confundirse con el azafrán, un colorante natural costoso que se utiliza en algunos métodos para impartir un color amarillo al colágeno, para contrastar con los colores azul y rojo impartidos por otros colorantes a los núcleos y al citoplasma en los tejidos animales (incluidos los humanos).
La ortografía incorrecta "safranina" es de uso común. La terminación -ina es apropiada para safranina O porque este colorante es una amina. [4] [22] [23]
Los tejidos que absorben las tinciones se denominan cromáticos . Los cromosomas recibieron ese nombre por su capacidad de absorber una tinción violeta.
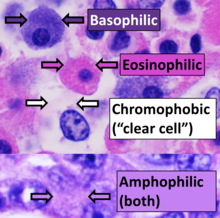
La afinidad positiva por una tinción específica puede designarse con el sufijo -fílico . Por ejemplo, los tejidos que se tiñen con una tinción azul pueden denominarse azurófilos . Esto también puede usarse para propiedades de tinción más generalizadas, como acidófilo para tejidos que se tiñen con tinciones ácidas (sobre todo eosina ), basófilo cuando se tiñen con colorantes básicos y anfófilo [24] cuando se tiñen con colorantes ácidos o básicos. Por el contrario, los tejidos cromófobos no absorben fácilmente el colorante coloreado.
Al igual que en la microscopía óptica, se pueden utilizar colorantes para mejorar el contraste en la microscopía electrónica de transmisión . Normalmente se utilizan compuestos de metales pesados densos en electrones.
[25] El ácido fosfotúngstico es una tinción negativa común para virus , nervios , polisacáridos y otros materiales de tejido biológico. Se utiliza principalmente en una forma de pH de 0,5-2%, lo que lo hace neutro y se combina con agua para hacer una solución acuosa. El ácido fosfotúngstico está lleno de materia densa en electrones que tiñe el fondo que rodea la muestra de oscuro y la muestra en sí de claro. Este proceso no es la técnica positiva normal para teñir donde la muestra es oscura y el fondo permanece claro.
El tetróxido de osmio se utiliza en microscopía óptica para teñir lípidos . Se disuelve en grasas y se reduce por la acción de materiales orgánicos a osmio elemental, una sustancia negra fácilmente visible. Debido a que es un metal pesado que absorbe electrones, es quizás el colorante más común utilizado para la morfología en microscopía electrónica biológica. También se utiliza para la tinción de varios polímeros para el estudio de su morfología mediante TEM. OsO
4Es muy volátil y extremadamente tóxico. Es un agente oxidante fuerte, ya que el osmio tiene un número de oxidación de +8. Oxida agresivamente muchos materiales, dejando un depósito de osmio no volátil en un estado de oxidación más bajo.
El tetróxido de rutenio es igualmente volátil e incluso más agresivo que el tetróxido de osmio y es capaz de manchar incluso materiales que resisten la tinción de osmio, por ejemplo el polietileno.
Otros productos químicos utilizados en la tinción de microscopía electrónica incluyen: molibdato de amonio , yoduro de cadmio , carbohidrazida , cloruro férrico , hexamina , tricloruro de indio , nitrato de lantano (III) , acetato de plomo , citrato de plomo , nitrato de plomo (II) , ácido peryódico , ácido fosfomolíbdico , ferricianuro de potasio , ferrocianuro de potasio , rojo de rutenio , nitrato de plata , proteinato de plata , cloroaurato de sodio, nitrato de talio , tiosemicarbazida , acetato de uranilo , nitrato de uranilo y sulfato de vanadilo .