

La combustión , o quema , [1] es una reacción química redox exotérmica de alta temperatura entre un combustible (el reductor) y un oxidante , generalmente oxígeno atmosférico , que produce productos oxidados, a menudo gaseosos, en una mezcla denominada humo . La combustión no siempre da como resultado un incendio , porque una llama solo es visible cuando las sustancias que experimentan combustión se vaporizan, pero cuando lo hace, una llama es un indicador característico de la reacción. Si bien se debe suministrar energía de activación para iniciar la combustión (por ejemplo, utilizando un fósforo encendido para encender un fuego), el calor de una llama puede proporcionar suficiente energía para que la reacción sea autosostenible . El estudio de la combustión se conoce como ciencia de la combustión .
La combustión es a menudo una secuencia complicada de reacciones radicales elementales . Los combustibles sólidos , como la madera y el carbón , primero experimentan una pirólisis endotérmica para producir combustibles gaseosos cuya combustión luego proporciona el calor necesario para producir más de ellos. La combustión suele ser lo suficientemente caliente como para producir luz incandescente en forma de resplandor o llama . Un ejemplo simple puede verse en la combustión de hidrógeno y oxígeno en vapor de agua , una reacción que se usa comúnmente para alimentar motores de cohetes . Esta reacción libera 242 kJ/mol de calor y reduce la entalpía en consecuencia (a temperatura y presión constantes):
La combustión no catalizada en el aire requiere temperaturas relativamente altas. La combustión completa es estequiométrica con respecto al combustible, donde no hay combustible restante e idealmente, ningún oxidante residual. Termodinámicamente, el equilibrio químico de la combustión en el aire está abrumadoramente del lado de los productos. Sin embargo, la combustión completa es casi imposible de lograr, ya que el equilibrio químico no se alcanza necesariamente, o puede contener productos no quemados como monóxido de carbono , hidrógeno e incluso carbono ( hollín o ceniza). Por lo tanto, el humo producido suele ser tóxico y contiene productos no quemados o parcialmente oxidados. Cualquier combustión a altas temperaturas en el aire atmosférico , que es 78 por ciento nitrógeno , también creará pequeñas cantidades de varios óxidos de nitrógeno , comúnmente conocidos como NOx , ya que la combustión del nitrógeno se favorece termodinámicamente a altas, pero no bajas temperaturas. Dado que la combustión rara vez es limpia, la limpieza de gases combustibles o convertidores catalíticos pueden ser requeridos por ley.
Los incendios se producen de forma natural, iniciados por la caída de rayos o por productos volcánicos . La combustión ( fuego ) fue la primera reacción química controlada descubierta por los seres humanos, en forma de fogatas y hogueras , y sigue siendo el principal método para producir energía para la humanidad. Por lo general, el combustible es carbono , hidrocarburos o mezclas más complicadas como la madera que contienen hidrocarburos parcialmente oxidados. La energía térmica producida a partir de la combustión de combustibles fósiles como el carbón o el petróleo , o de combustibles renovables como la leña , se aprovecha para diversos usos como cocinar , producir electricidad o calefacción industrial o doméstica. La combustión también es actualmente la única reacción utilizada para impulsar cohetes . La combustión también se utiliza para destruir ( incinerar ) residuos, tanto peligrosos como no peligrosos.
Los oxidantes para la combustión tienen un alto potencial de oxidación e incluyen oxígeno atmosférico o puro , cloro , flúor , trifluoruro de cloro , óxido nitroso y ácido nítrico . Por ejemplo, el hidrógeno se quema en cloro para formar cloruro de hidrógeno con la liberación de calor y luz característicos de la combustión. Aunque generalmente no se cataliza, la combustión puede ser catalizada por platino o vanadio , como en el proceso de contacto .

En la combustión completa, el reactivo se quema en oxígeno y produce una cantidad limitada de productos. Cuando un hidrocarburo se quema en oxígeno, la reacción producirá principalmente dióxido de carbono y agua. Cuando se queman elementos, los productos son principalmente los óxidos más comunes. El carbono producirá dióxido de carbono , el azufre producirá dióxido de azufre y el hierro producirá óxido de hierro (III) . El nitrógeno no se considera una sustancia combustible cuando el oxígeno es el oxidante . Aun así, pequeñas cantidades de varios óxidos de nitrógeno (comúnmente denominados NO
incógnitaLas especies se forman cuando el aire es el oxidante.
La combustión no es necesariamente favorable al grado máximo de oxidación y puede depender de la temperatura. Por ejemplo, el trióxido de azufre no se produce cuantitativamente mediante la combustión del azufre. Las especies de NOx aparecen en cantidades significativas por encima de los 2800 °F (1540 °C) y se producen más a temperaturas más altas. La cantidad de NOx también es una función del exceso de oxígeno. [2]
En la mayoría de las aplicaciones industriales y en los incendios , el aire es la fuente de oxígeno ( O
2). En el aire, cada mol de oxígeno se mezcla con aproximadamente3,71 moles de nitrógeno. El nitrógeno no participa en la combustión, pero a altas temperaturas, una parte del nitrógeno se convertirá en NO
incógnita(principalmente NO , con cantidades mucho más pequeñas de NO2). Por otra parte, cuando no hay suficiente oxígeno para quemar el combustible por completo, parte del carbono del combustible se convierte en monóxido de carbono y parte de los hidrógenos quedan sin reaccionar. Por lo tanto, un conjunto completo de ecuaciones para la combustión de un hidrocarburo en el aire requiere un cálculo adicional para la distribución de oxígeno entre el carbono y el hidrógeno en el combustible.
La cantidad de aire necesaria para una combustión completa se conoce como "aire teórico" o "aire estequiométrico". [3] La cantidad de aire por encima de este valor que realmente se necesita para una combustión óptima se conoce como "aire en exceso", y puede variar desde el 5% para una caldera de gas natural, hasta el 40% para carbón antracita , o el 300% para una turbina de gas . [4]
La combustión incompleta se produce cuando no hay suficiente oxígeno para permitir que el combustible reaccione por completo y produzca dióxido de carbono y agua. También ocurre cuando la combustión se extingue mediante un disipador de calor, como una superficie sólida o una trampa de llama. Al igual que en el caso de la combustión completa, la combustión incompleta produce agua; sin embargo, se produce carbono y monóxido de carbono en lugar de dióxido de carbono.
En la mayoría de los combustibles, como el gasóleo, el carbón o la madera, la pirólisis se produce antes de la combustión. En una combustión incompleta, los productos de la pirólisis permanecen sin quemar y contaminan el humo con partículas y gases nocivos. Los compuestos parcialmente oxidados también son un problema; la oxidación parcial del etanol puede producir acetaldehído nocivo y el carbono puede producir monóxido de carbono tóxico.
Los diseños de dispositivos de combustión pueden mejorar la calidad de la combustión, como los quemadores y los motores de combustión interna . Se pueden lograr mejoras adicionales mediante dispositivos de postcombustión catalítica (como los convertidores catalíticos ) o mediante el simple retorno parcial de los gases de escape al proceso de combustión. Estos dispositivos son requeridos por la legislación ambiental para los automóviles en la mayoría de los países. Pueden ser necesarios para permitir que los grandes dispositivos de combustión, como las centrales térmicas , alcancen los estándares legales de emisiones .
El grado de combustión se puede medir y analizar con equipos de prueba. Los contratistas de sistemas de calefacción , ventilación y aire acondicionado, los bomberos y los ingenieros utilizan analizadores de combustión para probar la eficiencia de un quemador durante el proceso de combustión. También se puede medir la eficiencia de un motor de combustión interna de esta manera, y algunos estados y municipios locales de EE. UU. utilizan el análisis de combustión para definir y calificar la eficiencia de los vehículos en la carretera en la actualidad.
El monóxido de carbono es uno de los productos de la combustión incompleta . [5] La formación de monóxido de carbono produce menos calor que la formación de dióxido de carbono, por lo que la combustión completa es mucho más preferible, especialmente porque el monóxido de carbono es un gas venenoso. Cuando se inhala, el monóxido de carbono reemplaza al oxígeno y se combina con parte de la hemoglobina en la sangre, lo que la vuelve incapaz de transportar oxígeno. [6]
Estos óxidos se combinan con el agua y el oxígeno de la atmósfera, creando ácido nítrico y ácido sulfúrico , que regresan a la superficie de la Tierra en forma de deposición ácida o "lluvia ácida". La deposición ácida daña a los organismos acuáticos y mata a los árboles. Debido a la formación de ciertos nutrientes que están menos disponibles para las plantas, como el calcio y el fósforo, reduce la productividad del ecosistema y de las granjas. Un problema adicional asociado con los óxidos de nitrógeno es que, junto con los contaminantes de hidrocarburos , contribuyen a la formación de ozono a nivel del suelo , un componente importante del smog. [7]
Respirar monóxido de carbono provoca dolor de cabeza, mareos, vómitos y náuseas. Si los niveles de monóxido de carbono son lo suficientemente altos, los seres humanos quedan inconscientes o mueren. La exposición a niveles moderados y altos de monóxido de carbono durante períodos prolongados está correlacionada positivamente con el riesgo de enfermedades cardíacas. Las personas que sobreviven a una intoxicación grave por monóxido de carbono pueden sufrir problemas de salud a largo plazo. [8] El monóxido de carbono del aire se absorbe en los pulmones, que luego se une a la hemoglobina de los glóbulos rojos humanos. Esto reduce la capacidad de los glóbulos rojos para transportar oxígeno por todo el cuerpo.
La combustión lenta es una forma de combustión lenta, a baja temperatura y sin llama, sostenida por el calor que se desprende cuando el oxígeno ataca directamente la superficie de un combustible en fase condensada. Es una reacción de combustión típicamente incompleta. Los materiales sólidos que pueden sostener una reacción de combustión lenta incluyen carbón, celulosa , madera , algodón , tabaco , turba , hojarasca , humus , espumas sintéticas, polímeros carbonizados (incluida la espuma de poliuretano ) y polvo . Ejemplos comunes de fenómenos de combustión lenta son el inicio de incendios residenciales en muebles tapizados por fuentes de calor débiles (por ejemplo, un cigarrillo, un cable en cortocircuito) y la combustión persistente de biomasa detrás de los frentes de llamas de los incendios forestales .
La combustión espontánea es un tipo de combustión que se produce por autocalentamiento (aumento de la temperatura debido a reacciones internas exotérmicas ), seguido de un descontrol térmico (autocalentamiento que se acelera rápidamente hasta alcanzar temperaturas elevadas) y, finalmente, la ignición. Por ejemplo, el fósforo se autoinflama a temperatura ambiente sin la aplicación de calor. Los materiales orgánicos sometidos a compostaje bacteriano pueden generar suficiente calor para alcanzar el punto de combustión. [9]
La combustión que produce una llama turbulenta es la más utilizada para aplicaciones industriales (por ejemplo, turbinas de gas , motores de gasolina , etc.) porque la turbulencia ayuda al proceso de mezcla entre el combustible y el oxidante .

El término gravedad "micro" se refiere a un estado gravitacional que es "bajo" (es decir, "micro" en el sentido de "pequeño" y no necesariamente una millonésima parte de la gravedad normal de la Tierra) de modo que la influencia de la flotabilidad en los procesos físicos puede considerarse pequeña en relación con otros procesos de flujo que estarían presentes en la gravedad normal. En un entorno de este tipo, la dinámica de transporte térmico y de flujo puede comportarse de forma bastante diferente que en condiciones de gravedad normal (por ejemplo, la llama de una vela toma la forma de una esfera. [10] ). La investigación de la combustión en microgravedad contribuye a la comprensión de una amplia variedad de aspectos que son relevantes tanto para el entorno de una nave espacial (por ejemplo, la dinámica del fuego relevante para la seguridad de la tripulación en la Estación Espacial Internacional ) como para las condiciones terrestres (basadas en la Tierra) (por ejemplo, la dinámica de la combustión de gotitas para ayudar a desarrollar nuevas mezclas de combustible para una mejor combustión, procesos de fabricación de materiales, gestión térmica de sistemas electrónicos , dinámica de ebullición de flujo multifásico y muchos otros).
Los procesos de combustión que se producen en volúmenes muy pequeños se denominan microcombustión . La elevada relación superficie-volumen aumenta la pérdida de calor específica. La distancia de extinción desempeña un papel fundamental en la estabilización de la llama en dichas cámaras de combustión .
Generalmente, la ecuación química para la combustión estequiométrica de un hidrocarburo en oxígeno es:
Por ejemplo, la combustión estequiométrica del metano en oxígeno es:
Si la combustión estequiométrica se lleva a cabo utilizando aire como fuente de oxígeno, el nitrógeno presente en el aire ( Atmósfera de la Tierra ) se puede agregar a la ecuación (aunque no reaccione) para mostrar la composición estequiométrica del combustible en el aire y la composición del gas de combustión resultante. Tratar todos los componentes no oxigenados en el aire como nitrógeno da una relación "nitrógeno" a oxígeno de 3,77, es decir (100% − O
2%) / O
2% donde O
2% es 20,95% vol:
dónde .
Por ejemplo, la combustión estequiométrica del metano en el aire es:
La composición estequiométrica del metano en el aire es 1 / (1 + 2 + 7,54) = 9,49% vol.
La reacción de combustión estequiométrica para C α H β O γ en el aire:
La reacción de combustión estequiométrica para C α H β O γ S δ :
La reacción de combustión estequiométrica para C α H β O γ N δ S ε :
La reacción de combustión estequiométrica para C α H β O γ F δ :
Varias otras sustancias comienzan a aparecer en cantidades significativas en los productos de combustión cuando la temperatura de la llama es superior a aproximadamente1600 K. Cuando se utiliza aire en exceso, el nitrógeno puede oxidarse a NO y, en mucha menor medida, a NO2El CO se forma por desproporción de CO 2 y H2y OH se forman por desproporción de H 2 O .
Por ejemplo, cuandoSe quema 1 mol de propano con28,6 moles de aire (120% de la cantidad estequiométrica), los productos de combustión contienen 3,3% de O
2. En1400 K , los productos de combustión en equilibrio contienen 0,03 % de NO y 0,002 % de OH .1800 K , los productos de combustión contienen 0,17 % de NO , 0,05 % de OH , 0,01 % de CO y 0,004 % de H
2. [11]
Los motores diésel funcionan con un exceso de oxígeno para quemar pequeñas partículas que tienden a formarse con una cantidad estequiométrica de oxígeno, lo que necesariamente produce emisiones de óxido de nitrógeno . Tanto los Estados Unidos como la Unión Europea imponen límites a las emisiones de óxido de nitrógeno de los vehículos, lo que requiere el uso de convertidores catalíticos especiales o el tratamiento de los gases de escape con urea (consulte Líquido de escape diésel ).
La combustión incompleta (parcial) de un hidrocarburo con oxígeno produce una mezcla de gases que contiene principalmente CO
2, CO , H 2 O y H
2Estas mezclas de gases se preparan comúnmente para su uso como atmósferas protectoras para el tratamiento térmico de metales y para la carburación de gases . [12] La ecuación de reacción general para la combustión incompleta de un mol de un hidrocarburo en oxígeno es:
Cuando z cae por debajo de aproximadamente el 50% del valor estequiométrico, CH4puede convertirse en un producto de combustión importante; cuando z cae por debajo de aproximadamente el 35% del valor estequiométrico, el carbono elemental puede volverse estable.
Los productos de una combustión incompleta se pueden calcular con la ayuda de un balance de materiales , junto con el supuesto de que los productos de la combustión alcanzan el equilibrio . [13] [14] Por ejemplo, en la combustión de un mol de propano ( C
3yo
8) con cuatro moles de O
2Se forman siete moles de gas de combustión y z es el 80% del valor estequiométrico. Las tres ecuaciones de balance elemental son:
Estas tres ecuaciones no son suficientes por sí solas para calcular la composición de los gases de combustión. Sin embargo, en la posición de equilibrio, la reacción de desplazamiento del gas de agua da otra ecuación:
Por ejemplo, en1200 K el valor de K eq es 0,728. [15] Resolviendo, el gas de combustión consta de 42,4 % H 2 O , 29,0 % CO 2 , 14,7 % H
2, y 13,9% de CO . El carbono se convierte en una fase estable en1200 K y1 atm de presión cuando z es menor que el 30% del valor estequiométrico, en cuyo punto los productos de combustión contienen más del 98% de H
2y CO y aproximadamente 0,5% CH
4.
Las sustancias o materiales que experimentan combustión se denominan combustibles . Los ejemplos más comunes son el gas natural, el propano, el queroseno , el diésel , la gasolina, el carbón vegetal, el carbón, la madera, etc.
La combustión de un combustible líquido en una atmósfera oxidante se produce en realidad en fase gaseosa. Es el vapor el que se quema, no el líquido. Por lo tanto, un líquido normalmente se incendiará solo por encima de una determinada temperatura: su punto de inflamación . El punto de inflamación del combustible líquido es la temperatura más baja a la que puede formar una mezcla inflamable con el aire. Es la temperatura mínima a la que hay suficiente combustible evaporado en el aire para iniciar la combustión.
La combustión de combustibles gaseosos puede ocurrir a través de uno de cuatro tipos distintivos de quema: llama de difusión , llama premezclada , frente de reacción autoinflamable o como detonación . [16] El tipo de combustión que ocurre realmente depende del grado en que el combustible y el oxidante se mezclan antes del calentamiento: por ejemplo, se forma una llama de difusión si el combustible y el oxidante se separan inicialmente, mientras que se forma una llama premezclada en caso contrario. De manera similar, el tipo de combustión también depende de la presión: una detonación, por ejemplo, es un frente de reacción autoinflamable acoplado a una fuerte onda de choque que le da su pico característico de alta presión y alta velocidad de detonación . [16]
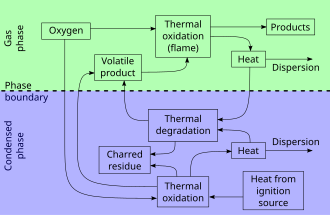
El acto de combustión consta de tres fases relativamente distintas pero superpuestas:
Un proceso de calentamiento eficiente requiere la recuperación de la mayor parte posible del calor de combustión de un combustible en el material que se está procesando. [17] [18] Existen muchas vías de pérdida en el funcionamiento de un proceso de calentamiento. Normalmente, la pérdida dominante es el calor sensible que sale con el gas de escape (es decir, el gas de combustión ). La temperatura y la cantidad de gas de escape indican su contenido de calor ( entalpía ), por lo que mantener su cantidad baja minimiza la pérdida de calor.
En un horno perfecto, el flujo de aire de combustión se adaptaría al flujo de combustible para dar a cada molécula de combustible la cantidad exacta de oxígeno necesaria para provocar una combustión completa. Sin embargo, en el mundo real, la combustión no se produce de manera perfecta. El combustible no quemado (normalmente CO y H
2) descargado del sistema representa una pérdida de valor calorífico (así como un riesgo de seguridad). Dado que los combustibles son indeseables en el gas de escape, mientras que la presencia de oxígeno sin reaccionar allí presenta preocupaciones mínimas de seguridad y ambientales, el primer principio de la gestión de la combustión es proporcionar más oxígeno del que se necesita teóricamente para garantizar que se queme todo el combustible. Para el metano ( CH
4) para la combustión, por ejemplo, se requieren un poco más de dos moléculas de oxígeno.
El segundo principio de la gestión de la combustión, sin embargo, es no utilizar demasiado oxígeno. La cantidad correcta de oxígeno requiere tres tipos de medición: primero, control activo del flujo de aire y combustible; segundo, medición del oxígeno de los gases de escape; y tercero, medición de los combustibles de los gases de escape. Para cada proceso de calentamiento, existe una condición óptima de mínima pérdida de calor de los gases de escape con niveles aceptables de concentración de combustibles. Minimizar el exceso de oxígeno ofrece un beneficio adicional: para una temperatura dada de los gases de escape, el nivel de NOx es más bajo cuando el exceso de oxígeno se mantiene al mínimo. [2]
La adherencia a estos dos principios se promueve al realizar balances de materia y calor en el proceso de combustión. [19] [20] [21] [22] El balance de materia relaciona directamente la relación aire/combustible con el porcentaje de O
2en el gas de combustión. El balance térmico relaciona el calor disponible para la carga con el calor neto total producido por la combustión del combustible. [23] [24] Se pueden realizar balances adicionales de material y calor para cuantificar la ventaja térmica del precalentamiento del aire de combustión, [25] [26] o de enriquecerlo con oxígeno. [27] [28]
La combustión en oxígeno es una reacción en cadena en la que participan muchos intermediarios radicales distintos . La alta energía requerida para la iniciación se explica por la estructura inusual de la molécula de dioxígeno . La configuración de energía más baja de la molécula de dioxígeno es un dirradical estable, relativamente no reactivo en un estado de espín triplete . La unión se puede describir con tres pares de electrones de enlace y dos electrones antienlazantes, con espines alineados, de modo que la molécula tiene un momento angular total distinto de cero. La mayoría de los combustibles, por otro lado, están en un estado singlete, con espines apareados y un momento angular total cero. La interacción entre los dos es mecánicamente cuántica una " transición prohibida ", es decir, posible con una probabilidad muy baja. Para iniciar la combustión, se requiere energía para forzar al dioxígeno a un estado de espín apareado, u oxígeno singlete . Este intermediario es extremadamente reactivo. La energía se suministra como calor , y la reacción luego produce calor adicional, lo que le permite continuar.
Se cree que la combustión de hidrocarburos se inicia por la abstracción de átomos de hidrógeno (no de protones) del combustible a oxígeno, para dar un radical hidroperóxido (HOO). Este reacciona aún más para dar hidroperóxidos, que se descomponen para dar radicales hidroxilo . Existe una gran variedad de estos procesos que producen radicales de combustible y radicales oxidantes. Las especies oxidantes incluyen oxígeno singlete, hidroxilo, oxígeno monoatómico e hidroperoxilo . Estos intermediarios tienen una vida corta y no se pueden aislar. Sin embargo, los intermediarios no radicales son estables y se producen en una combustión incompleta. Un ejemplo es el acetaldehído producido en la combustión de etanol . Un intermediario en la combustión de carbono e hidrocarburos, el monóxido de carbono , es de especial importancia porque es un gas venenoso , pero también económicamente útil para la producción de gas de síntesis .
Los combustibles sólidos y líquidos pesados también sufren una gran cantidad de reacciones de pirólisis que dan lugar a combustibles gaseosos que se oxidan con mayor facilidad. Estas reacciones son endotérmicas y requieren un aporte constante de energía de las reacciones de combustión en curso. La falta de oxígeno u otras condiciones mal diseñadas dan lugar a que estos productos de pirólisis nocivos y cancerígenos se emitan en forma de humo negro y espeso.
La velocidad de combustión es la cantidad de material que se quema durante un período de tiempo. Puede expresarse en gramos por segundo (g/s) o kilogramos por segundo (kg/s).
Las descripciones detalladas de los procesos de combustión, desde la perspectiva de la cinética química, requieren la formulación de grandes e intrincadas redes de reacciones elementales. [29] Por ejemplo, la combustión de combustibles de hidrocarburos generalmente involucra cientos de especies químicas que reaccionan de acuerdo con miles de reacciones.
La inclusión de dichos mecanismos en los solucionadores de flujo computacionales aún representa una tarea bastante desafiante, principalmente en dos aspectos. En primer lugar, el número de grados de libertad (proporcional al número de especies químicas) puede ser dramáticamente grande; en segundo lugar, el término fuente debido a las reacciones introduce un número dispar de escalas de tiempo que hace que todo el sistema dinámico sea rígido. Como resultado, la simulación numérica directa de flujos reactivos turbulentos con combustibles pesados pronto se vuelve intratable incluso para las supercomputadoras modernas. [30]
Por ello, se han ideado numerosas metodologías para reducir la complejidad de los mecanismos de combustión sin recurrir a niveles elevados de detalle. Algunos ejemplos son los siguientes:
Se puede explorar el modelado cinético para comprender mejor los mecanismos de reacción de la descomposición térmica en la combustión de diferentes materiales utilizando, por ejemplo, el análisis termogravimétrico . [49]

Suponiendo que las condiciones de combustión son perfectas, como una combustión completa en condiciones adiabáticas (es decir, sin pérdida ni ganancia de calor), se puede determinar la temperatura de combustión adiabática. La fórmula que da como resultado esta temperatura se basa en la primera ley de la termodinámica y toma nota del hecho de que el calor de la combustión se utiliza en su totalidad para calentar el combustible, el aire de combustión o el oxígeno y los gases de los productos de la combustión (comúnmente denominados gases de combustión ).
En el caso de los combustibles fósiles quemados en el aire, la temperatura de combustión depende de todos los siguientes factores:
La temperatura de combustión adiabática (también conocida como temperatura de llama adiabática ) aumenta para valores caloríficos más altos y temperaturas de aire y combustible de entrada y para relaciones de aire estequiométricas que se acercan a uno.
Lo más común es que las temperaturas de combustión adiabática del carbón sean de alrededor de 2200 °C (3992 °F) (para el aire de entrada y el combustible a temperaturas ambiente y para ), alrededor de 2150 °C (3902 °F) para el petróleo y 2000 °C (3632 °F) para el gas natural . [50] [51]
En los calentadores de combustión industriales , los generadores de vapor de las centrales eléctricas y las grandes turbinas a gas , la forma más común de expresar el uso de más del aire de combustión estequiométrico es el porcentaje de exceso de aire de combustión . Por ejemplo, un exceso de aire de combustión del 15 por ciento significa que se está utilizando un 15 por ciento más del aire estequiométrico requerido.
Las inestabilidades de la combustión son típicamente oscilaciones violentas de presión en una cámara de combustión. Estas oscilaciones de presión pueden ser tan altas como 180 dB, y la exposición a largo plazo a estas cargas térmicas y de presión cíclicas reduce la vida de los componentes del motor. En cohetes, como el F1 utilizado en el programa Saturno V, las inestabilidades provocaron daños masivos a la cámara de combustión y los componentes circundantes. Este problema se resolvió rediseñando el inyector de combustible. En los motores a reacción de líquido, el tamaño y la distribución de las gotas se pueden utilizar para atenuar las inestabilidades. Las inestabilidades de la combustión son una preocupación importante en los motores de turbina de gas terrestres debido a las emisiones de NOx . La tendencia es hacer funcionar la combustión pobre, una relación de equivalencia menor que 1, para reducir la temperatura de combustión y, por lo tanto, reducir las emisiones de NOx ; sin embargo, hacer funcionar la combustión pobre la hace muy susceptible a la inestabilidad de la combustión.
El criterio de Rayleigh es la base para el análisis de la inestabilidad de la combustión termoacústica y se evalúa utilizando el índice de Rayleigh durante un ciclo de inestabilidad [52].
donde q' es la perturbación de la tasa de liberación de calor y p' es la fluctuación de presión. [53] [54] Cuando las oscilaciones de liberación de calor están en fase con las oscilaciones de presión, el índice de Rayleigh es positivo y se maximiza la magnitud de la inestabilidad termoacústica. Por otro lado, si el índice de Rayleigh es negativo, entonces se produce amortiguamiento termoacústico. El criterio de Rayleigh implica que la inestabilidad termoacústica se puede controlar de forma óptima teniendo oscilaciones de liberación de calor 180 grados fuera de fase con las oscilaciones de presión a la misma frecuencia. [55] [56] Esto minimiza el índice de Rayleigh.