La placa dental es una biopelícula de microorganismos (principalmente bacterias , pero también hongos ) que crece en las superficies dentro de la boca . Al principio es un depósito pegajoso e incoloro, pero cuando forma sarro , a menudo es marrón o amarillo pálido. Se encuentra comúnmente entre los dientes, en la parte frontal de los dientes, detrás de los dientes, en las superficies de masticación, a lo largo de la línea de las encías (supragingival) o debajo de los márgenes cervicales de la línea de las encías (subgingival). [1] La placa dental también se conoce como placa microbiana, biopelícula oral, biopelícula dental, biopelícula de placa dental o biopelícula de placa bacteriana. La placa bacteriana es una de las principales causas de caries dental y enfermedad de las encías. [1]
La progresión y acumulación de placa dental puede dar lugar a caries dentales (la destrucción localizada de los tejidos del diente por el ácido producido a partir de la degradación bacteriana del azúcar fermentable ) y problemas periodontales como gingivitis y periodontitis ; [2] por lo tanto, es importante romper la masa de bacterias y eliminarla. [3] El control y la eliminación de la placa se pueden lograr con un cepillado de dientes correcto diario o dos veces al día y el uso de ayudas interdentales como hilo dental y cepillos interdentales . [1]
La higiene bucal es importante, ya que las biopelículas dentales pueden acidificarse y provocar la desmineralización de los dientes (también conocida como caries dental ) o endurecerse y convertirse en cálculo dental (también conocido como sarro). [4] El cálculo no se puede eliminar mediante el cepillado de dientes o con dispositivos interdentales, sino solo mediante una limpieza profesional. [2]
La placa dental es una biopelícula que se adhiere a las superficies de los dientes, restauraciones y aparatos protésicos (incluidas las dentaduras postizas y los puentes ) si no se toca. Comprender la formación, la composición y las características de la placa ayuda a controlarla. [5] Una película adquirida es una capa de saliva que se compone principalmente de glicoproteínas y se forma poco después de la limpieza de los dientes o la exposición de dientes nuevos. [6] Las bacterias luego se adhieren a la capa de película, forman microcolonias y maduran en el diente, lo que puede provocar enfermedades bucales. La siguiente tabla proporciona una explicación más detallada (en seis pasos) de la formación de biopelículas:
En la boca normalmente están presentes distintos tipos de bacterias. Estas bacterias, así como los leucocitos , los neutrófilos , los macrófagos y los linfocitos , forman parte de la cavidad bucal normal y contribuyen a la salud del individuo. [1] Aproximadamente entre el 80 y el 90 % del peso de la placa es agua. Mientras que el 70 % del peso seco son bacterias, el 30 % restante está formado por polisacáridos y glicoproteínas. [7]
La mayor parte de los microorganismos que forman la biopelícula son Streptococcus mutans y otros anaerobios , aunque la composición precisa varía según la ubicación en la boca. Ejemplos de tales anaerobios incluyen fusobacterium y actinobacteria . [1] S. mutans y otros anaerobios son los colonizadores iniciales de la superficie del diente y juegan un papel importante en el establecimiento de la comunidad temprana de la biopelícula. [8] Streptococcus mutans utiliza la enzima glucansacarasa para convertir la sacarosa en un polisacárido pegajoso, extracelular, basado en dextrano que permite que las bacterias se cohesionen, formando placa. (La sacarosa es el único azúcar que las bacterias pueden usar para formar este polisacárido pegajoso). [9] Todos estos microorganismos ocurren naturalmente en la cavidad oral y normalmente son inofensivos. Sin embargo, no eliminar la placa mediante el cepillado regular de los dientes permite que proliferen sin control y, por lo tanto, se acumulen en una capa gruesa, que puede, en virtud de su metabolismo ordinario, causar cualquiera de varias enfermedades dentales para el huésped. Los microorganismos más cercanos a la superficie del diente generalmente obtienen energía fermentando la sacarosa de la dieta; durante la fermentación comienzan a producir ácidos.
La posición de equilibrio bacteriano varía en las distintas etapas de formación. A continuación se presenta un resumen de las bacterias que pueden estar presentes durante las fases de maduración de la placa:
La placa dental se considera una biopelícula adherida a la superficie del diente. Se trata de una comunidad microbiana formada meticulosamente, que se organiza según una estructura y función particulares. [11] La placa es rica en especies, dado que se han reconocido alrededor de 1000 especies bacterianas diferentes mediante técnicas modernas. [12]
Una superficie dental limpia queda inmediatamente colonizada por películas salivales que actúan como adhesivo. Esto permite que las primeras bacterias (colonizadores tempranos) se adhieran al diente, para luego colonizarlo y crecer. Después de un cierto crecimiento de los colonizadores tempranos, la biopelícula se vuelve más adaptable a otras especies de bacterias, conocidas como colonizadores tardíos. [12]
Fuente: [12]
Fuente: [12]
Fusobacterium nucleatum se encuentra entre los colonizadores tempranos y tardíos, uniéndolos entre sí.
Algunos componentes salivales son cruciales para el ecosistema de las placas, como la alfa-amilasa salival, que desempeña un papel en la unión y la adhesión. [13] Las proteínas ricas en prolina (PRP) y las estaterinas también participan en la formación de la placa. [12]
La biopelícula supragingival es la placa dental que se forma sobre las encías y es el primer tipo de placa que se forma después del cepillado de los dientes. Se forma comúnmente entre los dientes, en las fosas y surcos de los dientes y a lo largo de las encías. Está formada principalmente por bacterias aeróbicas, lo que significa que estas bacterias necesitan oxígeno para sobrevivir. Si la placa permanece en el diente durante un período de tiempo más largo, las bacterias anaeróbicas comienzan a crecer en esta placa. [5]

La biopelícula subgingival es la placa que se encuentra debajo de las encías. Se produce después de la formación de la biopelícula supragingival por un crecimiento descendente de las bacterias desde arriba de las encías hacia abajo. Esta placa está formada principalmente por bacterias anaeróbicas, lo que significa que estas bacterias solo sobrevivirán si no hay oxígeno. Como esta placa se adhiere en una bolsa debajo de las encías, no está expuesta al oxígeno en la boca y, por lo tanto, prosperará si no se elimina. [10]
La matriz extracelular contiene proteínas, polisacáridos de cadena larga y lípidos.
Las razones más comunes de alteración de los ecosistemas son los factores ecológicos que se analizan en la sección sobre el medio ambiente. Las bacterias que muestran la plasticidad más adecuada para el cambio en el medio ambiente dominan el entorno en cuestión. A menudo, esto conduce a patógenos oportunistas que pueden causar caries dentales y enfermedad periodontal . Las bacterias patógenas que tienen el potencial de causar caries dentales prosperan en entornos ácidos; las que tienen el potencial de causar enfermedad periodontal prosperan en un entorno ligeramente alcalino. [14] [ verificación fallida ]
Los anticuerpos contra los patógenos orales Campylobacter rectus , Veillonella parvula y Prevotella melaninogenica se asociaron con hipertensión . [15]
A diferencia de otras partes del cuerpo, las superficies de los dientes son excepcionalmente duras y no se desprenden. Por lo tanto, el ambiente cálido y húmedo de la boca y la presencia de dientes crean un buen entorno para el crecimiento y desarrollo de la placa dental. [12] Los principales factores ecológicos que contribuyen a la formación de placa son el pH , la saliva , la temperatura y las reacciones redox . [16] [17] El rango de pH normal de la saliva está entre 6 y 7 y se sabe que la biopelícula de placa florece en un pH entre 6,7 y 8,3. [18] [19] Esto indica que el entorno natural de la boca proporcionado por la saliva es ideal para el crecimiento de bacterias en la placa dental. La saliva actúa como un amortiguador , lo que ayuda a mantener el pH en la boca entre 6 y 7. [16] Además de actuar como amortiguador, la saliva y el líquido crevicular gingival contienen nutrientes primarios que incluyen aminoácidos, proteínas y glicoproteínas. Esto alimenta a las bacterias involucradas en la formación de placa. La dieta del huésped juega solo un papel menor en el suministro de nutrientes para la microflora residente. [20] La temperatura normal de la boca oscila entre 35 y 36 °C, y se ha demostrado que un cambio de dos grados (°C) modifica drásticamente las especies dominantes en la placa. [17] Las reacciones redox las llevan a cabo bacterias aeróbicas . Esto mantiene los niveles de oxígeno en la boca en una condición homeostática semiestable, que permite que las bacterias sobrevivan. [17]

La gingivitis es una lesión inflamatoria, mediada por interacciones huésped-parásito que permanece localizada en el tejido gingival, es un resultado común de la acumulación de placa alrededor de los tejidos gingivales . Las bacterias que se encuentran en la biopelícula provocan una respuesta del huésped que resulta en una inflamación localizada del tejido. [21] Esto se caracteriza por los signos cardinales de inflamación que incluyen un aspecto rojo e hinchado de las encías y sangrado debido al cepillado o uso de hilo dental. [22] La gingivitis debido a la placa puede ser reversible mediante la eliminación de la placa. Sin embargo, si se deja durante un período prolongado de tiempo, la inflamación puede comenzar a afectar los tejidos de soporte, en una progresión conocida como periodontitis . [23] : 96–97 La respuesta de la gingivitis es un mecanismo de protección, que evita la periodontitis en muchos casos.

La periodontitis es una infección de las encías que provoca la destrucción del hueso alrededor de los dientes en la mandíbula. La periodontitis se produce después de que se haya establecido la gingivitis, pero no todas las personas que tienen gingivitis padecerán periodontitis. [23] : 111 [24] La acumulación de placa es vital en la progresión de la periodontitis, ya que las bacterias de la placa liberan enzimas que atacan el hueso y provocan su descomposición, y al mismo tiempo los osteoclastos del hueso descomponen el hueso como una forma de prevenir una mayor infección. Esto se puede tratar con una estricta higiene bucal, como el cepillado y la limpieza de los espacios entre los dientes, así como un desbridamiento quirúrgico realizado por un profesional dental. [25]
Las bacterias acumuladas, debido a la aparición de periodontitis a partir de la placa dental, pueden acceder a sitios distantes en el cuerpo a través del sistema circulatorio y respiratorio, lo que podría contribuir a varias enfermedades y afecciones sistémicas. Debido a la naturaleza infecciosa de las bacterias alojadas dentro de la cavidad oral, las bacterias producidas por la cavidad pueden propagarse dentro del sistema del cuerpo humano y causar condiciones adversas para la salud. [26] El acceso de las bacterias proviene del epitelio ulcerado de la bolsa periodontal que resulta de la acumulación de infección dentro de la encía . Las afecciones y enfermedades pueden incluir:

La caries dental es una enfermedad infecciosa causada principalmente por Streptococcus mutans , caracterizada por la desmineralización ácida del esmalte, que puede progresar a una mayor degradación del tejido dental interno más orgánico ( dentina ). [1] La comunidad bacteriana estaría compuesta principalmente por especies acidogénicas y tolerantes al ácido (por ejemplo, estreptococos mutans y lactobacilos ), mientras que otras especies con características relevantes también pueden estar involucradas. [31] Todo el mundo es susceptible a las caries, pero la probabilidad de desarrollo depende de los indicadores de la enfermedad individual del paciente, los factores de riesgo y los factores preventivos. Los factores que se consideran de alto riesgo para desarrollar lesiones cariosas en los dientes incluyen:
Los ácidos orgánicos liberados por la placa dental provocan la desmineralización de la superficie dental adyacente y, en consecuencia, la aparición de caries dentales. La saliva tampoco puede penetrar en la acumulación de placa y, por lo tanto, no puede actuar para neutralizar el ácido producido por las bacterias y remineralizar la superficie del diente.
Existen dos métodos principales para detectar la placa dental en la cavidad oral: mediante la aplicación de un gel o tableta reveladora y/o visualmente mediante la observación. La detección de placa suele realizarse clínicamente mediante agentes reveladores de placa . Los agentes reveladores contienen un tinte que se vuelve rojo brillante para indicar la acumulación de placa. [1]
Es importante que cada persona sepa qué buscar al realizar una autoevaluación de la placa dental. Es importante saber que todos tenemos placa dental, sin embargo, la gravedad de la acumulación y las consecuencias de no eliminar la placa pueden variar. [1]

Los productos reveladores de placa, también conocidos como reveladores, hacen que la placa sea clínicamente visible. Las superficies limpias de los dientes no absorben el revelador, solo las superficies ásperas. Los geles reveladores de placa se pueden preparar en casa o en la clínica dental. Antes de usarlos en casa o en la clínica dental, consulte con su médico de cabecera sobre cualquier alergia al yodo, colorante de alimentos o cualquier otro ingrediente que pueda estar presente en estos productos. Estos geles proporcionan una ayuda visual para evaluar la presencia de biopelícula de placa y también pueden mostrar la madurez de la placa dental.
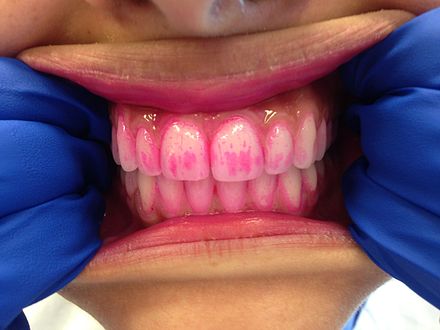
Las pastillas reveladoras son similares a los geles reveladores, excepto que se colocan en la boca y se mastican durante aproximadamente un minuto. Luego se escupe el resto de la pastilla o la saliva. Los geles reveladores mostrarán la presencia de la placa, pero a menudo no mostrarán el nivel de madurez de la placa. Las pastillas reveladoras a menudo se recetan o se dan a pacientes con aparatos de ortodoncia para usar antes y después del cepillado de dientes para garantizar una limpieza óptima. También son herramientas educativas útiles para niños pequeños o pacientes que tienen dificultades para eliminar la placa dental en ciertas áreas. Los geles y pastillas reveladores son útiles para personas de todas las edades para garantizar una eliminación eficaz de la placa dental.
La biopelícula dental comienza a formarse en el diente solo minutos después del cepillado. Puede ser difícil ver la placa dental en las superficies de los tejidos duros, sin embargo, se puede sentir como una superficie áspera. A menudo se siente como un depósito espeso, similar a la piel, que puede presentarse como una mancha amarilla, marrón o canela. Estos depósitos se encuentran comúnmente en los dientes o en los aparatos dentales, como los brackets de ortodoncia. La forma más común de evaluar la placa dental es a través de una evaluación dental en la clínica dental, donde los instrumentos dentales pueden raspar un poco de placa. Las áreas más comunes donde los pacientes encuentran placa son entre los dientes y a lo largo de los márgenes cervicales .
El enjuague bucal ha sido un método de uso común para controlar la acumulación de placa dental. Muchos estudios han respaldado el hecho de que el enjuague bucal que contiene alcohol podría no ser la mejor opción. Los enjuagues bucales que contienen alcohol no son sustancialmente más efectivos que los enjuagues bucales sin alcohol, y hay cierta evidencia que sugiere que los enjuagues bucales que contienen alcohol aumentan la probabilidad de cánceres bucales. [32] La ausencia de alcohol en el enjuague bucal ha impulsado a muchas marcas de enjuague bucal a desarrollar nuevos enjuagues bucales con aceites esenciales .
En 2018, se realizó un estudio sobre la eficacia de los enjuagues bucales con aceites esenciales disponibles comercialmente. Se utilizó un placebo y un control negativo, siendo el control negativo un enjuague bucal sin aceites esenciales. Se indujo gingivitis experimental a tres grupos de voluntarios sanos, que utilizaron sus respectivos enjuagues bucales y fueron monitoreados durante tres semanas. Los resultados mostraron que el enjuague bucal comercial con aceites esenciales tuvo un desempeño significativamente mejor en las puntuaciones de placa. Los resultados mostraron que las puntuaciones de placa para el enjuague bucal con aceites esenciales no fueron lo suficientemente bajas como para prevenir la gingivitis. Los investigadores concluyeron que el beneficio del enjuague bucal con aceites esenciales es cuestionable y requiere más investigación. [33]
Una investigación realizada por el Instituto Nacional de Salud de EE. UU. en 2022 estudió las propiedades y los efectos antimicrobianos de un enjuague bucal con aceite esencial de limoncillo. [34] Descubrieron que el limoncillo era un material natural a base de hierbas que era un buen sustituto del alcohol en los enjuagues bucales. La estabilidad del limoncillo le permite tener propiedades antimicrobianas contra los organismos que causan la placa. Una disminución en la formación de placa reduce las probabilidades de que se produzca gingivitis.
Un estudio realizado en 2022, con una muestra de 209 participantes, estudió el efecto de utilizar un enjuague bucal que contenía una mezcla de cuatro aceites esenciales frente a solo cepillarse los dientes y usar hilo dental. Demostró que después de 12 semanas, quienes se enjuagaron con el enjuague bucal de aceite esencial redujeron significativamente la placa y mejoraron su gingivitis en comparación con los grupos que solo se cepillaron los dientes y usaron hilo dental. [35]
En un metaanálisis realizado en 2021 se analizó la eficacia de varios enjuagues bucales y sus ingredientes activos sobre la placa. Se utilizó la base de datos de la Asociación Dental Americana para recopilar los estudios. Se seleccionaron un total de 22 artículos para la revisión general. Cuatro de los artículos seleccionados, todos metaanálisis, demostraron que los aceites esenciales tenían una actividad antiplaca sustancial. Los investigadores concluyeron que los aceites esenciales y la clorhexidina son los dos ingredientes más útiles para tener una buena salud bucal. [36]
Un estudio en el que participaron 20 personas descubrió que el enjuague bucal que contenía extracto de corteza de Magnolia grandiflora funcionó significativamente mejor que el placebo para reducir la prevalencia de Streptococcus mutans . [37]
La placa dental es extremadamente común en animales domésticos como perros y gatos. Sin embargo, las bacterias asociadas con la placa canina y felina parecen ser diferentes a las de los humanos. [38] [39] Consiste en causar inflamación periodontal y desencadena el sistema inmunológico del animal. Dos distinciones comunes que se derivan de la periodontitis son la gingivitis, que es la inflamación, y la periodontitis, que implica las reacciones de la gingivitis que causan una enfermedad grave de las encías, como la periodontitis, y que en última instancia puede causar la pérdida del diente. Los animales afectados por periodontitis sufren irritación. Además, se ha demostrado que esta enfermedad, al centrarse en las encías, puede afectar a los órganos cercanos. [40]
La enfermedad periodontal se relaciona más con la edad y el peso en que se encuentran los animales. Cuanto más mayores y pesados sean, más probabilidades habrá de que contraigan la enfermedad. Un estudio de 9 perros hembras y 5 perros machos de diferentes razas y edades de entre 1 y 14 años destaca la relación de la periodontitis con la edad y no con la raza o el sexo. En total, se detectó la enfermedad en el 50% de ellos. [41]
Los antibióticos que se utilizan habitualmente en animales son antimicrobianos que van desde la clindamicina, amoxicilina-clavulánico y amoxicilina. Estos antimicrobianos se utilizan habitualmente en procedimientos dentales para animales en los Estados Unidos. Se realizó un estudio con un total de 818.150 perros y gatos que dio como resultado la evidente promoción de los antimicrobianos en la retención de periodontitis. Se han realizado otros estudios que establecen que los restos de comida no son un factor preocupante en cuanto a la causa de la placa dental. En un estudio de 4 años, un perro Beagle fue sometido a una dieta estricta sin ninguna higiene bucal, lo que provocó la acumulación de gingivitis en tan solo unas pocas semanas. Sin embargo, algunos perros fueron sometidos a una dieta similar con precauciones de higiene de cepillado diario de los dientes y no mostraron signos de gingivitis. [42]
Los dueños de mascotas tienen diferentes puntos de vista sobre las causas de los problemas dentales en sus mascotas. Algunos creen que los alimentos secos o humedecidos afectan negativamente la salud dental, mientras que otros creen que los huesos con tuétano pueden provocar fracturas y molestias o fortalecer la salud bucal.
Las diferencias entre razas también son un hecho habitual en el que los propietarios no están de acuerdo. Muchos creen que ciertas razas son más propensas a sufrir problemas de salud que otras, mientras que la periodontitis se considera un factor menor. Algunos propietarios expresan sentimientos como "mi perro tiene buenos dientes para su edad", lo que respalda la idea de que, a medida que los animales envejecen, sus características dentales empeoran, junto con su peso. [43]
Es importante cuidar a las mascotas no solo manteniéndolas limpias y proporcionándoles alimentos saludables, sino también manteniendo la higiene bucal para evitar molestias y enfermedades. Por ello, los veterinarios suelen recomendar productos para el cuidado bucal de las mascotas afectadas.