La noradrenalina ( NE ), también llamada noradrenalina ( NA ) o noradrenalina , es una sustancia química orgánica de la familia de las catecolaminas que funciona en el cerebro y el cuerpo como hormona , neurotransmisor y neuromodulador . El nombre "noradrenalina" (del latín ad , "cerca", y ren , "riñón") se usa más comúnmente en el Reino Unido, mientras que "noradrenalina" (del griego antiguo ἐπῐ́ ( epí ), "sobre", y νεφρός ( nephrós ), "riñón") suele preferirse en los Estados Unidos. [2] "Noradrenalina" es también el nombre no propietario internacional que se le da al fármaco . [3] Independientemente del nombre que se use para la sustancia en sí, las partes del cuerpo que la producen o se ven afectadas por ella se denominan noradrenérgicas .
La función general de la noradrenalina es movilizar el cerebro y el cuerpo para la acción. La liberación de noradrenalina es más baja durante el sueño, aumenta durante la vigilia y alcanza niveles mucho más altos durante situaciones de estrés o peligro, en la llamada respuesta de lucha o huida . En el cerebro, la noradrenalina aumenta la excitación y el estado de alerta, promueve la vigilancia, mejora la formación y recuperación de la memoria y centra la atención; también aumenta la inquietud y la ansiedad. En el resto del cuerpo, la noradrenalina aumenta la frecuencia cardíaca y la presión arterial , desencadena la liberación de glucosa de las reservas de energía, aumenta el flujo sanguíneo al músculo esquelético , reduce el flujo sanguíneo al sistema gastrointestinal e inhibe el vaciado de la vejiga y la motilidad gastrointestinal .
En el cerebro, la noradrenalina se produce en núcleos pequeños pero que ejercen efectos potentes sobre otras áreas cerebrales. El más importante de estos núcleos es el locus coeruleus , ubicado en la protuberancia . Fuera del cerebro, la noradrenalina es utilizada como neurotransmisor por los ganglios simpáticos ubicados cerca de la médula espinal o en el abdomen , así como por las células de Merkel ubicadas en la piel. También se libera directamente al torrente sanguíneo por las glándulas suprarrenales . Independientemente de cómo y dónde se libere, la noradrenalina actúa sobre las células diana uniéndose a los receptores adrenérgicos ubicados en la superficie celular y activándolos.
Una variedad de medicamentos de importancia médica actúan alterando las acciones de los sistemas de noradrenalina. La noradrenalina en sí se usa ampliamente como un medicamento inyectable para el tratamiento de la presión arterial críticamente baja. Los estimulantes a menudo aumentan, potencian o actúan como agonistas de la noradrenalina. Medicamentos como la cocaína y el metilfenidato actúan como inhibidores de la recaptación de noradrenalina, al igual que algunos antidepresivos, como los de la clase de los IRSN . Uno de los medicamentos más notables de la clase de estimulantes es la anfetamina , que actúa como un análogo de la dopamina y la noradrenalina, inhibidor de la recaptación, así como un agente que aumenta la cantidad de señalización global de catecolaminas en todo el sistema nervioso al revertir los transportadores en las sinapsis. Los betabloqueantes , que contrarrestan algunos de los efectos de la noradrenalina al bloquear sus receptores, se utilizan con frecuencia para tratar el glaucoma , la migraña y una variedad de problemas cardiovasculares. Los alfabloqueantes , que contrarrestan un conjunto diferente de efectos de la noradrenalina, se utilizan para tratar varias enfermedades cardiovasculares y psiquiátricas. Los agonistas alfa-2 suelen tener un efecto sedante y se utilizan habitualmente como potenciadores de la anestesia en cirugías, así como en el tratamiento de la dependencia de drogas o alcohol . Por razones que aún no están claras, algunos fármacos alfa-2, como la guanfacina , también han demostrado ser eficaces en el tratamiento de los trastornos de ansiedad y el TDAH . Muchos fármacos psiquiátricos importantes ejercen fuertes efectos sobre los sistemas de noradrenalina en el cerebro, lo que da como resultado efectos que pueden ser beneficiosos o perjudiciales.
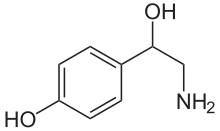
La noradrenalina es una catecolamina y una fenetilamina . [4] Su estructura difiere de la de la epinefrina solo en que la epinefrina tiene un grupo metilo unido a su nitrógeno, mientras que el grupo metilo está reemplazado por un átomo de hidrógeno en la noradrenalina. [4] El prefijo nor- se deriva como una abreviatura de la palabra "normal", utilizada para indicar un compuesto desmetilado . [5] La noradrenalina consta de una fracción de catecol (un anillo de benceno con dos grupos hidroxilo adyacentes en la posición meta - para ) y una cadena lateral de etilamina que consiste en un grupo hidroxilo unido en la posición bencílica. [6] [7]
La noradrenalina se sintetiza a partir del aminoácido tirosina mediante una serie de pasos enzimáticos en la médula suprarrenal y las neuronas posganglionares del sistema nervioso simpático . Mientras que la conversión de tirosina en dopamina ocurre predominantemente en el citoplasma, la conversión de dopamina en noradrenalina por la dopamina β-monooxigenasa ocurre predominantemente dentro de las vesículas de neurotransmisores . [11] La vía metabólica es:
Por lo tanto, el precursor directo de la noradrenalina es la dopamina , que se sintetiza indirectamente a partir del aminoácido esencial fenilalanina o del aminoácido no esencial tirosina . [11] Estos aminoácidos se encuentran en casi todas las proteínas y, como tales, se proporcionan mediante la ingestión de alimentos que contienen proteínas, siendo la tirosina la más común.
La fenilalanina se convierte en tirosina por la enzima fenilalanina hidroxilasa , con oxígeno molecular (O 2 ) y tetrahidrobiopterina como cofactores . La tirosina se convierte en L -DOPA por la enzima tirosina hidroxilasa , con tetrahidrobiopterina , O 2 y probablemente hierro ferroso (Fe 2+ ) como cofactores. [11] La conversión de tirosina a L -DOPA es inhibida por la metirosina , un análogo de la tirosina. La L -DOPA se convierte en dopamina por la enzima L -aminoácido aromático descarboxilasa (también conocida como DOPA descarboxilasa), con fosfato de piridoxal como cofactor. [11] La dopamina se convierte luego en noradrenalina por la enzima dopamina β-monooxigenasa (antes conocida como dopamina β-hidroxilasa ), con O 2 y ácido ascórbico como cofactores. [11]
La noradrenalina en sí puede convertirse además en epinefrina por acción de la enzima feniletanolamina N -metiltransferasa con S -adenosil- L -metionina como cofactor. [11]
En los mamíferos, la noradrenalina se degrada rápidamente en varios metabolitos . El paso inicial de la degradación puede ser catalizado por cualquiera de las enzimas monoaminooxidasa (principalmente monoaminooxidasa A ) o COMT . [12] A partir de ahí, la degradación puede proceder por una variedad de vías. Los principales productos finales son el ácido vanililmandélico o una forma conjugada de MHPG , ambos se cree que son biológicamente inactivos y se excretan en la orina. [13]

Al igual que muchas otras sustancias biológicamente activas, la noradrenalina ejerce sus efectos uniéndose a los receptores ubicados en la superficie de las células y activándolos. Se han identificado dos amplias familias de receptores de noradrenalina, conocidos como receptores adrenérgicos alfa y beta. [13] Los receptores alfa se dividen en los subtipos α 1 y α 2 ; los receptores beta en los subtipos β 1 , β 2 y β 3 . [13] Todos ellos funcionan como receptores acoplados a la proteína G , lo que significa que ejercen sus efectos a través de un complejo sistema de segundos mensajeros . [13] Los receptores alfa-2 suelen tener efectos inhibidores, pero muchos se encuentran presinápticamente (es decir, en la superficie de las células que liberan noradrenalina), por lo que el efecto neto de la activación de alfa-2 es a menudo una disminución de la cantidad de noradrenalina liberada. [13] Los receptores alfa-1 y los tres tipos de receptores beta suelen tener efectos excitatorios. [13]

Dentro del cerebro, la noradrenalina funciona como neurotransmisor y neuromodulador , y está controlada por un conjunto de mecanismos comunes a todos los neurotransmisores monoamínicos . [14] Después de la síntesis, la noradrenalina es transportada desde el citosol a las vesículas sinápticas por el transportador de monoamina vesicular (VMAT). [15] El VMAT puede ser inhibido por la reserpina causando una disminución en las reservas de neurotransmisores. La noradrenalina se almacena en estas vesículas hasta que es expulsada a la hendidura sináptica , típicamente después de que un potencial de acción hace que las vesículas liberen su contenido directamente en la hendidura sináptica a través de un proceso llamado exocitosis . [13]
Una vez en la sinapsis, la noradrenalina se une a los receptores y los activa. Después de un potencial de acción, las moléculas de noradrenalina se liberan rápidamente de sus receptores y luego son absorbidas nuevamente en la célula presináptica, a través de una recaptación mediada principalmente por el transportador de noradrenalina (NET). [16] Una vez que regresa al citosol, la noradrenalina puede ser degradada por la monoaminooxidasa o reempaquetada en vesículas por el VMAT, lo que la hace disponible para su liberación futura. [15]

La noradrenalina es el principal neurotransmisor utilizado por el sistema nervioso simpático, que consta de alrededor de dos docenas de ganglios de la cadena simpática ubicados junto a la médula espinal, más un conjunto de ganglios prevertebrales ubicados en el tórax y el abdomen. [17] Estos ganglios simpáticos están conectados a numerosos órganos, incluidos los ojos, las glándulas salivales, el corazón, los pulmones, el hígado, la vesícula biliar, el estómago, los intestinos, los riñones, la vejiga urinaria, los órganos reproductores, los músculos, la piel y las glándulas suprarrenales. [17] La activación simpática de las glándulas suprarrenales hace que la parte llamada médula suprarrenal libere noradrenalina (así como epinefrina) en el torrente sanguíneo, desde donde, funcionando como una hormona , obtiene mayor acceso a una amplia variedad de tejidos. [17]
En términos generales, el efecto de la noradrenalina en cada órgano diana es modificar su estado de manera que sea más propicio para el movimiento corporal activo, a menudo a costa de un mayor uso de energía y un mayor desgaste. [18] Esto puede contrastarse con los efectos mediados por la acetilcolina del sistema nervioso parasimpático , que modifica la mayoría de los mismos órganos a un estado más propicio para el descanso, la recuperación y la digestión de los alimentos, y generalmente menos costoso en términos de gasto energético. [18]
Los efectos simpáticos de la noradrenalina incluyen:
La noradrenalina y el ATP son cotransmisores simpáticos . Se ha descubierto que el endocannabinoide anandamida y el cannabinoide WIN 55,212-2 pueden modificar la respuesta global a la estimulación del nervio simpático, lo que indica que los receptores CB1 presinápticos median la acción simpaticoinhibitoria . Por lo tanto, los cannabinoides pueden inhibir tanto los componentes noradrenérgicos como los purinérgicos de la neurotransmisión simpática . [26]

Las neuronas noradrenérgicas del cerebro forman un sistema de neurotransmisores que, cuando se activan, ejercen efectos en grandes áreas del cerebro. Los efectos se manifiestan en estado de alerta, excitación y disposición para la acción.
Las neuronas noradrenérgicas (es decir, neuronas cuyo neurotransmisor primario es la noradrenalina) son comparativamente pocas en número, y sus cuerpos celulares están confinados a unas pocas áreas cerebrales relativamente pequeñas, pero envían proyecciones a muchas otras áreas cerebrales y ejercen efectos poderosos sobre sus objetivos. Estos grupos de células noradrenérgicas fueron mapeados por primera vez en 1964 por Annica Dahlström y Kjell Fuxe, quienes les asignaron etiquetas comenzando con la letra "A" (por "aminérgico"). [27] En su esquema, las áreas A1 a A7 contienen el neurotransmisor noradrenalina (A8 a A14 contienen dopamina ). El grupo de células noradrenérgicas A1 está ubicado en la parte ventrolateral caudal del bulbo raquídeo y desempeña un papel en el control del metabolismo de los fluidos corporales. [28] El grupo de células noradrenérgicas A2 está ubicado en un área del tronco encefálico llamada núcleo solitario ; Estas células han sido implicadas en una variedad de respuestas, incluido el control de la ingesta de alimentos y las respuestas al estrés. [29] Los grupos de células A5 y A7 se proyectan principalmente a la médula espinal. [30]
La fuente más importante de noradrenalina en el cerebro es el locus coeruleus , que contiene el grupo de células noradrenérgicas A6 y está adyacente al grupo de células A4 . El locus coeruleus es bastante pequeño en términos absolutos (se estima que en los primates contiene alrededor de 15.000 neuronas, menos de una millonésima parte de las neuronas del cerebro), pero envía proyecciones a todas las partes principales del cerebro y también a la médula espinal. [31]
El nivel de actividad del locus coeruleus se correlaciona ampliamente con la vigilancia y la velocidad de reacción. La actividad del locus coeruleus es baja durante el sueño y desciende a prácticamente nada durante el estado REM (sueño). [32] Se mantiene en un nivel basal durante la vigilia, pero aumenta temporalmente cuando una persona se enfrenta a cualquier tipo de estímulo que llame su atención. Los estímulos desagradables como el dolor, la dificultad para respirar, la distensión de la vejiga, el calor o el frío generan aumentos mayores. Los estados extremadamente desagradables como el miedo intenso o el dolor intenso se asocian con niveles muy altos de actividad del locus coeruleus. [31]
La noradrenalina liberada por el locus coeruleus afecta la función cerebral de diversas maneras. Mejora el procesamiento de las señales sensoriales, mejora la atención, mejora la formación y recuperación de la memoria de trabajo y de largo plazo, y mejora la capacidad del cerebro para responder a las señales modificando el patrón de actividad en la corteza prefrontal y otras áreas. [33] El control del nivel de excitación es lo suficientemente fuerte como para que la supresión inducida por fármacos del locus coeruleus tenga un potente efecto sedante. [32]
Existe una gran similitud entre las situaciones que activan el locus coeruleus en el cerebro y las situaciones que activan el sistema nervioso simpático en la periferia: el locus coeruleus moviliza esencialmente el cerebro para la acción, mientras que el sistema simpático moviliza el cuerpo. Se ha argumentado que esta similitud surge porque ambos están controlados en gran medida por las mismas estructuras cerebrales, en particular una parte del tronco encefálico llamada núcleo gigantocelular . [31]
La noradrenalina también es producida por las células de Merkel , que forman parte del sistema somatosensorial, y activa la neurona sensorial aferente. [34]
Un gran número de fármacos importantes ejercen sus efectos al interactuar con los sistemas de noradrenalina en el cerebro o el cuerpo. Sus usos incluyen el tratamiento de problemas cardiovasculares, shock y una variedad de afecciones psiquiátricas. Estos fármacos se dividen en: fármacos simpaticomiméticos que imitan o mejoran al menos algunos de los efectos de la noradrenalina liberada por el sistema nervioso simpático; fármacos simpaticolíticos , por el contrario, bloquean al menos algunos de los efectos. [35] Ambos son grandes grupos con diversos usos, dependiendo de exactamente qué efectos se potencian o bloquean. [35]
La noradrenalina en sí misma se clasifica como un fármaco simpaticomimético: sus efectos cuando se administra por inyección intravenosa de aumento de la frecuencia y la fuerza cardíacas y constricción de los vasos sanguíneos la hacen muy útil para tratar emergencias médicas que involucran presión arterial críticamente baja. [35] La Campaña Surviving Sepsis recomendó la noradrenalina como agente de primera línea en el tratamiento del choque séptico que no responde a la reanimación con líquidos , complementada con vasopresina y epinefrina . El uso de dopamina está restringido solo a pacientes altamente seleccionados. [36]
Estos son fármacos simpaticolíticos que bloquean los efectos de los receptores beta adrenérgicos mientras que tienen poco o ningún efecto sobre los receptores alfa. A veces se utilizan para tratar la hipertensión arterial , la fibrilación auricular y la insuficiencia cardíaca congestiva , pero revisiones recientes han concluido que otros tipos de fármacos suelen ser superiores para esos fines. [37] [38] Sin embargo, los betabloqueantes pueden ser una opción viable para otras afecciones cardiovasculares, incluida la angina de pecho y el síndrome de Marfan . [39] También se utilizan ampliamente para tratar el glaucoma , más comúnmente en forma de gotas para los ojos. [40] Debido a sus efectos en la reducción de los síntomas de ansiedad y el temblor, a veces los han utilizado artistas, oradores públicos y atletas para reducir la ansiedad por el rendimiento , aunque no están aprobados médicamente para ese propósito y están prohibidos por el Comité Olímpico Internacional . [41] [42]
Sin embargo, la utilidad de los betabloqueantes está limitada por una serie de efectos secundarios graves, entre ellos, disminución de la frecuencia cardíaca, caída de la presión arterial, asma e hipoglucemia reactiva . [40] Los efectos negativos pueden ser particularmente graves en personas con diabetes . [37]
Se trata de fármacos simpaticolíticos que bloquean los efectos de los receptores alfa adrenérgicos, mientras que tienen poco o ningún efecto sobre los receptores beta. [43] Sin embargo, los fármacos que pertenecen a este grupo pueden tener efectos muy diferentes, dependiendo de si bloquean principalmente los receptores alfa-1, los receptores alfa-2 o ambos. Los receptores alfa-2, como se describe en otra parte de este artículo, se localizan con frecuencia en las propias neuronas liberadoras de noradrenalina y tienen efectos inhibidores sobre ellas; en consecuencia, el bloqueo de los receptores alfa-2 suele dar lugar a un aumento de la liberación de noradrenalina. [43] Los receptores alfa-1 suelen estar situados en las células diana y tienen efectos excitatorios sobre ellas; en consecuencia, el bloqueo de los receptores alfa-1 suele dar lugar al bloqueo de algunos de los efectos de la noradrenalina. [43] Los fármacos como la fentolamina , que actúan sobre ambos tipos de receptores, pueden producir una combinación compleja de ambos efectos. En la mayoría de los casos, cuando se utiliza el término "bloqueador alfa" sin ninguna calificación, se refiere a un antagonista alfa-1 selectivo.
Los bloqueadores alfa-1 selectivos tienen una variedad de usos. Dado que uno de sus efectos es inhibir la contracción del músculo liso de la próstata, a menudo se utilizan para tratar los síntomas de la hiperplasia prostática benigna . [44] Los bloqueadores alfa también pueden ayudar a las personas a eliminar los cálculos renales. [45] Sus efectos sobre el sistema nervioso central los hacen útiles para tratar el trastorno de ansiedad generalizada , el trastorno de pánico y el trastorno de estrés postraumático . [46] Sin embargo, pueden tener efectos secundarios importantes, incluida una caída de la presión arterial. [43]
Algunos antidepresivos funcionan en parte como bloqueadores alfa-2 selectivos , pero el fármaco más conocido de esa clase es la yohimbina , que se extrae de la corteza del árbol africano yohimbe . [47] La yohimbina actúa como un potenciador de la potencia masculina , pero su utilidad para ese propósito está limitada por graves efectos secundarios que incluyen ansiedad e insomnio. [47] Las sobredosis pueden causar un aumento peligroso de la presión arterial. [47] La yohimbina está prohibida en muchos países, pero en los Estados Unidos, debido a que se extrae de una planta en lugar de sintetizarse químicamente, se vende sin receta como un suplemento nutricional . [48]
Estos son fármacos simpaticomiméticos que activan los receptores alfa-2 o potencian sus efectos. [49] Debido a que los receptores alfa-2 son inhibidores y muchos están ubicados presinápticamente en las células liberadoras de noradrenalina, el efecto neto de estos fármacos suele ser reducir la cantidad de noradrenalina liberada. [49] Los fármacos de este grupo que son capaces de entrar en el cerebro a menudo tienen fuertes efectos sedantes, debido a sus efectos inhibidores sobre el locus coeruleus . [49] La clonidina y la guanfacina , por ejemplo, se utilizan para el tratamiento de trastornos de ansiedad e insomnio, y también como premedicación sedante para pacientes que van a someterse a una cirugía. [50] La xilacina , otro fármaco de este grupo, también es un sedante potente y a menudo se utiliza en combinación con ketamina como anestésico general para cirugía veterinaria ; en los Estados Unidos no ha sido aprobado para su uso en humanos. [51]
Se trata de fármacos cuyos efectos primarios se cree que están mediados por diferentes sistemas de neurotransmisores ( dopamina para los estimulantes , serotonina para los antidepresivos ), pero muchos también aumentan los niveles de noradrenalina en el cerebro. [52] La anfetamina , por ejemplo, es un estimulante que aumenta la liberación de noradrenalina y dopamina. [53] Los inhibidores de la monoaminooxidasa A (MAO-A) son antidepresivos que inhiben la degradación metabólica de la noradrenalina, así como de la serotonina y la dopamina. [54] En algunos casos es difícil distinguir los efectos mediados por la noradrenalina de los efectos relacionados con otros neurotransmisores. [ cita requerida ]
Una serie de problemas médicos importantes implican una disfunción del sistema de noradrenalina en el cerebro o el cuerpo.
La hiperactivación del sistema nervioso simpático no es una afección reconocida en sí misma, pero es un componente de una serie de afecciones, así como una posible consecuencia de tomar fármacos simpaticomiméticos . Provoca un conjunto distintivo de síntomas que incluyen dolores y molestias, ritmo cardíaco acelerado, presión arterial elevada, sudoración, palpitaciones, ansiedad, dolor de cabeza, palidez y una caída de la glucosa en sangre. Si la actividad simpática se eleva durante un tiempo prolongado, puede causar pérdida de peso y otros cambios corporales relacionados con el estrés.
La lista de condiciones que pueden causar hiperactivación simpática incluye lesión cerebral grave, [55] daño a la médula espinal, [56] insuficiencia cardíaca, [57] presión arterial alta, [58] enfermedad renal, [59] y varios tipos de estrés.
El feocromocitoma es un tumor de la médula suprarrenal que se presenta raramente y que puede ser causado por factores genéticos o por ciertos tipos de cáncer. La consecuencia es un aumento masivo de la cantidad de noradrenalina y epinefrina liberadas en el torrente sanguíneo. Los síntomas más evidentes son los de hiperactivación simpática, incluyendo en particular un aumento de la presión arterial que puede alcanzar niveles fatales. El tratamiento más eficaz es la extirpación quirúrgica del tumor.
El estrés , para un fisiólogo, significa cualquier situación que amenace la estabilidad continua del cuerpo y sus funciones. [60] El estrés afecta a una amplia variedad de sistemas corporales: los dos que se activan de manera más constante son el eje hipotálamo-hipofisario-adrenal y el sistema de noradrenalina, que incluye tanto el sistema nervioso simpático como el sistema centrado en el locus coeruleus en el cerebro. [60] Los estresores de muchos tipos evocan aumentos en la actividad noradrenérgica, que moviliza el cerebro y el cuerpo para enfrentar la amenaza. [60] El estrés crónico, si se continúa durante mucho tiempo, puede dañar muchas partes del cuerpo. Una parte significativa del daño se debe a los efectos de la liberación sostenida de noradrenalina, debido a la función general de la noradrenalina de dirigir los recursos lejos del mantenimiento, la regeneración y la reproducción, y hacia los sistemas que se requieren para el movimiento activo. Las consecuencias pueden incluir retraso del crecimiento (en niños), insomnio, pérdida de la libido, problemas gastrointestinales, disminución de la resistencia a las enfermedades, menor ritmo de curación de las heridas, depresión y mayor vulnerabilidad a la adicción. [60]
El trastorno por déficit de atención con hiperactividad es un trastorno del desarrollo neurológico que implica problemas de atención, hiperactividad e impulsividad. [61] Se trata más comúnmente con fármacos estimulantes como el metilfenidato (Ritalin), cuyo efecto principal es aumentar los niveles de dopamina en el cerebro, pero los fármacos de este grupo también suelen aumentar los niveles cerebrales de noradrenalina, y ha sido difícil determinar si estas acciones están implicadas en su valor clínico. También hay evidencia sustancial de que muchas personas con TDAH muestran biomarcadores que implican un procesamiento alterado de la noradrenalina. [62] Se han probado varios fármacos cuyos efectos principales son sobre la noradrenalina, incluidos la guanfacina , la clonidina y la atomoxetina , como tratamientos para el TDAH, y se ha descubierto que tienen efectos comparables a los de los estimulantes. [63] [64]
Varias enfermedades, entre ellas la enfermedad de Parkinson , la diabetes y la denominada insuficiencia autonómica pura , pueden provocar una pérdida de neuronas secretoras de noradrenalina en el sistema nervioso simpático. Los síntomas son generalizados, siendo los más graves una reducción de la frecuencia cardíaca y una caída extrema de la presión arterial en reposo, lo que hace imposible que las personas gravemente afectadas permanezcan de pie durante más de unos pocos segundos sin desmayarse. El tratamiento puede implicar cambios en la dieta o medicamentos. [65]
La noradrenalina impide el sueño REM y la falta de sueño REM aumenta la secreción de noradrenalina [66] como resultado de que el locus coeruleus no deja de producirla. Provoca neurodegeneración si su pérdida se mantiene durante varios días. [67]
Se ha informado que la noradrenalina existe en una amplia variedad de especies animales, incluyendo protozoos , [68] placozoos y cnidarios (medusas y especies relacionadas), [69] pero no en ctenóforos (medusas peine), cuyos sistemas nerviosos difieren en gran medida de los de otros animales. [70] Generalmente está presente en deuteróstomos (vertebrados, etc.), pero en protóstomos (artrópodos, moluscos, platelmintos, nematodos, anélidos, etc.) es reemplazada por octopamina , una sustancia química estrechamente relacionada con una vía de síntesis estrechamente relacionada. [68] En los insectos, la octopamina tiene funciones de alerta y activación que se corresponden (al menos aproximadamente) con las funciones de la noradrenalina en los vertebrados. [71] Se ha argumentado que la octopamina evolucionó para reemplazar a la noradrenalina en lugar de al revés ; Sin embargo, se ha informado que el sistema nervioso del anfioxo (un cordado primitivo) contiene octopamina pero no noradrenalina, lo que presenta dificultades para esa hipótesis. [68]
A principios del siglo XX, Walter Cannon , que había popularizado la idea de un sistema simpático suprarrenal que prepara el cuerpo para la lucha y la huida , y su colega Arturo Rosenblueth desarrollaron una teoría de dos simpatías , la simpatía E (excitadora) y la simpatía I (inhibidora), responsables de estas acciones. [72] El farmacólogo belga Zénon Bacq , así como farmacólogos canadienses y estadounidenses entre 1934 y 1938, sugirieron que la noradrenalina podría ser un transmisor simpático. [72] En 1939, Hermann Blaschko y Peter Holtz identificaron de forma independiente el mecanismo biosintético de la noradrenalina en el cuerpo de los vertebrados. [73] [74] En 1945, Ulf von Euler publicó el primero de una serie de artículos que establecieron el papel de la noradrenalina como neurotransmisor. [75] Demostró la presencia de noradrenalina en los tejidos inervados simpáticamente y en el cerebro, y aportó pruebas de que es la simpatía de Cannon y Rosenblueth.
Stanley Peart fue el primero en demostrar la liberación de noradrenalina después de la estimulación de los nervios simpáticos.
Recomendamos la noradrenalina como vasopresor de primera elección (recomendación fuerte, calidad moderada de la evidencia).
La inhibición selectiva de MAO-A conduce a mayores niveles de neurotransmisor dentro de las neuronas noradrenérgicas (NA-érgicas) y 5-HT-érgicas del SNC, y a una acción antidepresiva clínica, mientras que la inhibición de MAO-B conduce a mayores niveles de DA en el cerebro parkinsoniano...