La desmetilación es el proceso químico que resulta en la eliminación de un grupo metilo (CH 3 ) de una molécula. [1] [2] Una forma común de desmetilación es el reemplazo de un grupo metilo por un átomo de hidrógeno, lo que resulta en una pérdida neta de un carbono y dos átomos de hidrógeno.
La contraparte de la desmetilación es la metilación .

La desmetilación es relevante para la epigenética . La desmetilación del ADN es catalizada por desmetilasas . Estas enzimas oxidan los grupos N-metilo, que se encuentran en las histonas , en los derivados de la lisina y en algunas formas de ADN. [4]
Una familia de tales enzimas oxidativas es el citocromo P450 . [5] Las hidroxilasas dependientes de alfa-cetoglutarato también son activas para la desmetilación del ADN, operando mediante una estequiometría similar. [6] Estas reacciones, que proceden mediante hidroxilación , explotan los enlaces CH ligeramente debilitados de las metilaminas y los metiléteres .
La desmetilación de algunos esteroles es un paso en la biosíntesis de testosterona y colesterol . Los grupos metilo se pierden en forma de formato . [7]
Los grupos metoxi decoran profusamente la lignina del biopolímero . Se ha mostrado mucho interés en convertir esta abundante forma de biomasa en productos químicos útiles (aparte del combustible). Un paso en dicho procesamiento es la desmetilación. [8] [9] La desmetilación de la vainillina , un derivado de la lignina, requiere 250 °C (482 °F) y una base fuerte. [10] La industria de pulpa y papel]] digiere la lignina utilizando sulfuro de sodio acuoso , que despolimeriza parcialmente la lignina. La deslignificación está acompañada de una extensa O-desmetilación, produciendo metanotiol , que es emitido por las fábricas de papel . [11]
La desmetilación a menudo se refiere a la escisión de éteres , especialmente éteres arílicos. [12]
Históricamente, los éteres de metilo de arilo, incluidos productos naturales como la codeína ( O -metilmorfina), se han desmetilado calentando la sustancia en clorhidrato de piridina fundido (punto de fusión 144 °C (291 °F)) a 180 a 220 °C (356 a 428 °F), a veces con exceso de cloruro de hidrógeno , en un proceso conocido como escisión del éter de Zeisel-Prey . [13] [14] El análisis cuantitativo de los éteres de metilo aromáticos se puede realizar mediante la determinación argentométrica del cloruro de N -metilpiridinio formado. [15] El mecanismo de esta reacción comienza con la transferencia de protones del ion piridinio al éter de metilo arilo, un paso altamente desfavorable ( K < 10 −11 ) que explica las duras condiciones requeridas, dada la acidez mucho más débil del piridinio ( p K a = 5,2) en comparación con el éter de metilo arilo protonado (un ion arilmetiloxonio, p K a = –6,7 para arilo = Ph [16] ). A esto le sigue el ataque S N 2 del ion arilmetiloxonio en el grupo metilo por piridina o ion cloruro (dependiendo del sustrato) para dar el fenol libre y, en última instancia, cloruro de N -metilpiridinio, ya sea directamente o por transferencia de metilo posterior del cloruro de metilo a la piridina. [15]

Otro método clásico (pero, de nuevo, severo) para la eliminación del grupo metilo de un éter de metilo arílico es calentar el éter en una solución de bromuro de hidrógeno o yoduro de hidrógeno, a veces también con ácido acético . [17] La escisión de los éteres por ácido bromhídrico o yodhídrico se produce por protonación del éter, seguida de desplazamiento por bromuro o yoduro . Un conjunto de condiciones ligeramente más suaves utiliza yoduro de ciclohexilo (CyI, 10,0 equiv) en N , N -dimetilformamida para generar una pequeña cantidad de yoduro de hidrógeno in situ . [18]
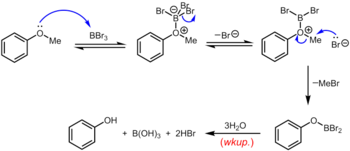
El tribromuro de boro , que se puede utilizar a temperatura ambiente o inferior, es un reactivo más especializado para la desmetilación de éteres de metilo de arilo. El mecanismo de desalquilación del éter se produce a través de la formación reversible inicial de un aducto ácido-base de Lewis entre el BBr3 fuertemente ácido de Lewis y el éter básico de Lewis. Este aducto de Lewis puede disociarse reversiblemente para dar un catión dibromoboril oxonio y Br – . La ruptura del enlace éter se produce a través del posterior ataque nucleofílico sobre la especie oxonio por Br – para producir un ariloxidibromoborano y bromuro de metilo. Una vez completada la reacción, el fenol se libera junto con el ácido bórico (H 3 BO 3 ) y el ácido bromhídrico (HBr ac.) tras la hidrólisis del derivado de dibromoborano durante el tratamiento acuoso . [19]
Los nucleófilos más fuertes , como los diorganofosfuros (LiPPh 2 ), también escinden los éteres arílicos, a veces en condiciones suaves. [20] Otros nucleófilos fuertes que se han empleado incluyen sales de tiolato como EtSNa. [21]
Los éteres metílicos aromáticos, particularmente aquellos con un grupo carbonilo adyacente, pueden desmetilarse regioselectivamente utilizando eterato de yoduro de magnesio . [22] Un ejemplo de este uso es la síntesis del producto natural Calphostin A , [23] como se ve a continuación.

Los ésteres metílicos también son susceptibles a la desmetilación, que generalmente se logra mediante saponificación . Son abundantes las desmetilaciones altamente especializadas, como la descarboxilación de Krapcho :
Se calentó una mezcla de anetol , KOH y alcohol en un autoclave. Aunque el producto de esta reacción fue el anol esperado, Charles Dodds también descubrió un producto de dimerización altamente reactivo en las aguas madres llamado dianol .
La N -desmetilación de las aminas 3° se realiza mediante la reacción de von Braun , que utiliza BrCN como reactivo para dar los derivados nor correspondientes . Se desarrolló una variación moderna de la reacción de von Braun, en la que el BrCN fue reemplazado por cloroformiato de etilo . La preparación de Paxil a partir de arecolina es una aplicación de esta reacción, así como la síntesis de GSK-372,475 , por ejemplo.
La N -desmetilación de la imipramina produce desipramina .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )