La nanotecnología del ADN es el diseño y la fabricación de estructuras artificiales de ácidos nucleicos para usos tecnológicos. En este campo, los ácidos nucleicos se utilizan como materiales de ingeniería no biológicos para la nanotecnología en lugar de como portadores de información genética en células vivas. Los investigadores en el campo han creado estructuras estáticas como redes cristalinas bidimensionales y tridimensionales , nanotubos , poliedros y formas arbitrarias, y dispositivos funcionales como máquinas moleculares y computadoras de ADN . El campo está comenzando a usarse como una herramienta para resolver problemas científicos básicos en biología estructural y biofísica , incluidas aplicaciones en cristalografía de rayos X y espectroscopia de resonancia magnética nuclear de proteínas para determinar estructuras. También se están investigando aplicaciones potenciales en electrónica a escala molecular y nanomedicina .
La base conceptual de la nanotecnología del ADN fue establecida por primera vez por Nadrian Seeman a principios de la década de 1980, y el campo comenzó a atraer un interés generalizado a mediados de la década de 2000. Este uso de los ácidos nucleicos es posible gracias a sus estrictas reglas de emparejamiento de bases , que hacen que solo las porciones de las cadenas con secuencias de bases complementarias se unan para formar estructuras de doble hélice fuertes y rígidas . Esto permite el diseño racional de secuencias de bases que se ensamblarán selectivamente para formar estructuras objetivo complejas con características a nanoescala controladas con precisión . Se utilizan varios métodos de ensamblaje para hacer estas estructuras, incluidas las estructuras basadas en mosaicos que se ensamblan a partir de estructuras más pequeñas, las estructuras plegables que utilizan el método del origami de ADN y las estructuras reconfigurables dinámicamente utilizando métodos de desplazamiento de hebras. El nombre del campo hace referencia específicamente al ADN , pero también se han utilizado los mismos principios con otros tipos de ácidos nucleicos, lo que lleva al uso ocasional del nombre alternativo nanotecnología de ácidos nucleicos .
La base conceptual de la nanotecnología del ADN fue establecida por primera vez por Nadrian Seeman a principios de la década de 1980. [2] La motivación original de Seeman era crear una red tridimensional de ADN para orientar otras moléculas grandes, lo que simplificaría su estudio cristalográfico al eliminar el difícil proceso de obtener cristales puros. Según se informa, esta idea se le había ocurrido a fines de 1980, después de darse cuenta de la similitud entre el grabado en madera Depth de MC Escher y una matriz de uniones de seis brazos de ADN. [3] [4] En ese momento se conocían varias estructuras de ADN ramificadas naturales, incluida la horquilla de replicación del ADN y la unión móvil de Holliday , pero la idea de Seeman fue que las uniones de ácidos nucleicos inmóviles se podían crear diseñando adecuadamente las secuencias de cadenas para eliminar la simetría en la molécula ensamblada, y que estas uniones inmóviles en principio se podían combinar en redes cristalinas rígidas. El primer artículo teórico que proponía este esquema se publicó en 1982, y la primera demostración experimental de una unión de ADN inmóvil se publicó el año siguiente. [5] [6]

En 1991, el laboratorio de Seeman publicó un informe sobre la síntesis de un cubo hecho de ADN, la primera nanoestructura sintética tridimensional de ácido nucleico, por la que recibió el Premio Feynman de Nanotecnología en 1995. A esto le siguió un octaedro truncado de ADN . Pronto quedó claro que estas estructuras, formas poligonales con uniones flexibles como sus vértices , no eran lo suficientemente rígidas como para formar redes tridimensionales extendidas. Seeman desarrolló el motivo estructural de doble cruce (DX), más rígido , y en 1998, en colaboración con Erik Winfree , publicó la creación de redes bidimensionales de mosaicos DX. [3] [2] [7] Estas estructuras basadas en mosaicos tenían la ventaja de que proporcionaban la capacidad de implementar la computación de ADN, lo que fue demostrado por Winfree y Paul Rothemund en su artículo de 2004 sobre el autoensamblaje algorítmico de una estructura de junta de Sierpinski, y por el que compartieron el Premio Feynman de Nanotecnología de 2006. La idea clave de Winfree fue que los mosaicos DX podrían usarse como mosaicos Wang , lo que significa que su ensamblaje podría realizar cálculos. [2] La síntesis de una red tridimensional fue finalmente publicada por Seeman en 2009, casi treinta años después de que se había propuesto lograrla. [8]
Durante la década de 2000, se siguieron descubriendo nuevas capacidades para las estructuras de ADN diseñadas. Seeman demostró la primera nanomáquina de ADN (un motivo que cambia su estructura en respuesta a una entrada) en 1999. Bernard Yurke demostró un sistema mejorado, que fue el primer dispositivo de ácido nucleico en utilizar el desplazamiento de hebra mediado por el punto de apoyo, en 2000. [9] El siguiente avance fue traducir esto en movimiento mecánico y, en 2004 y 2005, los grupos de Seeman, Niles Pierce , Andrew Turberfield y Chengde Mao demostraron varios sistemas de caminantes de ADN. [10] La idea de utilizar matrices de ADN para modelar el ensamblaje de otras moléculas como nanopartículas y proteínas, sugerida por primera vez por Bruche Robinson y Seeman en 1987, [11] fue demostrada en 2002 por Seeman, Kiehl et al. [12] y posteriormente por muchos otros grupos.
En 2006, Rothemund demostró por primera vez el método de origami de ADN para formar de manera fácil y robusta estructuras de ADN plegadas de forma arbitraria. Rothemund había concebido este método como un intermedio conceptual entre las redes DX de Seeman, que utilizaban muchas hebras cortas, y el octaedro de ADN de William Shih, que consistía principalmente en una hebra muy larga. El origami de ADN de Rothemund contiene una hebra larga cuyo plegado es asistido por varias hebras cortas. Este método permitió formar estructuras mucho más grandes de lo que era posible anteriormente, y que son menos exigentes técnicamente para diseñar y sintetizar. [7] El origami de ADN fue el tema de portada de Nature el 15 de marzo de 2006. [13] La investigación de Rothemund que demostraba estructuras de origami de ADN bidimensionales fue seguida por la demostración de origami de ADN tridimensional sólido por Douglas et al. en 2009, [14] mientras que los laboratorios de Jørgen Kjems y Yan demostraron estructuras tridimensionales huecas hechas de caras bidimensionales. [8]
La nanotecnología del ADN fue recibida inicialmente con cierto escepticismo debido al inusual uso no biológico de los ácidos nucleicos como materiales para construir estructuras y hacer cálculos, y la preponderancia de experimentos de prueba de principio que ampliaban las capacidades del campo pero estaban lejos de las aplicaciones reales. El artículo de Seeman de 1991 sobre la síntesis del cubo de ADN fue rechazado por la revista Science después de que un revisor elogiara su originalidad mientras que otro lo criticara por su falta de relevancia biológica. [15] A principios de la década de 2010, se consideró que el campo había aumentado sus capacidades hasta el punto de que las aplicaciones para la investigación científica básica estaban comenzando a hacerse realidad, y las aplicaciones prácticas en medicina y otros campos estaban comenzando a considerarse factibles. [8] [16] El campo había crecido de muy pocos laboratorios activos en 2001 a al menos 60 en 2010, lo que aumentó el grupo de talentos y, por lo tanto, el número de avances científicos en el campo durante esa década. [17]


La nanotecnología se define a menudo como el estudio de materiales y dispositivos con características en una escala inferior a 100 nanómetros . La nanotecnología del ADN, específicamente, es un ejemplo de autoensamblaje molecular de abajo hacia arriba , en el que los componentes moleculares se organizan espontáneamente en estructuras estables; la forma particular de estas estructuras es inducida por las propiedades físicas y químicas de los componentes seleccionados por los diseñadores. [19] En la nanotecnología del ADN, los materiales componentes son cadenas de ácidos nucleicos como el ADN; estas cadenas son a menudo sintéticas y casi siempre se utilizan fuera del contexto de una célula viva. El ADN es muy adecuado para la construcción a nanoescala porque la unión entre dos cadenas de ácidos nucleicos depende de reglas simples de apareamiento de bases que se entienden bien y forman la estructura a nanoescala específica de la doble hélice del ácido nucleico . Estas cualidades hacen que el ensamblaje de las estructuras de los ácidos nucleicos sea fácil de controlar a través del diseño de ácidos nucleicos . Esta propiedad está ausente en otros materiales utilizados en nanotecnología, incluidas las proteínas , para las que el diseño de proteínas es muy difícil, y las nanopartículas , que carecen de la capacidad de ensamblaje específico por sí mismas. [5]
La estructura de una molécula de ácido nucleico consiste en una secuencia de nucleótidos que se distinguen por la nucleobase que contienen. En el ADN, las cuatro bases presentes son adenina (A), citosina (C), guanina (G) y timina (T). Los ácidos nucleicos tienen la propiedad de que dos moléculas solo se unirán entre sí para formar una doble hélice si las dos secuencias son complementarias , lo que significa que forman secuencias coincidentes de pares de bases, con A solo uniéndose a T y C solo a G. [5] [20] Debido a que la formación de pares de bases correctamente emparejados es energéticamente favorable , se espera que las cadenas de ácido nucleico en la mayoría de los casos se unan entre sí en la conformación que maximiza el número de bases correctamente emparejadas. Las secuencias de bases en un sistema de cadenas determinan así el patrón de unión y la estructura general de una manera fácilmente controlable. En la nanotecnología del ADN, las secuencias de bases de las cadenas son diseñadas racionalmente por los investigadores para que las interacciones de apareamiento de bases hagan que las cadenas se ensamblen en la conformación deseada. [3] [5] Si bien el ADN es el material predominantemente utilizado, también se han construido estructuras que incorporan otros ácidos nucleicos como el ARN y el ácido nucleico peptídico (PNA). [21] [22]
La nanotecnología del ADN se divide a veces en dos subcampos superpuestos: la nanotecnología estructural del ADN y la nanotecnología dinámica del ADN. La nanotecnología estructural del ADN, a veces abreviada como SDN, se centra en la síntesis y caracterización de complejos y materiales de ácidos nucleicos que se ensamblan en un estado final estático y de equilibrio . Por otro lado, la nanotecnología dinámica del ADN se centra en complejos con un comportamiento útil fuera del equilibrio, como la capacidad de reconfigurarse en función de un estímulo químico o físico. Algunos complejos, como los dispositivos nanomecánicos de ácidos nucleicos, combinan características de los subcampos estructural y dinámico. [23] [24]
Los complejos construidos en nanotecnología de ADN estructural utilizan estructuras de ácidos nucleicos ramificadas topológicamente que contienen uniones. (En contraste, la mayor parte del ADN biológico existe como una doble hélice no ramificada ). Una de las estructuras ramificadas más simples es una unión de cuatro brazos que consta de cuatro cadenas de ADN individuales, porciones de las cuales son complementarias en un patrón específico. A diferencia de las uniones de Holliday naturales , cada brazo en la unión de cuatro brazos inmóvil artificial tiene una secuencia de bases diferente , lo que hace que el punto de unión se fije en una posición determinada. Se pueden combinar múltiples uniones en el mismo complejo, como en el motivo estructural de doble cruce (DX) ampliamente utilizado , que contiene dos dominios de doble hélice paralelos con cadenas individuales que se cruzan entre los dominios en dos puntos de cruce. Cada punto de cruce es, topológicamente, una unión de cuatro brazos, pero está restringido a una orientación, en contraste con la unión flexible de cuatro brazos simples, lo que proporciona una rigidez que hace que el motivo DX sea adecuado como un bloque de construcción estructural para complejos de ADN más grandes. [3] [5]
La nanotecnología de ADN dinámico utiliza un mecanismo llamado desplazamiento de cadena mediado por puntos de apoyo para permitir que los complejos de ácidos nucleicos se reconfiguren en respuesta a la adición de una nueva cadena de ácidos nucleicos. En esta reacción, la cadena entrante se une a una región de punto de apoyo monocatenario de un complejo bicatenario y luego desplaza una de las cadenas unidas en el complejo original a través de un proceso de migración de ramificación . El efecto general es que una de las cadenas del complejo se reemplaza por otra. [23] Además, se pueden crear estructuras y dispositivos reconfigurables utilizando ácidos nucleicos funcionales como desoxirribozimas y ribozimas , que pueden realizar reacciones químicas, y aptámeros , que pueden unirse a proteínas específicas o moléculas pequeñas. [25]
La nanotecnología estructural del ADN, a veces abreviada como SDN, se centra en la síntesis y caracterización de complejos y materiales de ácidos nucleicos en los que el ensamblaje tiene un punto final estático y de equilibrio. La doble hélice de los ácidos nucleicos tiene una geometría tridimensional definida y robusta que permite simular, [26] predecir y diseñar las estructuras de complejos de ácidos nucleicos más complicados. Se han creado muchas de estas estructuras, incluidas estructuras bidimensionales y tridimensionales, y estructuras periódicas, aperiódicas y discretas. [24]

Los complejos de ácidos nucleicos pequeños pueden estar equipados con extremos pegajosos y combinarse en redes periódicas bidimensionales más grandes que contienen un patrón teselado específico de las baldosas moleculares individuales. [24] El primer ejemplo de esto utilizó complejos de doble cruce (DX) como baldosas básicas, cada uno con cuatro extremos pegajosos diseñados con secuencias que hicieron que las unidades DX se combinaran en láminas planas bidimensionales periódicas que son esencialmente cristales bidimensionales rígidos de ADN. [30] [31] También se han creado matrices bidimensionales a partir de otros motivos, incluida la red de rombos de unión de Holliday , [32] y varias matrices basadas en DX que hacen uso de un esquema de doble cohesión. [33] [34] Las dos imágenes superiores a la derecha muestran ejemplos de redes periódicas basadas en baldosas.
Se pueden hacer arreglos bidimensionales para exhibir estructuras aperiódicas cuyo ensamblaje implementa un algoritmo específico, exhibiendo una forma de computación de ADN. [17] Los mosaicos DX pueden tener sus secuencias de extremos pegajosos elegidas para que actúen como mosaicos Wang , lo que les permite realizar cálculos. Se ha demostrado un arreglo DX cuyo ensamblaje codifica una operación XOR ; esto permite que el arreglo de ADN implemente un autómata celular que genera un fractal conocido como la junta de Sierpinski . La tercera imagen a la derecha muestra este tipo de arreglo. [29] Otro sistema tiene la función de un contador binario , que muestra una representación de números binarios crecientes a medida que crece. Estos resultados muestran que la computación se puede incorporar al ensamblaje de arreglos de ADN. [35]
Se han creado matrices DX para formar nanotubos huecos de 4 a 20 nm de diámetro, esencialmente redes bidimensionales que se curvan sobre sí mismas. [36] Estos nanotubos de ADN son algo similares en tamaño y forma a los nanotubos de carbono , y si bien carecen de la conductancia eléctrica de los nanotubos de carbono, los nanotubos de ADN se modifican y se conectan más fácilmente a otras estructuras. Uno de los muchos esquemas para construir nanotubos de ADN utiliza una red de teselas DX curvadas que se enroscan sobre sí mismas y se cierran en un tubo. [37] En un método alternativo que permite especificar la circunferencia de una manera simple y modular utilizando teselas de una sola hebra, la rigidez del tubo es una propiedad emergente . [38]
La formación de redes tridimensionales de ADN fue el primer objetivo de la nanotecnología del ADN, pero resultó ser uno de los más difíciles de lograr. El éxito obtenido con un motivo basado en el concepto de tensegridad , un equilibrio entre fuerzas de tensión y compresión, se informó finalmente en 2009. [17] [39]
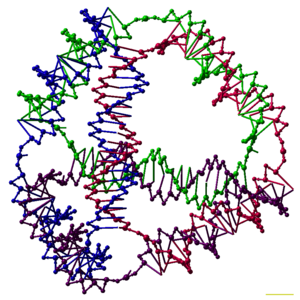
Los investigadores han sintetizado muchos complejos de ADN tridimensionales que tienen cada uno la conectividad de un poliedro , como un cubo o un octaedro , lo que significa que los dúplex de ADN trazan los bordes de un poliedro con una unión de ADN en cada vértice. [6] Las primeras demostraciones de poliedros de ADN requerían mucho trabajo, ya que requerían múltiples ligaduras y pasos de síntesis en fase sólida para crear poliedros encadenados . [40] El trabajo posterior produjo poliedros cuya síntesis fue mucho más fácil. Estos incluyen un octaedro de ADN hecho de una sola hebra larga diseñada para plegarse en la conformación correcta, [41] y un tetraedro que se puede producir a partir de cuatro hebras de ADN en un solo paso, que se muestra en la parte superior de este artículo. [1]
Las nanoestructuras de formas arbitrarias y no regulares se hacen generalmente utilizando el método del origami de ADN . Estas estructuras consisten en una hebra larga de virus natural como "andamio", que se hace doblar en la forma deseada por hebras cortas "básicas" diseñadas computacionalmente. Este método tiene las ventajas de ser fácil de diseñar, ya que la secuencia de bases está predeterminada por la secuencia de la hebra del andamio, y no requiere una alta pureza de la hebra y una estequiometría precisa , como la mayoría de los otros métodos de nanotecnología del ADN. El origami de ADN se demostró por primera vez para formas bidimensionales, como una cara sonriente , un mapa grueso del hemisferio occidental y la pintura de Mona Lisa. [6] [13] [42] Se pueden hacer estructuras tridimensionales sólidas utilizando hélices de ADN paralelas dispuestas en un patrón de panal, [14] y las estructuras con caras bidimensionales se pueden doblar en una forma tridimensional general hueca, similar a una caja de cartón. Estos pueden programarse para abrirse y revelar o liberar una carga molecular en respuesta a un estímulo, lo que los hace potencialmente útiles como jaulas moleculares programables . [43] [44]
Las estructuras de ácidos nucleicos pueden fabricarse para incorporar moléculas distintas a los ácidos nucleicos, a veces llamadas heteroelementos, incluyendo proteínas, nanopartículas metálicas, puntos cuánticos , aminas , [45] y fulerenos . Esto permite la construcción de materiales y dispositivos con un rango de funcionalidades mucho mayor que el posible con los ácidos nucleicos solos. El objetivo es utilizar el autoensamblaje de las estructuras de ácidos nucleicos para modelar el ensamblaje de las nanopartículas alojadas en ellas, controlando su posición y en algunos casos su orientación. [6] [46] Muchos de estos esquemas utilizan un esquema de unión covalente, utilizando oligonucleótidos con grupos funcionales amida o tiol como un controlador químico para unir los heteroelementos. Este esquema de unión covalente se ha utilizado para organizar nanopartículas de oro en una matriz basada en DX, [47] y para organizar moléculas de proteína estreptavidina en patrones específicos en una matriz DX. [48] Se utilizó un esquema de hospedaje no covalente utilizando poliamidas de Dervan en una matriz DX para organizar las proteínas de estreptavidina en un patrón específico en una matriz DX. [49] Los nanotubos de carbono se han hospedado en matrices de ADN en un patrón que permite que el conjunto actúe como un dispositivo electrónico molecular , un transistor de efecto de campo de nanotubos de carbono . [50] Además, existen métodos de metalización de ácidos nucleicos, en los que el ácido nucleico se reemplaza por un metal que asume la forma general de la estructura original del ácido nucleico, [51] y esquemas para usar nanoestructuras de ácidos nucleicos como máscaras de litografía , transfiriendo su patrón a una superficie sólida. [52]

La nanotecnología de ADN dinámico se centra en la formación de sistemas de ácidos nucleicos con funcionalidades dinámicas diseñadas relacionadas con sus estructuras generales, como la computación y el movimiento mecánico. Existe cierta superposición entre la nanotecnología de ADN estructural y dinámica, ya que las estructuras se pueden formar mediante recocido y luego reconfigurar dinámicamente, o se puede hacer que se formen dinámicamente en primer lugar. [6] [10]
Se han creado complejos de ADN que cambian su conformación ante algún estímulo, lo que los convierte en una forma de nanorobótica . Estas estructuras se forman inicialmente de la misma manera que las estructuras estáticas creadas en la nanotecnología de ADN estructural, pero están diseñadas de modo que sea posible la reconfiguración dinámica después del ensamblaje inicial. [23] [10] El primer dispositivo de este tipo hizo uso de la transición entre las formas B-ADN y Z-ADN para responder a un cambio en las condiciones del tampón al experimentar un movimiento de torsión. [53] Esta dependencia de las condiciones del tampón hizo que todos los dispositivos cambiaran de estado al mismo tiempo. Los sistemas posteriores podían cambiar de estado en función de la presencia de cadenas de control, lo que permitía que varios dispositivos funcionaran de forma independiente en solución. Algunos ejemplos de tales sistemas son un diseño de "pinzas moleculares" que tiene un estado abierto y uno cerrado, [54] un dispositivo que podría cambiar de una conformación de cruce paranémico (PX) a una conformación (JX2) con dos yuxtaposiciones sin unión de la cadena principal del ADN, experimentando un movimiento de rotación en el proceso, [55] y una matriz bidimensional que podría expandirse y contraerse dinámicamente en respuesta a las cadenas de control. [56] También se han creado estructuras que se abren o cierran dinámicamente, actuando potencialmente como una jaula molecular para liberar o revelar una carga funcional al abrirse. [43] [57] [58] En otro ejemplo, una nanoestructura de origami de ADN se acopló a la ARN polimerasa T7 y, por lo tanto, podría funcionar como un motor impulsado por energía química que puede acoplarse a un seguidor pasivo, que luego impulsa. [59]
Los caminantes de ADN son una clase de nanomáquinas de ácido nucleico que exhiben un movimiento direccional a lo largo de una pista lineal. Se ha demostrado una gran cantidad de esquemas. [10] Una estrategia es controlar el movimiento del caminante a lo largo de la pista utilizando cadenas de control que deben agregarse manualmente en secuencia. [60] [61] También es posible controlar los pasos individuales de un caminante de ADN mediante la irradiación con luz de diferentes longitudes de onda. [62] Otro enfoque es hacer uso de enzimas de restricción o desoxirribozimas para escindir las cadenas y hacer que el caminante avance, lo que tiene la ventaja de funcionar de forma autónoma. [63] [64] Un sistema posterior podría caminar sobre una superficie bidimensional en lugar de una pista lineal, y demostró la capacidad de recoger y mover selectivamente carga molecular. [65] En 2018, se demostró que un ADN encadenado que utiliza la transcripción de círculo rodante por una ARN polimerasa T7 unida camina a lo largo de una ruta de ADN, guiado por la cadena de ARN generada. [66] Además, se ha demostrado que un caminante lineal realiza una síntesis basada en ADN a medida que avanza por la pista, lo que permite una síntesis química autónoma de varios pasos dirigida por el caminante. [67] La función de los caminantes de ADN sintéticos es similar a la de las proteínas dineína y kinesina. [68]
Las cascadas de reacciones de desplazamiento de hebras se pueden utilizar con fines computacionales o estructurales. Una reacción de desplazamiento de hebra individual implica revelar una nueva secuencia en respuesta a la presencia de alguna hebra iniciadora. Muchas de estas reacciones se pueden vincular en una cascada donde la secuencia de salida recién revelada de una reacción puede iniciar otra reacción de desplazamiento de hebra en otro lugar. Esto a su vez permite la construcción de redes de reacción química con muchos componentes, que exhiben capacidades complejas de procesamiento de información y computacional. Estas cascadas se vuelven energéticamente favorables a través de la formación de nuevos pares de bases y la ganancia de entropía de las reacciones de desensamblaje. Las cascadas de desplazamiento de hebras permiten el funcionamiento isotérmico del ensamblaje o proceso computacional, en contraste con el requisito del ensamblaje de ácidos nucleicos tradicional de un paso de recocido térmico, donde la temperatura se eleva y luego se reduce lentamente para asegurar la formación adecuada de la estructura deseada. También pueden respaldar la función catalítica de la especie iniciadora, donde menos de un equivalente del iniciador puede hacer que la reacción se complete. [23] [69]
Los complejos de desplazamiento de hebras se pueden utilizar para crear puertas lógicas moleculares capaces de realizar cálculos complejos. [70] A diferencia de las computadoras electrónicas tradicionales, que utilizan la corriente eléctrica como entrada y salida, las computadoras moleculares utilizan las concentraciones de especies químicas específicas como señales. En el caso de los circuitos de desplazamiento de hebras de ácidos nucleicos, la señal es la presencia de hebras de ácidos nucleicos que se liberan o consumen mediante eventos de unión y desunión a otras hebras en complejos de desplazamiento. Este enfoque se ha utilizado para crear puertas lógicas como las puertas AND, OR y NOT. [71] Más recientemente, se demostró un circuito de cuatro bits que puede calcular la raíz cuadrada de los números enteros 0-15, utilizando un sistema de puertas que contiene 130 hebras de ADN. [72]
Otro uso de las cascadas de desplazamiento de hebras es crear estructuras ensambladas dinámicamente. Estas utilizan una estructura de horquilla para los reactivos, de modo que cuando la hebra de entrada se une, la secuencia recién revelada está en la misma molécula en lugar de desensamblarse. Esto permite que se agreguen nuevas horquillas abiertas a un complejo en crecimiento. Este enfoque se ha utilizado para crear estructuras simples como uniones de tres y cuatro brazos y dendrímeros . [69]
La nanotecnología del ADN proporciona una de las pocas formas de formar estructuras complejas diseñadas con un control preciso sobre las características a escala nanométrica. El campo está empezando a ver aplicaciones para resolver problemas de ciencias básicas en biología estructural y biofísica . La primera aplicación de este tipo prevista para el campo, y que todavía está en desarrollo, es en cristalografía , donde las moléculas que son difíciles de cristalizar de forma aislada podrían disponerse dentro de una red tridimensional de ácidos nucleicos, lo que permitiría la determinación de su estructura. Otra aplicación es el uso de varillas de origami de ADN para reemplazar cristales líquidos en experimentos de acoplamiento dipolar residual en espectroscopia de RMN de proteínas ; el uso de origami de ADN es ventajoso porque, a diferencia de los cristales líquidos, son tolerantes a los detergentes necesarios para suspender las proteínas de membrana en solución. Los caminantes de ADN se han utilizado como líneas de montaje a escala nanométrica para mover nanopartículas y dirigir la síntesis química . Además, las estructuras de origami de ADN han ayudado en los estudios biofísicos de la función enzimática y el plegamiento de proteínas . [24] [8]
La nanotecnología del ADN se está orientando hacia posibles aplicaciones en el mundo real. La capacidad de las matrices de ácidos nucleicos para organizar otras moléculas indica sus posibles aplicaciones en la electrónica a escala molecular. El ensamblaje de una estructura de ácido nucleico podría utilizarse para modelar el ensamblaje de elementos electrónicos moleculares como cables moleculares , lo que proporciona un método para el control a escala nanométrica de la colocación y la arquitectura general del dispositivo de manera análoga a una placa de pruebas molecular . [24] [6] La nanotecnología del ADN se ha comparado con el concepto de materia programable debido al acoplamiento de la computación a sus propiedades materiales. [73]
En un estudio realizado por un grupo de científicos de los centros iNANO y CDNA de la Universidad de Aarhus , los investigadores pudieron construir una pequeña caja de ADN en origami tridimensional multiconmutable. La nanopartícula propuesta se caracterizó mediante microscopía de fuerza atómica (AFM), microscopía electrónica de transmisión (TEM) y transferencia de energía por resonancia de Förster (FRET). Se demostró que la caja construida tenía un mecanismo de recierre único, que le permitía abrirse y cerrarse repetidamente en respuesta a un conjunto único de claves de ADN o ARN. Los autores propusieron que este "dispositivo de ADN puede usarse potencialmente para una amplia gama de aplicaciones, como el control de la función de moléculas individuales, la administración controlada de fármacos y la computación molecular". [74]
Existen aplicaciones potenciales para la nanotecnología del ADN en la nanomedicina, haciendo uso de su capacidad para realizar cálculos en un formato biocompatible para fabricar "fármacos inteligentes" para la administración dirigida de fármacos , así como para aplicaciones de diagnóstico . Uno de esos sistemas que se está investigando utiliza una caja de ADN hueca que contiene proteínas que inducen la apoptosis , o muerte celular, que solo se abrirá cuando esté cerca de una célula cancerosa . [8] [75] Además, ha habido interés en expresar estas estructuras artificiales en células bacterianas vivas diseñadas, probablemente utilizando el ARN transcrito para el ensamblaje, aunque se desconoce si estas estructuras complejas pueden plegarse o ensamblarse de manera eficiente en el citoplasma de la célula . Si tiene éxito, esto podría permitir la evolución dirigida de nanoestructuras de ácido nucleico. [6] Los científicos de la Universidad de Oxford informaron del autoensamblaje de cuatro hebras cortas de ADN sintético en una jaula que puede ingresar a las células y sobrevivir durante al menos 48 horas. Se descubrió que los tetraedros de ADN marcados con fluorescencia permanecían intactos en las células renales humanas cultivadas en laboratorio a pesar del ataque de las enzimas celulares después de dos días. Este experimento demostró el potencial de la administración de fármacos dentro de las células vivas utilizando la "jaula" de ADN. [76] [77] Un tetraedro de ADN se utilizó para administrar interferencia de ARN (ARNi) en un modelo de ratón, informó un equipo de investigadores del MIT . La administración del ARN interferente para el tratamiento ha demostrado cierto éxito utilizando polímeros o lípidos , pero existen límites de seguridad y una orientación imprecisa, además de una corta vida útil en el torrente sanguíneo. La nanoestructura de ADN creada por el equipo consta de seis hebras de ADN para formar un tetraedro, con una hebra de ARN fijada a cada uno de los seis bordes. El tetraedro está equipado además con una proteína de orientación, tres moléculas de folato , que conducen las nanopartículas de ADN a los abundantes receptores de folato que se encuentran en algunos tumores. El resultado mostró que la expresión génica dirigida por el ARNi, la luciferasa , se redujo a más de la mitad. Este estudio muestra la promesa de utilizar la nanotecnología del ADN como una herramienta eficaz para administrar el tratamiento utilizando la tecnología emergente de interferencia de ARN. [78] [79] El tetraedro de ADN también se utilizó en un esfuerzo por superar el fenómeno de la resistencia a múltiples fármacos . Doxorrubicina(DOX) se conjugó con el tetraedro y se cargó en células de cáncer de mama MCF-7 que contenían la bomba de eflujo de fármacos de la glicoproteína P. Los resultados del experimento mostraron que la DOX no se estaba bombeando hacia afuera y se logró la apoptosis de las células cancerosas. El tetraedro sin DOX se cargó en las células para probar su biocompatibilidad, y la estructura no mostró citotoxicidad en sí misma. [80] El tetraedro de ADN también se utilizó como código de barras para perfilar la expresión subcelular y la distribución de proteínas en las células con fines de diagnóstico. El tetraedro nanoestructurado mostró una señal mejorada debido a una mayor eficiencia y estabilidad del etiquetado. [81]
Las aplicaciones de la nanotecnología del ADN en la nanomedicina también se centran en imitar la estructura y función de las proteínas de membrana naturales con nanoestructuras de ADN diseñadas. En 2012, Langecker et al. [82] introdujeron una estructura de origami de ADN con forma de poro que puede autoinsertarse en las membranas lipídicas a través de modificaciones hidrofóbicas del colesterol e inducir corrientes iónicas a través de la membrana. Esta primera demostración de un canal iónico de ADN sintético fue seguida por una variedad de diseños inductores de poros que van desde un solo dúplex de ADN , [83] hasta pequeñas estructuras basadas en mosaicos, [84] [85] [86] [87] [88] y grandes porinas transmembrana de origami de ADN . [89] Similar a los canales iónicos de proteínas naturales , este conjunto de contrapartes hechas de ADN sintético abarca múltiples órdenes de magnitud en conductancia. El estudio del dúplex de ADN único que inserta la membrana mostró que la corriente también debe fluir en la interfaz ADN-lípido, ya que no hay un lumen de canal central presente en el diseño que permita que los iones pasen a través de la bicapa lipídica . Esto indicó que el poro lipídico inducido por el ADN tiene una forma toroidal , en lugar de cilíndrica, ya que los grupos de cabeza de lípidos se reorientan para mirar hacia la parte insertada en la membrana del ADN. [83] Luego, los investigadores de la Universidad de Cambridge y la Universidad de Illinois en Urbana-Champaign demostraron que un poro toroidal inducido por el ADN puede facilitar un rápido cambio de lípidos entre los folíolos de la bicapa lipídica. Utilizando este efecto, diseñaron una enzima sintética construida con ADN que cambia los lípidos en las membranas biológicas órdenes de magnitudes más rápido que las proteínas naturales llamadas scramblases . [90] Este desarrollo resalta el potencial de las nanoestructuras de ADN sintético para medicamentos y terapias personalizadas.
Las nanoestructuras de ADN deben diseñarse racionalmente para que las hebras de ácido nucleico individuales se ensamblen en las estructuras deseadas. Este proceso suele comenzar con la especificación de una estructura o función objetivo deseada. Luego, se determina la estructura secundaria general del complejo objetivo, especificando la disposición de las hebras de ácido nucleico dentro de la estructura y qué porciones de esas hebras deben unirse entre sí. El último paso es el diseño de la estructura primaria , que es la especificación de las secuencias de bases reales de cada hebra de ácido nucleico. [36] [91]
El primer paso para diseñar una nanoestructura de ácido nucleico es decidir cómo debe representarse una estructura dada mediante una disposición específica de cadenas de ácido nucleico. Este paso de diseño determina la estructura secundaria, o las posiciones de los pares de bases que mantienen unidas las cadenas individuales en la forma deseada. [36] Se han demostrado varios enfoques:
Después de utilizar cualquiera de los enfoques anteriores para diseñar la estructura secundaria de un complejo objetivo, se debe idear una secuencia real de nucleótidos que formará la estructura deseada. El diseño de ácidos nucleicos es el proceso de asignar una secuencia de bases de ácidos nucleicos específica a cada una de las cadenas constituyentes de una estructura para que se asocien en una conformación deseada. La mayoría de los métodos tienen el objetivo de diseñar secuencias de modo que la estructura objetivo tenga la energía más baja y, por lo tanto, sea la más favorable termodinámicamente, mientras que las estructuras ensambladas incorrectamente tengan energías más altas y, por lo tanto, sean desfavorecidas. Esto se hace mediante métodos heurísticos simples y más rápidos , como la minimización de la simetría de secuencia, o mediante el uso de un modelo termodinámico completo del vecino más cercano , que es más preciso pero más lento y más intensivo desde el punto de vista computacional. Los modelos geométricos se utilizan para examinar la estructura terciaria de las nanoestructuras y para garantizar que los complejos no estén demasiado tensos . [91] [93]
El diseño de ácidos nucleicos tiene objetivos similares al diseño de proteínas . En ambos, la secuencia de monómeros está diseñada para favorecer la estructura objetivo deseada y desfavorecer otras estructuras. El diseño de ácidos nucleicos tiene la ventaja de ser mucho más fácil computacionalmente que el diseño de proteínas, porque las reglas simples de apareamiento de bases son suficientes para predecir la favorabilidad energética de una estructura, y no se requiere información detallada sobre el plegamiento tridimensional general de la estructura. Esto permite el uso de métodos heurísticos simples que producen diseños experimentalmente robustos. Las estructuras de ácidos nucleicos son menos versátiles que las proteínas en su función debido a la mayor capacidad de las proteínas para plegarse en estructuras complejas y la diversidad química limitada de los cuatro nucleótidos en comparación con los veinte aminoácidos proteinogénicos . [93]

Las secuencias de las cadenas de ADN que forman una estructura objetivo se diseñan computacionalmente, utilizando software de modelado molecular y modelado termodinámico . [91] [93] Los propios ácidos nucleicos se sintetizan luego utilizando métodos estándar de síntesis de oligonucleótidos , generalmente automatizados en un sintetizador de oligonucleótidos , y las cadenas de secuencias personalizadas están disponibles comercialmente. [94] Las cadenas se pueden purificar mediante electroforesis en gel desnaturalizante si es necesario, [95] y se pueden determinar concentraciones precisas a través de cualquiera de varios métodos de cuantificación de ácidos nucleicos utilizando espectroscopia de absorbancia ultravioleta . [96]
Las estructuras objetivo completamente formadas se pueden verificar mediante electroforesis en gel nativa , que brinda información sobre el tamaño y la forma de los complejos de ácidos nucleicos. Un ensayo de cambio de movilidad electroforética puede evaluar si una estructura incorpora todas las cadenas deseadas. [97] El marcado fluorescente y la transferencia de energía por resonancia de Förster (FRET) se utilizan a veces para caracterizar la estructura de los complejos. [98]
Las estructuras de los ácidos nucleicos se pueden visualizar directamente mediante microscopía de fuerza atómica , que es muy adecuada para estructuras bidimensionales extendidas, pero menos útil para estructuras tridimensionales discretas debido a la interacción de la punta del microscopio con la frágil estructura del ácido nucleico; en este caso, se utilizan a menudo la microscopía electrónica de transmisión y la microscopía crioelectrónica . Las redes tridimensionales extendidas se analizan mediante cristalografía de rayos X. [99] [100]
General:
Subcampos específicos: