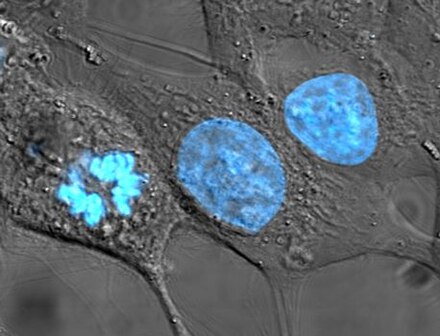
El núcleo celular (del latín núcleo o nuculeus 'núcleo, semilla'; pl.: núcleos ) es un orgánulo rodeado de membrana que se encuentra en las células eucariotas . Las células eucariotas suelen tener un solo núcleo, pero algunos tipos de células, como los glóbulos rojos de los mamíferos , no tienen núcleos, y algunos otros, incluidos los osteoclastos , tienen muchos . Las principales estructuras que componen el núcleo son la envoltura nuclear , una doble membrana que encierra todo el orgánulo y aísla su contenido del citoplasma celular ; y la matriz nuclear , una red dentro del núcleo que añade soporte mecánico.
El núcleo celular contiene casi todo el genoma de la célula . El ADN nuclear suele estar organizado en múltiples cromosomas : largas hebras de ADN salpicadas de diversas proteínas , como las histonas , que protegen y organizan el ADN. Los genes dentro de estos cromosomas están estructurados de tal manera que promueven la función celular. El núcleo mantiene la integridad de los genes y controla las actividades de la célula regulando la expresión genética .
Debido a que la envoltura nuclear es impermeable a las moléculas grandes , se requieren poros nucleares para regular el transporte nuclear de moléculas a través de la envoltura. Los poros cruzan ambas membranas nucleares, proporcionando un canal a través del cual las moléculas más grandes deben ser transportadas activamente por proteínas transportadoras, al tiempo que permiten el libre movimiento de moléculas e iones pequeños . El movimiento de moléculas grandes, como proteínas y ARN, a través de los poros es necesario tanto para la expresión genética como para el mantenimiento de los cromosomas. Aunque el interior del núcleo no contiene ningún subcompartimento rodeado de membranas, existen varios cuerpos nucleares , formados por proteínas únicas, moléculas de ARN y partes particulares de los cromosomas. El más conocido de ellos es el nucléolo , implicado en el ensamblaje de los ribosomas .
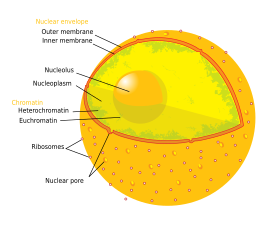
El núcleo contiene casi todo el ADN de la célula , rodeado por una red de filamentos intermedios fibrosos llamado matriz nuclear , y está envuelto por una doble membrana llamada envoltura nuclear . La envoltura nuclear separa el líquido del interior del núcleo, llamado nucleoplasma , del resto de la célula. El tamaño del núcleo está correlacionado con el tamaño de la célula, y esta relación se presenta en una variedad de tipos y especies de células. [1] En los eucariotas, el núcleo de muchas células suele ocupar el 10% del volumen celular. [2] : 178 El núcleo es el orgánulo más grande de las células animales. [3] : 12 En las células humanas, el diámetro del núcleo es de aproximadamente seis micrómetros (μm). [2] : 179

La envoltura nuclear consta de dos membranas , una interna y otra externa , perforadas por poros nucleares . [2] : 649 Juntas, estas membranas sirven para separar el material genético de la célula del resto del contenido celular y permiten que el núcleo mantenga un entorno distinto del resto de la célula. A pesar de su estrecha aposición alrededor de gran parte del núcleo, las dos membranas difieren sustancialmente en forma y contenido. La membrana interna rodea el contenido nuclear, proporcionando su borde definitorio. [3] : 14 Incrustadas dentro de la membrana interna, varias proteínas se unen a los filamentos intermedios que dan estructura al núcleo. [2] : 649 La membrana externa encierra la membrana interna y se continúa con la membrana del retículo endoplásmico adyacente . [2] : 649 Como parte de la membrana del retículo endoplásmico, la membrana nuclear externa está repleta de ribosomas que traducen activamente proteínas a través de la membrana. [2] : 649 El espacio entre las dos membranas se llama espacio perinuclear y se continúa con la luz del retículo endoplásmico . [2] : 649
En la envoltura nuclear de un mamífero hay entre 3.000 y 4.000 complejos de poros nucleares (NPC) que perforan la envoltura. [2] : 650 Cada NPC contiene una estructura en forma de anillo con simetría ocho veces mayor en una posición donde las membranas interna y externa se fusionan. [4] El número de NPC puede variar considerablemente según el tipo de célula; las células gliales pequeñas sólo tienen unos pocos cientos, y las células de Purkinje grandes tienen alrededor de 20.000. [2] : 650 El NPC proporciona transporte selectivo de moléculas entre el nucleoplasma y el citosol . [5] El complejo del poro nuclear está compuesto por aproximadamente treinta proteínas diferentes conocidas como nucleoporinas . [2] : 649 Los poros tienen entre 60 y 80 millones de daltons de peso molecular y constan de alrededor de 50 (en levaduras ) a varios cientos de proteínas (en vertebrados ). [3] : 622–4 Los poros tienen un diámetro total de 100 nm; sin embargo, el espacio a través del cual las moléculas se difunden libremente tiene sólo unos 9 nm de ancho, debido a la presencia de sistemas reguladores en el centro del poro. Este tamaño permite selectivamente el paso de pequeñas moléculas solubles en agua al tiempo que evita que moléculas más grandes, como ácidos nucleicos y proteínas más grandes, entren o salgan de manera inapropiada del núcleo. En cambio, estas grandes moléculas deben transportarse activamente al núcleo. Adjunta al anillo hay una estructura llamada canasta nuclear que se extiende hacia el nucleoplasma y una serie de extensiones filamentosas que llegan hasta el citoplasma. Ambas estructuras sirven para mediar la unión a proteínas de transporte nuclear. [6] : 509–10
La mayoría de las proteínas, las subunidades ribosómicas y algunos ARN se transportan a través de los complejos de poros en un proceso mediado por una familia de factores de transporte conocidos como carioferinas . Las carioferinas que median el movimiento hacia el núcleo también se denominan importinas, mientras que las que median el movimiento fuera del núcleo se denominan exportinas. La mayoría de las carioferinas interactúan directamente con su carga, aunque algunas utilizan proteínas adaptadoras . [7] Las hormonas esteroides como el cortisol y la aldosterona , así como otras pequeñas moléculas solubles en lípidos involucradas en la señalización intercelular , pueden difundirse a través de la membrana celular y hacia el citoplasma, donde se unen a las proteínas receptoras nucleares que son transportadas hacia el núcleo. Allí sirven como factores de transcripción cuando se unen a su ligando ; en ausencia de un ligando, muchos de estos receptores funcionan como histonas desacetilasas que reprimen la expresión génica. [6] : 488
En las células animales, dos redes de filamentos intermedios proporcionan soporte mecánico al núcleo: la lámina nuclear forma una red organizada en la cara interna de la envoltura, mientras que se proporciona un soporte menos organizado en la cara citosólica de la envoltura. Ambos sistemas proporcionan soporte estructural a la envoltura nuclear y sitios de anclaje para cromosomas y poros nucleares. [8]
La lámina nuclear está compuesta principalmente por proteínas lamínicas . Como todas las proteínas, las láminas se sintetizan en el citoplasma y posteriormente se transportan al interior del núcleo, donde se ensamblan antes de incorporarse a la red existente de láminas nucleares. [9] [10] Las laminas que se encuentran en la cara citosólica de la membrana, como la emerina y la nesprina , se unen al citoesqueleto para proporcionar soporte estructural. Las láminas también se encuentran dentro del nucleoplasma, donde forman otra estructura regular, conocida como velo nucleoplásmico , [11] [12] que es visible mediante microscopía de fluorescencia . La función real del velo no está clara, aunque está excluido del nucléolo y está presente durante la interfase . [13] Las estructuras laminares que forman el velo, como LEM3 , se unen a la cromatina y la alteración de su estructura inhibe la transcripción de genes que codifican proteínas. [14]
Al igual que los componentes de otros filamentos intermedios, el monómero de lámina contiene un dominio alfa-helicoidal utilizado por dos monómeros para enrollarse entre sí, formando una estructura de dímero llamada bobina enrollada . Luego, dos de estas estructuras dímeras se unen una al lado de la otra, en una disposición antiparalela , para formar un tetrámero llamado protofilamento . Ocho de estos protofilamentos forman una disposición lateral que se retuerce para formar un filamento en forma de cuerda . Estos filamentos se pueden ensamblar o desarmar de manera dinámica, lo que significa que los cambios en la longitud del filamento dependen de las tasas competitivas de adición y extracción de filamentos. [8]
Las mutaciones en los genes de las láminas que conducen a defectos en el ensamblaje de los filamentos causan un grupo de trastornos genéticos raros conocidos como laminopatías . La laminopatía más destacable es la familia de enfermedades conocidas como progeria , que provoca la aparición de envejecimiento prematuro en quienes padecen la afección. No se comprende bien el mecanismo exacto por el cual los cambios bioquímicos asociados dan lugar al fenotipo de envejecimiento. [15]

El núcleo celular contiene la mayor parte del material genético de la célula en forma de múltiples moléculas de ADN lineales organizadas en estructuras llamadas cromosomas . Cada célula humana contiene aproximadamente dos metros de ADN. [6] : 405 Durante la mayor parte del ciclo celular, estos se organizan en un complejo de ADN y proteína conocido como cromatina , y durante la división celular se puede ver que la cromatina forma los cromosomas bien definidos que son familiares en un cariotipo . En cambio, una pequeña fracción de los genes de la célula se encuentra en las mitocondrias . [6] : 438
Hay dos tipos de cromatina. La eucromatina es la forma de ADN menos compacta y contiene genes que la célula expresa con frecuencia. [16] El otro tipo, la heterocromatina , es la forma más compacta y contiene ADN que rara vez se transcribe. Esta estructura se clasifica además en heterocromatina facultativa , que consta de genes que se organizan como heterocromatina solo en ciertos tipos de células o en ciertas etapas de desarrollo, y heterocromatina constitutiva que consta de componentes estructurales cromosómicos como telómeros y centrómeros . [17] Durante la interfase, la cromatina se organiza en parches individuales discretos, [18] llamados territorios cromosómicos . [19] Los genes activos, que generalmente se encuentran en la región eucromatica del cromosoma, tienden a ubicarse hacia el límite del territorio del cromosoma. [20]
Los anticuerpos contra ciertos tipos de organización de la cromatina, en particular, los nucleosomas , se han asociado con una serie de enfermedades autoinmunes , como el lupus eritematoso sistémico . [21] Estos se conocen como anticuerpos antinucleares (ANA) y también se han observado junto con la esclerosis múltiple como parte de la disfunción general del sistema inmunológico. [22]
El nucléolo es la más grande de las estructuras discretas sin membrana, densamente teñidas, conocidas como cuerpos nucleares que se encuentran en el núcleo. Se forma alrededor de repeticiones en tándem de ADNr , ADN que codifica el ARN ribosomal (ARNr). Estas regiones se denominan regiones organizadoras nucleolares (NOR). Las funciones principales del nucleolo son sintetizar ARNr y ensamblar ribosomas . La cohesión estructural del nucléolo depende de su actividad, ya que el ensamblaje ribosomal en el nucléolo da como resultado la asociación transitoria de componentes nucleolos, lo que facilita un mayor ensamblaje ribosómico y, por tanto, una mayor asociación. Este modelo está respaldado por observaciones de que la inactivación del ADNr da como resultado el entremezclado de estructuras nucleolares. [23]
En el primer paso del ensamblaje de ribosomas, una proteína llamada ARN polimerasa I transcribe el ADNr, que forma un gran precursor de pre-ARNr. Éste se escinde en dos grandes subunidades de ARNr : 5,8S y 28S , y una pequeña subunidad de ARNr , 18S . [2] : 328 [24] La transcripción, el procesamiento postranscripcional y el ensamblaje del ARNr se producen en el nucléolo, con la ayuda de pequeñas moléculas de ARN nucleolar (snoRNA), algunas de las cuales se derivan de intrones empalmados de ARN mensajeros que codifican genes relacionados con función ribosómica. Las subunidades ribosómicas ensambladas son las estructuras más grandes que pasan a través de los poros nucleares . [6] : 526
Cuando se observa bajo el microscopio electrónico , se puede ver que el nucléolo consta de tres regiones distinguibles: los centros fibrilares más internos (FC), rodeados por el componente fibrilar denso (DFC) (que contiene fibrilarina y nucleolina ), que a su vez está bordeado por el componente granular (GC) (que contiene la proteína nucleofosmina ). La transcripción del ADNr se produce en la FC o en el límite FC-DFC y, por lo tanto, cuando aumenta la transcripción del ADNr en la célula, se detectan más FC. La mayor parte de la escisión y modificación de los ARNr se produce en la DFC, mientras que los últimos pasos que implican el ensamblaje de proteínas en las subunidades ribosómicas se producen en el GC. [24]
Además del nucléolo, el núcleo contiene otros cuerpos nucleares. Estos incluyen cuerpos de Cajal , cuerpos de Géminis de Cajal, asociación cariosomal de interfase polimórfica (PIKA), cuerpos de leucemia promielocítica (PML), paraspeckles y splicing speckles. Aunque se sabe poco sobre varios de estos dominios, son importantes porque muestran que el nucleoplasma no es una mezcla uniforme, sino que contiene subdominios funcionales organizados. [28]
Otras estructuras subnucleares aparecen como parte de procesos patológicos anormales. Por ejemplo, en algunos casos de miopatía nemalínica se ha descrito la presencia de pequeños bastones intranucleares . Esta afección suele ser el resultado de mutaciones en la actina , y los propios bastones están formados por actina mutante y otras proteínas citoesqueléticas. [30]
Un núcleo suele contener entre una y diez estructuras compactas llamadas cuerpos de Cajal o cuerpos enrollados (CB), cuyo diámetro mide entre 0,2 µm y 2,0 µm según el tipo y especie celular. [25] Cuando se observan bajo un microscopio electrónico, se parecen a bolas de hilo enredado [27] y son focos de distribución densos para la proteína coilin . [31] Los CB participan en varias funciones diferentes relacionadas con el procesamiento del ARN, específicamente la maduración del ARN nucleolar pequeño (ARNsno) y del ARN nuclear pequeño (ARNsn), y la modificación del ARNm de histonas. [25]
Similares a los cuerpos de Cajal son los cuerpos o gemas de Géminis de Cajal, cuyo nombre se deriva de la constelación de Géminis en referencia a su estrecha relación "gemela" con los CB. Las gemas son similares en tamaño y forma a los CB y, de hecho, son prácticamente indistinguibles bajo el microscopio. [31] A diferencia de los CB, las gemas no contienen pequeñas ribonucleoproteínas nucleares (snRNP), pero sí contienen una proteína llamada supervivencia de la neurona motora (SMN), cuya función se relaciona con la biogénesis de snRNP. Se cree que las gemas ayudan a los CB en la biogénesis de snRNP, [32] aunque también se ha sugerido a partir de evidencia microscópica que los CB y las gemas son manifestaciones diferentes de la misma estructura. [31] Estudios ultraestructurales posteriores han demostrado que las gemas son gemelas de los cuerpos de Cajal con la diferencia en el componente coilin; Los cuerpos de Cajal son SMN positivos y coilin positivos, y las gemas son SMN positivos y coilin negativos. [33]
Los dominios PIKA, o asociaciones cariosomales de interfase polimórfica, se describieron por primera vez en estudios de microscopía en 1991. Su función aún no está clara, aunque no se pensaba que estuvieran asociados con la replicación activa del ADN, la transcripción o el procesamiento del ARN. [34] Se ha descubierto que a menudo se asocian con dominios discretos definidos por una localización densa del factor de transcripción PTF, que promueve la transcripción de ARN nuclear pequeño (ARNsn). [35]
La proteína de la leucemia promielocítica (PML-cuerpos nucleares) son cuerpos esféricos que se encuentran dispersos por todo el nucleoplasma y miden entre 0,1 y 1,0 µm. Se les conoce con otros nombres, incluido el dominio nuclear 10 (ND10), los cuerpos de Kremer y los dominios oncogénicos de PML. [36] Los cuerpos nucleares de PML reciben el nombre de uno de sus componentes principales, la proteína de la leucemia promielocítica (PML). A menudo se ven en el núcleo en asociación con cuerpos de Cajal y cuerpos de escisión. [28] Los ratones Pml-/-, que son incapaces de crear cuerpos nucleares de PML, se desarrollan normalmente sin efectos nocivos obvios, lo que demuestra que los cuerpos nucleares de PML no son necesarios para la mayoría de los procesos biológicos esenciales. [37]
Las motas son estructuras subnucleares que están enriquecidas en factores de empalme de ARN premensajero y están ubicadas en las regiones de intercromatina del nucleoplasma de las células de mamíferos. [38] A nivel de microscopio de fluorescencia aparecen como estructuras puntiformes irregulares, que varían en tamaño y forma, y cuando se examinan mediante microscopía electrónica se ven como grupos de gránulos de intercromatina . Las motas son estructuras dinámicas, y tanto sus componentes proteicos como de proteínas de ARN pueden circular continuamente entre motas y otras ubicaciones nucleares, incluidos los sitios de transcripción activos. Los speckles pueden funcionar con p53 como potenciadores de la actividad genética para mejorar directamente la actividad de ciertos genes. Además, los objetivos del gen p53 asociado y no asociado a moteado son funcionalmente distintos. [39]
Los estudios sobre la composición, estructura y comportamiento de las motas han proporcionado un modelo para comprender la compartimentación funcional del núcleo y la organización de la maquinaria de expresión genética [40] que empalma las snRNP [41] [42] y otras proteínas de empalme necesarias para la pre- Procesamiento de ARNm. [40] Debido a los requisitos cambiantes de una célula, la composición y ubicación de estos cuerpos cambia de acuerdo con la transcripción y regulación del ARNm mediante la fosforilación de proteínas específicas. [43] Las motas de empalme también se conocen como motas nucleares (motas nucleares), compartimentos de factores de empalme (compartimentos SF), grupos de gránulos de intercromatina (IGC) y snurposomas B. [44] Los snurposomas B se encuentran en los núcleos de ovocitos de anfibios y en embriones de Drosophila melanogaster . Los snurposomas B aparecen solos o adheridos a los cuerpos de Cajal en las micrografías electrónicas de los núcleos de los anfibios. [45] Los IGC funcionan como sitios de almacenamiento para los factores de empalme. [46]
Descubierto por Fox et al. en 2002, los paraspeckles son compartimentos de forma irregular en el espacio de intercromatina del núcleo. [47] Documentados por primera vez en células HeLa, donde generalmente hay entre 10 y 30 por núcleo, [48] ahora se sabe que los paraspeckles también existen en todas las células primarias humanas, líneas celulares transformadas y secciones de tejido. [49] Su nombre se deriva de su distribución en el núcleo; el "para" es la abreviatura de paralelo y las "motas" se refieren a las motas de empalme a las que siempre están muy cerca. [48]
Los paraspeckles secuestran proteínas nucleares y ARN y, por lo tanto, parecen funcionar como una esponja molecular [50] que participa en la regulación de la expresión genética. [51] Además, los paraspeckles son estructuras dinámicas que se alteran en respuesta a cambios en la actividad metabólica celular. Dependen de la transcripción [47] y, en ausencia de la transcripción de RNA Pol II, el paraspeckle desaparece y todos sus componentes proteicos asociados (PSP1, p54nrb, PSP2, CFI(m)68 y PSF) forman una tapa perinucleolar en forma de media luna en el nucléolo. Este fenómeno se demuestra durante el ciclo celular. En el ciclo celular , los paramoteos están presentes durante la interfase y durante toda la mitosis excepto la telofase . Durante la telofase, cuando se forman los dos núcleos hijos, no hay transcripción de ARN Pol II , por lo que los componentes proteicos forman una capa perinucleolar. [49]
Las fibrillas de pericromatina son visibles sólo bajo un microscopio electrónico. Están ubicados junto a la cromatina transcripcionalmente activa y se supone que son los sitios de procesamiento activo del pre-ARNm . [46]
Los clastosomas son pequeños cuerpos nucleares (0,2 a 0,5 µm) que se describen con una forma de anillo grueso debido a la cápsula periférica que rodea estos cuerpos. [26] Este nombre se deriva del griego klastos , roto y soma , cuerpo. [26] Los clastosomas no suelen estar presentes en las células normales, lo que los hace difíciles de detectar. Se forman en condiciones proteolíticas elevadas dentro del núcleo y se degradan una vez que hay una disminución de la actividad o si las células se tratan con inhibidores del proteasoma . [26] [52] La escasez de clastosomas en las células indica que no son necesarios para la función del proteasoma . [53] También se ha demostrado que el estrés osmótico causa la formación de clastosomas. [54] Estos cuerpos nucleares contienen subunidades catalíticas y reguladoras del proteasoma y sus sustratos, lo que indica que los clastosomas son sitios para degradar proteínas. [53]
El núcleo proporciona un sitio para la transcripción genética que está separado del lugar de traducción en el citoplasma, lo que permite niveles de regulación genética que no están disponibles para los procariotas . La función principal del núcleo celular es controlar la expresión genética y mediar en la replicación del ADN durante el ciclo celular. [6] : 171
La envoltura nuclear permite el control del contenido nuclear y lo separa del resto del citoplasma cuando es necesario. Esto es importante para controlar los procesos a ambos lados de la membrana nuclear: en la mayoría de los casos en los que es necesario restringir un proceso citoplasmático, un participante clave se traslada al núcleo, donde interactúa con factores de transcripción para regular negativamente la producción de ciertas enzimas en la membrana nuclear. ruta. Este mecanismo regulador ocurre en el caso de la glucólisis , una vía celular para descomponer la glucosa para producir energía. La hexoquinasa es una enzima responsable del primer paso de la glucólisis, formando glucosa-6-fosfato a partir de glucosa. En altas concentraciones de fructosa-6-fosfato , una molécula formada posteriormente a partir de glucosa-6-fosfato, una proteína reguladora elimina la hexoquinasa al núcleo, [55] donde forma un complejo represor transcripcional con proteínas nucleares para reducir la expresión de los genes involucrados. en la glucólisis. [56]
Para controlar qué genes se transcriben, la célula separa algunas proteínas de factores de transcripción responsables de regular la expresión génica del acceso físico al ADN hasta que son activadas por otras vías de señalización. Esto previene incluso niveles bajos de expresión genética inapropiada. Por ejemplo, en el caso de los genes controlados por NF-κB , que participan en la mayoría de las respuestas inflamatorias , la transcripción se induce en respuesta a una vía de señales como la iniciada por la molécula de señalización TNF-α , que se une a un receptor de la membrana celular. lo que resulta en el reclutamiento de proteínas de señalización y, finalmente, activa el factor de transcripción NF-κB. Una señal de localización nuclear en la proteína NF-κB permite que sea transportada a través del poro nuclear hasta el núcleo, donde estimula la transcripción de los genes diana. [8]
La compartimentación permite que la célula impida la traducción del ARNm no empalmado. [57] El ARNm eucariota contiene intrones que deben eliminarse antes de traducirse para producir proteínas funcionales. El empalme se realiza dentro del núcleo antes de que los ribosomas puedan acceder al ARNm para su traducción. Sin el núcleo, los ribosomas traducirían el ARNm recién transcrito (no procesado), lo que daría como resultado proteínas malformadas y no funcionales. [6] : 108-15
La función principal del núcleo celular es controlar la expresión genética y mediar en la replicación del ADN durante el ciclo celular. [6] : 171 Se ha descubierto que la replicación ocurre de forma localizada en el núcleo celular. En la fase S de la interfase del ciclo celular; tiene lugar la replicación. Contrariamente a la visión tradicional de mover las horquillas de replicación a lo largo del ADN estancado, surgió el concepto de fábricas de replicación , lo que significa que las horquillas de replicación se concentran en algunas regiones de "fábrica" inmovilizadas a través de las cuales pasan las hebras de ADN modelo como cintas transportadoras. [58]

La expresión genética implica primero la transcripción, en la que el ADN se utiliza como plantilla para producir ARN. En el caso de los genes que codifican proteínas, el ARN producido a partir de este proceso es el ARN mensajero (ARNm), que luego debe ser traducido por los ribosomas para formar una proteína. Como los ribosomas se encuentran fuera del núcleo, es necesario exportar el ARNm producido. [59]
Dado que el núcleo es el sitio de la transcripción, también contiene una variedad de proteínas que median directamente la transcripción o participan en la regulación del proceso. Estas proteínas incluyen helicasas , que desenrollan la molécula de ADN de doble cadena para facilitar el acceso a ella, ARN polimerasas , que se unen al promotor del ADN para sintetizar la molécula de ARN en crecimiento, topoisomerasas , que cambian la cantidad de superenrollamiento en el ADN, ayudándolo a enrollarse y relajarse, así como una gran variedad de factores de transcripción que regulan la expresión. [60]
Las moléculas de ARNm recién sintetizadas se conocen como transcripciones primarias o pre-ARNm. Deben sufrir una modificación postranscripcional en el núcleo antes de ser exportados al citoplasma; El ARNm que aparece en el citoplasma sin estas modificaciones se degrada en lugar de utilizarse para la traducción de proteínas. Las tres modificaciones principales son la protección en 5' , la poliadenilación en 3' y el empalme de ARN . Mientras está en el núcleo, el pre-ARNm se asocia con una variedad de proteínas en complejos conocidos como partículas de ribonucleoproteínas heterogéneas (hnRNP). La adición del casquete 5' se produce de forma cotranscripcional y es el primer paso en la modificación postranscripcional. La cola de poliadenina 3' sólo se añade una vez completada la transcripción. [6] : 509-18
El empalme del ARN, llevado a cabo por un complejo llamado espliceosoma , es el proceso mediante el cual los intrones, o regiones del ADN que no codifican proteínas, se eliminan del pre-ARNm y los exones restantes se conectan para volver a formar una única molécula continua. . Este proceso normalmente ocurre después de la protección en 5' y la poliadenilación en 3', pero puede comenzar antes de que se complete la síntesis en transcripciones con muchos exones. [6] : 494 Muchos pre-ARNm se pueden unir de múltiples maneras para producir diferentes ARNm maduros que codifican diferentes secuencias de proteínas . Este proceso se conoce como empalme alternativo y permite la producción de una gran variedad de proteínas a partir de una cantidad limitada de ADN. [61]

La entrada y salida de moléculas grandes del núcleo está estrechamente controlada por los complejos de poros nucleares. Aunque las moléculas pequeñas pueden ingresar al núcleo sin regulación, [62] las macromoléculas como el ARN y las proteínas requieren carioferinas de asociación llamadas importinas para ingresar al núcleo y exportinas para salir. Las proteínas "de carga" que deben ser translocadas desde el citoplasma al núcleo contienen secuencias cortas de aminoácidos conocidas como señales de localización nuclear , que están unidas por importinas, mientras que las transportadas desde el núcleo al citoplasma llevan señales de exportación nuclear unidas por exportinas. La capacidad de las importinas y exportinas para transportar su carga está regulada por las GTPasas , enzimas que hidrolizan la molécula trifosfato de guanosina (GTP) para liberar energía. La GTPasa clave en el transporte nuclear es Ran , que está unida a GTP o GDP (difosfato de guanosina), dependiendo de si está ubicado en el núcleo o en el citoplasma. Mientras que las importadoras dependen de RanGTP para disociarse de su carga, las exportadoras requieren RanGTP para unirse a su carga. [7]
La importación nuclear depende de que la importina una su carga en el citoplasma y la transporte a través del poro nuclear hasta el núcleo. Dentro del núcleo, RanGTP actúa para separar la carga de la importina, permitiendo que la importina salga del núcleo y se reutilice. La exportación nuclear es similar, ya que la exportina une la carga dentro del núcleo en un proceso facilitado por RanGTP, sale a través del poro nuclear y se separa de su carga en el citoplasma. [63]
Existen proteínas de exportación especializadas para la translocación de ARNm y ARNt maduros al citoplasma una vez completada la modificación postranscripcional. Este mecanismo de control de calidad es importante debido al papel central de estas moléculas en la traducción de proteínas. La mala expresión de una proteína debido a una escisión incompleta de exones o una mala incorporación de aminoácidos podría tener consecuencias negativas para la célula; por tanto, el ARN modificado de forma incompleta que llega al citoplasma se degrada en lugar de utilizarse en la traducción. [6]

Durante su vida, un núcleo puede descomponerse o destruirse, ya sea en el proceso de división celular o como consecuencia de la apoptosis (el proceso de muerte celular programada ). Durante estos eventos, los componentes estructurales del núcleo (la envoltura y la lámina) pueden degradarse sistemáticamente. En la mayoría de las células, el desmontaje de la envoltura nuclear marca el final de la profase de la mitosis. Sin embargo, este desmontaje del núcleo no es una característica universal de la mitosis y no ocurre en todas las células. Algunos eucariotas unicelulares (p. ej., las levaduras) sufren la llamada mitosis cerrada , en la que la envoltura nuclear permanece intacta. En la mitosis cerrada, los cromosomas hijos migran a polos opuestos del núcleo, que luego se divide en dos. Las células de los eucariotas superiores, sin embargo, suelen sufrir mitosis abierta , que se caracteriza por la ruptura de la envoltura nuclear. Luego, los cromosomas hijos migran a polos opuestos del huso mitótico y nuevos núcleos se reensamblan a su alrededor. [6] : 854
En cierto punto durante el ciclo celular en la mitosis abierta, la célula se divide para formar dos células. Para que este proceso sea posible, cada una de las nuevas células hijas debe tener un conjunto completo de genes, proceso que requiere la replicación de los cromosomas y la segregación de los conjuntos separados. Esto ocurre porque los cromosomas replicados, las cromátidas hermanas , se unen a los microtúbulos , que a su vez están unidos a diferentes centrosomas . Luego, las cromátidas hermanas pueden separarse en lugares separados de la célula. En muchas células, el centrosoma está situado en el citoplasma, fuera del núcleo; los microtúbulos no podrían unirse a las cromátidas en presencia de la envoltura nuclear. [64] Por lo tanto, en las primeras etapas del ciclo celular, comenzando en la profase y hasta alrededor de la prometafase , la membrana nuclear se desmantela. [11] Asimismo, durante el mismo periodo también se desmonta la lámina nuclear, proceso regulado por la fosforilación de las láminas por proteínas quinasas como la proteína quinasa CDC2 . [65] Hacia el final del ciclo celular, la membrana nuclear se reforma y, aproximadamente al mismo tiempo, la lámina nuclear se vuelve a ensamblar mediante la desfosforilación de las láminas. [sesenta y cinco]
Sin embargo, en los dinoflagelados , la envoltura nuclear permanece intacta, los centrosomas se ubican en el citoplasma y los microtúbulos entran en contacto con los cromosomas, cuyas regiones centroméricas se incorporan a la envoltura nuclear (la llamada mitosis cerrada con huso extranuclear). En muchos otros protistas (p. ej., ciliados , esporozoos ) y hongos, los centrosomas son intranucleares y su envoltura nuclear tampoco se desmonta durante la división celular. [66]
La apoptosis es un proceso controlado en el que los componentes estructurales de la célula se destruyen, lo que provoca la muerte de la célula. Los cambios asociados a la apoptosis afectan directamente al núcleo y su contenido, por ejemplo, en la condensación de la cromatina y la desintegración de la envoltura y lámina nuclear. La destrucción de las redes de láminas está controlada por proteasas apoptóticas especializadas llamadas caspasas , que escinden las proteínas de láminas y, por lo tanto, degradan la integridad estructural del núcleo. La escisión de la lamina se utiliza a veces como indicador de laboratorio de la actividad de caspasa en ensayos de actividad apoptótica temprana. [11] Las células que expresan láminas mutantes resistentes a caspasa son deficientes en los cambios nucleares relacionados con la apoptosis, lo que sugiere que las láminas desempeñan un papel en el inicio de los eventos que conducen a la degradación apoptótica del núcleo. [11] La inhibición del ensamblaje de láminas en sí misma es un inductor de la apoptosis. [67]
La envoltura nuclear actúa como una barrera que impide que los virus de ADN y ARN ingresen al núcleo. Algunos virus requieren acceso a proteínas dentro del núcleo para poder replicarse y/o ensamblarse. Los virus de ADN, como el herpesvirus , se replican y ensamblan en el núcleo celular y salen por gemación a través de la membrana nuclear interna. Este proceso va acompañado del desmontaje de la lámina de la cara nuclear de la membrana interna. [11]
Inicialmente se sospechaba que las inmunoglobulinas en general y los autoanticuerpos en particular no penetraban en el núcleo. Actualmente existe evidencia de que en condiciones patológicas (por ejemplo, lupus eritematoso ) la IgG puede ingresar al núcleo. [68]
La mayoría de los tipos de células eucariotas suelen tener un solo núcleo, pero algunas no tienen núcleos, mientras que otras tienen varios. Esto puede ser el resultado de un desarrollo normal, como en la maduración de los glóbulos rojos de los mamíferos , o de una división celular defectuosa. [69]
Una célula anucleada no contiene núcleo y, por tanto, es incapaz de dividirse para producir células hijas. La célula anucleada más conocida es el glóbulo rojo de los mamíferos, o eritrocito , que también carece de otros orgánulos como las mitocondrias y sirve principalmente como vaso de transporte para transportar oxígeno desde los pulmones a los tejidos del cuerpo. Los eritrocitos maduran mediante eritropoyesis en la médula ósea , donde pierden sus núcleos, orgánulos y ribosomas. El núcleo es expulsado durante el proceso de diferenciación de eritroblasto a reticulocito , que es el precursor inmediato del eritrocito maduro. [70] La presencia de mutágenos puede inducir la liberación de algunos eritrocitos "micronucleados" inmaduros en el torrente sanguíneo. [71] [72] Las células anucleadas también pueden surgir de una división celular defectuosa en la que una hija carece de núcleo y la otra tiene dos núcleos.
En las plantas con flores , esta condición ocurre en los elementos del tubo criboso . [73]
Las células multinucleadas contienen múltiples núcleos. La mayoría de las especies de protozoos acantareos [74] y algunos hongos en micorrizas [75] tienen células multinucleadas de forma natural. Otros ejemplos incluyen los parásitos intestinales del género Giardia , que tienen dos núcleos por célula. [76] Los ciliados tienen dos tipos de núcleos en una sola célula, un macronúcleo somático y un micronúcleo de la línea germinal . [77] En los seres humanos, las células del músculo esquelético , también llamadas miocitos y sincitios , se vuelven multinucleadas durante el desarrollo; la disposición resultante de los núcleos cerca de la periferia de las células permite un espacio intracelular máximo para las miofibrillas . [6] Otras células multinucleadas en el ser humano son los osteoclastos, un tipo de célula ósea . Las células multinucleadas y binucleadas también pueden ser anormales en humanos; por ejemplo, las células que surgen de la fusión de monocitos y macrófagos , conocidas como células multinucleadas gigantes , a veces acompañan a la inflamación [78] y también están implicadas en la formación de tumores. [79]
Se sabe que varios dinoflagelados tienen dos núcleos. A diferencia de otras células multinucleadas, estos núcleos contienen dos linajes distintos de ADN: uno del dinoflagelado y el otro de una diatomea simbiótica . [80]
Como principal característica definitoria de la célula eucariota, el origen evolutivo del núcleo ha sido objeto de mucha especulación. Se han propuesto cuatro hipótesis principales para explicar la existencia del núcleo, aunque ninguna ha obtenido todavía un apoyo generalizado. [81] [82] [83]
El primer modelo conocido como "modelo sintrófico" propone que una relación simbiótica entre las arqueas y las bacterias creó la célula eucariota que contiene el núcleo. (Los organismos del dominio Archaea y Bacteria no tienen núcleo celular. [84] ) Se plantea la hipótesis de que la simbiosis se originó cuando las arqueas antiguas, similares a las arqueas metanogénicas modernas , invadieron y vivieron dentro de bacterias similares a las mixobacterias modernas , formando finalmente el núcleo temprano. Esta teoría es análoga a la teoría aceptada sobre el origen de las mitocondrias y los cloroplastos eucariotas , que se cree que se desarrollaron a partir de una relación endosimbiótica similar entre protoeucariotas y bacterias aeróbicas. [85] Una posibilidad es que la membrana nuclear surgiera como un nuevo sistema de membranas siguiendo el origen de las mitocondrias en un huésped arquebacteriano . [86] La membrana nuclear puede haber servido para proteger el genoma de las dañinas especies reactivas de oxígeno producidas por las protomitocondrias. [87] El origen arqueal del núcleo está respaldado por observaciones de que las arqueas y eukarya tienen genes similares para ciertas proteínas, incluidas las histonas . Las observaciones de que las mixobacterias son móviles, pueden formar complejos multicelulares y poseen quinasas y proteínas G similares a las eucariotas, respaldan un origen bacteriano de la célula eucariota. [88]
Un segundo modelo propone que las células protoeucariotas evolucionaron a partir de bacterias sin una etapa endosimbiótica. Este modelo se basa en la existencia de bacterias Planctomycetota modernas que poseen una estructura nuclear con poros primitivos y otras estructuras de membrana compartimentadas. [89] Una propuesta similar afirma que una célula similar a un eucariota, el cronocito , evolucionó primero y fagocitó arqueas y bacterias para generar el núcleo y la célula eucariota. [90]
El modelo más controvertido, conocido como eucariogénesis viral , postula que el núcleo rodeado de membrana, junto con otras características eucariotas, se originó a partir de la infección de un procariota por un virus. La sugerencia se basa en similitudes entre eucariotas y virus, como cadenas lineales de ADN, protección de ARNm y unión estrecha a proteínas (analogizando las histonas a las envolturas virales ). Una versión de la propuesta sugiere que el núcleo evolucionó junto con la fagocitosis para formar un " depredador " celular temprano. [91] Otra variante propone que los eucariotas se originaron a partir de arqueas tempranas infectadas por poxvirus , sobre la base de la similitud observada entre las ADN polimerasas en los poxvirus modernos y los eucariotas. [92] [93] Se ha sugerido que la cuestión no resuelta de la evolución del sexo podría estar relacionada con la hipótesis de la eucariogénesis viral. [94]
Una propuesta más reciente, la hipótesis de la exomembrana , sugiere que el núcleo se originó a partir de una única célula ancestral que desarrolló una segunda membrana celular exterior; la membrana interior que encierra la célula original se convirtió luego en la membrana nuclear y desarrolló estructuras de poros cada vez más elaboradas para el paso de componentes celulares sintetizados internamente, como las subunidades ribosómicas. [95]


El núcleo fue el primer orgánulo descubierto. El que probablemente sea el dibujo más antiguo conservado se remonta al primer microscopista Antonie van Leeuwenhoek (1632-1723). Observó una "luz", el núcleo, en los glóbulos rojos del salmón . [96] A diferencia de los glóbulos rojos de los mamíferos, los de otros vertebrados todavía contienen núcleos. [97]
El núcleo también fue descrito por Franz Bauer en 1804 [98] y con más detalle en 1831 por el botánico escocés Robert Brown en una charla en la Sociedad Linneana de Londres . Brown estaba estudiando orquídeas bajo el microscopio cuando observó una zona opaca, a la que llamó "areola" o "núcleo", en las células de la capa exterior de la flor. [99] No sugirió una función potencial.
En 1838, Matthias Schleiden propuso que el núcleo desempeña un papel en la generación de células, por lo que introdujo el nombre de " citoblasto " ("constructor de células"). Creía haber observado nuevas células reuniéndose alrededor de "citoblastos". Franz Meyen se opuso firmemente a este punto de vista, ya que había descrito células que se multiplicaban por división y creía que muchas células no tendrían núcleo. La idea de que las células pueden generarse de novo, por el "citoblasto" o de otra manera, contradecía el trabajo de Robert Remak (1852) y Rudolf Virchow (1855), quienes propagaron decisivamente el nuevo paradigma de que las células son generadas únicamente por células (" Omnis cellula e célula "). La función del núcleo seguía sin estar clara. [100]
Entre 1877 y 1878, Oscar Hertwig publicó varios estudios sobre la fertilización de huevos de erizo de mar , demostrando que el núcleo del espermatozoide ingresa al ovocito y se fusiona con su núcleo. Esta fue la primera vez que se sugirió que un individuo se desarrolla a partir de una (única) célula nucleada. Esto contradecía la teoría de Ernst Haeckel de que la filogenia completa de una especie se repetiría durante el desarrollo embrionario, incluida la generación de la primera célula nucleada a partir de una "monérula", una masa sin estructura de protoplasma primordial (" Urschleim "). Por lo tanto, durante bastante tiempo se discutió la necesidad del núcleo del espermatozoide para la fertilización. Sin embargo, Hertwig confirmó su observación en otros grupos de animales, incluidos anfibios y moluscos . Eduard Strasburger produjo los mismos resultados para las plantas en 1884. Esto allanó el camino para asignar al núcleo un papel importante en la herencia. En 1873, August Weismann postuló la equivalencia de las células germinales maternas y paternas en la herencia. La función del núcleo como portador de información genética sólo quedó clara más tarde, tras el descubrimiento de la mitosis y el redescubrimiento de las reglas mendelianas a principios del siglo XX; Por tanto, se desarrolló la teoría cromosómica de la herencia . [100]
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )