Los Planctomycetota son un filo de bacterias ampliamente distribuidas , que se encuentran tanto en hábitats acuáticos como terrestres. [5] Desempeñan un papel considerable en los ciclos globales del carbono y el nitrógeno, y muchas especies de este filo son capaces de realizar oxidación anaeróbica de amonio, también conocida como anammox . [5] [6] Muchos Planctomycetota se encuentran en abundancia relativamente alta como biopelículas , [7] a menudo asociándose con otros organismos como macroalgas y esponjas marinas . [8]
Planctomycetota se incluye en el superfilo PVC junto con Verrucomicrobiota , Chlamydiota , Lentisphaerota , Kiritimatiellaeota y Candidatus Omnitrophica . [9] [10] El filo Planctomycetota está compuesto por las clases Planctomycetia y Phycisphaerae. Descritos por primera vez en 1924, los miembros de Planctomycetota fueron identificados como eucariotas y sólo más tarde fueron descritos como bacterias en 1972. [5] El examen inicial de los miembros de Planctomycetota sugirió un plan celular que difiere considerablemente de otras bacterias, aunque ahora se confirma que son Gram -Bacterias negativas , pero con muchas características únicas.
Las bacterias de Planctomycetota suelen ser células pequeñas y esféricas, pero se observa una gran cantidad de variación morfológica. [11] Los miembros de Planctomycetota también muestran hábitos reproductivos distintos, y muchas especies se dividen por gemación , en contraste con todas las demás bacterias de vida libre, que se dividen por fisión binaria . [5] [12] [13]
Está creciendo el interés en Planctomycetota con respecto a la biotecnología y las aplicaciones humanas, principalmente como fuente de moléculas bioactivas. [14] Además, algunos Planctomycetota fueron descritos recientemente como patógenos humanos. [8]
Se ha identificado específicamente que la especie Gemmata obscuriglobus comprende bacterias con características únicas entre los Planctomycetota, [15] [16] , como su capacidad para sintetizar esteroles . [5] [17] [15]
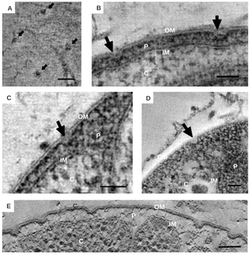
Las distintas características morfológicas de las bacterias de Planctomycetota se han discutido ampliamente. [6] La morfología común es a menudo células esféricas de aproximadamente 2 μm de diámetro, como se observa en la especie Aquisphaera giovannonii . Sin embargo, la diversidad en la forma de las células a menudo varía mucho en ellas. En algunas especies se han descrito células ovoides y en forma de pera, que a menudo se presentan en rosetas de tres a 10 células. [11] Gemmata obscuriglobus es una especie bien estudiada del Planctomycetota con células esféricas. Por el contrario, las bacterias de la especie Planctopirus limnophila tienen células ovoides. [15]
Muchas especies de Planctomycetota presentan estructuras y apéndices en la superficie exterior de la célula. Los flagelos , comunes en la mayoría de las bacterias, también se han observado en la especie P. limnophila. [5] [11] [18] Muchos Planctomycetota también tienen un soporte o tallo que une la célula a una superficie o sustrato. [5] [18] Sin embargo, los miembros de algunas especies, como Isosphaera pallida, carecen de un punto de sujeción. [5]
Se han observado apéndices únicos conocidos como estructuras crateriformes [5] [11] [18] en especies de Planctomycetota que pertenecen a la clase Planctomycetia. [13] La superficie exterior de las células de la especie P. limnophila muestra estructuras crateriformes tanto grandes como pequeñas. Las estructuras crateriformes grandes a menudo cubren la superficie celular, mientras que las estructuras crateriformes pequeñas suelen estar solo en el extremo de la célula. La microscopía óptica demostró fibras de tipo tallo y pili en P. limnophila y G. obscuriglobus . Las fibras del pili en ambas especies a menudo estaban asociadas con grandes estructuras crateriformes; por el contrario, las fibras del tallo estaban asociadas con pequeñas estructuras crateriformes. [18]
El examen inicial de Planctomycetota sugirió que su plan celular difería considerablemente del de las bacterias Gram positivas y Gram negativas . [5] Hasta hace poco, se pensaba que las bacterias de Planctomycetota carecían de peptidoglicanos en sus paredes celulares y, en cambio, se sugería que tenían paredes celulares proteicas. El peptidoglicano es un polímero esencial de glicanos, presente en todas las bacterias de vida libre, y su rigidez ayuda a mantener la integridad de la célula. La síntesis de peptidoglicanos también es esencial durante la división celular . Recientemente, se descubrió que los de la especie G. obscuriglobus tenían peptidoglicano en sus paredes celulares. [5] [18]
Alguna vez se pensó que Planctomycetota mostraba una compartimentación distinta dentro del citosol . [5] [18] La reconstrucción por tomografía electrónica tridimensional de G. obscuriglobus mostró diversas interpretaciones de esta compartimentación sugerida. [16] Se sugirió que el citosol estuviera separado en compartimentos, tanto el parifoplasma como el pirelulosoma, mediante una membrana intracitoplasmática. Desde entonces se ha demostrado que esta interpretación es incorrecta. De hecho, es bien sabido que la membrana intracitoplasmática es la membrana citoplasmática que muestra invaginaciones únicas , dando la apariencia de compartimentación dentro del citosol. [5] [16] [18] Por lo tanto, Planctomycetota muestra los dos compartimentos típicos de las bacterias Gram-negativas, el citoplasma y el periplasma .
El exceso de membrana observado en G. obscuriglobus triplica la superficie de la célula en relación con su volumen , lo que se sugiere que está asociado con la síntesis de esteroles. [dieciséis]
Muchas especies de Planctomycetota muestran una coloración rosada o naranja, que se cree que es el resultado de la producción de pigmentos carotenoides. Los carotenoides son producidos por plantas y hongos , y por algunas bacterias heterótrofas para proteger contra el estrés oxidativo . Se han identificado tres pigmentos carotenoides diferentes en dos cepas diferentes de Planctomycetota. [19]
En ambientes marinos, Planctomycetota a menudo está suspendido en la columna de agua o presente como biopelículas en la superficie de macroalgas y, a menudo, está expuesto a la dañina radiación ultravioleta. Las especies más pigmentadas de Planctomycetota son más resistentes a la radiación ultravioleta, aunque esto aún no se comprende bien. [20] Desde entonces se ha demostrado que Planctomycetota sintetiza carotenoides C30 a partir de escualeno y que esta ruta del escualeno a carotenoides C30 es la más extendida en procariotas. [21]
Las bacterias de Planctomycetota que son capaces de anammox forman el orden Brocadiales. [22] Las células de las bacterias anammox son a menudo cocoides con un diámetro de aproximadamente 0,8 μm, [7] y se sugiere que contienen tres compartimentos, cada uno rodeado por una membrana. La membrana externa encierra la célula y el protoplasma y la membrana más interna rodea el anammoxosoma, la estructura central de las bacterias anammox. [18] [23] La membrana del anammoxosoma está compuesta en gran parte por lípidos inusuales a base de ladderano . [23]
Las especies de Planctomycetota crecen lentamente, en comparación con otras bacterias, [5] [10] [7] [24] a menudo formando estructuras en roseta de 3 a 5 células. [5] [24] Se sugiere que la especie P. limnophila crece relativamente rápido, [5] [25] con un tiempo de duplicación de aproximadamente 6 a 14 días. Por el contrario, algunos otros Planctomycetota tienen tiempos de duplicación de alrededor de 30 días. [25] Su gran abundancia en muchos ecosistemas es sorprendente, dadas sus lentas tasas de crecimiento. [7] [10]
_and_in_current_PVC_species_(Right).jpg/440px-Representation_of_division_modes_in_the_last_PVC_common_ancestor_(Left)_and_in_current_PVC_species_(Right).jpg)
Planctomycetota a menudo realiza un cambio de estilo de vida entre una etapa de pedúnculo sésil y una etapa de natación libre. [24] Los miembros de la especie P. limnophila realizan un cambio de estilo de vida que a menudo se asocia con la división celular. La célula madre sésil produce una célula hija que nada libremente. Luego, la célula hija debe adherirse a una superficie antes de comenzar el ciclo nuevamente. Sin embargo, no todos los Planctomycetota tienen una etapa móvil y el cambio de estilo de vida observado en muchas especies puede no ser común entre todos los Planctomycetota. [5]
.jpg/440px-Fmicb-07-01964-g002_(1).jpg)
La comprensión actual de la división celular bacteriana se basa en organismos modelo como Escherichia coli . [15] La forma dominante de reproducción observada en casi todas las bacterias es la división celular por fisión binaria , que implica la síntesis tanto de peptidoglicanos como de proteínas conocidas como FtsZ . [15] [26] Por el contrario, muchas bacterias de Planctomycetota se dividen por gemación . [5] [12] [13]
Se sugiere que las proteínas FtsZ tienen una estructura similar a la de la tubulina , la proteína presente en los eucariotas, [27] y es esencial para la formación de tabiques durante la división celular. [5] [6] La falta de proteínas FtsZ es a menudo letal. [5] El peptidoglicano también juega un papel considerable en la división celular por fisión binaria. [26]
Planctomycetota es uno de los únicos filos conocidos cuyos miembros carecen de proteínas FtsZ. [5] [26] [27] Las bacterias de Chlamydiales, también miembro del superfilo PVC, también carecen de FtsZ. [27] Aunque las bacterias de Planctomycetota carecen de FtsZ, se han observado dos modos distintos de división celular. [5] La mayoría de los Planctomycetota se dividen por fisión binaria, principalmente especies de la clase Phycisphaerae. Por el contrario, las especies de la clase Planctomycetia se dividen por gemación. [5] [12] [13]
Los mecanismos implicados en la gemación se han descrito ampliamente para las células de levadura . Sin embargo, la gemación bacteriana observada en Planctomycetota aún no se conoce bien. [15] Se ha observado gemación tanto en células con simetría radial, como las bacterias de la especie P. limnophila , como en células con simetría axial. [13] Durante la división celular en miembros de P. limnophila , las células hijas se originan en la región opuesta al polo con el soporte o tallo.
Se ha observado una diversidad considerable en la división celular entre las bacterias de Planctomycetota. [12] [13] Durante la división celular en Fuerstia marisgermanicae , una estructura tubular está conectada desde la yema a la célula madre. [5] [22] La especie Kolteria novifilia forma un clado distinto de Planctomycetota y es la única especie conocida que se divide por gemación lateral en el centro de la célula. Por último, los miembros del clado Saltatorellus son capaces de alternar entre fisión binaria y gemación. [12] [13]
Los planctomycetota son conocidos por sus características celulares inusuales, y su distinción de todas las demás bacterias está respaldada además por la presencia compartida de dos indeles de firma conservados (CSI). [28] Estos CSI delimitan el grupo de los filos vecinos dentro del grupo PVC. [29] Se ha encontrado un CSI adicional que comparten todas las especies de Planctomycetota, con la excepción de Kuenenia stuttgartiensis. Esto apoya la idea de que K. stuttgartiensis forma una rama profunda dentro del filo Planctomycetota.
También se ha descubierto que todo el superfilo de PVC, incluido Planctomycetota, comparte un CSI. [28] [29] Planctomycetota también contiene una importante proteína distintiva conservada que se ha caracterizado por desempeñar una importante función de mantenimiento que es exclusiva de los miembros que pertenecen al superfilo PVC. [30]
Se ha estimado que el tamaño del genoma de Rhodopirellula baltica supera los 7 millones de bases, lo que lo convierte en uno de los genomas procarióticos más grandes secuenciados. La duplicación extensa del genoma ocupa aproximadamente el 25% de la secuencia del genoma. [6] Esta puede ser una forma para que el organismo se adapte a las mutaciones , permitiendo la redundancia si una parte del genoma está dañada. El cebador de reacción en cadena de la polimerasa utilizado a menudo no coincide con los genes, lo que crea dificultades a la hora de secuenciar el genoma. [9]
Al comparar bajo un microscopio, una característica definitoria de algunos Planctomycetota es que se puede identificar un único operón de ARNr no unido cerca del origen. Los cambios de material genético se producen mediante inversión cromosómica interna y no mediante transferencia lateral de genes. Esto crea una forma de diversificación en las variantes de Planctomycetota, ya que múltiples genes transposones en estas regiones tienen una orientación inversa que se transfiere a reordenamientos.
Algunos Planctomycetota prosperan en regiones que contienen nitrato altamente concentrado , [6] y tienen genes necesarios para la fermentación del ácido heterotáctico. La enzima lactato deshidrogenasa juega un papel clave en este proceso. El proceso genético también tiene respuesta de protección contra la radiación ultravioleta , y está asociado con los genes recA, lexA, uvrA, uvrB y uvrC , además de un gen de fotoliasa que se expresa cuando el ambiente ofrece estrés excesivo por radiación ultravioleta. Otras respuestas al estrés incluyen la descomposición del peróxido de hidrógeno y la oxidación .
Muchos Planctomycetota también expresan genes de sulfatasa . El genoma de Pirellula sp. La cepa 1 incorpora 110 genes que contribuyen a codificar proteínas que producen enzimas sulfatasas. En comparación con otra especie de procariótico, Pseudomonas aeruginosa, sólo se producen 6 sulfatasas y los genes que expresan estas proteínas están contenidos en dos a cinco pares, normalmente agrupados en 22 grupos. [6]
Los planctomycetota se originan dentro de las bacterias y estas similitudes entre las proteínas de Planctomycetales y eucariotas reflejan una evolución convergente . Las familias de proteínas obtenidas en Gemmataceae , un subgrupo dentro de Planctomycetota, tienen baja similitud de secuencia con las proteínas eucariotas; sin embargo, muestran la mayor similitud de secuencia con otras familias de proteínas de Gemmataceae. [31]
Hay una aparición masiva de nuevas familias de proteínas dentro de Gemmataceae . Se adquirieron más de mil familias de proteínas mediante duplicaciones y reordenamientos de dominios. Los nuevos parálogos funcionan en la transducción de señales , los sistemas reguladores y las vías de interacción de proteínas. Están relacionados con la organización funcional de la célula, lo que puede interpretarse como una adaptación a un estilo de vida más complejo. [31] La longitud de la proteína es más larga en Gemmataceae que en la mayoría de las otras bacterias y los genes tienen conectores. Existe una superposición entre las proteínas más largas de Planctomycetales y las proteínas más cortas de eucariotas. En términos de paralogía genética, longitud de las proteínas y estructuras de dominios de las proteínas, los procariotas y los eucariotas no tienen límites definidos. [31]
Originalmente clasificado como eucariota debido a su morfología, la llegada de la secuenciación genética permitió a los investigadores estar de acuerdo en que Planctomycetota pertenece al dominio Bacteria. [5] Dentro de ese dominio, Planctomycetota se clasifica como su propio filo; sin embargo, otros investigadores han argumentado que también podrían clasificarse como parte de un superfilo más grande titulado PVC, que abarcaría los filos Verrucomicrobia, Chlamydiae y Lentisphaerae, y el filo candidato. " Candidatus omnitrófico". [9] Dentro de este superfilo, se ha descubierto que sus miembros están estrechamente relacionados mediante la creación de árboles de ARNr 16S. Tanto Planctomycetota como Chlamydiota codifican proteínas para transportadores de nucleótidos , y también se ha descubierto que Verrucomicrobiota tiene características comunes entre las células eucariotas. Por tanto, un ancestro común de este superfilo puede haber sido el inicio del linaje eucariota. [9] Si bien esta es una posible explicación, debido a que el PVC no es el comienzo del árbol bacteriano, [32] la existencia de rasgos y genes eucarióticos se explica más probablemente a través de la transferencia lateral de genes, y no de un ancestro eucariótico más reciente. [9]
Los miembros de Planctomycetota se encuentran en una amplia gama de entornos, tanto geográficos como ecológicos, [39] y se encuentran tanto en hábitats acuáticos como terrestres. [5] En ambientes acuáticos, se encuentran tanto en sistemas marinos como de agua dulce. [39] Originalmente se creía que Planctomycetota existía exclusivamente en ambientes acuáticos, pero ahora se sabe que también abundan en suelos [40] y ambientes hipersalinos. [41] Están muy extendidos en los cinco continentes, incluida la Antártida y Australia . [40] [39]
Se utilizó hibridación fluorescente in situ para detectar Planctomycetota en diversos ambientes, y Planctomycetota se encuentra en abundancia en turberas de sphagnum. Algunos Planctomycetota se encontraron en los sistemas digestivos de formas de vida marinas, mientras que otros tienden a vivir entre eucariotas. [9]
Planctomycetota representa aproximadamente el 11% de las comunidades procarióticas en los sistemas marinos, y su amplia distribución demuestra su capacidad para habitar muchos ambientes diferentes. También pueden adaptarse a condiciones tanto aeróbicas como anaeróbicas. Muchos factores pueden afectar su distribución, como la humedad, los niveles de oxígeno y los niveles de pH. La diversidad y abundancia de Planctomycetota están fuertemente asociadas con la humedad relativa. Los efectos de los niveles de oxígeno demuestran las necesidades energéticas del individuo. Muchas especies de Planctomycetota son quimioheterótrofas, incluida G. obscuriglobus . Thermostilla marina , una especie anaeróbica termófila que ocupa regiones de respiraderos hidrotermales , puede utilizar azufre elemental para generar sulfuro y respirar con nitrato . Planctomycetota también puede habitar regiones con rangos de niveles de pH de 4,2 a 11,6. [8]
Planctomycetota tiene un impacto significativo en la biogeoquímica y el clima global, con su capacidad para mineralizar y descomponer partículas de detritos en la columna de agua. [6] [20]
Planctomycetota juega un papel considerable en el ciclo global del carbono . [5] [6] [13] [42] Como quimioheterótrofos aeróbicos obligados y facultativos , la principal fuente de carbono utilizada por Planctomycetota proviene de los carbohidratos . Muchos Planctomycetota tienen la capacidad de descomponer carbohidratos extremadamente complejos, poniendo estos nutrientes a disposición de otros organismos. Esta capacidad de reciclar carbono se ha relacionado con genes específicos del metabolismo C1 observados en muchos Planctomycetota y se sugiere que desempeñan un papel importante, pero esta área de investigación aún no se comprende bien.
Planctomycetota también muestra muchas enzimas sulfatasas , que son capaces de descomponer los heteropolisacáridos sulfatados, que son producidos por muchos grupos de macroalgas. La degradación de estos heteropolisacáridos sulfatados por Planctomycetota se utiliza luego como fuente de energía. Se sugiere que algunos Planctomycetota son capaces de descomponer la carragenina . [42]

Planctomycetota se ha observado a menudo en asociación con muchos organismos, incluidas macroalgas, microalgas, esponjas marinas y plantas como líquenes y briofitas . [8] También se les ha observado habitando filtraciones frías de aguas profundas , donde son organismos dominantes que viven en gusanos tubulares . [5]

Los planctomycetota a menudo se asocian con superficies marinas ricas en nutrientes. Ocurren como biopelículas en superficies de algas en abundancia relativamente alta. [7] Se sugiere que las macroalgas como las algas Laminaria hyperborea y Ecklonia radiata son un hábitat importante para Planctomycetota. [5] [43] Aproximadamente el 70% de la comunidad bacteriana de Ecklonia radiata eran Planctomycetota. [5] [10] Casi 150 especies de Planctomycetota se han aislado de las biopelículas de macroalgas, y estas comunidades asociadas con macroalgas son principalmente independientes de los cambios en la distribución geográfica. Esto sugeriría una relación simbiótica . [8]
Los bosques de algas dominan las costas rocosas de las regiones templadas y proporcionan hábitat, refugio y alimento para muchos organismos, incluido Planctomycetota. [5] Dado el papel considerable de los bosques de algas marinas en la productividad primaria costera , la asociación de Planctomycetota con algas marinas podría indicar su papel importante en los hábitats costeros. [44] Planctomycetota también juega un papel importante como componente de los detritos en la columna de agua, también conocida como nieve marina , [5] [44] dada su capacidad para adherirse a las superficies. [45]
A medida que el clima continúa calentándose, la abundancia de Planctomycetota asociada con macroalgas podría aumentar. El alga Caulerpa taxifolia se incubó en condiciones con niveles más elevados de CO 2 y la abundancia de Planctomycetota aumentó sustancialmente, hasta 10 veces en algunas especies. [5]
Si bien las macroalgas son sustratos bien conocidos para las comunidades de Planctomycetota, también se sabe que su abundancia se correlaciona con la proliferación de microalgas como las diatomeas. [44] [5] Las floraciones de cianobacterias , diatomeas y dinoflagelados proporcionan nutrientes a Planctomycetota, lo que podría explicar la asociación. [8]
Las especies de Planctomycetota suelen estar asociadas con las superficies de esponjas marinas. [8] [45] Interactúan con las esponjas ya sea mediante un apego a un soporte o mediante una relación simbiótica. Una gran diversidad de Planctomycetota está presente en forma de biopelículas sobre esponjas. La relación simbiótica entre las esponjas y Planctomycetota contribuye a la salud de la esponja, y la esponja a menudo proporciona hábitat y nutrientes adecuados para Planctomycetota. [8]
Se descubrió que Planctomycetota era muy abundante en las comunidades de líquenes en todo el noroeste de Siberia y mostraba una diversidad extremadamente alta. Planctomycetota también se ha asociado con comunidades de líquenes y humedales de Sphagnum . Los humedales de Sphagnum almacenan grandes cantidades de carbono, lo que contribuye al ciclo global del carbono. Planctomycetota desempeña un papel considerable en la degradación del esfagno y representa aproximadamente el 15% de la comunidad bacteriana. [8]
Planctomycetota muestra asociaciones con otras comunidades bacterianas, principalmente Alphaproteobacteria , Bacteroidota , Gemmatimonadota y Verrucomicrobiota . El crecimiento de muchos Planctomycetota suele estar respaldado por los nutrientes esenciales proporcionados por otras bacterias dentro de la comunidad, y algunos Planctomycetota dependen en gran medida de relaciones simbióticas con otras bacterias. [8]
La existencia de proteínas de cubierta de membrana cerca de la membrana intracitoplasmática podría usarse para un sistema de captación similar a la endocitosis , que sería el primer caso en el que se encuentra esta función fuera del dominio eucariota. Sin embargo, ahora que se ha confirmado la existencia de una pared celular rígida de peptidoglicano, parece poco probable que estas vesículas puedan atravesar esta pared celular. Además, la eliminación de una de estas proteínas de cubierta de membrana dentro de P. limnophila no encontró ninguna disminución en la absorción de macromoléculas . [18] Además, con el uso de la reconstrucción tridimensional de Planctomycetota basada en tomografía crioelectrónica se ha descubierto que lo que originalmente se pensaba que eran vesículas mantenidas en el periplasma son en realidad solo pliegues en la membrana citoplasmática. [5] Sin embargo, se ha demostrado que Planctomycetota puede sobrevivir con polisacáridos de alto peso molecular como única fuente de carbono, lo que significa que deben tener la capacidad de incorporar sustratos de carbono complejos en su citoplasma. Se han planteado tres hipótesis: En primer lugar, los Planctomycetota excretan una enzima que, fuera de la pared celular, degrada los sustratos complejos en monosacáridos más pequeños, que pueden ser transportados más fácilmente a través de las diferentes membranas. En segundo lugar, los sustratos complejos quedan anclados al exterior de Planctomycetota, que luego pueden descomponerlos lentamente en oligosacáridos, que pueden ser transportados al periplasma de Planctomycetota mediante proteínas especializadas. La tercera hipótesis involucra las estructuras crateriformes que se encuentran en el exterior de las paredes celulares de Planctomycetota. Estas estructuras tienen fibras que recubren sus fosas y que pueden absorber polisacáridos completos en el periplasma, donde luego serían digeridos. [18]

Casi todas las bacterias tienen un citosol que sigue la forma exterior de su pared celular de peptidoglicano. Los eucariotas se diferencian en que tienen su citosol dividido en múltiples compartimentos para crear orgánulos como un núcleo . Los planctomycetota son únicos porque tienen grandes invaginaciones de su membrana citoplasmática, alejándose de la pared celular de peptidoglicano y dejando espacio para el periplasma. Tradicionalmente, se pensaba que la membrana citoplasmática era responsable de controlar la presión osmótica de las células bacterianas. Sin embargo, debido a los pliegues de la membrana citoplasmática y a la existencia de grandes espacios de periplasma dentro de Planctomycetota, su peptidoglicano actúa como una barrera osmótica y el periplasma es isotónico con respecto al citosol. [5]
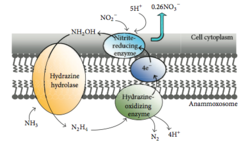
Anammox es el proceso de oxidación del amonio donde el nitrito actúa como aceptor de electrones. Este proceso crea energía para el organismo que realiza la reacción de la misma manera que los humanos obtienen energía al oxidar la glucosa. [46] En un ambiente marino, esto finalmente elimina el nitrógeno del agua, ya que el fitoplancton no puede utilizar el gas N 2 y se libera a la atmósfera . Hasta el 67% de la producción de gas dinitrógeno en el océano puede atribuirse al anammox [47] y se cree que alrededor del 50% del gas nitrógeno en la atmósfera se produce a partir del anammox. [48] Los Planctomycetota son el filo más dominante de bacterias capaces de realizar anammox, por lo que los Planctomycetota capaces de realizar anammox desempeñan un papel importante en el ciclo global del nitrógeno. [49]
La síntesis de esteroles, que se observa a menudo en eucariotas y poco común entre bacterias, se ha observado muy raramente en Planctomycetota. [5] [15] La síntesis de esteroles como el lanosterol se ha observado en G. obscuriglobus . El lanosterol es común en eucariotas y otros dos grupos de bacterias, tanto Pseudomonadota metilotróficas como mixobacterias . La síntesis de esteroles observada en G. obscuriglobus es única dentro de Planctomycetota. Se sugiere que la síntesis de esteroles está asociada con la regulación de la fluidez de la membrana en Planctomycetota, [15] y se ha descrito como esencial para el crecimiento y la reproducción adecuados de G. obscuriglobus . [17]
Recientemente, ha surgido interés en examinar Planctomycetota con respecto a sus roles potenciales en biotecnología, principalmente como fuente de moléculas bioactivas, [8] [14] de interés principalmente para la industria farmacéutica. Los compuestos bioactivos están presentes principalmente como metabolitos secundarios, [14] aunque se sabe poco sobre los metabolitos secundarios de Planctomycetota. [50] Esto es inesperado, ya que Planctomycetota tiene varias características clave como otros productores conocidos de moléculas bioactivas, como las Mixobacterias. [50] Sin embargo, una serie de estudios en curso sirven como primeros pasos para incluir Planctomycetota en el desarrollo de fármacos de molécula pequeña para humanos.
Las especies de Planctomycetota merecen consideraciones valiosas para desafiar los modelos actuales sobre el origen del núcleo, junto con otros aspectos del origen y la evolución del sistema de endomembranas eucariotas. [41]
Los impactos de la investigación sobre Planctomycetota y sus usos podrían ser de importancia global con respecto a los procesos de ciclo de nutrientes y ayudar a mejorar la comprensión de la biogeoquímica marina global. Sin embargo, dada la creciente influencia de Planctomycetota en los procesos metabólicos que involucran el agua y el aire, también puede desempeñar un papel en los intercambios entre los océanos y la atmósfera, lo que podría afectar el cambio climático. [41]
Las especies de Planctomycetota fueron identificadas recientemente como un patógeno humano oportunista, [ cita necesaria ] pero la falta de medios de cultivo limita los estudios sobre las bacterias de Planctomycetota como patógenos de los humanos. [8]