



Una micorriza arbuscular ( AM ) (en plural micorrizas ) es un tipo de micorriza en la que el hongo simbionte ( hongos AM o HMA) penetra en las células corticales de las raíces de una planta vascular formando arbúsculos . La micorriza arbuscular es un tipo de endomicorriza junto con la micorriza ericoide y la micorriza de orquídeas (que no debe confundirse con la ectomicorriza ). Se caracterizan por la formación de estructuras únicas parecidas a árboles, los arbúsculos. [1] Además, a menudo se encuentran estructuras de almacenamiento globulares llamadas vesículas.
Las micorrizas arbusculares están formadas por hongos del subfilo Glomeromycotina . Este subfilo, junto con Mortierellomycotina y Mucoromycotina, forman el filo Mucoromycota , un clado hermano de los hongos dikaryan más conocidos y diversos . [2]
Los hongos AM ayudan a las plantas a capturar nutrientes como fósforo , azufre , nitrógeno y micronutrientes del suelo. Se cree que el desarrollo de la simbiosis de micorrizas arbusculares jugó un papel crucial en la colonización inicial de la tierra por las plantas y en la evolución de las plantas vasculares. [3] Se ha dicho que es más rápido enumerar las plantas que no forman endomicorrizas que las que sí lo hacen. [4] Esta simbiosis es una relación mutualista altamente evolucionada que se encuentra entre hongos y plantas, la simbiosis vegetal más frecuente conocida, [5] y el HMA se encuentra en el 80% de las familias de plantas vasculares que existen en la actualidad. [6]
Anteriormente a este tipo de asociaciones micorrícicas se les denominaba 'Micorriza vesicular arbuscular (VAM)', pero como algunos miembros de estos hongos no producen ninguna vesícula, como por ejemplo los miembros de Gigasporaceae ; el término se ha cambiado a 'Micorrizas arbusculares' para incluirlas. [7] [8]
Los avances en la investigación sobre fisiología y ecología de las micorrizas desde la década de 1970 han llevado a una mayor comprensión de las múltiples funciones de los HMA en el ecosistema. Un ejemplo es la importante contribución de la proteína glomalina , similar a un pegamento, a la estructura del suelo (ver más abajo). Este conocimiento es aplicable a los esfuerzos humanos de gestión de ecosistemas , restauración de ecosistemas y agricultura .
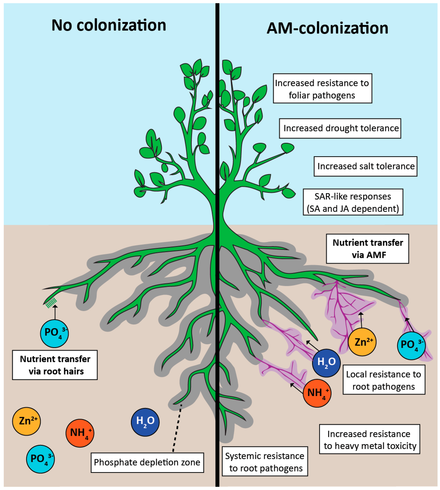
Tanto la evidencia paleobiológica como molecular indican que la AM es una simbiosis antigua que se originó hace al menos 460 millones de años. La simbiosis AM es omnipresente entre las plantas terrestres, lo que sugiere que las micorrizas estaban presentes en los primeros ancestros de las plantas terrestres existentes. Esta asociación positiva con las plantas puede haber facilitado el desarrollo de las plantas terrestres. [5]
El pedernal de Rhynie del Devónico inferior ha producido fósiles de las primeras plantas terrestres en las que se han observado hongos AM. [10] Las plantas fosilizadas que contenían hongos micorrízicos se conservaron en sílice.
El Devónico temprano vio el desarrollo de la flora terrestre. Se descubrió que las plantas de pedernal de Rhynie del Devónico Inferior (hace 400 millones de años) contenían estructuras que se asemejaban a vesículas y esporas de las especies actuales de Glomus . Se han observado raíces fósiles colonizadas en Aglaophyton major y Rhynia , que son plantas antiguas que poseen características de plantas vasculares y briofitas con rizomas protostélicos primitivos . [10]
Se observó micelio intraradical en los espacios intracelulares de la raíz y arbúsculos en la capa de células de pared delgada similar al parénquima en empalizada . Los arbúsculos fósiles parecen muy similares a los de los HMA existentes. [10] Las células que contienen arbúsculos tienen paredes engrosadas, que también se observan en las células colonizadas existentes.
Las micorrizas del Mioceno exhiben una morfología vesicular muy parecida a la de los Glomerales actuales . Esta morfología conservada puede reflejar la fácil disponibilidad de nutrientes proporcionados por las plantas hospedantes en los mutualismos tanto modernos como del Mioceno. [11] Sin embargo, se puede argumentar que la eficacia de los procesos de señalización probablemente haya evolucionado desde el Mioceno, y esto no puede detectarse en el registro fósil. Un ajuste de los procesos de señalización mejoraría la coordinación y el intercambio de nutrientes entre simbiontes y al mismo tiempo aumentaría la aptitud tanto de los hongos como de las plantas simbiontes.
La naturaleza de la relación entre las plantas y los ancestros de los hongos micorrízicos arbusculares es controvertida. Dos hipótesis son:
En Rhynie Chert se encontraron tanto saprótrofos como biótrofos, pero hay poca evidencia que respalde cualquiera de las hipótesis.
Existe cierta evidencia fósil que sugiere que los hongos parásitos no mataron las células huésped inmediatamente después de la invasión, aunque se observó una respuesta a la invasión en las células huésped. Esta respuesta puede haber evolucionado hasta convertirse en los procesos de señalización química necesarios para la simbiosis. [10]
En ambos casos, se cree que la interacción simbiótica entre plantas y hongos evolucionó de una relación en la que los hongos tomaban nutrientes de la planta a una relación simbiótica en la que la planta y los hongos intercambian nutrientes.
Las plantas antiguas no tenían raíces verdaderas. Strullu-Derrien y Strullu propusieron el término 'Paramycorrhizae' para las micorrizas que infectan el rizoma, el brote o los talos, y 'Eumycorrhizae' que infecta las raíces verdaderas. [12] [13] [14] Estas estructuras se informaron tanto en esporofitos como en gametofitos de las primeras plantas terrestres. [13]
El creciente interés en la simbiosis micorrízica y el desarrollo de técnicas moleculares sofisticadas ha llevado al rápido desarrollo de evidencia genética. Wang y cols. (2010) investigaron genes de plantas implicados en la comunicación con los socios fúngicos del orden Glomales (DMI1, DMI3, IPD3). [15] [16] Estos tres genes podrían secuenciarse de todos los clados principales de plantas terrestres modernas, incluidas las hepáticas , el grupo más basal, y se demostró que la filogenia de los tres genes concordaba con las filogenias de plantas terrestres actuales. Esto implica que los genes de micorrizas deben haber estado presentes en el ancestro común de las plantas terrestres y que deben haber sido heredados verticalmente desde que las plantas colonizaron la tierra. [15]
Se reveló que los hongos AM tienen la enzima central de tipo bacteriano (ribonucleasa III) del mecanismo de procesamiento de ARNs, probablemente por el proceso de transferencia horizontal de genes desde un ancestro cianobacteriano, y posiblemente relacionado con la simbiosis. [17] Este hallazgo de un fósil genético dentro de los hongos AM plantea la posibilidad de una relación íntima entre los hongos AM y los ancestros de las cianobacterias. Anteriormente se informó de una simbiosis similar entre Geosiphon y Nostoc . [18]
Sorprendentemente, a pesar de su larga evolución como compañero subterráneo de las raíces de las plantas, cuyo entorno está lejos de la luz y las fluctuaciones de temperatura, los AMF todavía conservan un reloj circadiano cuyo oscilador circadiano fúngico ( frq ) se activa con la luz azul, similar al modelo circadiano. hongo Neurospora crassa . [19] La conservación comprobada de un reloj circadiano y genes de salida en R. irregulare abre la puerta al estudio de los relojes circadianos en el hongo asociado a la simbiosis AM. La misma investigación caracterizó el gen AMF frq , [19] que es el primer gen frq identificado en un grupo externo de Dikarya, y sugiere que la evolución del gen frq en el reino fúngico es mucho más antigua de lo que se pensaba anteriormente.
El desarrollo de los hongos AM antes de la colonización de las raíces, conocido como presimbiosis, consta de tres etapas: germinación de esporas, crecimiento de hifas, reconocimiento del huésped y formación de apresorio .
Las esporas de los hongos AM son estructuras en reposo multinucleadas de paredes gruesas. [21] La germinación de la espora no depende de la planta, ya que las esporas han sido germinadas en condiciones experimentales en ausencia de plantas tanto in vitro como en el suelo. Sin embargo, la tasa de germinación puede verse incrementada por los exudados de las raíces del huésped . [22] Las esporas de hongos AM germinan en condiciones adecuadas de matriz del suelo, temperatura, concentración de dióxido de carbono, pH y concentración de fósforo. [21]
El crecimiento de las hifas AM a través del suelo está controlado por los exudados de las raíces del huésped conocidos como estrigolactonas y la concentración de fósforo del suelo. [23] Las concentraciones bajas de fósforo en el suelo aumentan el crecimiento y la ramificación de las hifas, así como inducen la exudación de compuestos de las plantas que controlan la intensidad de la ramificación de las hifas. [22] [24]
La ramificación de las hifas de los hongos AM cultivadas en medios de fósforo de 1 mM se reduce significativamente, pero la longitud del tubo germinal y el crecimiento total de las hifas no se vieron afectados. Una concentración de fósforo 10 mM inhibió tanto el crecimiento como la ramificación de las hifas. Esta concentración de fósforo se produce en las condiciones naturales del suelo y, por tanto, podría contribuir a una reducción de la colonización de micorrizas. [24]
Se ha demostrado que los exudados de raíces de plantas hospedantes de HMA cultivadas en un medio líquido con y sin fósforo afectan el crecimiento de las hifas. Se cultivaron esporas de Gigaspora margarita en exudados de plantas hospedantes. Las hifas de los hongos que crecieron en los exudados de raíces privadas de fósforo crecieron más y produjeron ramas terciarias en comparación con las que crecieron en exudados de plantas que recibieron suficiente fósforo. Cuando se agregaron exudados de raíces que promueven el crecimiento en baja concentración, los hongos AM produjeron ramas largas dispersas. A medida que aumentaba la concentración de exudados, los hongos producían ramas más agrupadas. En los arbúsculos de mayor concentración se formaron las estructuras AMF de intercambio de fósforo. [24]
Se cree que esta respuesta fúngica quimiotáxica a los exudados de las plantas hospedantes aumenta la eficacia de la colonización de las raíces hospedantes en suelos bajos en fósforo. [22] Es una adaptación de los hongos para explorar eficientemente el suelo en busca de una planta huésped adecuada. [24]
Evidencia adicional de que los hongos micorrízicos arbusculares exhiben quimiotaxis específica del huésped , que permite el crecimiento de hifas hacia las raíces de una planta huésped potencial: las esporas de Glomus mosseae se separaron de las raíces de una planta huésped, de plantas no huéspedes y de plantas huésped muertas mediante una membrana permeable. sólo a las hifas. En el tratamiento con la planta huésped, los hongos cruzaron la membrana y siempre emergieron dentro de los 800 µm de la raíz, pero no en los tratamientos con plantas no huésped y plantas muertas. [25]
Se han utilizado técnicas moleculares para comprender las vías de señalización entre las micorrizas arbusculares y las raíces de las plantas. En 2003 se demostró cómo la MA sufre cambios fisiológicos en presencia de exudados de raíces potenciales de plantas hospedantes, para colonizarla. Los exudados de las raíces de las plantas hospedantes desencadenan y activan genes de hongos AM necesarios para la respiración de los compuestos de carbono de las esporas. En los experimentos, la tasa de transcripción de 10 genes aumentó media hora después de la exposición y a un ritmo aún mayor después de 1 hora. después de 4 horas de exposición AM responden con crecimiento morfológico. Los genes aislados de esa época están involucrados en la actividad mitocondrial y la producción de enzimas. La tasa de respiración de los hongos, medida por la tasa de consumo de O 2 , aumentó en un 30% 3 horas después de la exposición a los exudados de las raíces, lo que indica que los exudados de las raíces de la planta huésped estimulan la actividad mitocondrial de las esporas de HMA. Puede ser parte de un mecanismo regulador de hongos que conserva la energía de las esporas para un crecimiento eficiente y la ramificación de las hifas al recibir señales de una planta huésped potencial. [26]
Cuando las hifas de hongos micorrízicos arbusculares encuentran la raíz de una planta huésped, se forma un apresorio o "estructura de infección" en la epidermis de la raíz. Desde esta estructura, las hifas pueden penetrar en la corteza parenquimática del huésped . [27] AM no necesita señales químicas de la planta para formar los apresorios. Los hongos AM podrían formar apresorios en las paredes celulares de las células "fantasmas" en las que se había eliminado el protoplasto para eliminar la señalización entre los hongos y la planta huésped. Sin embargo, las hifas no penetraron más en las células ni crecieron hacia la corteza de la raíz, lo que indica que se requiere señalización entre simbiontes para un mayor crecimiento una vez que se forman los apresorios. [22]
Una vez dentro del parénquima, el hongo forma estructuras muy ramificadas para el intercambio de nutrientes con la planta llamadas arbúsculos . [27] Estas son las estructuras distintivas del hongo micorrízico arbuscular. Los arbúsculos son los sitios de intercambio de fósforo, carbono, agua y otros nutrientes. [21] Hay dos formas: el tipo París se caracteriza por el crecimiento de hifas de una célula a la siguiente; y el tipo Arum se caracteriza por el crecimiento de hifas en el espacio entre las células vegetales. [28] La elección entre el tipo París y el tipo Arum está determinada principalmente por la familia de la planta huésped, aunque algunas familias o especies son capaces de elegir cualquiera de los dos tipos. [29] [30]
La planta huésped ejerce un control sobre la proliferación de hifas intercelulares y la formación de arbúsculos. Hay una descondensación de la cromatina de la planta , lo que indica una mayor transcripción del ADN de la planta en las células que contienen arbúsculos. [27] Se requieren modificaciones importantes en la célula huésped de la planta para acomodar los arbúsculos. Las vacuolas se reducen y otros orgánulos celulares proliferan. El citoesqueleto de las células vegetales se reorganiza alrededor de los arbúsculos.
Hay otros dos tipos de hifas que se originan en la raíz de la planta huésped colonizada. Una vez que se ha producido la colonización, las hifas de corredor de corta duración crecen desde la raíz de la planta hasta el suelo. Se trata de las hifas que captan el fósforo y los micronutrientes, que se confieren a la planta. Las hifas de los hongos AM tienen una alta relación superficie-volumen, lo que hace que su capacidad de absorción sea mayor que la de las raíces de las plantas. [31] Las hifas de los HMA también son más finas que las raíces y pueden entrar en los poros del suelo que son inaccesibles a las raíces. [32] El cuarto tipo de hifas de HMA crece a partir de las raíces y coloniza las raíces de otras plantas hospedantes. Los cuatro tipos de hifas son morfológicamente distintos. [21]
Los hongos AM son simbiontes obligados . Tienen una capacidad saprobia limitada y dependen de la planta para su nutrición de carbono. [33] Los hongos AM absorben los productos de la fotosíntesis de la planta huésped como hexosas .
La transferencia de carbono de la planta a los hongos puede ocurrir a través de los arbúsculos o hifas intrarradicales. [34] La síntesis secundaria a partir de las hexosas por AM ocurre en el micelio intraradical . Dentro del micelio, la hexosa se convierte en trehalosa y glucógeno . La trehalosa y el glucógeno son formas de almacenamiento de carbono que pueden sintetizarse y degradarse rápidamente y pueden amortiguar las concentraciones de azúcar intracelular. [34] La hexosa intraradical entra en la vía oxidativa de las pentosas fosfato , que produce pentosas para los ácidos nucleicos.
La biosíntesis de lípidos también ocurre en el micelio intraradical. Luego, los lípidos se almacenan o exportan a hifas extrarradicales donde pueden almacenarse o metabolizarse. La degradación de los lípidos en hexosas, conocida como gluconeogénesis , se produce en el micelio extraradical. [34] Aproximadamente el 25% del carbono translocado de la planta a los hongos se almacena en las hifas extrarradicales. [35] Hasta el 20% del carbono de la planta huésped puede transferirse a los hongos AM. [34] Esto representa la considerable inversión de carbono de la planta huésped en la red de micorrizas y la contribución al depósito de carbono orgánico subterráneo.
Aumentar el suministro de carbono de la planta a los hongos AM aumenta la absorción y transferencia de fósforo de los hongos a la planta. [36] Asimismo, la absorción y transferencia de fósforo disminuye cuando disminuye el fotosintato suministrado a los hongos. Las especies de HMA se diferencian en su capacidad para suministrar fósforo a la planta. [37] En algunos casos, las micorrizas arbusculares son malos simbiontes, ya que proporcionan poco fósforo y toman cantidades relativamente altas de carbono. [37]
El principal beneficio de las micorrizas para las plantas se ha atribuido a una mayor absorción de nutrientes, especialmente fósforo. Esto puede deberse a una mayor superficie en contacto con el suelo, un mayor movimiento de nutrientes hacia las micorrizas, un entorno radicular modificado y un mayor almacenamiento. [32] Las micorrizas pueden ser mucho más eficientes que las raíces de las plantas para absorber fósforo. El fósforo viaja hasta la raíz o por difusión y las hifas reducen la distancia requerida para la difusión, aumentando así la absorción. La tasa de fósforo que fluye hacia las micorrizas puede ser hasta seis veces mayor que la de los pelos de la raíz. [32] En algunos casos, el papel de la absorción de fósforo puede ser asumido completamente por la red de micorrizas, y todo el fósforo de la planta puede ser de origen hifal. [37] Se sabe menos sobre el papel de la nutrición con nitrógeno en el sistema de micorrizas arbusculares y su impacto en la simbiosis y la comunidad. Si bien se han logrado avances significativos en el esclarecimiento de los mecanismos de esta compleja interacción, aún queda mucha investigación por hacer.
La actividad micorrízica aumenta la concentración de fósforo disponible en la rizosfera . Las micorrizas reducen el pH de la zona de la raíz mediante la absorción selectiva de NH 4 + ( iones de amonio ) y la liberación de iones H + . La disminución del pH del suelo aumenta la solubilidad de los precipitados de fósforo. La absorción de NH 4 + por las hifas también aumenta el flujo de nitrógeno a la planta a medida que las superficies internas del suelo absorben amonio y lo distribuyen por difusión. [35]
Los hongos AM se han considerado asexuales porque carecen de estructuras sexuales observables . [38] Sin embargo, se encontró que los homólogos de 51 genes que funcionan en la meiosis , incluidos siete genes específicos de la meiosis, están conservados en los genomas de varias especies de HMA, lo que sugiere que estos hongos asexuales supuestamente antiguos pueden ser capaces de sufrir una meiosis convencional. [39] Además, en Rhizophagus irregularis se descubrió que el intercambio genético que implicaba recombinación recíproca ocurría en dicariones entre genomas haploides. [38]
Investigaciones recientes han demostrado que los hongos AM liberan un factor de difusión, conocido como factor myc , que activa el gen inducible del factor de nodulación MtEnod11. Este es el mismo gen involucrado en el establecimiento de simbiosis con las bacterias rizobias fijadoras de nitrógeno (Kosuta et al. 2003). El factor fue identificado por primera vez por Fabienne Maillet y sus compañeros de trabajo [40] en un trabajo innovador publicado en Nature, donde extrajeron trescientos litros de raíces de zanahoria micorrizadas y exudados de 40 millones de esporas en germinación de Rhizophagus irregularis y purificaron la fracción activa. Demostraron que este principio activo es de naturaleza lipoquitooligosacárido.
El reconocimiento de los factores Myc desencadena la vía de señalización simbiótica común (CSSP) que eventualmente conduce al programa de acomodación de la planta para proporcionar rehenes a las micorrizas arbusculares.

La vía de señalización simbiótica común (CSSP) es una cascada de señalización en plantas que se activa tanto en la percepción del factor NOD (para rizobios que forman nódulos ) como en la percepción del factor MYC que se liberan de los hongos micorrízicos arbusculares. La vía se distingue de las vías de reconocimiento de patógenos , pero puede tener algunos receptores comunes involucrados tanto en el reconocimiento de patógenos como en CSSP. Un trabajo reciente [41] de Kevin Cope y colegas demostró que posiblemente otro tipo de micorrizas pueda involucrar componentes CSSP como el reconocimiento del factor Myc.
La colonización de la AMF requiere la siguiente cadena [42] de eventos que se pueden dividir aproximadamente en los siguientes pasos:
Los hongos micorrízicos arbusculares son más frecuentes en plantas que crecen en suelos minerales y son de extrema importancia para plantas que crecen en sustratos deficientes en nutrientes, como suelos volcánicos y ambientes de dunas de arena . Las poblaciones de hongos AM son mayores en comunidades de plantas con alta diversidad, como las selvas tropicales y los pastizales templados, donde tienen muchas plantas huéspedes potenciales y pueden aprovechar su capacidad para colonizar una amplia gama de huéspedes. [43] Hay una menor incidencia de colonización de micorrizas en suelos muy áridos o ricos en nutrientes. Se han observado micorrizas en hábitats acuáticos ; sin embargo, se ha demostrado que los suelos anegados disminuyen la colonización en algunas especies. [43] Los hongos micorrízicos arbusculares se encuentran en el 80% de las especies de plantas [44] y han sido estudiados en todos los continentes excepto en la Antártida. [45] [46] La biogeografía de glomeromycota está influenciada por la limitación de la dispersión, [47] factores ambientales como el clima, [45] series de suelo y pH del suelo, [46] nutrientes del suelo [48] y comunidad de plantas. [45] [49] Si bien la evidencia de 2000 sugiere que los hongos AM no son especialistas en sus especies hospedadoras, [50] estudios de 2002 han indicado que al menos algunos taxones de hongos son especialistas en hospedadores. [51] La ecología de los hongos mucoromycotinianos, que forman micorrizas arbusculares de 'endófitos de raíz fina', es en gran medida desconocida.
La especificidad, el rango de huéspedes y el grado de colonización de los hongos micorrízicos son difíciles de analizar en el campo debido a la complejidad de las interacciones entre los hongos dentro de una raíz y dentro del sistema. No hay evidencia clara que sugiera que los hongos micorrízicos arbusculares exhiban especificidad para la colonización de especies potenciales de plantas hospedantes de AM al igual que los hongos patógenos para sus plantas hospedantes. [43] Esto puede deberse a la presión selectiva opuesta involucrada.
En relaciones patógenas, la planta huésped se beneficia de mutaciones que previenen la colonización, mientras que, en una relación simbiótica mutualista, la planta se beneficia de mutaciones que permiten la colonización por HMA. [43] Sin embargo, las especies de plantas difieren en el grado y la dependencia de la colonización por ciertos hongos AM, y algunas plantas pueden ser micotrofos facultativos , mientras que otras pueden ser micotrofos obligados. [43] Recientemente, el estado de las micorrizas se ha relacionado con la distribución de las plantas, [52] con plantas con micorrizas obligadas que ocupan hábitats más cálidos y secos, mientras que las plantas con micorrizas facultativas ocupan rangos más amplios de hábitats.
La capacidad de los mismos hongos AM para colonizar muchas especies de plantas tiene implicaciones ecológicas. Plantas de diferentes especies pueden unirse bajo tierra a una red micelial común. [43] Una planta puede proporcionar el carbono fotosintato para el establecimiento de la red micelial que otra planta de una especie diferente puede utilizar para la absorción de minerales. Esto implica que las micorrizas arbusculares son capaces de equilibrar las interacciones subterráneas intra e interespecíficas de las plantas. [43]
Dado que los hongos Glomeromycota viven dentro de las raíces de las plantas, su planta huésped puede influir sustancialmente en ellos y, a cambio, también afectan a las comunidades de plantas. Las plantas pueden asignar hasta el 30% de su carbono fotosintético a los hongos AM [53] y, a cambio, los hongos AM pueden adquirir hasta el 80% del fósforo y nitrógeno de las plantas. [44] La diversidad de las comunidades de hongos AM se ha relacionado positivamente con la diversidad de plantas, [54] la productividad de las plantas [55] y la herbivoría. [56] Los hongos micorrízicos arbusculares pueden verse influenciados por interacciones a pequeña escala con la comunidad vegetal local. Por ejemplo, la vecindad de las plantas alrededor de una planta focal puede alterar las comunidades de hongos AM [57] , al igual que el orden de establecimiento de las plantas dentro de los sitios. [58]
Durante las invasiones de especies de plantas, la comunidad y la biomasa de los hongos AM pueden alterarse drásticamente. En la mayoría de los casos, la biomasa y la diversidad de los hongos AM disminuyen con las invasiones. [59] [60] [61] Sin embargo, algunas especies de plantas micotróficas pueden en realidad aumentar la diversidad de hongos AM durante la invasión. [62]
El estado de micorrizas de las especies de plantas invasoras a menudo varía entre regiones. Por ejemplo, en el Reino Unido y Europa central recientemente las plantas invasoras son micorrizas obligatoriamente con mayor frecuencia de lo esperado, [52] [63] mientras que en California se encontró que las plantas invasoras tienen menos frecuencia de micorrizas de lo esperado. [64]
Todos los simbiontes dentro de una planta huésped interactúan, a menudo de manera impredecible. Un metaanálisis de 2010 indicó que las plantas colonizadas tanto por hongos AM como por endófitos transmitidos verticalmente a menudo son más grandes que las plantas colonizadas de forma independiente por estos simbiontes. [65] Sin embargo, esta relación depende del contexto, ya que los hongos AM pueden interactuar sinérgicamente con hongos endófitos que habitan las hojas de su planta huésped, [66] [67] o de manera antagónica. [68] [69] [70] Pueden ocurrir rangos similares de interacciones entre los hongos AM y los hongos ectomicorrízicos y los endófitos septados oscuros . [71]
Los hongos micorrízicos arbusculares varían en muchos gradientes ambientales . Se sabe que su tolerancia a la congelación y al secado cambia entre los taxones de hongos AM. [72] Los hongos AM se vuelven menos prevalentes y diversos a concentraciones más altas de nutrientes y humedad del suelo, [73] presumiblemente porque ambas plantas asignan menos carbono a los hongos AM y los hongos AM reasignan sus recursos a hifas intrarradicales en estas condiciones ambientales. [74] A largo plazo, estas condiciones ambientales pueden incluso crear una adaptación local entre las plantas hospedantes, los hongos AM y las concentraciones locales de nutrientes del suelo. [75] La composición de la AM a menudo se vuelve menos diversa en las cimas de las montañas que en elevaciones más bajas, lo que está impulsado por la composición de las especies de plantas. [76]
Se ha demostrado que los hongos AM mejoran la tolerancia de las plantas a factores ambientales abióticos como la salinidad . Alivian el estrés salino y benefician el crecimiento y la productividad de las plantas. [77]
La rizosfera es la zona del suelo en las inmediaciones de un sistema de raíces.
La simbiosis de micorrizas arbusculares afecta la comunidad y la diversidad de otros organismos en el suelo. Esto puede verse directamente por la liberación de exudados, o indirectamente por un cambio en la especie de planta y el tipo y cantidad de exudados de plantas. [78]
Se ha demostrado que la diversidad de micorrizas aumenta la diversidad de especies de plantas a medida que aumenta el número potencial de asociaciones. Los hongos micorrízicos arbusculares dominantes pueden prevenir la invasión de plantas no micorrízicas en terrenos donde han establecido simbiosis y promover su huésped micorrízico. [79]
Cuando las bacterias rizobios están presentes en el suelo, la colonización de micorrizas aumenta debido a un aumento en la concentración de señales químicas involucradas en el establecimiento de la simbiosis (Xie et al. 2003). Se aislaron moléculas similares a los factores Nod de hongos AM y se demostró que inducen MtEnod11, la formación de raíces laterales y mejoran la micorrización. [80] La colonización micorrízica eficaz también puede aumentar las nodulaciones y la fijación simbiótica de nitrógeno en las leguminosas micorrízicas. [35]
El grado de colonización y especies de micorrizas arbusculares afecta la población bacteriana en la rizosfera. [81] Las especies bacterianas difieren en su capacidad para competir por los exudados de raíces compuestos de carbono. Un cambio en la cantidad o composición de los exudados de raíces y de hongos debido a la colonización de micorrizas AM existente determina la diversidad y abundancia de la comunidad bacteriana en la rizosfera. [78]
La influencia de los hongos AM en el crecimiento de raíces y brotes de las plantas también puede tener un efecto indirecto sobre las bacterias de la rizosfera. Los HMA aportan una cantidad sustancial de carbono a la rizosfera a través del crecimiento y degeneración de la red de hifas. También hay evidencia que sugiere que los hongos AM pueden desempeñar un papel importante en la mediación del efecto específico de las especies de plantas sobre la composición bacteriana de la rizosfera. [78]
El cambio climático global está afectando a las comunidades de hongos AM y a las interacciones entre los hongos AM y sus plantas hospedantes. Si bien se acepta generalmente que las interacciones entre organismos afectarán su respuesta al cambio climático global, todavía carecemos de la capacidad de predecir el resultado de estas interacciones en los climas futuros. [82] En metanálisis recientes, se encontró que los hongos AM aumentan la biomasa de las plantas en condiciones de sequía y disminuyen la biomasa de las plantas en estudios simulados de deposición de nitrógeno. [83] [84] Se ha demostrado que los propios hongos micorrízicos arbusculares aumentan su biomasa en respuesta al elevado CO 2 atmosférico . [85]
Los miembros de la familia de la mostaza ( Brassicaceae ), como el repollo, la coliflor, la canola y el crambe , no establecen hongos micorrízicos arbusculares en sus raíces. [86]
En los últimos diez años se han producido avances espectaculares en tecnologías y herramientas de genética molecular. Estos avances permiten a los ecólogos microbianos y micorrízicos plantear preguntas nuevas y apasionantes sobre las funciones ecológicas y evolutivas de los hongos micorrízicos arbusculares (MA) como individuos, en comunidades y ecosistemas. Los análisis genéticos de los hongos AM se han utilizado para explorar la estructura genética de esporas individuales utilizando el genotipado multilocus, [87] la diversidad y adaptación de los hongos AM en múltiples comunidades de pastizales, [88] hasta llegar a una investigación global de la diversidad de los hongos AM, que Aumentó enormemente la diversidad molecular descrita dentro del filo Glomeromycota. [89]
Todos los avances recientes en genética molecular permiten claramente el análisis de comunidades microbianas a escalas mucho más finas y funcionales y potencialmente con más confianza que los métodos anteriores. El método clásico de identificación de hongos AM de extracción de esporas del suelo y análisis morfológico adicional de las esporas [90] está plagado de problemas complicados debido a las diversas estrategias y formas de hongos AM, por ejemplo, falta de esporulación en ciertas especies, estacionalidad, alta inculturabilidad, posible identificación errónea (error humano) y nueva evidencia de esporas multinucleadas [91] y alta variación genética dentro de especies clonales de AM. [92] Debido a estos diversos problemas, en el pasado los investigadores probablemente tergiversaron la verdadera composición de las comunidades de hongos AM presentes en cualquier momento o lugar. Además, al seguir los métodos tradicionales de extracción, cultivo e identificación microscópica, no hay forma de determinar las poblaciones de hongos MA activas/funcionales, que probablemente sean las más importantes cuando se intenta relacionar las interacciones y los mecanismos simbióticos planta-MA con la función ecológica o del ecosistema. Esto es especialmente cierto en el caso de los análisis de colonización de raíces, que pueden determinar el porcentaje de raíces colonizadas por hongos MA. El principal problema con este análisis se encuentra en los suelos de campo, que contienen múltiples especies de hongos AM en asociación con una planta objetivo al mismo tiempo (ver Ecología de AM). La identificación de los hongos simbiontes asociados es imposible sin el uso de métodos moleculares. Aunque el análisis genético de las comunidades de hongos AM ha avanzado mucho en la última década, la metodología aún no está completamente refinada. A continuación se muestra una descripción general de los métodos utilizados en los análisis genéticos moleculares de hongos AM, junto con aplicaciones a la investigación, direcciones futuras y algunos de sus problemas.
Los análisis genéticos de hongos AM a partir de muestras de suelo y raíces varían en su aplicabilidad para responder preguntas ecológicas o filogenéticas. Los análisis de ADN utilizan varios marcadores nucleares para describir los hongos AM y representar diferentes regiones del operón ribosomal nuclear ( ARNr 18S ) que se encuentra en todos los organismos eucariotas. El análisis de ADN de hongos AM utilizando estos marcadores comenzó a principios de la década de 1990 [93] y continúa desarrollándose en la actualidad. El gen de ARNr de la subunidad pequeña (SSU), el gen espaciador transcrito interno ( ITS ) y el gen de ARNr de la subunidad grande (LSU) son actualmente los marcadores de ADN más utilizados. La región SSU se ha utilizado con mayor frecuencia en estudios ecológicos, [94] mientras que las regiones ITS y LSU se han utilizado predominantemente en construcciones taxonómicas del filo Glomeromycota. [95]
La PCR en tiempo real o PCR cuantitativa (qPCR) se está convirtiendo en un método bien establecido para amplificar rápidamente y cuantificar simultáneamente el ADN de hongos AM específico a partir de muestras biológicas (raíces de plantas o suelos). Los desarrollos bastante recientes en marcadores qPCR permiten a los investigadores explorar la abundancia relativa de especies de hongos AM dentro de las raíces en experimentos de invernadero, así como en el campo para identificar comunidades locales de hongos AM.
Los marcadores qPCR para hongos micorrízicos arbusculares consistirán en cebadores específicos de AM y sondas de hidrólisis marcadas con fluorescencia. El investigador puede elegir estos cebadores específicos de AM (analizados anteriormente) y esta decisión generalmente está guiada por la pregunta en cuestión, los recursos disponibles y la voluntad de solucionar problemas en el laboratorio.
El análisis de microarrays de ADN se utiliza actualmente en la investigación de hongos AM para medir simultáneamente la expresión de muchos genes de especies objetivo o muestras experimentales. La herramienta o método más común es utilizar la tecnología de matriz de genes funcionales (FGA), una micromatriz especializada que contiene sondas para genes que son funcionalmente importantes en procesos microbianos como el ciclo del carbono, el nitrógeno o el fósforo. Los FGA tienen la capacidad de examinar simultáneamente muchos genes funcionales. [96] Esta técnica se utiliza normalmente para el análisis general de genes microbianos funcionales, pero cuando se complementa con secuenciación genética, se pueden hacer inferencias sobre la conexión entre la composición de la comunidad fúngica y la funcionalidad microbiana.
Se pueden utilizar firmas químicas de organismos específicos para detectar biomasa de organismos más crípticos, como hongos AM o bacterias del suelo. Los lípidos, más específicamente los fosfolípidos y los lípidos neutros, contienen ácidos grasos conectados a una columna vertebral de glicerol. La composición de ácidos grasos de los organismos varía y las proporciones de ácidos grasos específicos pueden ser específicas del organismo. Por ejemplo, en los hongos AM, la proporción de ácidos grasos, 16:1ω5 y 18:1ω7, en la porción de fosfolípidos representa aproximadamente el 58% de la composición total de ácidos grasos. [97] El ácido graso 16:1ω5 es el ácido más comúnmente utilizado para caracterizar hongos AM en suelos y puede usarse como un fuerte indicador de la biomasa micelial en muestras de suelo. [97]
El análisis de ácidos grasos y lípidos neutros de los hongos AM generalmente se considera un método para indicar el almacenamiento de energía, pero lo más importante es que la proporción de NLFA (16:1ω5) a PLFA (16:1ω5) puede usarse potencialmente para indicar el estado nutricional de los hongos AM. hongos en los suelos. La energía se almacena principalmente en los hongos AM como lípidos neutros en estructuras de almacenamiento como esporas y vesículas. Debido a esto, el NLFA se correlaciona bastante bien con el número de esporas en un volumen determinado de suelo. [97] La relación entre la concentración de NLFA y la concentración de PLFA (micelia activa) puede dar la proporción de carbono asignado a las estructuras de almacenamiento (esporas, medidas como NLFA).
Los problemas con los análisis de ácidos grasos lipídicos incluyen la especificidad incompleta de los ácidos grasos para los hongos MA, la variación específica de especie o género en la composición de ácidos grasos puede complicar el análisis en sistemas con múltiples especies de hongos MA (por ejemplo, suelo de campo), los altos niveles de fondo de cierta concentración de ácidos grasos en los suelos, y que los fosfolípidos están correlacionados con el área de la membrana de un organismo, y que la relación superficie-volumen puede variar ampliamente entre organismos como bacterias y hongos. [98] Se debe trabajar más para identificar la eficacia de este método en suelos de campo con muchos géneros y especies de hongos AM para discernir la capacidad del método para discriminar entre muchas composiciones diferentes de ácidos grasos.
Una perspectiva para el análisis futuro de los hongos AM es el uso de sondas de isótopos estables. El sondeo de isótopos estables ( SIP ) es una técnica que se puede utilizar para determinar la función metabólica activa de taxones individuales dentro de un sistema complejo de microbios. Este nivel de especificidad, que vincula la función microbiana y la filogenética, no se había logrado anteriormente en ecología microbiana. Este método también se puede utilizar independientemente de los métodos de cultivo clásicos en ecología microbiana, lo que permite el análisis in situ de microbios funcionales. Recientemente también se ha desarrollado la aplicación de la secuenciación de núcleos únicos de esporas de hongos AM y también evita la necesidad de métodos de cultivo. [99]
SIP, más explícitamente SIP basado en ADN/ARN, utiliza sustratos enriquecidos con isótopos estables, como 13 C, 15 N o H 2 18 O, y luego analiza los marcadores "etiquetados" utilizando marcadores de ADN o ARN específicos de cada especie. [100] El análisis del ADN marcado se realiza separando el ADN marcado y no marcado en un gradiente de cloruro de cesio formado en una ultracentrífuga. [101] Debido a que todos los organismos microbianos son capaces de importar agua a sus células, el uso de sondas con isótopos estables H 2 18 O es un nuevo método muy interesante que puede arrojar luz sobre preguntas que los ecólogos y biólogos microbianos han luchado por responder durante años, en En particular, ¿cuáles son los organismos microbianos activos en mi sistema? El método del H 2 18 O, o agua pesada, se dirigirá a todos los organismos que están creciendo activamente e inducirá poca influencia sobre el crecimiento en sí. Esto sería especialmente cierto en la mayoría de los experimentos en invernadero con micorrizas arbusculares porque las plantas deben regarse de todos modos y el agua no selecciona directamente organismos con rutas metabólicas específicas, [101] como sucedería al usar 13 C y 15 N.
Se ha hecho poco con este método en experimentos con micorrizas arbusculares, pero si se demuestra que funciona en un experimento controlado y con un mayor refinamiento de las técnicas de análisis de comunidades fúngicas de ADN/ARN, esta puede ser una opción viable para determinar de manera muy específica la porción de micorrizas en crecimiento activo. Especies de hongos AM a lo largo de las estaciones de crecimiento, con diferentes plantas hospedantes o tratamientos, y frente al cambio climático.
Se ha informado que los ARNs desempeñan un papel crucial en la comunicación cruzada entre el huésped y el simbionte. [102] El mecanismo de procesamiento de los ARNs es, por tanto, importante para comprender la simbiosis AM. Parece que los hongos AM tienen la característica única de tener una enzima central de tipo bacteriano, así como una gran cantidad de proteínas Argonautas en su sistema de procesamiento de ARNs (o sistema de ARNi). [17] La investigación del sRNA y del mecanismo de procesamiento del sRNA también es un tema interesante para comprender la simbiosis de los hongos AM.
La perturbación de las comunidades de plantas nativas en áreas amenazadas por la desertificación suele ir seguida de la degradación de las propiedades físicas y biológicas del suelo, de su estructura, de la disponibilidad de nutrientes y de la materia orgánica. Al restaurar tierras perturbadas, es esencial reemplazar no sólo la vegetación aérea sino también las propiedades biológicas y físicas del suelo. [103]
Un enfoque relativamente nuevo para restaurar la tierra es inocular el suelo con hongos AM cuando se reintroduce vegetación en proyectos de restauración ecológica (fitorremediación). Ha permitido que las plantas hospedantes se establezcan en suelos degradados y mejoren la calidad y la salud del suelo . [104] Los parámetros de calidad del suelo mejoraron significativamente a largo plazo cuando se introdujo una mezcla de especies de hongos micorrízicos arbusculares autóctonos en comparación con el suelo no inoculado y el suelo inoculado con una sola especie exótica de hongos AM. [103] Los beneficios fueron un mayor crecimiento de las plantas, una mayor absorción de fósforo [105] y un mayor contenido de nitrógeno en el suelo, un mayor contenido de materia orgánica en el suelo y una mayor agregación del suelo, atribuidos a una mayor nodulación de las leguminosas en presencia de hongos MA, una mejor infiltración de agua y aireación del suelo. debido a la agregación del suelo. [103] Las cepas nativas de hongos AM mejoran la extracción de metales pesados de los suelos contaminados y hacen que el suelo sea saludable y adecuado para la producción de cultivos. [106]
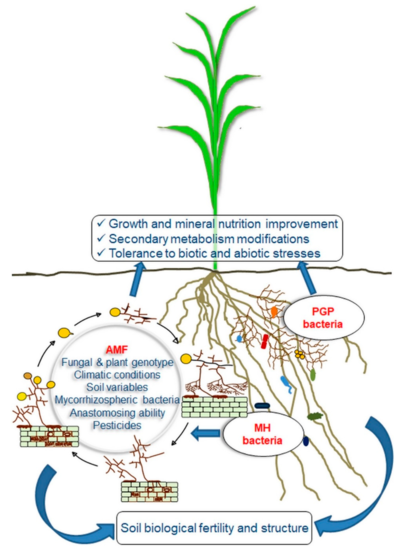
Muchas prácticas agronómicas modernas alteran la simbiosis micorrízica. Existe un gran potencial para que la agricultura de bajos insumos gestione el sistema de una manera que promueva la simbiosis de micorrizas.
Las prácticas agrícolas convencionales, como la labranza , los fertilizantes y fungicidas intensos , la mala rotación de cultivos y la selección de plantas que sobrevivan a estas condiciones, obstaculizan la capacidad de las plantas para formar simbiosis con hongos micorrízicos arbusculares.
La mayoría de los cultivos agrícolas pueden tener un mejor rendimiento y ser más productivos cuando están bien colonizados por hongos AM. La simbiosis AM aumenta la absorción y el crecimiento de fósforo y micronutrientes de su planta huésped (George et al. 1992).
El manejo de los hongos MA es especialmente importante para los sistemas agrícolas orgánicos y de bajos insumos donde el fósforo del suelo es, en general, bajo, aunque todos los agroecosistemas pueden beneficiarse al promover el establecimiento de micorrizas arbusculares.
Algunos cultivos que no buscan nutrientes en el suelo son muy dependientes de los hongos AM para la absorción de fósforo. Por ejemplo, el lino , que tiene poca capacidad quimiotáxica, depende en gran medida de la absorción de fósforo mediada por AM en concentraciones bajas e intermedias de fósforo en el suelo (Thingstrup et al. 1998).
Una gestión adecuada de los HMA en los agroecosistemas puede mejorar la calidad del suelo y la productividad de la tierra. Las prácticas agrícolas como la labranza reducida, el uso de fertilizantes con bajo contenido de fósforo y los sistemas de cultivo perennes promueven la simbiosis micorrízica funcional.
La labranza reduce el potencial de inoculación del suelo y la eficacia de las micorrizas al alterar la red de hifas extrarradicales (Miller et al. 1995, McGonigle & Miller 1999, Mozafar et al. 2000).
Al romper la macroestructura del suelo, la red de hifas se vuelve no infecciosa (Miller et al. 1995, McGonigle & Miller 1999). La alteración de la red de hifas disminuye la capacidad de absorción de las micorrizas porque el área de superficie que abarcan las hifas se reduce considerablemente. Esto, a su vez, reduce el aporte de fósforo a las plantas que están conectadas a la red de hifas (Figura 3, McGonigle y Miller 1999).
En el sistema de labranza reducida, es posible que no se requiera una gran cantidad de fertilizantes con fósforo en comparación con los sistemas de labranza intensa. Esto se debe al aumento de la red de micorrizas, lo que permite que las micorrizas proporcionen a la planta suficiente fósforo (Miller et al. 1995).
Los beneficios del AMF son mayores en sistemas donde los insumos son bajos. El uso intensivo de fertilizantes con fósforo puede inhibir la colonización y el crecimiento de micorrizas.
A medida que aumentan los niveles de fósforo en el suelo disponibles para las plantas, la cantidad de fósforo también aumenta en los tejidos de la planta, y el drenaje de carbono en la planta por la simbiosis de hongos AM deja de ser beneficioso para la planta (Grant 2005).
Una disminución en la colonización de micorrizas debido a altos niveles de fósforo en el suelo puede conducir a deficiencias de las plantas en otros micronutrientes que tienen una absorción mediada por micorrizas, como el cobre (Timmer y Leyden 1980).
Los cultivos de cobertura se cultivan en otoño, invierno y primavera, cubriendo el suelo durante los períodos en los que normalmente quedaría sin una cobertura de plantas en crecimiento.
Los cultivos de cobertura de micorrizas se pueden utilizar para mejorar el potencial de inóculo de micorrizas y la red de hifas (Kabir y Koide 2000, Boswell et al. 1998, Sorensen et al. 2005).
Dado que los hongos AM son biotróficos, dependen de las plantas para el crecimiento de sus redes de hifas. El cultivo de un cultivo de cobertura extiende el tiempo de crecimiento por la mañana hasta el otoño, el invierno y la primavera. La promoción del crecimiento de las hifas crea una red de hifas más extensa. El aumento de la colonización de micorrizas encontrado en los sistemas de cultivos de cobertura puede atribuirse en gran medida a un aumento en la red de hifas extrarradicales que puede colonizar las raíces del nuevo cultivo (Boswell et al. 1998). Los micelios extrarradicales pueden sobrevivir el invierno, proporcionando una rápida colonización primaveral y una simbiosis temprana (McGonigle y Miller 1999). Esta simbiosis temprana permite a las plantas aprovechar la red de hifas bien establecida y recibir una nutrición adecuada de fósforo durante el crecimiento inicial, lo que mejora enormemente el rendimiento del cultivo.
La restauración de hongos AM nativos aumenta el éxito del proyecto de restauración ecológica y la rapidez de la recuperación del suelo. [103] Los hongos AM mejoran la estabilidad de los agregados del suelo debido a la producción de hifas extrarradicales y una proteína del suelo conocida como glomalina .
Las proteínas del suelo relacionadas con la glomalina (GRSP) se han identificado utilizando un anticuerpo monoclonal (Mab32B11) generado contra esporas de HMA trituradas. Se define por sus condiciones de extracción y reacción con el anticuerpo Mab32B11.
Hay otra evidencia circunstancial que demuestra que la glomalina es de origen fúngico AM. Cuando los hongos AM se eliminan del suelo mediante la incubación del suelo sin plantas hospedantes, la concentración de GRSP disminuye. También se ha observado una disminución similar en GRSP en suelos incubados de tierras boscosas, forestadas y agrícolas [108] y pastizales tratados con fungicida. [109]
Se plantea la hipótesis de que la glomalina mejora la estabilidad del agua de los agregados del suelo y disminuye la erosión del suelo . Se ha encontrado una fuerte correlación entre GRSP y la estabilidad del agua de los agregados del suelo en una amplia variedad de suelos donde el material orgánico es el principal agente aglutinante, aunque se desconoce el mecanismo. [109] La proteína glomalina aún no se ha aislado ni descrito, y el vínculo entre la glomalina, GRSP y los hongos micorrízicos arbusculares aún no está claro. [109]
{{cite journal}}: Citar diario requiere |journal=( ayuda ){{cite book}}: Mantenimiento CS1: varios nombres: lista de autores ( enlace )