_01.JPG/440px-Операционная._ФЦН_(Тюмень)_01.JPG)

La ingeniería biomédica ( BME ) o ingeniería médica es la aplicación de principios de ingeniería y conceptos de diseño a la medicina y la biología para aplicaciones de atención médica (por ejemplo, fines diagnósticos o terapéuticos). La BME también es tradicionalmente una ciencia lógica para avanzar en el tratamiento de la atención médica, incluido el diagnóstico , el monitoreo y la terapia . [1] [2] También se incluye bajo el alcance de un ingeniero biomédico la gestión del equipo médico actual en los hospitales, al tiempo que se adhiere a los estándares relevantes de la industria. Esto implica la adquisición, las pruebas de rutina, el mantenimiento preventivo y la realización de recomendaciones de equipos, un rol también conocido como Técnico en Equipos Biomédicos (BMET) o como ingeniero clínico .
La ingeniería biomédica ha surgido recientemente como su propio campo de estudio, en comparación con muchos otros campos de ingeniería. [3] Tal evolución es común a medida que un nuevo campo pasa de ser una especialización interdisciplinaria entre campos ya establecidos a ser considerado un campo en sí mismo. Gran parte del trabajo en ingeniería biomédica consiste en investigación y desarrollo , que abarca una amplia gama de subcampos (ver a continuación). Las aplicaciones destacadas de la ingeniería biomédica incluyen el desarrollo de prótesis biocompatibles , varios dispositivos médicos de diagnóstico y terapéuticos que van desde equipos clínicos hasta microimplantes, tecnologías de imágenes como MRI y EKG / ECG , crecimiento de tejido regenerativo y el desarrollo de medicamentos farmacéuticos, incluidos los biofarmacéuticos .

La bioinformática es un campo interdisciplinario que desarrolla métodos y herramientas de software para comprender datos biológicos. Como campo interdisciplinario de la ciencia, la bioinformática combina la informática, la estadística, las matemáticas y la ingeniería para analizar e interpretar datos biológicos.
La bioinformática se considera un término general para el conjunto de estudios biológicos que utilizan la programación informática como parte de su metodología, así como una referencia a "canalizaciones" de análisis específicas que se utilizan repetidamente, en particular en el campo de la genómica. Los usos comunes de la bioinformática incluyen la identificación de genes y nucleótidos candidatos (SNP). A menudo, dicha identificación se realiza con el objetivo de comprender mejor la base genética de la enfermedad, las adaptaciones únicas, las propiedades deseables (especialmente en especies agrícolas) o las diferencias entre poblaciones. De una manera menos formal, la bioinformática también intenta comprender los principios organizativos dentro de las secuencias de ácidos nucleicos y proteínas.
.jpg/440px-B09685P005_(1).jpg)
La biomecánica es el estudio de la estructura y función de los aspectos mecánicos de los sistemas biológicos, en cualquier nivel desde organismos completos hasta órganos , células y orgánulos celulares , [4] utilizando los métodos de la mecánica . [5]
Un biomaterial es cualquier materia, superficie o construcción que interactúa con los sistemas vivos. Como ciencia, los biomateriales tienen unos cincuenta años. El estudio de los biomateriales se denomina ciencia de los biomateriales o ingeniería de biomateriales . Ha experimentado un crecimiento constante y sólido a lo largo de su historia, con muchas empresas invirtiendo grandes cantidades de dinero en el desarrollo de nuevos productos. La ciencia de los biomateriales abarca elementos de la medicina, la biología, la química, la ingeniería de tejidos y la ciencia de los materiales.
La óptica biomédica combina los principios de la física, la ingeniería y la biología para estudiar la interacción del tejido biológico y la luz, y cómo esto puede aprovecharse para la detección, la obtención de imágenes y el tratamiento. [6] Tiene una amplia gama de aplicaciones, que incluyen la obtención de imágenes ópticas, la microscopía, la oftalmoscopia, la espectroscopia y la terapia. Algunos ejemplos de técnicas y tecnologías de óptica biomédica incluyen la tomografía de coherencia óptica (OCT), la microscopía de fluorescencia , la microscopía confocal y la terapia fotodinámica (PDT). La OCT, por ejemplo, utiliza la luz para crear imágenes tridimensionales de alta resolución de estructuras internas, como la retina en el ojo o las arterias coronarias en el corazón. La microscopía de fluorescencia implica marcar moléculas específicas con tintes fluorescentes y visualizarlas utilizando luz, lo que proporciona información sobre los procesos biológicos y los mecanismos de las enfermedades. Más recientemente, la óptica adaptativa está ayudando a la obtención de imágenes al corregir las aberraciones en el tejido biológico, lo que permite obtener imágenes de mayor resolución y una precisión mejorada en procedimientos como la cirugía láser y la obtención de imágenes de retina.
La ingeniería de tejidos, al igual que la ingeniería genética (ver más abajo), es un segmento importante de la biotecnología , que se superpone significativamente con la BME.
Uno de los objetivos de la ingeniería de tejidos es crear órganos artificiales (a partir de material biológico) para pacientes que necesitan trasplantes de órganos. Los ingenieros biomédicos están investigando actualmente métodos para crear dichos órganos. Los investigadores han creado mandíbulas sólidas [7] y tráqueas [8] a partir de células madre humanas con este fin. Se han creado varias vejigas urinarias artificiales en laboratorios y se han trasplantado con éxito a pacientes humanos. [9] Los órganos bioartificiales, que utilizan componentes tanto sintéticos como biológicos, también son un área de interés en la investigación, como los dispositivos de asistencia hepática que utilizan células hepáticas dentro de una construcción de biorreactor artificial. [10]

La ingeniería genética, la tecnología del ADN recombinante, la modificación/manipulación genética (GM) y el empalme de genes son términos que se aplican a la manipulación directa de los genes de un organismo. A diferencia de la cría tradicional, un método indirecto de manipulación genética, la ingeniería genética utiliza herramientas modernas como la clonación y la transformación molecular para alterar directamente la estructura y las características de los genes objetivo. Las técnicas de ingeniería genética han tenido éxito en numerosas aplicaciones. Algunos ejemplos incluyen la mejora de la tecnología de los cultivos ( no es una aplicación médica , pero véase ingeniería de sistemas biológicos ), la fabricación de insulina humana sintética mediante el uso de bacterias modificadas, la fabricación de eritropoyetina en células de ovario de hámster y la producción de nuevos tipos de ratones experimentales como el oncómido (ratón canceroso) para la investigación. [ cita requerida ]
La ingeniería neuronal (también conocida como neuroingeniería) es una disciplina que utiliza técnicas de ingeniería para comprender, reparar, reemplazar o mejorar los sistemas neuronales. Los ingenieros neuronales están especialmente calificados para resolver problemas de diseño en la interfaz entre tejido neuronal vivo y estructuras no vivas. La ingeniería neuronal puede ayudar en numerosas áreas, incluido el desarrollo futuro de prótesis. Por ejemplo, las prótesis neuronales cognitivas (CNP) están siendo investigadas en profundidad y permitirían la implantación de un chip para ayudar a las personas que tienen prótesis al proporcionar señales para operar dispositivos de asistencia. [11]
La ingeniería farmacéutica es una ciencia interdisciplinaria que incluye la ingeniería de fármacos, la administración y la selección de nuevos fármacos, la tecnología farmacéutica, las operaciones unitarias de la ingeniería química y el análisis farmacéutico. Puede considerarse parte de la farmacia debido a su enfoque en el uso de tecnología en agentes químicos para brindar un mejor tratamiento medicinal.

Se trata de una categoría extremadamente amplia , que abarca básicamente todos los productos sanitarios que no consiguen los resultados previstos mediante medios predominantemente químicos (por ejemplo, productos farmacéuticos) o biológicos (por ejemplo, vacunas) y que no implican el metabolismo.
Un dispositivo médico está destinado a ser utilizado en:
Algunos ejemplos incluyen marcapasos , bombas de infusión , la máquina corazón-pulmón , máquinas de diálisis , órganos artificiales , implantes , miembros artificiales , lentes correctivas , implantes cocleares , prótesis oculares , prótesis faciales , prótesis somatoprótesis e implantes dentales .
La estereolitografía es un ejemplo práctico de modelado médico utilizado para crear objetos físicos. Además de modelar órganos y el cuerpo humano, las técnicas de ingeniería emergentes también se utilizan actualmente en la investigación y el desarrollo de nuevos dispositivos para terapias innovadoras, [12] tratamientos, [13] monitoreo de pacientes y [14] de enfermedades complejas.
Los dispositivos médicos están regulados y clasificados (en los EE. UU.) de la siguiente manera (ver también Regulación ):
La obtención de imágenes médicas y biomédicas es un segmento importante de los dispositivos médicos . Esta área se ocupa de permitir a los médicos "ver" directa o indirectamente cosas que no son visibles a simple vista (por ejemplo, debido a su tamaño o ubicación). Esto puede implicar el uso de ultrasonidos, magnetismo, rayos ultravioleta, radiología y otros medios.
Como alternativa, los equipos guiados por navegación utilizan tecnología de seguimiento electromagnético , como la colocación de catéteres en el cerebro o los sistemas de colocación de sondas de alimentación . Por ejemplo, ENvue de ENvizion Medical, un sistema de navegación electromagnética para la colocación de sondas de alimentación enteral. El sistema utiliza un generador de campo externo y varios sensores pasivos EM que permiten ajustar la escala de la pantalla al contorno corporal del paciente y una vista en tiempo real de la ubicación y dirección de la punta de la sonda de alimentación, lo que ayuda al personal médico a garantizar la colocación correcta en el tracto gastrointestinal . [15]

Las tecnologías de imágenes suelen ser esenciales para el diagnóstico médico y suelen ser el equipo más complejo que se encuentra en un hospital, incluyendo: fluoroscopia , resonancia magnética (MRI), medicina nuclear , tomografía por emisión de positrones (PET), exploraciones PET-CT , radiografía de proyección como rayos X y tomografías computarizadas , tomografía , ultrasonido , microscopía óptica y microscopía electrónica .
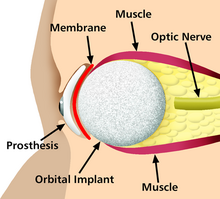
Un implante es un tipo de dispositivo médico diseñado para reemplazar y actuar como una estructura biológica faltante (a diferencia de un trasplante, que indica tejido biomédico trasplantado). La superficie de los implantes que entran en contacto con el cuerpo puede estar hecha de un material biomédico como titanio, silicona o apatita, según cuál sea el más funcional. En algunos casos, los implantes contienen componentes electrónicos, por ejemplo, marcapasos artificiales e implantes cocleares. Algunos implantes son bioactivos, como los dispositivos de administración subcutánea de fármacos en forma de píldoras implantables o stents liberadores de fármacos .

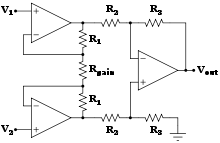
Los reemplazos de partes del cuerpo por prótesis son una de las muchas aplicaciones de la biónica. La biónica, que se ocupa del estudio minucioso y complejo de las propiedades y funciones de los sistemas del cuerpo humano, puede aplicarse para resolver algunos problemas de ingeniería. El estudio minucioso de las diferentes funciones y procesos de los ojos, los oídos y otros órganos allanó el camino para la mejora de las cámaras, la televisión, los transmisores y receptores de radio y muchas otras herramientas.
En los últimos años, los sensores biomédicos basados en tecnología de microondas han ganado más atención. Se pueden fabricar diferentes sensores para usos específicos tanto en el diagnóstico como en el control de enfermedades; por ejemplo, los sensores de microondas se pueden utilizar como una técnica complementaria a los rayos X para controlar los traumatismos de las extremidades inferiores. [16] El sensor controla las propiedades dieléctricas y, por lo tanto, puede detectar cambios en el tejido (hueso, músculo, grasa, etc.) debajo de la piel, de modo que, al medir en diferentes momentos durante el proceso de curación, la respuesta del sensor cambiará a medida que se cura el traumatismo.
La ingeniería clínica es la rama de la ingeniería biomédica que se ocupa de la implementación real de equipos y tecnologías médicas en hospitales u otros entornos clínicos. Las principales funciones de los ingenieros clínicos incluyen la capacitación y supervisión de técnicos en equipos biomédicos (BMET) , la selección de productos/servicios tecnológicos y la gestión logística de su implementación, el trabajo con los reguladores gubernamentales en inspecciones/auditorías y la función de consultores tecnológicos para otro personal del hospital (por ejemplo, médicos, administradores, TI, etc.). Los ingenieros clínicos también asesoran y colaboran con los productores de dispositivos médicos en relación con posibles mejoras de diseño basadas en experiencias clínicas, así como también monitorean la progresión del estado de la técnica para redirigir los patrones de adquisición en consecuencia.
Su enfoque inherente en la implementación práctica de la tecnología ha tendido a mantenerlos orientados más hacia rediseños y reconfiguraciones de nivel incremental , en oposición a la investigación y desarrollo revolucionarios o ideas que estarían a muchos años de su adopción clínica; sin embargo, hay un esfuerzo creciente para expandir este horizonte temporal sobre el cual los ingenieros clínicos pueden influir en la trayectoria de la innovación biomédica. En sus diversas funciones, forman un "puente" entre los diseñadores principales y los usuarios finales, al combinar las perspectivas de estar cerca del punto de uso, mientras que también están capacitados en ingeniería de productos y procesos. Los departamentos de ingeniería clínica a veces contratarán no solo ingenieros biomédicos, sino también ingenieros industriales/de sistemas para ayudar a abordar la investigación/optimización de operaciones, factores humanos, análisis de costos, etc. Además, consulte ingeniería de seguridad para una discusión de los procedimientos utilizados para diseñar sistemas seguros. El departamento de ingeniería clínica está construido con un gerente, supervisor, ingeniero y técnico. Un ingeniero por cada ochenta camas en el hospital es la proporción. Los ingenieros clínicos también están autorizados a auditar las tiendas farmacéuticas y asociadas para monitorear los retiros de productos invasivos de la FDA.

La ingeniería de rehabilitación es la aplicación sistemática de las ciencias de la ingeniería para diseñar, desarrollar, adaptar, probar, evaluar, aplicar y distribuir soluciones tecnológicas a los problemas que enfrentan las personas con discapacidades. Las áreas funcionales que se abordan mediante la ingeniería de rehabilitación pueden incluir la movilidad, las comunicaciones, la audición, la visión y la cognición, y las actividades asociadas con el empleo, la vida independiente, la educación y la integración a la comunidad. [1]
Si bien algunos ingenieros de rehabilitación tienen títulos de maestría en ingeniería de rehabilitación, generalmente una subespecialidad de ingeniería biomédica, la mayoría de los ingenieros de rehabilitación tienen títulos de grado o posgrado en ingeniería biomédica, ingeniería mecánica o ingeniería eléctrica. Una universidad portuguesa ofrece un título de grado y un título de maestría en Ingeniería de Rehabilitación y Accesibilidad. [7] [9] La calificación para convertirse en ingeniero de rehabilitación en el Reino Unido es posible a través de un curso de licenciatura con honores en la Universidad, como el Instituto de Diseño y Tecnología de la Salud de la Universidad de Coventry. [10]
El proceso de rehabilitación para personas con discapacidad a menudo implica el diseño de dispositivos de asistencia, como ayudas para caminar, destinados a promover la inclusión de sus usuarios en la sociedad, el comercio y la recreación.
En las últimas décadas, los problemas regulatorios han aumentado constantemente para responder a los numerosos incidentes que los dispositivos provocan a los pacientes. Por ejemplo, entre 2008 y 2011, en Estados Unidos, hubo 119 retiradas de productos sanitarios clasificados como clase I por parte de la FDA. Según la Administración de Alimentos y Medicamentos de Estados Unidos (FDA), la retirada de productos de clase I está asociada a "una situación en la que existe una probabilidad razonable de que el uso o la exposición a un producto cause consecuencias adversas graves para la salud o la muerte" [17].
Independientemente de la legislación específica de cada país, los principales objetivos regulatorios coinciden en todo el mundo. [18] Por ejemplo, en la reglamentación sobre dispositivos médicos, un producto debe ser: 1) seguro y 2) efectivo y 3) para todos los dispositivos fabricados (¿por qué se elimina esta parte?)
Un producto es seguro si los pacientes, usuarios y terceros no corren riesgos inaceptables de peligro físico (muerte, lesiones, etc.) en el uso previsto. Se deben introducir medidas de protección en los productos para reducir los riesgos residuales a un nivel aceptable en comparación con el beneficio derivado de su uso.
Un producto es eficaz si funciona según lo especificado por el fabricante en el uso previsto. La eficacia se logra mediante una evaluación clínica, el cumplimiento de los estándares de rendimiento o demostraciones de equivalencia sustancial con un dispositivo ya comercializado.
Las características anteriores deben garantizarse para todos los elementos fabricados del dispositivo médico. Esto requiere que exista un sistema de calidad para todas las entidades y procesos relevantes que puedan afectar la seguridad y la eficacia a lo largo de todo el ciclo de vida del dispositivo médico.
El área de ingeniería de dispositivos médicos es uno de los campos de ingeniería más regulados, y los ingenieros biomédicos en ejercicio deben consultar y cooperar rutinariamente con abogados especializados en derecho regulatorio y otros expertos. La Administración de Alimentos y Medicamentos (FDA) es la principal autoridad regulatoria de la atención médica en los Estados Unidos, y tiene jurisdicción sobre dispositivos médicos, medicamentos, productos biológicos y productos combinados. Los objetivos primordiales que impulsan las decisiones políticas de la FDA son la seguridad y la eficacia de los productos para el cuidado de la salud, que deben garantizarse mediante un sistema de calidad implementado según lo especificado en la regulación 21 CFR 829. Además, debido a que los ingenieros biomédicos a menudo desarrollan dispositivos y tecnologías para uso "del consumidor", como dispositivos de fisioterapia (que también son dispositivos "médicos"), estos también pueden estar regidos en algunos aspectos por la Comisión de Seguridad de Productos del Consumidor . Los mayores obstáculos tienden a ser la "autorización" 510K (normalmente para dispositivos de Clase 2) o la "aprobación" previa a la comercialización (normalmente para medicamentos y dispositivos de Clase 3).
En el contexto europeo, la seguridad, eficacia y calidad se aseguran mediante la "Evaluación de la conformidad", que se define como "el método por el cual un fabricante demuestra que su dispositivo cumple con los requisitos de la Directiva Europea de Dispositivos Médicos ". La directiva especifica diferentes procedimientos según la clase del dispositivo, que van desde la simple Declaración de conformidad (Anexo VII) para dispositivos de Clase I hasta la verificación CE (Anexo IV), el aseguramiento de la calidad de la producción (Anexo V), el aseguramiento de la calidad del producto (Anexo VI) y el aseguramiento de la calidad total (Anexo II). La Directiva de Dispositivos Médicos especifica procedimientos detallados para la Certificación. En términos generales, estos procedimientos incluyen pruebas y verificaciones que deben estar contenidas en entregas específicas como el expediente de gestión de riesgos, el expediente técnico y las entregas del sistema de calidad. El expediente de gestión de riesgos es el primer entregable que condiciona los siguientes pasos de diseño y fabricación. La etapa de gestión de riesgos debe conducir al producto de manera que los riesgos del producto se reduzcan a un nivel aceptable con respecto a los beneficios esperados para los pacientes por el uso del dispositivo. El expediente técnico contiene todos los datos y registros de la documentación que respaldan la certificación del dispositivo médico. El expediente técnico de la FDA tiene un contenido similar aunque organizado en una estructura diferente. Los resultados del sistema de calidad suelen incluir procedimientos que garantizan la calidad durante todo el ciclo de vida del producto. La misma norma (ISO EN 13485) se suele aplicar a los sistemas de gestión de calidad en los EE. UU. y en todo el mundo.

En la Unión Europea existen entidades certificadoras denominadas “ Organismos Notificados ”, acreditadas por los Estados Miembros de la Unión Europea. Los Organismos Notificados deben garantizar la eficacia del proceso de certificación de todos los productos sanitarios, excepto los de clase I, para los que una declaración de conformidad elaborada por el fabricante es suficiente para su comercialización. Una vez que un producto ha superado todos los pasos exigidos por la Directiva de Productos Sanitarios, el producto tiene derecho a llevar el marcado CE , que indica que se considera que el producto es seguro y eficaz cuando se utiliza según lo previsto y, por tanto, puede comercializarse en el ámbito de la Unión Europea.
Los diferentes acuerdos regulatorios a veces hacen que determinadas tecnologías se desarrollen primero en Estados Unidos o en Europa, según la forma de regulación más favorable. Si bien los países suelen esforzarse por lograr una armonía sustancial para facilitar la distribución transnacional, las diferencias filosóficas sobre el grado óptimo de regulación pueden ser un obstáculo; las regulaciones más restrictivas parecen atractivas a un nivel intuitivo, pero los críticos denuncian el costo que esto implica en términos de desaceleración del acceso a avances que salvan vidas.
La Directiva 2011/65/UE, más conocida como RoHS 2, es una nueva versión de la legislación introducida originalmente en 2002. La legislación original de la UE "Restricciones de determinadas sustancias peligrosas en dispositivos eléctricos y electrónicos" (Directiva RoHS 2002/95/CE) fue reemplazada y derogada por la 2011/65/UE publicada en julio de 2011 y comúnmente conocida como RoHS 2. RoHS busca limitar las sustancias peligrosas en circulación en los productos electrónicos, en particular toxinas y metales pesados, que posteriormente se liberan al medio ambiente cuando dichos dispositivos se reciclan.
El ámbito de aplicación de la directiva RoHS 2 se amplía para incluir productos que antes estaban excluidos, como los dispositivos médicos y los equipos industriales. Además, los fabricantes están obligados a proporcionar evaluaciones de riesgo de conformidad e informes de pruebas, o explicar por qué no los presentan. Por primera vez, no solo los fabricantes, sino también los importadores y distribuidores comparten la responsabilidad de garantizar que los equipos eléctricos y electrónicos incluidos en el ámbito de aplicación de la directiva RoHS cumplan con los límites de sustancias peligrosas y tengan el marcado CE en sus productos.
La nueva norma internacional IEC 60601 para dispositivos electromédicos de atención sanitaria domiciliaria define los requisitos de los dispositivos utilizados en el entorno de atención sanitaria domiciliaria. La norma IEC 60601-1-11 (2010) debe incorporarse ahora al diseño y la verificación de una amplia gama de dispositivos médicos de uso domiciliario y en el punto de atención, junto con otras normas aplicables de la serie IEC 60601 de 3.ª edición.
La fecha obligatoria para la implementación de la versión europea EN de la norma es el 1 de junio de 2013. La FDA de EE. UU. exige el uso de la norma el 30 de junio de 2013, mientras que Health Canada recientemente extendió la fecha requerida de junio de 2012 a abril de 2013. Las agencias de América del Norte solo requerirán estas normas para las presentaciones de nuevos dispositivos, mientras que la UE adoptará el enfoque más severo de exigir que todos los dispositivos aplicables que se coloquen en el mercado consideren la norma de atención médica domiciliaria.
AS/ANS 3551:2012 es la norma australiana y neozelandesa para la gestión de dispositivos médicos. La norma especifica los procedimientos necesarios para mantener una amplia gama de activos médicos en un entorno clínico (por ejemplo, un hospital). [19] Las normas se basan en las normas IEC 606101.
La norma cubre una amplia gama de elementos de gestión de equipos médicos, incluidos la adquisición, las pruebas de aceptación, el mantenimiento (seguridad eléctrica y pruebas de mantenimiento preventivo) y el desmantelamiento.
Los ingenieros biomédicos requieren un conocimiento considerable tanto de ingeniería como de biología, y normalmente tienen una licenciatura (B.Sc., BS, B.Eng. o BSE) o una maestría (MS, M.Sc., MSE o M.Eng.) o un doctorado (Ph.D. o MD-PhD [20] [21] [22] ) en BME (Ingeniería Biomédica) u otra rama de la ingeniería con un potencial considerable de superposición de BME. A medida que aumenta el interés en BME, muchas escuelas de ingeniería ahora tienen un Departamento o Programa de Ingeniería Biomédica, con ofertas que van desde el nivel de pregrado (B.Sc., BS, B.Eng. o BSE) hasta el doctorado. La ingeniería biomédica recién ha estado surgiendo como una disciplina propia en lugar de una especialización híbrida interdisciplinaria de otras disciplinas; Los programas de ingeniería biomédica en todos los niveles se están extendiendo cada vez más, incluida la Licenciatura en Ciencias en Ingeniería Biomédica , que incluye suficiente contenido de ciencias biológicas como para que muchos estudiantes la utilicen como una carrera " premédica " en preparación para la facultad de medicina . Se espera que el número de ingenieros biomédicos aumente como causa y efecto de las mejoras en la tecnología médica. [23]
En los EE. UU., la ABET también está reconociendo un número cada vez mayor de programas de grado como programas acreditados de bioingeniería/ingeniería biomédica. En 2023, 155 programas están acreditados por la ABET. [24]
En Canadá y Australia, los programas de posgrado acreditados en ingeniería biomédica son comunes. [25] Por ejemplo, la Universidad McMaster ofrece un MASc, un MD/PhD y un doctorado en ingeniería biomédica. [26] El primer programa de licenciatura en ingeniería biomédica canadiense se ofreció en la Universidad de Guelph como un programa de B.Eng. de cuatro años. [27] La Politécnica de Montreal también ofrece una licenciatura en ingeniería biomédica [28] al igual que la Universidad Flinders. [29]
Al igual que ocurre con muchos títulos, la reputación y la clasificación de un programa pueden influir en la conveniencia de que un licenciado sea admitido en un programa de posgrado o de empleo. La reputación de muchos títulos de grado también está vinculada a los programas de posgrado o de investigación de la institución, que tienen algunos factores tangibles para la clasificación, como la financiación y el volumen de investigación, las publicaciones y las citas. En el caso de las universidades de minorías étnicas, en particular, la clasificación del hospital y la facultad de medicina de una universidad también puede ser un factor importante en el prestigio percibido de su departamento o programa de minorías étnicas.
La educación de posgrado es un aspecto particularmente importante en BME. Si bien muchos campos de ingeniería (como la ingeniería mecánica o eléctrica) no requieren una formación de nivel de posgrado para obtener un trabajo de nivel inicial en su campo, la mayoría de los puestos BME sí la prefieren o incluso la requieren. [30] Dado que la mayoría de las profesiones relacionadas con BME involucran investigación científica, como en el desarrollo farmacéutico y de dispositivos médicos , la educación de posgrado es casi un requisito (ya que los títulos de grado generalmente no involucran suficiente capacitación y experiencia en investigación). Esta puede ser una maestría o un doctorado; si bien en ciertas especialidades un doctorado es notablemente más común que en otras, casi nunca es la mayoría (excepto en el ámbito académico). De hecho, la necesidad percibida de algún tipo de credencial de posgrado es tan fuerte que algunos programas de BME de pregrado desalientan activamente a los estudiantes de especializarse en BME sin una intención expresa de obtener también una maestría o postularse a la escuela de medicina después.
Los programas de posgrado en BME, al igual que en otros campos científicos, son muy variados y algunos programas pueden enfatizar ciertos aspectos dentro del campo. También pueden incluir amplios esfuerzos de colaboración con programas en otros campos (como la Facultad de Medicina de la universidad u otras divisiones de ingeniería), debido nuevamente a la naturaleza interdisciplinaria de BME. Los programas de maestría y doctorado generalmente requerirán que los solicitantes tengan un título universitario en BME u otra disciplina de ingeniería (más ciertos cursos de ciencias de la vida), o ciencias de la vida (más ciertos cursos de ingeniería).
La educación en BME también varía mucho en todo el mundo. En virtud de su amplio sector de biotecnología, sus numerosas universidades importantes y relativamente pocas barreras internas, Estados Unidos ha avanzado mucho en el desarrollo de oportunidades de educación y capacitación en BME. Europa, que también tiene un gran sector de biotecnología y un sistema educativo impresionante, ha encontrado problemas para crear estándares uniformes a medida que la comunidad europea intenta suplantar algunas de las barreras jurisdiccionales nacionales que aún existen. Recientemente, han surgido iniciativas como BIOMEDEA para desarrollar educación y estándares profesionales relacionados con BME. [31] Otros países, como Australia, están reconociendo y tomando medidas para corregir deficiencias en su educación BME. [32] Además, como los esfuerzos de alta tecnología suelen ser distintivos de las naciones desarrolladas, algunas áreas del mundo son propensas a un desarrollo más lento en educación, incluida la BME.
Al igual que con otras profesiones académicas, cada estado tiene ciertos requisitos (bastante similares) para obtener una licencia de ingeniero profesional registrado (PE), pero, en los EE. UU., en la industria, no se requiere dicha licencia para ser empleado como ingeniero en la mayoría de las situaciones (debido a una excepción conocida como la exención industrial, que se aplica efectivamente a la gran mayoría de los ingenieros estadounidenses). El modelo estadounidense generalmente ha sido el de exigir únicamente que los ingenieros en ejercicio que ofrecen servicios de ingeniería que impactan en el bienestar público, la seguridad, la protección de la vida, la salud o la propiedad tengan licencia, mientras que los ingenieros que trabajan en la industria privada sin una oferta directa de servicios de ingeniería al público u otras empresas, la educación y el gobierno no necesitan licencia. Esto no es notable en muchos otros países, donde una licencia es tan legalmente necesaria para ejercer la ingeniería como lo es para el derecho o la medicina.
La ingeniería biomédica está regulada en algunos países, como Australia, pero el registro generalmente sólo se recomienda y no es obligatorio. [33]
En el Reino Unido, los ingenieros mecánicos que trabajan en las áreas de ingeniería médica, bioingeniería o ingeniería biomédica pueden obtener el estatus de ingeniero colegiado a través de la Institución de Ingenieros Mecánicos . La Institución también dirige la División de Ingeniería en Medicina y Salud. [34] El Instituto de Física e Ingeniería en Medicina (IPEM) tiene un panel para la acreditación de cursos de maestría en ingeniería biomédica y el estatus de ingeniero colegiado también se puede solicitar a través del IPEM.
El examen Fundamentos de la ingeniería , el primero (y más general) de los dos exámenes de licencia para la mayoría de las jurisdicciones de los EE. UU., ahora cubre la biología (aunque técnicamente no BME). Para el segundo examen, llamado Principios y prácticas, parte 2, o el examen de ingeniería profesional, los candidatos pueden seleccionar el contenido de una disciplina de ingeniería en particular sobre la que se realizará la prueba; actualmente no existe una opción para BME con esto, lo que significa que cualquier ingeniero biomédico que busque una licencia debe prepararse para tomar este examen en otra categoría (lo que no afecta la licencia real, ya que la mayoría de las jurisdicciones no reconocen especialidades disciplinarias de todos modos). Sin embargo, la Sociedad de Ingeniería Biomédica (BMES) está explorando, a partir de 2009, la posibilidad de intentar implementar una versión específica de BME de este examen para facilitar a los ingenieros biomédicos la búsqueda de la licencia.
Además del registro gubernamental, ciertas organizaciones profesionales/industriales del sector privado también ofrecen certificaciones con distintos grados de relevancia. Un ejemplo de ello es la certificación de Ingeniero Clínico Certificado (CCE) para ingenieros clínicos.
En 2012, había alrededor de 19.400 ingenieros biomédicos empleados en los EE. UU., y se predijo que el campo crecería un 5% (más rápido que el promedio) entre 2012 y 2022. [35] La ingeniería biomédica tiene el porcentaje más alto de ingenieras en comparación con otras profesiones de ingeniería comunes.