Los tumores de células germinales de ovario (OGCT) son tumores heterogéneos que se derivan de las células germinales primitivas de la gónada embrionaria , que representa aproximadamente el 2,6 % de todas las neoplasias malignas de ovario. [1] Hay cuatro tipos principales de OGCT, a saber, disgerminomas , tumor del saco vitelino , teratoma y coriocarcinoma . [1]
Los dygerminomas son tumores malignos de células germinales del ovario y son particularmente prominentes en pacientes diagnosticadas con disgenesia gonadal . [1] Los OGCT son relativamente difíciles de detectar y diagnosticar en una etapa temprana debido a las características histológicas no específicas. [1] Los síntomas comunes de OGCT son hinchazón , distensión abdominal , ascitis y dispareunia . [1] El OGCT es causado principalmente por la formación de células cancerosas malignas en las células germinales primordiales del ovario. [1] La patogenia exacta de los OGCT aún se desconoce, sin embargo, se han identificado varias mutaciones genéticas y factores ambientales. [1] Los OGCT se encuentran comúnmente durante el embarazo cuando se encuentra una masa anexial durante un examen pélvico, las ecografías muestran una masa sólida en el ovario o la prueba de suero sanguíneo muestra niveles elevados de alfa-fetoproteína . [1] Es poco probable que hayan hecho metástasis y, por lo tanto, el tratamiento estándar del tumor es la resección quirúrgica , junto con quimioterapia . [2] La tasa de aparición es inferior al 3% en todo el mundo. [3]
Los OGCT se pueden clasificar en disgerminomas, teratomas, tumores del saco vitelino y coriocarcinomas, enumerados en orden de prevalencia. [1]

Los disgerminomas son comparables a los seminomas testiculares y representan aproximadamente el 32-37% de todos los OGCT. [1] Son particularmente prominentes en individuos con gónadas disgénicas de pacientes con disgenesia gonadal pura 46, XY. [1] Con base en exámenes macroscópicos, los disgerminomas se caracterizan por tener una "apariencia macroscópica sólida, lobulada , bronceada, similar a la carne con una superficie lisa". [1] Microscópicamente, la estructura celular se distingue por una forma redonda-ovoide que contiene un amplio citoplasma eosinofílico y un núcleo de forma irregular. [1] Las células ubicadas uniformemente están separadas a través de las hebras fibrosas y comúnmente se observa infiltración linfocítica . [5]

Los teratomas son los tumores de células germinales más comunes del ovario. Los teratomas se pueden dividir en dos tipos: teratoma maduro (benigno) y teratoma inmaduro (maligno). Los teratomas inmaduros contienen tejido inmaduro o embrionario que los diferencia significativamente de los teratomas maduros, ya que llevan quistes dermoides . [7] Se observa comúnmente en mujeres de 15 a 19 años y rara vez en mujeres después de la menopausia. [8] Los teratomas inmaduros se caracterizan por un diámetro de 14 a 25 cm, masa encapsulada, áreas quísticas y aparición ocasional de áreas hemorrágicas . [9] El estadio de los teratomas inmaduros se determina según la cantidad de tejido neuroepitelio inmaduro detectado. [7]

Los tumores del saco vitelino ovárico , también conocidos como tumores del seno endodérmico , son responsables de aproximadamente el 15,5% de todos los OGCT. [11] Se han observado en mujeres, particularmente en sus edades tempranas, y rara vez después de los 40 años de edad. [12] Las características patológicas críticas son una superficie externa lisa y desgarros capsulares debido a su rápida tasa de crecimiento. Un estudio que consta de 71 casos individuales de tumor del saco vitelino ovárico proporciona evidencia de la proliferación del tumor. En uno de los casos, el examen pélvico reveló actividad normal hasta que se descubrió un tumor de tamaño de 9 cm y 12 cm 4 semanas después. [12] En otro caso, se descubrió un tumor de 23 cm en una mujer embarazada que fue monitoreada regularmente y tuvo hallazgos normales hasta que la ooforectomía se volvió esencial. [12] Histológicamente, estos tumores se caracterizan por componentes sólidos y quísticos mixtos . [1] Los componentes sólidos mixtos se caracterizan por ser de color gris suave a amarillo acompañados de hemorragia y necrosis significativas . Los quistes tienen aproximadamente 2 cm de diámetro y están distribuidos por todo el tejido, lo que da a la neoplasia una "apariencia de panal de abejas". [1]

Los coriocarcinomas son excepcionalmente raros y representan entre el 2,1% y el 3,4% de todos los OGCT. [14] En el examen macroscópico, las células sinciciotrofoblasto están alineadas en una disposición plexiforme con las células citotrofoblasto mononucleares que rodean los focos de hemorragia. [1] Los coriocarcinomas se pueden dividir en coriocarcinomas gestacionales y coriocarcinomas no gestacionales que tienen diferencias inmunohistoquímicas . [15]
Los OGCT son relativamente difíciles de detectar y diagnosticar en una etapa temprana, principalmente porque los síntomas normalmente son sutiles e inespecíficos. Se vuelven detectables cuando se convierten en masas grandes y tangibles. Los síntomas incluyen hinchazón, distensión abdominal, ascitis y dispareunia. [16] En casos raros en los que el tumor se rompe, se puede experimentar dolor abdominal agudo. [17] El indicador crítico de malignidad suele ser la aparición del nódulo de la Hermana María José . [18] Los OGCT pueden dar lugar además a torsión ovárica , hemorragia e incluso pubertad precoz isosexual en niños pequeños. [19]
La causa exacta de los OGCT aún no se ha determinado. Sin embargo, se han identificado algunos factores que pueden contribuir a un mayor riesgo de OGCT, incluidos la endometriosis , el síndrome de ovario poliquístico y los factores de riesgo genéticos. [20] Las personas que son más propensas a desarrollar OGCT generalmente contienen las mutaciones autosómicas dominantes , BRCA-1 / BRCA-2 . [20] Las complicaciones con otros cánceres, como el cáncer colorrectal hereditario no polipósico , también conocido como síndrome de Lynch , aumentan el riesgo de desarrollar cáncer de ovario . [20] Se sabe que el embarazo, la lactancia y los anticonceptivos orales reducen el riesgo de OGCT. [20] La etiología de los OGCT aún está en estudio, sin embargo, las alteraciones genéticas pueden contribuir al desarrollo de OGCT, como los genes supresores de tumores clásicos y los oncogenes . Además de las modificaciones genéticas, ciertos factores ambientales como los disruptores endocrinos , la presencia de una rutina diaria que afecta la bioquímica del individuo y la exposición a las hormonas maternas también podrían contribuir a la proliferación de OGCT. [20] Un estudio reciente en ratas mostró la herencia epigenética transgeneracional que respalda la influencia de sustancias ambientales peligrosas, incluidos plásticos, pesticidas y dioxinas , en la patogénesis de OGCT. [20]
Sin embargo, se han hecho algunas especulaciones sobre las causas. Durante la ovulación , el folículo se rompe y provoca daños en las células epiteliales . [1] Para curar el tejido y reemplazar el daño, las células se dividen . Cada vez que la célula se divide, existe la posibilidad de que se produzcan mutaciones y aumenta la posibilidad de formación de tumores. [1] El tumor se produce cuando las células germinales de los ovarios comienzan a dividirse de forma incontrolable y se vuelven malignas, que se caracterizan por sus núcleos menos organizados y sus bordes poco definidos. [1] Otra posible etiología es la disfunción del gen supresor de tumores , TRC8/RNF139, o incluso anomalías cariotípicas tras un examen molecular minucioso. [21]
La OGCT tiene sus raíces en el desarrollo embrionario, donde las células germinales primordiales (PGC) se aíslan en etapas tempranas y tienen la capacidad de alterar el genoma, así como el transcriptoma . [20] Las OGCT se pueden atribuir al mecanismo interno de las PGC y sus características transformadoras. [20]
Una vez que se ha diagnosticado el OGCT, se realizarán varias pruebas para determinar si el cáncer se ha propagado a otras áreas del cuerpo. La propagación del OGCT se identifica a través de diferentes etapas: etapa I, etapa II, etapa III y etapa IV, a saber:
Estadio I: Las células tumorales se localizan en los ovarios o las trompas de Falopio sin diseminación extensa a otras regiones del cuerpo. [22]
Estadio II: El cáncer está en uno o ambos ovarios o trompas de Falopio y se ha propagado a la pelvis. [22]
Estadio III: el cáncer se ha propagado más allá de la pelvis hacia el abdomen y los ganglios linfáticos retroperitoneales (ubicados en la parte posterior del abdomen ). Los subestadios se caracterizan por el tamaño relativo del tumor. [22]
Nota: El cáncer de ovario en estadio II también se declarará si las células cancerosas se han propagado al hígado . Estadio IV: el cáncer se ha propagado fuera del abdomen y la pelvis a órganos más distantes, como los pulmones . [22]
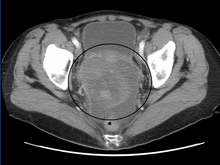
El diagnóstico preliminar comienza con un examen pélvico , una prueba de marcadores tumorales séricos y estudios de imagen. Los médicos pueden sentir una gran masa palpable o un bulto en el abdomen inferior al insertar los dedos enguantados en la vagina. Para identificar aún más los subtipos histológicos de OGMT, se recolectan muestras de sangre de las pacientes para analizar el nivel sérico de biomarcadores liberados por las células tumorales. Un aumento en los niveles plasmáticos de gonadotropina coriónica humana y alfa-fetoproteína es indicativo de OGMT. [1] La lactato deshidrogenasa , la fosfatasa alcalina y el antígeno canceroso 125 también podrían aumentar potencialmente. [24] Para visualizar la ubicación y la morfología del tumor, generalmente se emplea la ecografía transvaginal . [1] La apariencia más característica es una masa heteroecoica similar al parénquima con bordes definidos y alta vascularización. [1] La tomografía computarizada produciría una imagen apilada dentro de la región peritoneal del cuerpo para visualizar el patrón lobulillar del tumor. [1] Generalmente, en el caso del disgerminoma, la masa sólida compartimentada en lóbulos con tabiques realzados puede ser evidente en caso de hemorragia o necrosis. [1]
De acuerdo con las pautas de estadificación FIGO , se realizará una estadificación quirúrgica integral para examinar el grado de propagación del tumor a través de las regiones peritoneales o los drenajes linfáticos .
En el 28% de los pacientes en estadio II se encontrarán con el desarrollo de crecimientos malignos secundarios en ganglios linfáticos alejados del sitio primario del cáncer, llamado metástasis de ganglio linfático . [1]
Existen tres vías principales de drenaje linfático: [1]
Se realizarán palpaciones o biopsias de ganglios linfáticos pélvicos y paraaórticos unilaterales como paso preoperatorio para deducir el pronóstico del tumor y la diseminación linfática [1].
También se emplearán biopsias peritoneales y omentectomía para evaluar el grado de derrame o implantación del contenido tumoral en la cavidad peritoneal. [1] Las células tumorales pueden desprenderse del sitio original hacia la cavidad peritoneal e implantarse en la superficie de la cápsula hepática o el diafragma . [24] Pueden obstruirse dentro del vaso linfático alrededor del diafragma y evitar la reabsorción del líquido peritoneal. [24] Al final, la linfadenopatía pericardiofrénica y la ascitis pueden resultar de esta invasión franca. [1] [24]
Los OGCT malignos son predominantemente unilaterales y quimiosensibles, lo que significa que se localizan en un solo lado del ovario. [24] La cirugía para preservar la fertilidad está estandarizada principalmente para mantener intactos el ovario contralateral y la trompa de Falopio, también conocida como salpingooforectomía unilateral. [1] [24] Para pacientes en estadio II con metástasis observable, se puede realizar una cirugía citorreductora para reducir el volumen del tumor, como la histerectomía (extirpación de todo o parte del útero) y la salpingooforectomía bilateral . [1] [24] Una incisión quirúrgica en la cavidad abdominal después de completar la quimioterapia adyuvante, llamada laparotomía de segunda mirada , es la más aplicable para pacientes con elementos teratomatosos informados después de una cirugía citorreductora previa. [1] [24]

Con una recurrencia de hasta el 15-25% para pacientes en etapa temprana, [1] la quimioterapia adyuvante debe combinarse con la resección quirúrgica del tumor para asegurar el rescate completo. Para la quimioterapia sistémica (administrada por vía oral o intravenosa), el régimen está estandarizado en cada estadificación FIGO para comprender bleomicina , etopósido y cisplatino , también conocido como tratamiento BEP. [2] A los pacientes se les deben recetar 3-4 ciclos de BEP para asegurar el rescate completo. [2] Dependiendo de las condiciones personalizadas, a algunos pacientes que no responden a la terapia BEP se les prescribirá una terapia de rescate, que consiste en cisplatino, ifosfamida y paclitaxel . [2] [26] Sin embargo, es probable que los sobrevivientes de OGCT después de la terapia BEP tengan una menopausia prematura a una edad aproximada de 36 años. [24] Alternativamente, algunos hospitales optaron por quimioterapia basada en platino ya que los complejos de platino presentes en el fármaco intervienen en la transcripción del ADN formando enlaces cruzados químicos dentro de las cadenas de ADN, lo que impide la reproducción de células cancerosas. [27] Los elementos principales son cisplatino, carboplatino y oxaliplatino . [28] Se ha informado de una recuperación completa entre los pacientes en etapa temprana y solo una cuarta parte de los pacientes en etapa avanzada no se salvan potencialmente debido a la resistencia a los medicamentos. [1] [29]
En pacientes en etapa avanzada, después de la cirugía citorreductora, aún pueden estar presentes células cancerosas microscópicas invisibles o nódulos en el sitio de la infección. [27] Por lo tanto, los médicos pueden instilar una solución de quimioterapia calentada (~42-43 °C) en la cavidad abdominal a través de tubos de Carter durante 1,5 horas. [30] Basado en el principio de que las células cancerosas normalmente mueren a 40 °C, las células somáticas no se ven afectadas ya que mueren a 44 °C. [30] Este nuevo método ha demostrado ser eficaz con solo un 10% de tasa de recurrencia y sin mortalidad registrada. [31] Se conoce como quimioterapia intraperitoneal hipertérmica (HIPEC), que contiene docetaxel y cisplatino. [31] Dado que el fármaco se disemina localmente en las regiones intraperitoneales, no tiene efectos secundarios sistémicos en otras células que se reproducen activamente y se prefiere a la quimioterapia sistémica. [30]
Por lo general, la distribución incontrolable de fármacos en la quimioterapia sistémica produce mielosupresión , específicamente con neutropenia febril , neurotoxicidad , ototoxicidad y nefrotoxicidad observadas . [2] Los tratamientos correctivos para abordar las toxicidades inducidas por la quimioterapia son mediante la inyección de factor estimulante de colonias de granulocitos o factores de crecimiento mieloide o la ingesta oral de antibióticos profilácticos. [2]
El OGCT es un tumor poco frecuente dentro del ámbito del cáncer de ovario, que representa menos del 5% de todas las neoplasias malignas de ovario. Se presenta principalmente en mujeres de 15 a 19 años y muestra una tasa de incidencia del 75% en mujeres <30 años. [31] En 2011, el número de casos nuevos ocurridos en todo el mundo fue de 5,3 por millón. [32] En la mayoría de los países, la tasa de incidencia en promedio es inferior al 3% de la población. [3] Sin embargo, Asia ha informado la mayor proporción de casos, hasta un 4,3%, debido al perfil de edad más joven de la población. [3] Para otras regiones, las tasas de incidencia informadas son del 2,5% en Oceanía, del 2,0% en América del Norte y del 1,3% en Europa. [3]
Las tasas de supervivencia a cinco años han alcanzado hasta el 90-92%, lo que es mucho más alto que el de los cánceres de ovario epiteliales . [33] La razón principal es la alta efectividad de la quimioterapia basada en platino . [1]