En biología , la traducción es el proceso en las células vivas en el que se producen proteínas utilizando moléculas de ARN como plantillas. La proteína generada es una secuencia de aminoácidos . Esta secuencia está determinada por la secuencia de nucleótidos del ARN. Los nucleótidos se consideran de tres en tres. Cada uno de estos triples da como resultado la adición de un aminoácido específico a la proteína que se genera. La coincidencia del triple de nucleótidos con el aminoácido se denomina código genético . La traducción la realiza un gran complejo de ARN funcional y proteínas llamado ribosomas . Todo el proceso se llama expresión genética .
En la traducción, el ARN mensajero (ARNm) se decodifica en un ribosoma, fuera del núcleo, para producir una cadena de aminoácidos específica o polipéptido . Posteriormente, el polipéptido se pliega formando una proteína activa y realiza sus funciones en la célula. "El ribosoma facilita la decodificación al inducir la unión de secuencias de anticodón de ARN de transferencia complementaria (ARNt) a codones de ARNm ". Los ARNt transportan aminoácidos específicos que se encadenan en un polipéptido a medida que el ARNm pasa y es "leído" por el ribosoma.
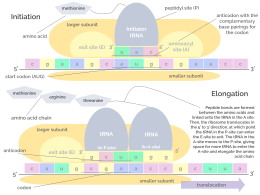
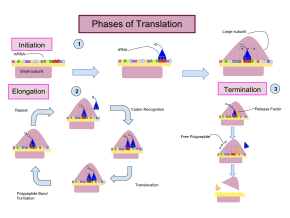
La traducción se desarrolla en tres fases:
En los procariotas (bacterias y arqueas), la traducción se produce en el citosol, donde las subunidades grandes y pequeñas del ribosoma se unen al ARNm. En eucariotas , la traducción se produce en el citoplasma o a través de la membrana del retículo endoplásmico en un proceso llamado translocación cotraduccional . En la translocación cotraduccional, todo el complejo ribosoma/ARNm se une a la membrana externa del retículo endoplásmico rugoso (RE) y la nueva proteína se sintetiza y libera en el RE; el polipéptido recién creado puede almacenarse dentro del ER para futuro transporte de vesículas y secreción fuera de la célula, o secretarse inmediatamente.
Muchos tipos de ARN transcrito, como el ARNt, el ARN ribosómico y el ARN nuclear pequeño, no se traducen en proteínas.
Varios antibióticos actúan inhibiendo la traducción. Estos incluyen anisomicina , cicloheximida , cloranfenicol , tetraciclina , estreptomicina , eritromicina y puromicina . Los ribosomas procarióticos tienen una estructura diferente a la de los ribosomas eucariotas y, por lo tanto, los antibióticos pueden atacar específicamente las infecciones bacterianas sin dañar las células del huésped eucariota .
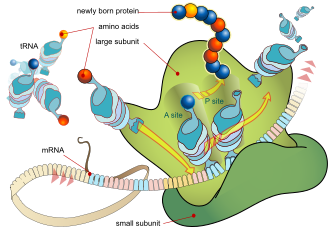
El proceso básico de producción de proteínas es la adición de un aminoácido a la vez al final de una proteína. Esta operación la realiza un ribosoma . [1] Un ribosoma está formado por dos subunidades, una subunidad pequeña y una subunidad grande. Estas subunidades se unen antes de la traducción del ARNm en una proteína para proporcionar un lugar para que se lleve a cabo la traducción y se produzca un polipéptido. [2] La elección del tipo de aminoácido a agregar está determinada por una molécula de ARN mensajero (ARNm). Cada aminoácido agregado coincide con una subsecuencia de tres nucleótidos del ARNm. Para cada uno de estos tripletes posibles, se acepta el aminoácido correspondiente. Los sucesivos aminoácidos añadidos a la cadena se emparejan con sucesivos tripletes de nucleótidos en el ARNm. De esta manera, la secuencia de nucleótidos en la cadena de ARNm molde determina la secuencia de aminoácidos en la cadena de aminoácidos generada. [3] La adición de un aminoácido se produce en el extremo C del péptido; por tanto, se dice que la traducción está dirigida de amina a carboxilo. [4]
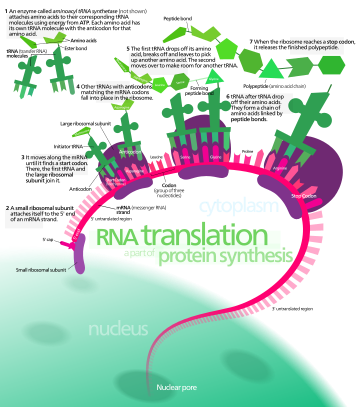
El ARNm transporta información genética codificada como una secuencia de ribonucleótidos desde los cromosomas hasta los ribosomas. Los ribonucleótidos son "leídos" por maquinaria de traducción en una secuencia de tripletes de nucleótidos llamados codones. Cada uno de esos tripletes codifica para un aminoácido específico .
Las moléculas de ribosomas traducen este código a una secuencia específica de aminoácidos. El ribosoma es una estructura de múltiples subunidades que contiene ARN ribosomal (ARNr) y proteínas. Es la "fábrica" donde los aminoácidos se ensamblan en proteínas.Los ARN de transferencia (ARNt) son pequeñas cadenas de ARN no codificantes (74 a 93 nucleótidos) que transportan aminoácidos al ribosoma. El repertorio de genes de ARNt varía ampliamente entre especies: algunas bacterias tienen entre 20 y 30 genes, mientras que los eucariotas complejos pueden tener miles. [5] Los ARNt tienen un sitio para la unión de aminoácidos y un sitio llamado anticodón. El anticodón es un triplete de ARN complementario al triplete de ARNm que codifica su aminoácido de carga .
Las aminoacil ARNt sintetasas ( enzimas ) catalizan la unión entre ARNt específicos y los aminoácidos que requieren sus secuencias de anticodones. El producto de esta reacción es un aminoacil-ARNt . En las bacterias, este aminoacil-ARNt se transporta al ribosoma mediante EF-Tu , donde los codones del ARNm se emparejan mediante emparejamiento de bases complementarias con anticodones de ARNt específicos. Las aminoacil-ARNt sintetasas que emparejan mal los ARNt con los aminoácidos incorrectos pueden producir aminoacil-ARNt mal cargados, lo que puede dar como resultado aminoácidos inadecuados en la posición respectiva en la proteína. Esta "traducción errónea" [6] del código genético ocurre naturalmente en niveles bajos en la mayoría de los organismos, pero ciertos entornos celulares provocan un aumento en la decodificación permisiva del ARNm, a veces en beneficio de la célula.
El ribosoma tiene dos sitios de unión para el ARNt. Son el sitio aminoacilo (abreviado A) y el sitio peptidilo/sitio de salida (abreviado P/E). En cuanto al ARNm, los tres sitios están orientados de 5' a 3' EPA, porque los ribosomas se mueven hacia el extremo 3' del ARNm. El sitio A une el ARNt entrante con el codón complementario del ARNm. El sitio P/E contiene el ARNt con la cadena polipeptídica en crecimiento. Cuando un aminoacil-ARNt se une inicialmente a su codón correspondiente en el ARNm, se encuentra en el sitio A. Luego, se forma un enlace peptídico entre el aminoácido del ARNt en el sitio A y el aminoácido del ARNt cargado en el sitio P/E. La cadena polipeptídica en crecimiento se transfiere al ARNt en el sitio A. Se produce la translocación, lo que mueve el ARNt al sitio P/E, ahora sin aminoácido; el ARNt que estaba en el sitio A, ahora cargado con la cadena polipeptídica, se mueve al sitio P/E y el ARNt sale, y otro aminoacil-ARNt ingresa al sitio A para repetir el proceso. [7]
Después de que se agrega el nuevo aminoácido a la cadena, y después de que el ARNt se libera del ribosoma al citosol, la energía proporcionada por la hidrólisis de un GTP unido a la translocasa EF-G (en bacterias ) y a/eEF -2 (en eucariotas y arqueas ) mueve el ribosoma hacia abajo un codón hacia el extremo 3' . La energía necesaria para la traducción de proteínas es significativa. Para una proteína que contiene n aminoácidos, el número de enlaces fosfato de alta energía necesarios para traducirla es 4 n -1. [8] La tasa de traducción varía; es significativamente mayor en las células procarióticas (hasta 17 a 21 residuos de aminoácidos por segundo) que en las células eucariotas (hasta 6 a 9 residuos de aminoácidos por segundo). [9]
Aunque los ribosomas suelen considerarse máquinas precisas y procesivas, el proceso de traducción está sujeto a errores que pueden conducir a la síntesis de proteínas erróneas o al abandono prematuro de la traducción, ya sea porque un ARNt se acopla a un codón equivocado o porque un ARNt está acoplado al aminoácido equivocado. [10] Se ha estimado que la tasa de error en la síntesis de proteínas es de entre 1 en 10 5 y 1 en 10 3 aminoácidos mal incorporados, dependiendo de las condiciones experimentales. [11] En cambio, se ha estimado que la tasa de abandono prematuro de la traducción es del orden de magnitud de 10 −4 eventos por codón traducido. [12] El aminoácido correcto está unido covalentemente al ARNt correcto mediante aminoaciltransferasas. El aminoácido está unido por su grupo carboxilo al 3' OH del ARNt mediante un enlace éster . Cuando el ARNt tiene un aminoácido unido, el ARNt se denomina "cargado". La iniciación implica la unión de la subunidad pequeña del ribosoma al extremo 5 'del ARNm con la ayuda de factores de iniciación (IF). En las bacterias y una minoría de arqueas, el inicio de la síntesis de proteínas implica el reconocimiento de una secuencia de iniciación rica en purinas en el ARNm llamada secuencia Shine-Dalgarno. La secuencia Shine-Dalgarno se une a una secuencia complementaria rica en pirimidina en el extremo 3' de la parte del ARNr 16S de la subunidad ribosómica 30S. La unión de estas secuencias complementarias asegura que la subunidad ribosómica 30S esté unida al ARNm y alineada de manera que el codón de iniciación se coloque en la porción 30S del sitio P. Una vez que el ARNm y la subunidad 30S están unidos adecuadamente, un factor de iniciación lleva el complejo iniciador de ARNt-aminoácido, f-Met-ARNt, al sitio 30S P. La fase de iniciación se completa una vez que una subunidad 50S se une a la subunidad 30, formando un ribosoma 70S activo. [13] La terminación del polipéptido ocurre cuando el sitio A del ribosoma está ocupado por un codón de parada (UAA, UAG o UGA) en el ARNm, creando la estructura primaria de una proteína. El ARNt generalmente no puede reconocer ni unirse a codones de parada. En cambio, el codón de parada induce la unión de una proteína del factor de liberación [14] (RF1 y RF2) que provoca el desmontaje de todo el complejo ribosoma/ARNm mediante la hidrólisis de la cadena polipeptídica del centro de peptidil transferasa [1] del ribosoma. . [15] Los fármacos o motivos de secuencia especiales en el ARNm pueden cambiar la estructura ribosómica de modo que los ARNt casi afines se unan al codón de parada en lugar de a los factores de liberación. En tales casos de "lectura traslacional", la traducción continúa hasta que el ribosoma encuentra el siguiente codón de parada. [dieciséis]
El proceso de traducción está altamente regulado tanto en organismos eucariotas como procarióticos. La regulación de la traducción puede afectar la tasa global de síntesis de proteínas, que está estrechamente relacionada con el estado metabólico y proliferativo de una célula.
Para profundizar en este intrincado proceso, los científicos suelen utilizar una técnica conocida como elaboración de perfiles de ribosomas. [17] Este método permite a los investigadores tomar una instantánea del translatomo, mostrando qué partes del ARNm están siendo traducidas en proteínas por los ribosomas en un momento dado. El perfil de ribosomas proporciona información valiosa sobre la dinámica de la traducción, revelando la compleja interacción entre la secuencia de genes, la estructura del ARNm y la regulación de la traducción. Por ejemplo, la investigación que utiliza este método ha revelado que las diferencias genéticas y su posterior expresión como ARNm también pueden afectar la tasa de traducción de una manera específica del ARN. [18]
Ampliando este concepto, un desarrollo más reciente es el perfilado de ribosomas unicelulares, una técnica que nos permite estudiar el proceso de traducción en la resolución de células individuales. [19] Esto es particularmente significativo ya que las células, incluso aquellas del mismo tipo, pueden exhibir una variabilidad considerable en su síntesis de proteínas. La elaboración de perfiles de ribosomas unicelulares tiene el potencial de arrojar luz sobre la naturaleza heterogénea de las células, lo que lleva a una comprensión más matizada de cómo la regulación de la traducción puede afectar el comportamiento celular, el estado metabólico y la capacidad de respuesta a diversos estímulos o condiciones.
El control traslacional es fundamental para el desarrollo y la supervivencia del cáncer . Las células cancerosas con frecuencia deben regular la fase de traducción de la expresión genética, aunque no se comprende completamente por qué la traducción se centra en pasos como la transcripción. Si bien las células cancerosas a menudo tienen factores de traducción genéticamente alterados, es mucho más común que las células cancerosas modifiquen los niveles de los factores de traducción existentes. [20] Varias vías de señalización oncogénica importantes, incluidas las vías RAS-MAPK , PI3K/AKT/mTOR , MYC y WNT-β-catenina , en última instancia, reprograman el genoma mediante la traducción. [21] Las células cancerosas también controlan la traducción para adaptarse al estrés celular. Durante el estrés, la célula traduce ARNm que pueden mitigar el estrés y promover la supervivencia. Un ejemplo de esto es la expresión de AMPK en varios cánceres; su activación desencadena una cascada que, en última instancia, puede permitir que el cáncer escape de la apoptosis (muerte celular programada) provocada por la privación de nutrición. Las terapias futuras contra el cáncer pueden implicar alterar la maquinaria de traducción de la célula para contrarrestar los efectos posteriores del cáncer. [20]
La descripción del proceso de transcripción-traducción, mencionando sólo los procesos "elementales" más básicos, consta de:
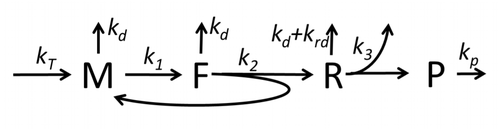
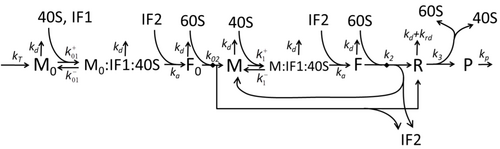
El proceso de construcción de aminoácidos para crear proteínas en traducción es objeto de varios modelos físicos durante mucho tiempo, comenzando desde los primeros modelos cinéticos detallados como [23] u otros que tienen en cuenta aspectos estocásticos de la traducción y utilizan simulaciones por computadora. En las últimas cuatro décadas se han desarrollado y analizado muchos modelos de síntesis de proteínas basados en la cinética química. [24] [25] Más allá de la cinética química, se han aplicado varios formalismos de modelado, como el proceso de exclusión simple totalmente asimétrico , [25] redes booleanas probabilísticas , redes de Petri y álgebra max-plus para modelar la cinética detallada de la síntesis de proteínas o algunas de sus etapas. Se ha desarrollado un modelo básico de síntesis de proteínas que tiene en cuenta los ocho procesos "elementales", [22] siguiendo el paradigma de que " los modelos útiles son simples y ampliables". [26] El modelo M0 más simple está representado por el mecanismo cinético de reacción (Figura M0). Se generalizó para incluir la unión de 40S, 60S y factores de iniciación (IF) (Figura M1'). Se amplió aún más para incluir el efecto del microARN sobre la síntesis de proteínas. [27] La mayoría de los modelos en esta jerarquía se pueden resolver analíticamente. Estas soluciones se utilizaron para extraer "firmas cinéticas" de diferentes mecanismos específicos de regulación de la síntesis.
También es posible traducir a mano (para secuencias cortas) o por computadora (después de programarla adecuadamente, consulte la sección siguiente); esto permite a los biólogos y químicos dibujar en papel la estructura química de la proteína codificada.
Primero, convierta cada base de ADN molde en su complemento de ARN (tenga en cuenta que el complemento de A ahora es U), como se muestra a continuación. Tenga en cuenta que la cadena plantilla del ADN es contra la que se polimeriza el ARN; la otra cadena de ADN sería igual que la de ARN, pero con timina en lugar de uracilo.
ADN -> ARN A->U T->A C -> GRAMO GRAMO -> C A=T->A=U
Luego divida el ARN en tripletes (grupos de tres bases). Tenga en cuenta que hay 3 "ventanas" de traducción o marcos de lectura , dependiendo de dónde comience a leer el código. Finalmente, use la tabla en Código genético para traducir lo anterior a una fórmula estructural como se usa en química.
Esto dará la estructura primaria de la proteína. Sin embargo, las proteínas tienden a plegarse , dependiendo en parte de los segmentos hidrófilos e hidrófobos a lo largo de la cadena. A menudo todavía se puede adivinar la estructura secundaria , pero la estructura terciaria adecuada suele ser muy difícil de determinar.
Mientras que otros aspectos, como la estructura tridimensional de las proteínas, denominada estructura terciaria , sólo pueden predecirse mediante sofisticados algoritmos , la secuencia de aminoácidos, denominada estructura primaria, puede determinarse únicamente a partir de la secuencia de ácidos nucleicos con la ayuda de una tabla de traducción .
Es posible que este enfoque no proporcione la composición de aminoácidos correcta de la proteína, en particular si se incorporan a la proteína aminoácidos no convencionales como la selenocisteína , que está codificada por un codón de parada convencional en combinación con una horquilla aguas abajo (SElenoCysteine Insertion Sequence, o SECIS).
Existen muchos programas informáticos capaces de traducir una secuencia de ADN/ARN en una secuencia de proteínas. Normalmente esto se realiza utilizando el Código Genético Estándar, sin embargo, pocos programas pueden manejar todos los casos "especiales", como el uso de codones de iniciación alternativos que son biológicamente significativos. Por ejemplo, el raro codón de inicio alternativo CTG codifica metionina cuando se usa como codón de inicio y leucina en todas las demás posiciones.
Ejemplo: tabla de traducción condensada del Código Genético Estándar (de la página web de Taxonomía del NCBI). [28]
AA = FFLLSSSSYY**CC*WLLLPPPPHHQQRRRRIIIMTTTTTNNKKSSRRVVVVAAAADDEEGGGG Inicios = ---M--------------M---------------M------------ ---------------- Base1 = TTTTTTTTTTTTTTTCCCCCCCCCCCCCAAAAAAAAAAAAAAAAAGGGGGGGGGGGGGGGGG Base2 = TTTTCCCCAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGGTTTTCCCCAAAAGGGG Base3 = TCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAGTCAG
La fila "Inicios" indica tres codones de inicio, UUG, CUG y el muy común AUG. También indica el primer residuo de aminoácido cuando se interpreta como un inicio: en este caso es todo metionina.
Incluso cuando se trabaja con secuencias eucariotas ordinarias, como el genoma de la levadura , a menudo se desea poder utilizar tablas de traducción alternativas, concretamente para la traducción de los genes mitocondriales. Actualmente, el Grupo de Taxonomía del NCBI define las siguientes tablas de traducción para la traducción de las secuencias en GenBank : [28]
{{cite journal}}: CS1 maint: multiple names: authors list (link)