La espectrometría de masas ( MS ) es una técnica analítica que se utiliza para medir la relación masa-carga de los iones . Los resultados se presentan como un espectro de masas , un gráfico de intensidad en función de la relación masa-carga. La espectrometría de masas se utiliza en muchos campos diferentes y se aplica tanto a muestras puras como a mezclas complejas.
Un espectro de masas es un tipo de representación gráfica de la señal iónica en función de la relación masa-carga. Estos espectros se utilizan para determinar la firma elemental o isotópica de una muestra, las masas de partículas y moléculas , y para dilucidar la identidad química o la estructura de moléculas y otros compuestos químicos .

En un procedimiento típico de MS, una muestra, que puede ser sólida, líquida o gaseosa, se ioniza , por ejemplo bombardeándola con un haz de electrones . Esto puede hacer que algunas de las moléculas de la muestra se rompan en fragmentos cargados positivamente o simplemente se carguen positivamente sin fragmentarse. Estos iones (fragmentos) se separan luego de acuerdo con su relación masa-carga, por ejemplo acelerándolos y sometiéndolos a un campo eléctrico o magnético: los iones de la misma relación masa-carga sufrirán la misma cantidad de desviación. [1] Los iones se detectan mediante un mecanismo capaz de detectar partículas cargadas, como un multiplicador de electrones . Los resultados se muestran como espectros de la intensidad de la señal de los iones detectados en función de la relación masa-carga. Los átomos o moléculas de la muestra se pueden identificar correlacionando masas conocidas (por ejemplo, una molécula entera) con las masas identificadas o mediante un patrón de fragmentación característico.
.jpg/440px-Early_Mass_Spectrometer_(replica).jpg)
En 1886, Eugen Goldstein observó rayos en descargas de gas a baja presión que viajaban lejos del ánodo y a través de canales en un cátodo perforado , en dirección opuesta a la de los rayos catódicos con carga negativa (que viajan del cátodo al ánodo). Goldstein llamó a estos rayos anódicos con carga positiva "Kanalstrahlen"; la traducción estándar de este término al inglés es " rayos de canal ". Wilhelm Wien descubrió que los campos eléctricos o magnéticos fuertes desviaban los rayos de canal y, en 1899, construyó un dispositivo con campos eléctricos y magnéticos perpendiculares que separaban los rayos positivos según su relación carga-masa ( Q/m ). Wien descubrió que la relación carga-masa dependía de la naturaleza del gas en el tubo de descarga. El científico inglés JJ Thomson mejoró más tarde el trabajo de Wien al reducir la presión para crear el espectrógrafo de masas.

La palabra espectrógrafo se había convertido en parte del vocabulario científico internacional en 1884. [2] [3] Los primeros dispositivos de espectrometría que medían la relación masa-carga de los iones se llamaban espectrógrafos de masas , que consistían en instrumentos que registraban un espectro de valores de masa en una placa fotográfica . [4] [5] Un espectroscopio de masas es similar a un espectrógrafo de masas, excepto que el haz de iones se dirige a una pantalla de fósforo . [6] Una configuración de espectroscopio de masas se utilizó en los primeros instrumentos cuando se deseaba que los efectos de los ajustes se observaran rápidamente. Una vez que el instrumento estaba correctamente ajustado, se insertaba y exponía una placa fotográfica. El término espectroscopio de masas continuó utilizándose aunque la iluminación directa de una pantalla de fósforo fue reemplazada por mediciones indirectas con un osciloscopio . [7] El uso del término espectroscopia de masas ahora se desaconseja debido a la posibilidad de confusión con la espectroscopia de luz . [1] [8] La espectrometría de masas a menudo se abrevia como espec-masa o simplemente como MS . [1]
Las técnicas modernas de espectrometría de masas fueron ideadas por Arthur Jeffrey Dempster y FW Aston en 1918 y 1919 respectivamente.
Los espectrómetros de masas sectoriales conocidos como calutrones fueron desarrollados por Ernest O. Lawrence y utilizados para separar los isótopos del uranio durante el Proyecto Manhattan . [9] Los espectrómetros de masas Calutron se utilizaron para el enriquecimiento de uranio en la planta Y-12 de Oak Ridge, Tennessee, establecida durante la Segunda Guerra Mundial.
En 1989, la mitad del Premio Nobel de Física fue otorgado a Hans Dehmelt y Wolfgang Paul por el desarrollo de la técnica de trampa de iones en los años 1950 y 1960.
En 2002, el Premio Nobel de Química fue otorgado a John Bennett Fenn por el desarrollo de la ionización por electrospray (ESI) y a Koichi Tanaka por el desarrollo de la desorción láser suave (SLD) y su aplicación a la ionización de macromoléculas biológicas , especialmente proteínas . [10]
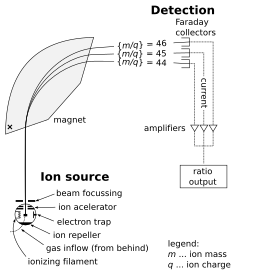
Un espectrómetro de masas consta de tres componentes: una fuente de iones, un analizador de masas y un detector. El ionizador convierte una parte de la muestra en iones. Existe una amplia variedad de técnicas de ionización, dependiendo de la fase (sólida, líquida, gaseosa) de la muestra y de la eficiencia de los diversos mecanismos de ionización para las especies desconocidas. Un sistema de extracción elimina los iones de la muestra, que luego se dirigen a través del analizador de masas hacia el detector . Las diferencias en las masas de los fragmentos permiten al analizador de masas clasificar los iones por su relación masa-carga. El detector mide el valor de una cantidad indicadora y, por lo tanto, proporciona datos para calcular las abundancias de cada ion presente. Algunos detectores también brindan información espacial, por ejemplo, una placa multicanal.
A continuación se describe el funcionamiento de un analizador de masas de espectrómetro, que es del tipo sectorial . (A continuación se tratan otros tipos de analizadores). Considere una muestra de cloruro de sodio (sal de mesa). En la fuente de iones, la muestra se vaporiza (se convierte en gas ) y se ioniza (se transforma en partículas cargadas eléctricamente) en iones de sodio (Na + ) y cloruro (Cl − ). Los átomos y los iones de sodio son monoisotópicos , con una masa de aproximadamente 23 daltons (símbolo: Da o símbolo más antiguo: u). Los átomos y los iones de cloruro vienen en dos isótopos estables con masas de aproximadamente 35 u (con una abundancia natural de aproximadamente el 75 por ciento) y aproximadamente 37 u (con una abundancia natural de aproximadamente el 25 por ciento). La parte del analizador del espectrómetro contiene campos eléctricos y magnéticos , que ejercen fuerzas sobre los iones que viajan a través de estos campos. La velocidad de una partícula cargada puede aumentar o disminuir mientras pasa a través del campo eléctrico, y su dirección puede ser alterada por el campo magnético. La magnitud de la desviación de la trayectoria del ion en movimiento depende de su relación masa-carga. Los iones más ligeros son desviados por la fuerza magnética en mayor grado que los iones más pesados (según la segunda ley de movimiento de Newton , F = ma ). Las corrientes de iones clasificados magnéticamente pasan del analizador al detector, que registra la abundancia relativa de cada tipo de ion. Esta información se utiliza para determinar la composición del elemento químico de la muestra original (es decir, que tanto el sodio como el cloro están presentes en la muestra) y la composición isotópica de sus constituyentes (la relación de 35 Cl a 37 Cl).

La fuente de iones es la parte del espectrómetro de masas que ioniza el material que se analiza (el analito). Los iones son luego transportados por campos magnéticos o eléctricos hasta el analizador de masas.
Las técnicas de ionización han sido clave para determinar qué tipos de muestras se pueden analizar mediante espectrometría de masas. La ionización electrónica y la ionización química se utilizan para gases y vapores . En las fuentes de ionización química, el analito se ioniza mediante reacciones químicas ion-molécula durante las colisiones en la fuente. Dos técnicas que se utilizan a menudo con muestras biológicas líquidas y sólidas son la ionización por electropulverización (inventada por John Fenn [11] ) y la desorción/ionización láser asistida por matriz (MALDI, inicialmente desarrollada como una técnica similar "Soft Laser Desorption (SLD)" por K. Tanaka [12] por la que se otorgó un Premio Nobel y como MALDI por M. Karas y F. Hillenkamp [13] ).

En espectrometría de masas, la ionización se refiere a la producción de iones en fase gaseosa adecuados para su resolución en el analizador de masas o el filtro de masas. La ionización se produce en la fuente de iones . Hay varias fuentes de iones disponibles; cada una tiene ventajas y desventajas para aplicaciones particulares. Por ejemplo, la ionización electrónica (EI) proporciona un alto grado de fragmentación, lo que produce espectros de masas muy detallados que, cuando se analizan hábilmente, pueden proporcionar información importante para la elucidación/caracterización estructural y facilitar la identificación de compuestos desconocidos por comparación con bibliotecas de espectros de masas obtenidas en condiciones de operación idénticas. Sin embargo, la EI no es adecuada para acoplarse a HPLC , es decir, LC-MS , ya que a presión atmosférica, los filamentos utilizados para generar electrones se queman rápidamente. Por lo tanto, la EI se acopla predominantemente con GC , es decir, GC-MS , donde todo el sistema está bajo alto vacío.
Las técnicas de ionización dura son procesos que imparten grandes cantidades de energía residual en la molécula en cuestión, lo que genera grandes grados de fragmentación (es decir, la ruptura sistemática de enlaces actúa para eliminar el exceso de energía, restaurando la estabilidad del ion resultante). Los iones resultantes tienden a tener una relación m/z menor que el ion molecular (excepto en el caso de transferencia de protones y sin incluir los picos de isótopos). El ejemplo más común de ionización dura es la ionización electrónica (EI).
La ionización suave se refiere a los procesos que imparten poca energía residual a la molécula en cuestión y, como tal, dan como resultado poca fragmentación. Algunos ejemplos incluyen el bombardeo de átomos rápidos (FAB), la ionización química (CI), la ionización química a presión atmosférica (APCI), la fotoionización a presión atmosférica (APPI), la ionización por electrospray (ESI), la ionización por electrospray de desorción (DESI) y la desorción/ionización láser asistida por matriz (MALDI).

Las fuentes de plasma acoplado inductivamente (ICP) se utilizan principalmente para el análisis de cationes de una amplia gama de tipos de muestras. En esta fuente, se utiliza un plasma que es eléctricamente neutro en general, pero que ha tenido una fracción sustancial de sus átomos ionizados por alta temperatura, para atomizar las moléculas de muestra introducidas y para eliminar aún más los electrones externos de esos átomos. El plasma generalmente se genera a partir de gas argón, ya que la primera energía de ionización de los átomos de argón es mayor que la primera de cualquier otro elemento excepto He, F y Ne, pero menor que la segunda energía de ionización de todos, excepto los metales más electropositivos. El calentamiento se logra mediante una corriente de radiofrecuencia que pasa a través de una bobina que rodea el plasma.
La fotoionización se puede utilizar en experimentos que buscan utilizar la espectrometría de masas como un medio para resolver los mecanismos cinéticos químicos y la ramificación de productos isoméricos. [14] En tales casos, se utiliza un fotón de alta energía, ya sea de rayos X o ultravioleta, para disociar moléculas gaseosas estables en un gas portador de He o Ar. En los casos en que se utiliza una fuente de luz de sincrotrón , se puede utilizar una energía de fotón ajustable para adquirir una curva de eficiencia de fotoionización que se puede utilizar junto con la relación de carga m/z para identificar especies moleculares e iónicas. Más recientemente, se ha desarrollado la fotoionización a presión atmosférica (APPI) para ionizar moléculas principalmente como efluentes de sistemas LC-MS.
Algunas aplicaciones de la ionización ambiental incluyen aplicaciones ambientales, así como aplicaciones clínicas. En estas técnicas, los iones se forman en una fuente de iones fuera del espectrómetro de masas. El muestreo se vuelve fácil ya que las muestras no necesitan separación ni preparación previa. Algunos ejemplos de técnicas de ionización ambiental son el análisis directo en tiempo real (DART), DESI , SESI , LAESI , ionización química a presión atmosférica por desorción (DAPCI), ionización suave por reacción química en transferencia (SICRT) y fotoionización a presión atmosférica por desorción (DAPPI ), entre otras.
Otras incluyen descarga luminiscente , desorción de campo (FD), bombardeo de átomos rápidos (FAB), termopulverización , desorción/ionización sobre silicio (DIOS), ionización química a presión atmosférica (APCI), espectrometría de masas de iones secundarios (SIMS), ionización por chispa e ionización térmica (TIMS). [15]
Los analizadores de masas separan los iones según su relación masa-carga . Las dos leyes siguientes rigen la dinámica de las partículas cargadas en campos eléctricos y magnéticos en el vacío:
Aquí F es la fuerza aplicada al ion, m es la masa del ion, a es la aceleración, Q es la carga del ion, E es el campo eléctrico y v × B es el producto vectorial de la velocidad del ion y el campo magnético.
Igualando las expresiones anteriores para la fuerza aplicada al ion se obtiene:
Esta ecuación diferencial es la ecuación clásica de movimiento para partículas cargadas . Junto con las condiciones iniciales de la partícula, determina completamente el movimiento de la partícula en el espacio y el tiempo en términos de m/Q . Por lo tanto, los espectrómetros de masas podrían considerarse como "espectrómetros de masa-carga". Al presentar datos, es común utilizar la (oficialmente) adimensional m/z , donde z es el número de cargas elementales ( e ) en el ion (z=Q/e). Esta cantidad, aunque informalmente se llama relación masa-carga, más exactamente representa la relación entre el número de masa y el número de carga, z .
Existen muchos tipos de analizadores de masas que utilizan campos estáticos o dinámicos, y campos magnéticos o eléctricos, pero todos funcionan de acuerdo con la ecuación diferencial anterior. Cada tipo de analizador tiene sus puntos fuertes y débiles. Muchos espectrómetros de masas utilizan dos o más analizadores de masas para la espectrometría de masas en tándem (MS/MS) . Además de los analizadores de masas más comunes que se enumeran a continuación, existen otros diseñados para situaciones especiales.
Existen varias características importantes del analizador. El poder de resolución de masa es la medida de la capacidad de distinguir dos picos de m/z ligeramente diferentes . La precisión de masa es la relación entre el error de medición de m/z y el m/z verdadero . La precisión de masa se mide generalmente en ppm o miliunidades de masa . El rango de masa es el rango de m/z susceptible de análisis por un analizador determinado. El rango dinámico lineal es el rango en el que la señal iónica es lineal con la concentración del analito. La velocidad se refiere al marco de tiempo del experimento y, en última instancia, se utiliza para determinar la cantidad de espectros por unidad de tiempo que se pueden generar.

Un analizador de masas de campo sectorial utiliza un campo eléctrico y/o magnético estático para afectar de alguna manera la trayectoria y/o velocidad de las partículas cargadas . Como se muestra arriba, los instrumentos sectoriales desvían las trayectorias de los iones a medida que pasan a través del analizador de masas, de acuerdo con sus relaciones masa-carga, desviando más los iones más cargados y de movimiento más rápido, más ligeros. El analizador se puede utilizar para seleccionar un rango estrecho de m/z o para escanear a través de un rango de m/z para catalogar los iones presentes. [16]
El analizador de tiempo de vuelo (TOF) utiliza un campo eléctrico para acelerar los iones a través del mismo potencial y luego mide el tiempo que tardan en llegar al detector. Si todas las partículas tienen la misma carga , sus energías cinéticas serán idénticas y sus velocidades dependerán solo de sus masas . Por ejemplo, los iones con una masa menor viajarán más rápido y llegarán primero al detector. [17] Los iones generalmente se mueven antes de ser acelerados por el campo eléctrico , esto hace que las partículas con la misma m/z lleguen en diferentes momentos al detector. Esta diferencia en las velocidades iniciales a menudo no depende de la masa del ion y se convertirá en una diferencia en la velocidad final. Esta distribución en las velocidades amplía los picos que se muestran en el gráfico de recuento frente a m/z , pero generalmente no cambiará la ubicación central de los picos, ya que la velocidad inicial de los iones generalmente está centrada en cero. Para solucionar este problema, se ha combinado el enfoque con retardo de tiempo/ extracción retardada con TOF-MS. [18]
Los analizadores de masas cuadrupolos utilizan campos eléctricos oscilantes para estabilizar o desestabilizar selectivamente las trayectorias de los iones que pasan a través de un campo cuadrupolo de radiofrecuencia (RF) creado entre cuatro barras paralelas. Solo los iones en un cierto rango de relación masa/carga pasan a través del sistema en cualquier momento, pero los cambios en los potenciales de las barras permiten que se recorra rápidamente un amplio rango de valores m/z , ya sea de forma continua o en una sucesión de saltos discretos. Un analizador de masas cuadrupolo actúa como un filtro selectivo de masas y está estrechamente relacionado con la trampa de iones cuadrupolo , particularmente la trampa de iones cuadrupolo lineal, excepto que está diseñado para pasar los iones no atrapados en lugar de recolectar los atrapados, y por esa razón se lo conoce como cuadrupolo de transmisión. Un analizador de masas cuadrupolo mejorado magnéticamente incluye la adición de un campo magnético, ya sea aplicado axial o transversalmente. Este nuevo tipo de instrumento conduce a una mejora adicional del rendimiento en términos de resolución y/o sensibilidad dependiendo de la magnitud y orientación del campo magnético aplicado. [19] [20] Una variación común del cuadrupolo de transmisión es el espectrómetro de masas de triple cuadrupolo. El "triple cuadrupolo" tiene tres etapas consecutivas de cuadrupolo, la primera actúa como un filtro de masa para transmitir un ion entrante particular al segundo cuadrupolo, una cámara de colisión, en donde ese ion puede romperse en fragmentos. El tercer cuadrupolo también actúa como un filtro de masa, para transmitir un ion fragmento particular al detector. Si se hace que un cuadrupolo pase rápidamente y repetidamente por un rango de configuraciones de filtro de masa, se pueden informar espectros completos. De la misma manera, se puede hacer que un triple cuadrupolo realice varios tipos de escaneo característicos de la espectrometría de masas en tándem .
La trampa de iones cuadrupolo funciona según los mismos principios físicos que el analizador de masas cuadrupolo, pero los iones quedan atrapados y expulsados secuencialmente. Los iones quedan atrapados en un campo de RF principalmente cuadrupolo, en un espacio definido por un electrodo de anillo (normalmente conectado al potencial de RF principal) entre dos electrodos de tapa terminal (normalmente conectados a potenciales de CC o CA auxiliares). La muestra se ioniza internamente (por ejemplo, con un haz de electrones o láser) o externamente, en cuyo caso los iones se introducen a menudo a través de una abertura en un electrodo de tapa terminal.
Existen muchos métodos de separación y aislamiento de masa/carga, pero el más utilizado es el modo de inestabilidad de masa, en el que el potencial de RF se incrementa de forma que la órbita de los iones con una masa a > b sea estable, mientras que los iones con una masa b se vuelven inestables y son expulsados en el eje z hacia un detector. También existen métodos de análisis no destructivos.
Los iones también pueden ser expulsados mediante el método de excitación por resonancia, mediante el cual se aplica un voltaje de excitación oscilatorio suplementario a los electrodos de la tapa terminal, y se varía la amplitud del voltaje de captura y/o la frecuencia del voltaje de excitación para llevar a los iones a una condición de resonancia en orden de su relación masa/carga. [21] [22]
El espectrómetro de masas con trampa de iones cilíndrica (CIT) es un derivado de la trampa de iones cuadrupolo, en la que los electrodos están formados por anillos planos en lugar de electrodos con forma hiperbólica. La arquitectura se presta bien a la miniaturización porque, a medida que se reduce el tamaño de una trampa, la forma del campo eléctrico cerca del centro de la trampa, la región donde quedan atrapados los iones, adopta una forma similar a la de una trampa hiperbólica.
Una trampa de iones cuadrupolo lineal es similar a una trampa de iones cuadrupolo, pero atrapa iones en un campo cuadrupolo bidimensional, en lugar de un campo cuadrupolo tridimensional como en una trampa de iones cuadrupolo 3D. La LTQ ("trampa cuadrupolo lineal") de Thermo Fisher es un ejemplo de trampa de iones lineal. [23]
Una trampa de iones toroidal se puede visualizar como un cuadrupolo lineal curvado y conectado en los extremos o como una sección transversal de una trampa de iones 3D rotada sobre el borde para formar la trampa toroidal con forma de rosquilla. La trampa puede almacenar grandes volúmenes de iones distribuyéndolos por toda la estructura de trampa en forma de anillo. Esta trampa con forma toroidal es una configuración que permite una mayor miniaturización de un analizador de masas de trampa de iones. Además, todos los iones se almacenan en el mismo campo de captura y se expulsan juntos, lo que simplifica la detección que puede ser complicada con configuraciones de matriz debido a variaciones en la alineación del detector y el mecanizado de las matrices. [24]
Al igual que con la trampa toroidal, las trampas lineales y las trampas de iones cuadrupolo 3D son los analizadores de masas más comúnmente miniaturizados debido a su alta sensibilidad, tolerancia a la presión mTorr y capacidades para la espectrometría de masas en tándem con un solo analizador (por ejemplo, exploraciones de iones de producto). [25]

Los instrumentos Orbitrap son similares a los espectrómetros de masas de resonancia ciclotrónica de iones por transformada de Fourier (ver texto a continuación). Los iones quedan atrapados electrostáticamente en una órbita alrededor de un electrodo central con forma de huso. El electrodo confina los iones de modo que orbitan alrededor del electrodo central y oscilan hacia adelante y hacia atrás a lo largo del eje largo del electrodo central. Esta oscilación genera una corriente de imagen en las placas del detector que es registrada por el instrumento. Las frecuencias de estas corrientes de imagen dependen de las relaciones masa-carga de los iones. Los espectros de masa se obtienen mediante la transformada de Fourier de las corrientes de imagen registradas.
Las trampas orbitales tienen una alta precisión de masa, alta sensibilidad y un buen rango dinámico. [26]
_Mass_spectrometer.jpg/440px-IonSpec_FT-ICR_(Fourier_transform_Ion_cyclotron_resonance)_Mass_spectrometer.jpg)
La espectrometría de masas por transformada de Fourier (FTMS), o más precisamente, la resonancia ciclotrónica iónica por transformada de Fourier , mide la masa detectando la corriente de imagen producida por la ciclotronización de iones en presencia de un campo magnético. En lugar de medir la desviación de iones con un detector como un multiplicador de electrones , los iones se inyectan en una trampa de Penning (una trampa de iones electromagnética estática ) donde forman parte de un circuito. Los detectores en posiciones fijas en el espacio miden la señal eléctrica de los iones que pasan cerca de ellos a lo largo del tiempo, produciendo una señal periódica. Dado que la frecuencia del ciclo de un ion está determinada por su relación masa-carga, esto se puede deconvolucionar realizando una transformada de Fourier en la señal. La FTMS tiene la ventaja de una alta sensibilidad (ya que cada ion se "cuenta" más de una vez) y una resolución mucho mayor y, por lo tanto, precisión. [27] [28]
La resonancia ciclotrónica de iones (ICR) es una técnica de análisis de masas más antigua similar a la FTMS, con la excepción de que los iones se detectan con un detector tradicional. Los iones atrapados en una trampa de Penning se excitan mediante un campo eléctrico de radiofrecuencia hasta que impactan en la pared de la trampa, donde se encuentra el detector. Los iones de diferente masa se resuelven según el tiempo de impacto.

El elemento final del espectrómetro de masas es el detector. El detector registra la carga inducida o la corriente producida cuando un ion pasa por una superficie o la toca. En un instrumento de escaneo, la señal producida en el detector durante el transcurso del escaneo en función de dónde se encuentra el instrumento en el escaneo (a qué m/Q ) producirá un espectro de masas , un registro de iones en función de m/Q .
Por lo general, se utiliza algún tipo de multiplicador de electrones , aunque también se utilizan otros detectores, como las copas de Faraday y los detectores de iones a fotones . Debido a que la cantidad de iones que salen del analizador de masas en un instante particular suele ser bastante pequeña, a menudo se necesita una amplificación considerable para obtener una señal. Los detectores de placas de microcanales se utilizan comúnmente en los instrumentos comerciales modernos. [29] En FTMS y Orbitraps , el detector consta de un par de superficies metálicas dentro de la región del analizador de masas/trampa de iones por las que los iones solo pasan cuando oscilan. No se produce corriente continua, solo se produce una corriente de imagen de CA débil en un circuito entre los electrodos. También se han utilizado otros detectores inductivos. [30]

Un espectrómetro de masas en tándem es capaz de realizar múltiples rondas de espectrometría de masas, generalmente separadas por alguna forma de fragmentación de moléculas. Por ejemplo, un analizador de masas puede aislar un péptido de muchos que ingresan a un espectrómetro de masas. Luego, una celda de colisión estabiliza los iones peptídicos mientras chocan con un gas, lo que hace que se fragmenten por disociación inducida por colisión (CID). Luego, un analizador de masas adicional clasifica los fragmentos producidos a partir de los péptidos. La espectrometría de masas en tándem también se puede realizar en un solo analizador de masas a lo largo del tiempo, como en una trampa de iones cuadrupolo . Existen varios métodos para fragmentar moléculas para la espectrometría de masas en tándem, incluida la disociación inducida por colisión (CID), la disociación por captura de electrones (ECD), la disociación por transferencia de electrones (ETD), la disociación multifotónica infrarroja (IRMPD), la disociación radiativa infrarroja de cuerpo negro (BIRD), la disociación por desprendimiento de electrones (EDD) y la disociación inducida por superficie (SID). Una aplicación importante que utiliza la espectrometría de masas en tándem es la identificación de proteínas. [31]
La espectrometría de masas en tándem permite una variedad de secuencias experimentales. Muchos espectrómetros de masas comerciales están diseñados para acelerar la ejecución de secuencias rutinarias como el monitoreo de reacciones seleccionadas (SRM), el escaneo de iones precursores, el escaneo de iones de productos y el escaneo de pérdida neutra. [32]
Otro tipo de espectrometría de masas en tándem utilizada para la datación por radiocarbono es la espectrometría de masas con acelerador (AMS), que utiliza voltajes muy altos, generalmente en el rango de los megavoltios, para acelerar los iones negativos en un tipo de espectrómetro de masas en tándem.
La base de datos de entidades químicas y metabolitos de METLIN [33] [34] [35] [36] es el mayor repositorio de datos de espectrometría de masas en tándem experimentales adquiridos a partir de estándares. Los datos de espectrometría de masas en tándem de más de 930 000 estándares moleculares (a enero de 2024) [33] [36] se proporcionan para facilitar la identificación de entidades químicas a partir de experimentos de espectrometría de masas en tándem. [37] Además de la identificación de moléculas conocidas, también es útil para identificar incógnitas mediante su búsqueda/análisis de similitudes. [38] Todos los datos de espectrometría de masas en tándem provienen del análisis experimental de estándares a múltiples energías de colisión y en modos de ionización tanto positivos como negativos. [33]
Cuando una combinación específica de fuente, analizador y detector se vuelve convencional en la práctica, puede surgir un acrónimo compuesto para designarla de manera sucinta. Un ejemplo es MALDI-TOF , que se refiere a una combinación de una fuente de ionización/desorción láser asistida por matriz con un analizador de masas de tiempo de vuelo . Otros ejemplos incluyen espectrometría de masas con plasma acoplado inductivamente (ICP-MS) , espectrometría de masas con acelerador (AMS) , espectrometría de masas con ionización térmica (TIMS) y espectrometría de masas con fuente de chispa (SSMS) .
Algunas aplicaciones de la espectrometría de masas han recibido denominaciones que, aunque en sentido estricto parecen referirse a una aplicación amplia, en la práctica han llegado a connotar una configuración específica o un número limitado de instrumentos. Un ejemplo de esto es la espectrometría de masas de relación isotópica (IRMS), que en la práctica se refiere al uso de un número limitado de analizadores de masas basados en sectores; este nombre se utiliza para referirse tanto a la aplicación como al instrumento utilizado para la aplicación.
Una mejora importante en las capacidades de resolución y determinación de masas de la espectrometría de masas es su uso en conjunto con técnicas cromatográficas y otras técnicas de separación.

Una combinación común es la cromatografía de gases -espectrometría de masas (GC/MS o GC-MS). En esta técnica, se utiliza un cromatógrafo de gases para separar diferentes compuestos. Esta corriente de compuestos separados se alimenta en línea a la fuente de iones , un filamento metálico al que se aplica voltaje . Este filamento emite electrones que ionizan los compuestos. Los iones pueden luego fragmentarse aún más, produciendo patrones predecibles. Los iones y fragmentos intactos pasan al analizador del espectrómetro de masas y finalmente se detectan. [39] Sin embargo, las altas temperaturas (300 °C) utilizadas en el puerto de inyección (y el horno) del GC-MS pueden provocar la degradación térmica de las moléculas inyectadas, lo que da como resultado la medición de productos de degradación en lugar de la(s) molécula(s) de interés real(es). [40]

De manera similar a la cromatografía de gases MS (GC-MS), la cromatografía líquida-espectrometría de masas (LC/MS o LC-MS) separa los compuestos cromatográficamente antes de que se introduzcan en la fuente de iones y el espectrómetro de masas. Se diferencia de la GC-MS en que la fase móvil es líquida, normalmente una mezcla de agua y disolventes orgánicos , en lugar de gas. Lo más habitual es que en la LC-MS se utilice una fuente de ionización por electropulverización . Otras fuentes de iones de LC-MS populares y disponibles comercialmente son la ionización química a presión atmosférica y la fotoionización a presión atmosférica . También existen algunas técnicas de ionización de reciente desarrollo, como la pulverización láser .
La electroforesis capilar-espectrometría de masas (CE-MS) es una técnica que combina el proceso de separación de líquidos de la electroforesis capilar con la espectrometría de masas. [41] La CE-MS suele estar acoplada a la ionización por electrospray. [42]
La espectrometría de movilidad iónica-espectrometría de masas (IMS/MS o IMMS) es una técnica en la que los iones se separan primero por tiempo de deriva a través de un gas neutro bajo un gradiente de potencial eléctrico aplicado antes de introducirlos en un espectrómetro de masas. [43] El tiempo de deriva es una medida de la sección transversal de colisión relativa a la carga del ion. El ciclo de trabajo de la IMS (el tiempo durante el cual se lleva a cabo el experimento) es más largo que la mayoría de las técnicas espectrométricas de masas, de modo que el espectrómetro de masas puede tomar muestras a lo largo del curso de la separación IMS. Esto produce datos sobre la separación IMS y la relación masa-carga de los iones de una manera similar a la LC-MS . [44]
El ciclo de trabajo del IMS es corto en relación con las separaciones por cromatografía líquida o cromatografía de gases y, por lo tanto, se puede acoplar a dichas técnicas, produciendo modalidades triples como LC/IMS/MS. [45]

La espectrometría de masas produce distintos tipos de datos. La representación de datos más común es el espectro de masas .
Ciertos tipos de datos de espectrometría de masas se representan mejor como un cromatograma de masas . Los tipos de cromatogramas incluyen el monitoreo de iones seleccionados (SIM), la corriente de iones totales (TIC) y el monitoreo de reacciones seleccionadas (SRM), entre muchos otros.
Otros tipos de datos de espectrometría de masas se representan bien como un mapa de contorno tridimensional . En esta forma, la relación masa-carga, m/z, se encuentra en el eje x , la intensidad en el eje y , y un parámetro experimental adicional, como el tiempo, se registra en el eje z .
El análisis de datos de espectrometría de masas es específico del tipo de experimento que produce los datos. Las subdivisiones generales de los datos son fundamentales para comprenderlos.
Muchos espectrómetros de masas funcionan en modo de iones negativos o en modo de iones positivos . Es muy importante saber si los iones observados tienen carga negativa o positiva. Esto suele ser importante para determinar la masa neutra, pero también indica algo sobre la naturaleza de las moléculas.
Los distintos tipos de fuentes de iones dan como resultado diferentes conjuntos de fragmentos producidos a partir de las moléculas originales. Una fuente de ionización electrónica produce muchos fragmentos y, en su mayoría, radicales de carga simple (1-) (número impar de electrones), mientras que una fuente de electrospray suele producir iones cuasimoleculares no radicales que, con frecuencia, tienen carga múltiple. La espectrometría de masas en tándem produce deliberadamente iones de fragmentos después de la fuente y puede cambiar drásticamente el tipo de datos obtenidos mediante un experimento.
El conocimiento del origen de una muestra puede proporcionar información sobre las moléculas que la componen y sus fragmentaciones. Una muestra de un proceso de síntesis o fabricación probablemente contendrá impurezas relacionadas químicamente con el componente de interés. Una muestra biológica preparada de forma rudimentaria probablemente contendrá una cierta cantidad de sal, que puede formar aductos con las moléculas del analito en determinados análisis.
Los resultados también pueden depender en gran medida de la preparación de la muestra y de cómo se procesó o introdujo. Un ejemplo importante es la cuestión de qué matriz se utiliza para la detección mediante MALDI, ya que gran parte de la energía del evento de desorción/ionización está controlada por la matriz en lugar de la potencia del láser. A veces, las muestras se enriquecen con sodio u otra especie portadora de iones para producir aductos en lugar de una especie protonada.
La espectrometría de masas permite medir la masa molar, la estructura molecular y la pureza de la muestra. Cada una de estas cuestiones requiere un procedimiento experimental diferente; por lo tanto, la definición adecuada del objetivo experimental es un requisito previo para recopilar los datos adecuados e interpretarlos correctamente.
Dado que la estructura precisa o la secuencia peptídica de una molécula se descifra a través del conjunto de masas de los fragmentos, la interpretación de los espectros de masas requiere el uso combinado de varias técnicas. Por lo general, la primera estrategia para identificar un compuesto desconocido es comparar su espectro de masas experimental con una biblioteca de espectros de masas. Si no se obtienen resultados de la búsqueda, se debe realizar una interpretación manual [46] o una interpretación asistida por software de los espectros de masas . La simulación por computadora de los procesos de ionización y fragmentación que ocurren en el espectrómetro de masas es la herramienta principal para asignar la estructura o la secuencia peptídica a una molécula. Una información estructural a priori se fragmenta in silico y el patrón resultante se compara con el espectro observado. Dicha simulación a menudo está respaldada por una biblioteca de fragmentación [47] que contiene patrones publicados de reacciones de descomposición conocidas. Se ha desarrollado un software que aprovecha esta idea tanto para moléculas pequeñas como para proteínas .
El análisis de los espectros de masas también puede ser espectros con masa exacta . Un valor de relación masa-carga ( m/z ) con solo precisión entera puede representar una inmensa cantidad de estructuras iónicas teóricamente posibles; sin embargo, cifras de masa más precisas reducen significativamente la cantidad de fórmulas moleculares candidatas. Un algoritmo informático llamado generador de fórmulas calcula todas las fórmulas moleculares que teóricamente se ajustan a una masa dada con una tolerancia especificada.
Una técnica reciente para la elucidación de la estructura en espectrometría de masas, llamada huella de iones precursores, identifica piezas individuales de información estructural realizando una búsqueda de los espectros en tándem de la molécula bajo investigación contra una biblioteca de espectros de iones producto de iones precursores caracterizados estructuralmente. [48]

La espectrometría de masas tiene aplicaciones tanto cualitativas como cuantitativas . Entre ellas se incluyen la identificación de compuestos desconocidos, la determinación de la composición isotópica de los elementos de una molécula y la determinación de la estructura de un compuesto mediante la observación de su fragmentación. Otros usos incluyen la cuantificación de la cantidad de un compuesto en una muestra o el estudio de los fundamentos de la química de iones en fase gaseosa (la química de iones y neutros en el vacío). La espectrometría de masas se utiliza ahora comúnmente en laboratorios analíticos que estudian las propiedades físicas, químicas o biológicas de una gran variedad de compuestos. La cuantificación puede ser relativa (analizada en relación con una muestra de referencia) o absoluta (analizada utilizando un método de curva estándar). [49] [50]
Como técnica analítica posee ventajas distintivas tales como: Mayor sensibilidad sobre la mayoría de las otras técnicas analíticas debido a que el analizador, como filtro masa-carga, reduce la interferencia de fondo, Excelente especificidad a partir de patrones de fragmentación característicos para identificar compuestos desconocidos o confirmar la presencia de compuestos sospechosos, Información sobre el peso molecular, Información sobre la abundancia isotópica de los elementos, Datos químicos resueltos temporalmente.
Algunas de las desventajas del método es que a menudo no distingue entre isómeros ópticos y geométricos y las posiciones de los sustituyentes en las posiciones o, m y p en un anillo aromático. Además, su alcance es limitado para identificar hidrocarburos que producen iones fragmentados similares.

La espectrometría de masas también se utiliza para determinar la composición isotópica de los elementos dentro de una muestra. Las diferencias de masa entre los isótopos de un elemento son muy pequeñas, y los isótopos menos abundantes de un elemento suelen ser muy raros, por lo que se requiere un instrumento muy sensible. Estos instrumentos, a veces denominados espectrómetros de masas de relación isotópica (IR-MS), suelen utilizar un solo imán para doblar un haz de partículas ionizadas hacia una serie de copas de Faraday que convierten los impactos de las partículas en corriente eléctrica . Se puede realizar un análisis rápido en línea del contenido de deuterio del agua utilizando espectrometría de masas de resplandor en flujo , FA-MS. Probablemente el espectrómetro de masas más sensible y preciso para este propósito es el espectrómetro de masas de acelerador (AMS). Esto se debe a que proporciona una sensibilidad máxima, capaz de medir átomos individuales y medir nucleidos con un rango dinámico de ~10 15 en relación con el isótopo estable principal. [51] Las relaciones isotópicas son marcadores importantes de una variedad de procesos. Algunas proporciones de isótopos se utilizan para determinar la edad de los materiales, por ejemplo, en la datación por carbono . El marcado con isótopos estables también se utiliza para la cuantificación de proteínas (consulte la caracterización de proteínas a continuación).
La espectrometría de masas por introducción de membrana combina la espectrometría de masas de relación isotópica con una cámara/celda de reacción separada por una membrana permeable a los gases. Este método permite el estudio de los gases a medida que evolucionan en solución. Este método se ha utilizado ampliamente para el estudio de la producción de oxígeno por el fotosistema II . [52]
Varias técnicas utilizan iones creados en una fuente de iones dedicada inyectada en un tubo de flujo o un tubo de deriva: el tubo de flujo de iones seleccionados (SIFT-MS) y la reacción de transferencia de protones (PTR-MS) son variantes de ionización química dedicadas al análisis de gases traza del aire, el aliento o el espacio de cabeza del líquido utilizando un tiempo de reacción bien definido que permite cálculos de concentraciones de analito a partir de la cinética de reacción conocida sin la necesidad de un estándar interno o calibración.
Otra técnica con aplicaciones en el campo del análisis de gases traza es la ionización por electrospray secundaria (SESI-MS), que es una variante de la ionización por electrospray . La SESI consiste en una columna de electrospray de disolvente acidificado puro que interactúa con vapores neutros. Las moléculas de vapor se ionizan a presión atmosférica cuando la carga se transfiere de los iones formados en el electrospray a las moléculas. Una ventaja de este enfoque es que es compatible con la mayoría de los sistemas ESI-MS. [53] [54]

Un analizador de gases residuales (RGA) es un espectrómetro de masas pequeño y generalmente robusto , diseñado típicamente para el control de procesos y el monitoreo de la contaminación en sistemas de vacío . Cuando se construye como un analizador de masas cuadrupolo , existen dos implementaciones, utilizando una fuente de iones abierta (OIS) o una fuente de iones cerrada (CIS). Los RGA se pueden encontrar en aplicaciones de alto vacío, como cámaras de investigación, configuraciones de ciencia de superficies , aceleradores , microscopios de barrido , etc. Los RGA se utilizan en la mayoría de los casos para monitorear la calidad del vacío y detectar fácilmente trazas diminutas de impurezas en el entorno de gas de baja presión. Estas impurezas se pueden medir hasta niveles de Torr , y poseen una detectabilidad sub- ppm en ausencia de interferencias de fondo.
Los RGA también se utilizarían como detectores de fugas in situ sensibles, generalmente utilizando helio , alcohol isopropílico u otras moléculas trazadoras. Con sistemas de vacío bombeados a niveles inferiores a Torr (para verificar la integridad de los sellos de vacío y la calidad del vacío), se pueden detectar fugas de aire, fugas virtuales y otros contaminantes a niveles bajos antes de que se inicie un proceso.Una sonda atómica es un instrumento que combina la espectrometría de masas de tiempo de vuelo y la microscopía de evaporación de campo para mapear la ubicación de átomos individuales.
La farmacocinética se estudia a menudo mediante espectrometría de masas debido a la naturaleza compleja de la matriz (a menudo sangre u orina) y la necesidad de una alta sensibilidad para observar datos de dosis bajas y puntos de tiempo largos. La instrumentación más común utilizada en esta aplicación es LC-MS con un espectrómetro de masas de triple cuadrupolo . La espectrometría de masas en tándem se emplea habitualmente para una mayor especificidad. Las curvas estándar y los estándares internos se utilizan para la cuantificación de, por lo general, un único fármaco en las muestras. Las muestras representan diferentes puntos de tiempo a medida que se administra un fármaco y luego se metaboliza o se elimina del cuerpo. Las muestras en blanco o t = 0 tomadas antes de la administración son importantes para determinar el fondo y garantizar la integridad de los datos con matrices de muestra tan complejas. Se presta mucha atención a la linealidad de la curva estándar; sin embargo, no es raro utilizar el ajuste de curvas con funciones más complejas, como las cuadráticas, ya que la respuesta de la mayoría de los espectrómetros de masas es menos que lineal en grandes rangos de concentración. [55] [56] [57]
Actualmente existe un interés considerable en el uso de espectrometría de masas de muy alta sensibilidad para estudios de microdosificación , que se consideran una alternativa prometedora a la experimentación con animales .
Estudios recientes muestran que la ionización por electrospray secundaria (SESI) es una técnica poderosa para monitorear la cinética de los fármacos a través del análisis del aliento. [58] [59] Debido a que el aliento se produce de manera natural, se pueden recopilar fácilmente varios puntos de datos. Esto permite aumentar considerablemente la cantidad de puntos de datos recopilados. [60] En estudios con animales, este enfoque SESI puede reducir el sacrificio de animales. [59] En humanos, el análisis no invasivo SESI-MS del aliento puede ayudar a estudiar la cinética de los fármacos a un nivel personalizado. [58] [61] [62]
La espectrometría de masas es un método importante para la caracterización y secuenciación de proteínas. Los dos métodos principales para la ionización de proteínas completas son la ionización por electrospray (ESI) y la desorción/ionización láser asistida por matriz (MALDI). De acuerdo con el rendimiento y el rango de masas de los espectrómetros de masas disponibles, se utilizan dos enfoques para caracterizar las proteínas. En el primero, las proteínas intactas se ionizan mediante cualquiera de las dos técnicas descritas anteriormente y luego se introducen en un analizador de masas. Este enfoque se conoce como estrategia " de arriba hacia abajo " de análisis de proteínas. Sin embargo, el enfoque de arriba hacia abajo se limita en gran medida a estudios de proteína única de bajo rendimiento. En el segundo, las proteínas se digieren enzimáticamente en péptidos más pequeños utilizando proteasas como tripsina o pepsina , ya sea en solución o en gel después de la separación electroforética . También se utilizan otros agentes proteolíticos. La colección de productos peptídicos a menudo se separa por cromatografía antes de la introducción al analizador de masas. Cuando se utiliza el patrón característico de los péptidos para la identificación de la proteína, el método se denomina huella de masa de péptidos (PMF), si la identificación se realiza utilizando los datos de secuencia determinados en el análisis MS en tándem, se denomina secuenciación de péptidos de novo . Estos procedimientos de análisis de proteínas también se conocen como el enfoque " de abajo hacia arriba ", y también se han utilizado para analizar la distribución y la posición de las modificaciones postraduccionales, como la fosforilación en las proteínas. [63] También se está empezando a utilizar un tercer enfoque, este enfoque intermedio "de medio hacia abajo" implica analizar péptidos proteolíticos que son más grandes que el péptido tríptico típico. [64]

Como método estándar de análisis, los espectrómetros de masas han llegado a otros planetas y lunas. Dos fueron llevados a Marte por el programa Viking . A principios de 2005, la misión Cassini-Huygens entregó un instrumento GC-MS especializado a bordo de la sonda Huygens a través de la atmósfera de Titán , la luna más grande del planeta Saturno . Este instrumento analizó muestras atmosféricas a lo largo de su trayectoria de descenso y pudo vaporizar y analizar muestras de la superficie congelada y cubierta de hidrocarburos de Titán una vez que la sonda aterrizó. Estas mediciones comparan la abundancia de isótopos de cada partícula en comparación con la abundancia natural de la Tierra. [65] También a bordo de la nave espacial Cassini-Huygens había un espectrómetro de masas iónico y neutro que había estado tomando mediciones de la composición atmosférica de Titán, así como de la composición de las columnas de Encélado . Un espectrómetro de masas Analizador de Gas Térmico y Evolucionado fue llevado por el Aterrizador Mars Phoenix lanzado en 2007. [66]
Los espectrómetros de masas también se utilizan ampliamente en misiones espaciales para medir la composición de los plasmas. Por ejemplo, la sonda espacial Cassini transportaba el Espectrómetro de Plasma Cassini (CAPS), [67] que medía la masa de los iones en la magnetosfera de Saturno .
Los espectrómetros de masas se utilizaron en los hospitales para el análisis de gases respiratorios desde aproximadamente 1975 hasta finales de siglo. Es probable que algunos de ellos todavía estén en uso, pero actualmente no se fabrica ninguno. [68]
Se encontraban principalmente en el quirófano y formaban parte de un sistema complejo en el que las muestras de gas respirado de los pacientes sometidos a anestesia se introducían en el instrumento a través de un mecanismo de válvula diseñado para conectar secuencialmente hasta 32 salas al espectrómetro de masas. Una computadora dirigía todas las operaciones del sistema. Los datos recopilados del espectrómetro de masas se enviaban a las salas individuales para que los utilizara el anestesiólogo.
La singularidad de este espectrómetro de masas de sector magnético puede haber sido el hecho de que un plano de detectores, cada uno posicionado a propósito para recolectar todas las especies de iones que se esperaba que estuvieran en las muestras, permitió que el instrumento informara simultáneamente todos los gases respirados por el paciente. Aunque el rango de masas estaba limitado a un poco más de 120 u , la fragmentación de algunas de las moléculas más pesadas anuló la necesidad de un límite de detección más alto. [69]
La función principal de la espectrometría de masas es la de servir de herramienta para los análisis químicos basados en la detección y cuantificación de iones según su relación masa-carga. Sin embargo, la espectrometría de masas también es prometedora para la síntesis de materiales. [51] El aterrizaje suave de iones se caracteriza por la deposición de especies intactas sobre superficies a bajas energías cinéticas, lo que impide la fragmentación de las especies incidentes. [70] La técnica de aterrizaje suave se informó por primera vez en 1977 para la reacción de iones de baja energía que contienen azufre sobre una superficie de plomo. [71]