
En química orgánica , un tiol ( / ˈθaɪɒl / ; [1] del griego antiguo θεῖον (teión) ' azufre ' [ 2] ) , o derivado de tiol , es cualquier compuesto organosulfurado de la forma R−SH , donde R representa un alquilo u otro sustituyente orgánico . El grupo funcional −SH en sí mismo se conoce como un grupo tiol o un grupo sulfhidrilo , o un grupo sulfanilo . Los tioles son el análogo azufrado de los alcoholes (es decir, el azufre toma el lugar del oxígeno en el grupo hidroxilo ( −OH ) de un alcohol), y la palabra es una mezcla de " tio- " con "alcohol".
Muchos tioles tienen olores fuertes que se asemejan al del ajo o al de los huevos podridos. Los tioles se utilizan como odorantes para ayudar a detectar el gas natural (que en forma pura es inodoro), y el "olor a gas natural" se debe al olor del tiol utilizado como odorante. A veces se hace referencia a los tioles como mercaptanos ( / m ər ˈ k æ p t æ n / ) [3] o compuestos mercapto , [4] [5] [6] un término introducido en 1832 por William Christopher Zeise y que se deriva del latín mercurio captāns ('capturar mercurio') [7] porque el grupo tiolato ( RS − ) se une muy fuertemente con los compuestos de mercurio . [8]
Los tioles que tienen la estructura R−SH, en la que un grupo alquilo (R) está unido a un grupo sulfhidrilo (SH), se denominan alcanotioles o alquiltioles . [9] Los tioles y los alcoholes tienen una conectividad similar. Debido a que los átomos de azufre son más grandes que los átomos de oxígeno, las longitudes de enlace C−S (normalmente alrededor de 180 picómetros ) son unos 40 picómetros más largas que los enlaces C−O típicos. Los ángulos C−S−H se acercan a los 90°, mientras que el ángulo para el grupo C−O−H es más obtuso. En sólidos y líquidos, el enlace de hidrógeno entre grupos tioles individuales es débil, y la principal fuerza de cohesión son las interacciones de Van der Waals entre los centros de azufre divalentes altamente polarizables.
El enlace S−H es mucho más débil que el enlace O−H, como se refleja en sus respectivas energías de disociación de enlace (BDE). Para CH3S − H, la BDE es 366 kJ/mol (87 kcal/mol), mientras que para CH3O − H, la BDE es 440 kJ/mol (110 kcal/mol). [10]
Un enlace S−H es moderadamente polar debido a la pequeña diferencia en la electronegatividad del azufre y el hidrógeno. En cambio, los enlaces O−H en los grupos hidroxilo son más polares. Los tioles tienen un momento dipolar menor en relación con sus alcoholes correspondientes.
Hay varias formas de nombrar los alquiltioles:
Muchos tioles tienen olores fuertes que se parecen al del ajo . Los olores de los tioles, particularmente los de bajo peso molecular, suelen ser fuertes y repulsivos. El rocío de los zorrillos consiste principalmente en tioles y derivados de bajo peso molecular. [11] [ 12] [13] [14] [15] Estos compuestos son detectables por la nariz humana en concentraciones de solo 10 partes por mil millones. [16] El sudor humano contiene ( R )/( S )-3-metil-3-mercapto-1-ol (MSH), detectable a 2 partes por mil millones y que tiene un olor afrutado, parecido a la cebolla . El (metiltio)metanotiol (MeSCH 2 SH; MTMT) es un tiol volátil de olor fuerte, también detectable a niveles de partes por mil millones, que se encuentra en la orina de ratones macho . Lawrence C. Katz y sus colaboradores demostraron que el MTMT funcionaba como un semioquímico , activando ciertas neuronas sensoriales olfativas de ratones y atrayendo a ratones hembra . [17] Se ha demostrado que el cobre es requerido por un receptor olfativo específico de ratón, MOR244-3, que es altamente sensible al MTMT, así como a varios otros tioles y compuestos relacionados. [18] Se ha identificado un receptor olfativo humano, OR2T11 , que, en presencia de cobre, es altamente sensible a los odorantes gaseosos (ver más abajo) etanotiol y t -butil mercaptano , así como otros tioles de bajo peso molecular, incluyendo el alil mercaptano encontrado en el aliento humano a ajo , y el sulfuro cíclico de olor fuerte tietano . [19]
Los tioles también son responsables de una clase de defectos del vino causados por una reacción no deseada entre el azufre y la levadura y el olor "a zorrillo" de la cerveza que ha estado expuesta a la luz ultravioleta.
No todos los tioles tienen olores desagradables. Por ejemplo, el furan-2-ilmetanotiol contribuye al aroma del café tostado , mientras que el mercaptano de pomelo , un tiol monoterpenoide , es responsable del olor característico del pomelo . El efecto de este último compuesto está presente solo en bajas concentraciones. El mercaptano puro tiene un olor desagradable.
En los Estados Unidos, los distribuidores de gas natural tuvieron que agregar tioles, originalmente etanotiol , al gas natural (que es naturalmente inodoro) después de la mortal explosión de la New London School en New London, Texas , en 1937. Muchos distribuidores de gas estaban odorizando el gas antes de este evento. La mayoría de los odorantes de gas utilizados actualmente contienen mezclas de mercaptanos y sulfuros, con t -butil mercaptano como el principal componente del olor en el gas natural y etanotiol en el gas licuado de petróleo (GLP, propano). [20] En situaciones en las que se utilizan tioles en la industria comercial, como los buques cisterna de gas licuado de petróleo y los sistemas de manipulación a granel, se utiliza un catalizador oxidante para destruir el olor. Un catalizador de oxidación a base de cobre neutraliza los tioles volátiles y los transforma en productos inertes.
Los tioles muestran poca asociación por puentes de hidrógeno , tanto con moléculas de agua como entre ellos mismos. Por lo tanto, tienen puntos de ebullición más bajos y son menos solubles en agua y otros disolventes polares que los alcoholes de peso molecular similar. Por esta razón también, los tioles y sus isómeros del grupo funcional sulfuro correspondiente tienen características de solubilidad y puntos de ebullición similares, mientras que no ocurre lo mismo con los alcoholes y sus éteres isoméricos correspondientes.
El enlace S−H en los tioles es débil en comparación con el enlace O−H en los alcoholes. Para CH 3 X−H, las entalpías de enlace son365,07 ± 2,1 kcal/mol para X = S y440,2 ± 3,0 kcal/mol para X = O. [21] La abstracción de un átomo de hidrógeno de un tiol da un radical tiilo con la fórmula RS • , donde R = alquilo o arilo.
Los tioles volátiles se detectan fácilmente y casi con certeza por su olor distintivo. Los analizadores específicos de azufre para cromatógrafos de gases son útiles. Los indicadores espectroscópicos son la señal S H intercambiable con D 2 O en el espectro de RMN 1 H ( 33 S es activo en RMN pero las señales para el azufre divalente son muy amplias y de poca utilidad [22] ). La banda ν SH aparece cerca de 2400 cm −1 en el espectro IR . [4] En la reacción del nitroprusiato , los grupos tiol libres reaccionan con nitroprusiato de sodio e hidróxido de amonio para dar un color rojo.
En la industria, el metanotiol se prepara mediante la reacción de sulfuro de hidrógeno con metanol . Este método se emplea para la síntesis industrial de metanotiol :
Estas reacciones se llevan a cabo en presencia de catalizadores ácidos. La otra vía principal para obtener tioles implica la adición de sulfuro de hidrógeno a los alquenos . Estas reacciones se llevan a cabo normalmente en presencia de un catalizador ácido o luz ultravioleta. También se ha utilizado el desplazamiento de haluro , utilizando el haluro orgánico adecuado y sulfuro de hidrógeno de sodio. [23]
Otro método implica la alquilación de hidrosulfuro de sodio .
Este método se utiliza para la producción de ácido tioglicólico a partir de ácido cloroacético .
En general, en la escala típica de laboratorio, la reacción directa de un haloalcano con hidrosulfuro de sodio es ineficiente debido a la formación competitiva de sulfuros. En cambio, los haluros de alquilo se convierten en tioles a través de una S -alquilación de tiourea . Este proceso de varios pasos en un solo recipiente se lleva a cabo mediante la intermediación de la sal de isotiouronio , que se hidroliza en un paso separado: [24] [25]
La ruta de la tiourea funciona bien con haluros primarios, especialmente los activados. Los tioles secundarios y terciarios se preparan con menos facilidad. Los tioles secundarios se pueden preparar a partir de la cetona a través de los ditiocetales correspondientes . [26] Un proceso relacionado de dos pasos implica la alquilación del tiosulfato para dar el tiosulfonato (" sal de Bunte "), seguida de hidrólisis. El método se ilustra con una síntesis de ácido tioglicólico :
Los compuestos de organolitio y los reactivos de Grignard reaccionan con el azufre para dar los tiolatos, que se hidrolizan fácilmente: [27]
Los fenoles pueden convertirse en tiofenoles mediante la reorganización de sus dialquiltiocarbamatos de O -arilo. [28]
Los tioles se preparan mediante desalquilación reductora de sulfuros, especialmente derivados de bencilo y tioacetales. [29]
Los tiofenoles se producen por S -arilación o reemplazo del grupo saliente de diazonio con anión sulfhidrilo (SH − ): [30] [31]
De manera similar a la química de los alcoholes, los tioles forman sulfuros , tioacetales y tioésteres , que son análogos a los éteres , acetales y ésteres respectivamente. Los tioles y los alcoholes también son muy diferentes en su reactividad, siendo los tioles más fácilmente oxidables que los alcoholes. Los tiolatos son nucleófilos más potentes que los alcóxidos correspondientes .
Los tioles, o más específicamente sus bases conjugadas, se alquilan fácilmente para dar sulfuros:
Los tioles se desprotonan fácilmente. [32] En relación con los alcoholes, los tioles son más ácidos. La base conjugada de un tiol se llama tiolato . El butanotiol tiene un p K a de 10,5 frente a 15 para el butanol. El tiofenol tiene un p K a de 6, frente a 10 para el fenol . Un tiol altamente ácido es el pentafluorotiofenol (C 6 F 5 SH) con un p K a de 2,68. Por lo tanto, los tiolatos se pueden obtener a partir de tioles mediante tratamiento con hidróxidos de metales alcalinos.

Los tioles, especialmente en presencia de bases, se oxidan fácilmente con reactivos como el bromo y el yodo para dar un disulfuro orgánico (R−S−S−R).
La oxidación mediante reactivos más potentes, como el hipoclorito de sodio o el peróxido de hidrógeno, también puede producir ácidos sulfónicos (RSO 3 H).
La oxidación también puede efectuarse por oxígeno en presencia de catalizadores: [33]
Los tioles participan en el intercambio tiol-disulfuro:
Esta reacción es importante en la naturaleza.
Con los iones metálicos, los tiolatos se comportan como ligandos para formar complejos de tiolatos de metales de transición . El término mercaptano se deriva del latín mercurium captans (que captura mercurio) [7] porque el grupo tiolato se une tan fuertemente con los compuestos de mercurio . Según la teoría de ácido/base duro/blando (HSAB) , el azufre es un átomo relativamente blando (polarizable). Esto explica la tendencia de los tioles a unirse a elementos e iones blandos como el mercurio, el plomo o el cadmio. La estabilidad de los tiolatos metálicos es paralela a la de los minerales de sulfuro correspondientes.
Los tiolatos reaccionan con disulfuro de carbono para dar tioxantato ( RSCS).−
2).
Los radicales libres derivados de los mercaptanos, llamados radicales tiilo , se invocan comúnmente para explicar reacciones en química orgánica y bioquímica . Tienen la fórmula RS • donde R es un sustituyente orgánico como alquilo o arilo . [6] Surgen o pueden generarse por varias rutas, pero el método principal es la abstracción de átomos de H de los tioles. Otro método implica la homólisis de disulfuros orgánicos. [34] En biología, los radicales tiilo son responsables de la formación de los ácidos desoxirribonucleicos, bloques de construcción para el ADN . Esta conversión es catalizada por la ribonucleótido reductasa (ver figura). [35] Los intermediarios tiilo también se producen por la oxidación del glutatión , un antioxidante en biología. Los radicales tiilo (centrados en el azufre) pueden transformarse en radicales centrados en el carbono a través de equilibrios de intercambio de átomos de hidrógeno . La formación de radicales centrados en el carbono podría provocar daño a las proteínas a través de la formación de enlaces C −C o fragmentación de la cadena principal. [36]
Debido a la debilidad del enlace S−H, los tioles pueden funcionar como eliminadores de radicales libres . [37]
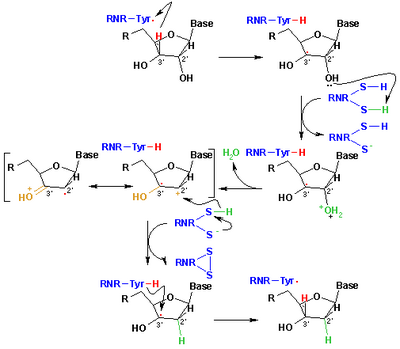
Como grupo funcional del aminoácido cisteína , el grupo tiol desempeña un papel muy importante en biología. Cuando los grupos tiol de dos residuos de cisteína (como en monómeros o unidades constituyentes) se acercan entre sí durante el plegamiento de la proteína , una reacción de oxidación puede generar una unidad de cistina con un enlace disulfuro (−S−S−). Los enlaces disulfuro pueden contribuir a la estructura terciaria de una proteína si las cisteínas son parte de la misma cadena peptídica , o contribuir a la estructura cuaternaria de proteínas multiunitarias al formar enlaces covalentes bastante fuertes entre diferentes cadenas peptídicas. Una manifestación física del equilibrio cisteína-cistina la proporcionan las tecnologías de alisado del cabello . [38]
Los grupos sulfhidrilo en el sitio activo de una enzima también pueden formar enlaces no covalentes con el sustrato de la enzima , lo que contribuye a la actividad catalítica covalente en las tríadas catalíticas . Los residuos de cisteína del sitio activo son la unidad funcional en las tríadas catalíticas de la proteasa de cisteína . Los residuos de cisteína también pueden reaccionar con iones de metales pesados (Zn 2+ , Cd 2+ , Pb 2+ , Hg 2+ , Ag + ) debido a la alta afinidad entre el sulfuro blando y el metal blando (ver ácidos y bases duros y blandos ). Esto puede deformar e inactivar la proteína, y es un mecanismo de envenenamiento por metales pesados .
Medicamentos que contienen grupo tiol 6-Mercaptopurina (anticancerígeno) Captopril (antihipertensivo) D-penicilamina (antiartrítico) Aurotiolato de sodio (antiartrítico) [39]
Muchos cofactores (moléculas auxiliares no basadas en proteínas) contienen tioles. La biosíntesis y degradación de los ácidos grasos y los hidrocarburos de cadena larga relacionados se lleva a cabo en un andamio que ancla la cadena en crecimiento a través de un tioéster derivado del tiol Coenzima A . La biosíntesis de metano , el principal hidrocarburo de la Tierra, surge de la reacción mediada por la coenzima M , ácido 2-mercaptoetil sulfónico. Los tiolatos, las bases conjugadas derivadas de los tioles, forman complejos fuertes con muchos iones metálicos, especialmente aquellos clasificados como blandos. La estabilidad de los tiolatos metálicos es paralela a la de los minerales de sulfuro correspondientes.
El espray defensivo de los zorrillos se compone principalmente de tioles de bajo peso molecular y derivados con un olor desagradable, que protegen a los zorrillos de los depredadores. Los búhos pueden cazar zorrillos, ya que carecen de sentido del olfato. [40]
son eliminadores de radicales libres y protegen contra el daño químico inducido por la radiación ionizante o los agentes alquilantes.