
Lipopolisacárido , ahora más comúnmente conocido como endotoxina , [1] es un término colectivo para los componentes de la membrana más externa de la envoltura celular de las bacterias gramnegativas, como E. coli y Salmonella [2] con una arquitectura estructural común. Los lipopolisacáridos ( LPS ) son moléculas grandes que constan de tres partes: un polisacárido de núcleo externo denominado antígeno O , un oligosacárido de núcleo interno y lípido A (del que se deriva en gran medida la toxicidad), todos unidos covalentemente. En la terminología actual, el término endotoxina a menudo se usa como sinónimo de LPS, aunque hay algunas endotoxinas (en el sentido original de toxinas que están dentro de la célula bacteriana que se liberan cuando la célula se desintegra) que no están relacionadas con LPS, como las llamadas proteínas delta endotoxina producidas por Bacillus thuringiensis . [3]
Los lipopolisacáridos pueden tener efectos importantes en la salud humana, principalmente a través de interacciones con el sistema inmunológico. El LPS es un potente activador del sistema inmunológico y es un pirógeno (agente que causa fiebre). [4] En casos graves, el LPS puede desencadenar una respuesta rápida del huésped y múltiples tipos de insuficiencia orgánica aguda [5] que puede provocar un choque séptico . [6] En niveles más bajos y durante un período de tiempo más prolongado, existe evidencia de que el LPS puede desempeñar un papel importante y perjudicial en la autoinmunidad , la obesidad , la depresión y la senescencia celular . [7] [8] [9] [10]
La actividad tóxica del LPS fue descubierta por primera vez y denominada endotoxina por Richard Friedrich Johannes Pfeiffer . Él distinguió entre exotoxinas , toxinas que son liberadas por bacterias al ambiente circundante, y endotoxinas, que son toxinas "dentro" de la célula bacteriana y liberadas solo después de la destrucción de la membrana externa bacteriana. [11] Trabajos posteriores demostraron que la liberación de LPS de microbios Gram negativos no requiere necesariamente la destrucción de la pared celular bacteriana, sino que el LPS se secreta como parte de la actividad fisiológica normal del tráfico de vesículas de membrana en forma de vesículas de membrana externa bacterianas (OMV) , que también pueden contener otros factores de virulencia y proteínas. [12] [2]
El LPS es un componente importante de la membrana celular externa de las bacterias gramnegativas , que contribuye en gran medida a la integridad estructural de las bacterias y protege la membrana de ciertos tipos de ataques químicos. El LPS es el antígeno más abundante en la superficie celular de la mayoría de las bacterias gramnegativas, y contribuye hasta en un 80% a la membrana externa de E. coli y Salmonella . [2] El LPS aumenta la carga negativa de la membrana celular y ayuda a estabilizar la estructura general de la membrana. Es de importancia crucial para muchas bacterias gramnegativas, que mueren si los genes que lo codifican se mutan o se eliminan. Sin embargo, parece que el LPS no es esencial en al menos algunas bacterias gramnegativas, como Neisseria meningitidis , Moraxella catarrhalis y Acinetobacter baumannii . [13] También se lo ha implicado en aspectos no patógenos de la ecología bacteriana, incluida la adhesión a la superficie, la sensibilidad a los bacteriófagos y las interacciones con depredadores como las amebas . El LPS también es necesario para el funcionamiento de las omptinas , una clase de proteasa bacteriana. [14]
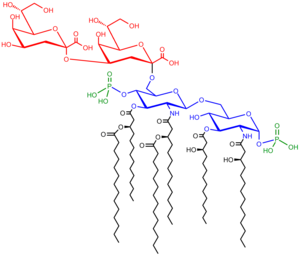
Los LPS son anfipáticos y se componen de tres partes: el antígeno O (o polisacárido O) que es hidrófilo, el oligosacárido central (también hidrófilo) y el lípido A , el dominio hidrófobo.
El polímero de glicano repetitivo contenido dentro de un LPS se conoce como antígeno O , polisacárido O o cadena lateral O de las bacterias. El antígeno O está unido al oligosacárido central y comprende el dominio más externo de la molécula de LPS. La estructura y composición de la cadena O es muy variable de una cepa a otra, lo que determina la especificidad serológica de la cepa bacteriana original; [15] hay más de 160 estructuras de antígeno O diferentes producidas por diferentes cepas de E. coli . [16] La presencia o ausencia de cadenas O determina si el LPS se considera "rugoso" o "liso". Las cadenas O de longitud completa harían que el LPS fuera liso, mientras que la ausencia o reducción de cadenas O haría que el LPS fuera rugoso. [ 17] Las bacterias con LPS rugoso suelen tener membranas celulares más penetrables para los antibióticos hidrófobos, ya que un LPS rugoso es más hidrófobo . [18] El antígeno O está expuesto en la superficie más externa de la célula bacteriana y, como consecuencia, es un objetivo para el reconocimiento por parte de los anticuerpos del huésped .
El dominio central siempre contiene un componente oligosacárido que se une directamente al lípido A y comúnmente contiene azúcares como heptosa y ácido 3-desoxi-D-mano-oct-2-ulosónico (también conocido como KDO, ceto-desoxioctulosonato). [19] El oligosacárido central es menos variable en su estructura y composición, siendo una estructura central dada común a grandes grupos de bacterias. [15] Los núcleos de LPS de muchas bacterias también contienen componentes no carbohidratos, como fosfato, aminoácidos y sustituyentes de etanolamina.
El lípido A es, en circunstancias normales, un disacárido de glucosamina fosforilada decorado con múltiples ácidos grasos . Estas cadenas de ácidos grasos hidrofóbicos anclan el LPS en la membrana bacteriana, y el resto del LPS se proyecta desde la superficie celular. El dominio del lípido A es el más bioactivo y responsable de gran parte de la toxicidad de las bacterias Gram-negativas . Cuando las células bacterianas son lisadas por el sistema inmunológico , fragmentos de membrana que contienen lípido A pueden liberarse en la circulación, causando fiebre, diarrea y posible choque séptico endotóxico fatal (una forma de choque séptico ). La fracción de lípido A es un componente muy conservado del LPS. [20] Sin embargo, la estructura del lípido A varía entre las especies bacterianas. La estructura del lípido A define en gran medida el grado y la naturaleza de la activación inmune general del huésped. [21]
La "forma rugosa" de LPS tiene un peso molecular más bajo debido a la ausencia del polisacárido O. En su lugar hay un oligosacárido corto: esta forma se conoce como lipooligosacárido (LOS), y es un glicolípido que se encuentra en la membrana externa de algunos tipos de bacterias Gram-negativas , como Neisseria spp. y Haemophilus spp. [7] [22] El LOS juega un papel central en el mantenimiento de la integridad y funcionalidad de la membrana externa de la envoltura celular de las Gram negativas . Los LOS juegan un papel importante en la patogénesis de ciertas infecciones bacterianas porque son capaces de actuar como inmunoestimuladores e inmunomoduladores. [7] Además, las moléculas de LOS son responsables de la capacidad de algunas cepas bacterianas para mostrar mimetismo molecular y diversidad antigénica , ayudando en la evasión de las defensas inmunes del huésped y contribuyendo así a la virulencia de estas cepas bacterianas . En el caso de Neisseria meningitidis , la porción de lípido A de la molécula tiene una estructura simétrica y el núcleo interno está compuesto por restos de ácido 3-desoxi-D-mano-2-octulosónico (KDO) y heptosa (Hep). La cadena de oligosacáridos del núcleo externo varía según la cepa bacteriana . [7] [22]
Una enzima hospedadora altamente conservada llamada aciloxiacilo hidrolasa (AOAH) puede desintoxicar el LPS cuando ingresa o se produce en los tejidos animales. También puede convertir el LPS en el intestino en un inhibidor de LPS. Los neutrófilos, macrófagos y células dendríticas producen esta lipasa, que inactiva el LPS eliminando las dos cadenas acilo secundarias del lípido A para producir tetraacilo LPS. Si a los ratones se les administra LPS por vía parenteral, aquellos que carecen de AOAH desarrollan altos títulos de anticuerpos no específicos, desarrollan hepatomegalia prolongada y experimentan una tolerancia prolongada a las endotoxinas. La inactivación del LPS puede ser necesaria para que los animales restablezcan la homeostasis después de la exposición parenteral al LPS. [23] Aunque los ratones tienen muchos otros mecanismos para inhibir la señalización del LPS, ninguno es capaz de prevenir estos cambios en los animales que carecen de AOAH.
La desfosforilación de LPS por la fosfatasa alcalina intestinal puede reducir la gravedad de la infección por Salmonella tryphimurium y Clostridioides difficile , restaurando la microbiota intestinal normal. [24] La fosfatasa alcalina previene la inflamación intestinal (y el " intestino permeable ") causada por bacterias al desfosforilar la porción de lípido A de LPS. [25] [26] [27]
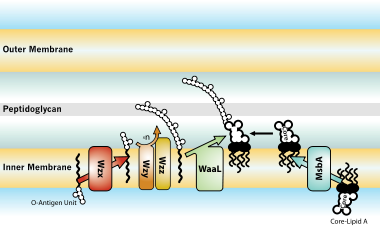

Todo el proceso de fabricación de LPS comienza con una molécula llamada lípido A-Kdo2, que primero se crea en la superficie de la membrana interna de la célula bacteriana. Luego, se añaden azúcares adicionales a esta molécula en la membrana interna antes de que se mueva al espacio entre las membranas interna y externa ( espacio periplásmico ) con la ayuda de una proteína llamada MsbA. El antígeno O, otra parte del LPS, se produce mediante complejos enzimáticos especiales en la membrana interna. Luego se mueve a la membrana externa a través de tres sistemas diferentes: uno depende de Wzy, otro se basa en transportadores ABC y el tercero implica un proceso dependiente de la sintasa. [30]
Finalmente, el LPS es transportado a la membrana externa por un puente de membrana a membrana de proteínas de transporte de lipolisacáridos (Lpt). [29] [31] Este transportador es un objetivo antibiótico potencial. [32] [33]
El cuerpo humano tiene reservas endógenas de LPS. [34] Las superficies epiteliales están colonizadas por una flora microbiana compleja (incluidas las bacterias gramnegativas), que superan en número a las células humanas en un factor de 10 a 1. Las bacterias gramnegativas liberan endotoxinas. Esta interacción huésped-microbio es una relación simbiótica que desempeña un papel fundamental en la homeostasis inmunológica sistémica. Cuando se altera, puede provocar enfermedades como la endotoxemia y el choque séptico endotóxico.
El LPS actúa como la endotoxina prototípica porque se une al complejo receptor CD14 / TLR4 / MD2 en muchos tipos de células, pero especialmente en monocitos , células dendríticas , macrófagos y células B , lo que promueve la secreción de citocinas proinflamatorias , óxido nítrico y eicosanoides . [35] Bruce Beutler recibió una parte del Premio Nobel de Fisiología o Medicina de 2011 por su trabajo que demuestra que TLR4 es el receptor de LPS. [36] [37]
Como parte de la respuesta al estrés celular , el superóxido es una de las principales especies reactivas de oxígeno inducidas por LPS en varios tipos de células que expresan TLR ( receptor tipo Toll ). [38] El LPS también es un pirógeno exógeno (sustancia que induce fiebre). [4]
La función del LPS ha sido objeto de investigación experimental durante varios años debido a su papel en la activación de muchos factores de transcripción . El LPS también produce muchos tipos de mediadores involucrados en el choque séptico . De los mamíferos, los humanos son mucho más sensibles al LPS que otros primates, [39] y también otros animales (por ejemplo, ratones). Una dosis de 1 μg/kg induce un choque en humanos, pero los ratones tolerarán una dosis hasta mil veces mayor. [40] Esto puede estar relacionado con las diferencias en el nivel de anticuerpos naturales circulantes entre las dos especies. [41] [42] También puede estar vinculado a múltiples tácticas inmunes contra patógenos y ser parte de una estrategia antimicrobiana multifacética que ha sido informada por los cambios de comportamiento humano a lo largo de la evolución de nuestra especie (por ejemplo, el consumo de carne, las prácticas agrícolas y el tabaquismo). [39] Said et al. demostró que el LPS causa una inhibición dependiente de IL-10 de la expansión y función de las células T CD4 al regular positivamente los niveles de PD-1 en los monocitos , lo que conduce a la producción de IL-10 por los monocitos después de la unión de PD-1 por PD-L1 . [43]
Las endotoxinas son en gran parte responsables de las dramáticas manifestaciones clínicas de las infecciones con bacterias gramnegativas patógenas, como Neisseria meningitidis , el patógeno que causa la enfermedad meningocócica , incluida la meningococemia , el síndrome de Waterhouse-Friderichsen y la meningitis .
Se ha demostrado que porciones del LPS de varias cepas bacterianas son químicamente similares a las moléculas de la superficie de las células huésped humanas; la capacidad de algunas bacterias para presentar moléculas en su superficie que son químicamente idénticas o similares a las moléculas de la superficie de algunos tipos de células huésped se denomina mimetismo molecular . [44] Por ejemplo, en Neisseria meningitidis L2,3,5,7,9, la porción tetrasacárida terminal del oligosacárido (lacto-N-neotetraosa) es el mismo tetrasacárido que se encuentra en el paraglobósido, un precursor de los antígenos glucolípidos ABH que se encuentran en los eritrocitos humanos . [7] En otro ejemplo, la porción trisacárida terminal (lactotriaosa) del oligosacárido del LOS patógeno de Neisseria spp. también se encuentra en los glucoesfingolípidos de la lactoneoserie de las células humanas. [7] Se ha demostrado que la mayoría de los meningococos de los grupos B y C, así como los gonococos , tienen este trisacárido como parte de su estructura LOS. [7] La presencia de estos "miméticos" de la superficie celular humana puede, además de actuar como un "camuflaje" del sistema inmunológico, desempeñar un papel en la abolición de la tolerancia inmunológica cuando se infectan huéspedes con ciertos genotipos del antígeno leucocitario humano (HLA), como el HLA-B35 . [7]
Las células madre hematopoyéticas (HSC) pueden detectar directamente el LPS mediante la unión con TLR4, lo que hace que proliferen en reacción a una infección sistémica. Esta respuesta activa la señalización TLR4-TRIF-ROS-p38 dentro de las HSC y, a través de una activación sostenida de TLR4, puede causar un estrés proliferativo, lo que lleva a perjudicar su capacidad competitiva de repoblación. [45] La infección en ratones con S. typhimurium mostró resultados similares, lo que validó el modelo experimental también in vivo .

Los antígenos O (los carbohidratos externos) son la porción más variable de la molécula de LPS, lo que les confiere especificidad antigénica. En contraste, el lípido A es la parte más conservada. Sin embargo, la composición del lípido A también puede variar (por ejemplo, en número y naturaleza de las cadenas de acilo incluso dentro de un género o entre géneros). Algunas de estas variaciones pueden conferir propiedades antagónicas a estos LPS. Por ejemplo, el difosforil lípido A de Rhodobacter sphaeroides (RsDPLA) es un potente antagonista del LPS en células humanas, pero es un agonista en células de hámster y equino. [46]
Se ha especulado que el lípido A cónico (por ejemplo, de E. coli ) es más agonista, mientras que el lípido A menos cónico como el de Porphyromonas gingivalis puede activar una señal diferente ( TLR2 en lugar de TLR4), y el lípido A completamente cilíndrico como el de Rhodobacter sphaeroides es antagónico a los TLR. [47] [48] En general, los grupos de genes LPS son muy variables entre diferentes cepas, subespecies y especies de patógenos bacterianos de plantas y animales. [49] [50]
El suero sanguíneo humano normal contiene anticuerpos anti-LOS que son bactericidas y los pacientes que tienen infecciones causadas por cepas serotípicamente distintas poseen anticuerpos anti-LOS que difieren en su especificidad en comparación con el suero normal. [51] Estas diferencias en la respuesta inmune humoral a diferentes tipos de LOS se pueden atribuir a la estructura de la molécula de LOS, principalmente dentro de la estructura de la porción oligosacárida de la molécula de LOS. [51] En Neisseria gonorrhoeae se ha demostrado que la antigenicidad de las moléculas de LOS puede cambiar durante una infección debido a la capacidad de estas bacterias para sintetizar más de un tipo de LOS, [51] una característica conocida como variación de fase . Además, Neisseria gonorrhoeae , así como Neisseria meningitidis y Haemophilus influenzae , [7] son capaces de modificar aún más su LOS in vitro , por ejemplo a través de la sialilación (modificación con residuos de ácido siálico), y como resultado pueden aumentar su resistencia a la muerte mediada por el complemento [51] o incluso regular negativamente la activación del complemento [7] o evadir los efectos de los anticuerpos bactericidas . [7] La sialilación también puede contribuir a obstaculizar la adhesión de los neutrófilos y la fagocitosis por parte de las células del sistema inmunitario, así como a una reducción del estallido oxidativo. [7] También se ha demostrado que Haemophilus somnus , un patógeno del ganado, muestra una variación de la fase LOS, una característica que puede ayudar a evadir las defensas inmunitarias del huésped bovino . [52] En conjunto, estas observaciones sugieren que las variaciones en las moléculas de la superficie bacteriana, como el LOS, pueden ayudar al patógeno a evadir las defensas inmunes del huésped tanto humorales (mediadas por anticuerpos y complemento) como mediadas por células (muerte por neutrófilos, por ejemplo).
Recientemente, se ha demostrado que además de las vías mediadas por TLR4 , ciertos miembros de la familia de canales iónicos de potencial receptor transitorio reconocen LPS. [53] La activación mediada por LPS de TRPA1 se ha demostrado en ratones [54] y moscas Drosophila melanogaster . [55] En concentraciones más altas, LPS activa también a otros miembros de la familia de canales sensoriales TRP , como TRPV1 , TRPM3 y, en cierta medida, TRPM8 . [56] TRPV4 reconoce LPS en células epiteliales. La activación de TRPV4 por LPS fue necesaria y suficiente para inducir la producción de óxido nítrico con un efecto bactericida. [57]
El lipopolisacárido es un factor importante que hace que las bacterias sean dañinas y ayuda a clasificarlas en diferentes grupos según su estructura y función. Esto hace que el LPS sea un marcador útil para distinguir varias bacterias gramnegativas. Identificar y comprender rápidamente los tipos de patógenos involucrados es crucial para controlar y tratar las infecciones de inmediato. Dado que el LPS es el principal desencadenante de la respuesta inmunitaria en nuestras células, actúa como una señal temprana de una infección aguda. Por lo tanto, la prueba de LPS es más específica y significativa que muchas otras pruebas serológicas. [58]
Los métodos actuales para analizar los LPS son bastante sensibles, pero muchos de ellos tienen dificultades para diferenciar entre los distintos grupos de LPS. Además, la naturaleza de los LPS, que tienen propiedades tanto de atracción como de repelencia del agua (anfifílicas), dificulta el desarrollo de pruebas sensibles y fáciles de usar. [58]
Los métodos de detección típicos se basan en la identificación de la parte del lípido A del LPS, ya que el lípido A es muy similar entre las diferentes especies y serotipos bacterianos. Las técnicas de prueba de LPS se dividen en seis categorías y, a menudo, se superponen: pruebas in vivo, pruebas in vitro, inmunoensayos modificados, ensayos biológicos y ensayos químicos. [58]
Debido a que el LPS es muy difícil de medir en sangre completa y debido a que la mayor parte del LPS está unido a proteínas y complemento, el Ensayo de Actividad de Endotoxina (EAA™) fue desarrollado y aprobado por la FDA de EE. UU. en 2003. EAA es una prueba inmunodiagnóstica quimioluminiscente in vitro rápida. Utiliza un anticuerpo monoclonal específico para medir la actividad de la endotoxina en muestras de sangre completa con EDTA. Este ensayo utiliza la respuesta biológica de los neutrófilos en la sangre de un paciente a un complejo inmunológico de endotoxina y anticuerpo exógeno: la reacción quimioluminiscente formada crea una emisión de luz. La cantidad de quimioluminiscencia es proporcional a la concentración logarítmica de LPS en la muestra y es una medida de la actividad de la endotoxina en la sangre. [59] El ensayo reacciona específicamente con la fracción de lípido A del LPS de las bacterias gramnegativas y no reacciona de forma cruzada con los componentes de la pared celular de las bacterias grampositivas y otros microorganismos.
El LPS es una toxina potente que, cuando se encuentra en el cuerpo, desencadena la inflamación al unirse a los receptores celulares. El exceso de LPS en la sangre, la endotoxemia, puede causar una forma altamente letal de sepsis conocida como shock séptico endotóxico. [5] Esta afección incluye síntomas que se enmarcan en un continuo de estados fisiopatológicos, comenzando con un síndrome de respuesta inflamatoria sistémica (SIRS) y terminando en un síndrome de disfunción multiorgánica (MODS) antes de la muerte. Los primeros síntomas incluyen frecuencia cardíaca rápida, respiración rápida, cambios de temperatura y problemas de coagulación sanguínea, lo que resulta en un ensanchamiento de los vasos sanguíneos y una reducción del volumen sanguíneo, lo que conduce a una disfunción celular. [58]
Investigaciones recientes indican que incluso una pequeña exposición a LPS está asociada con enfermedades autoinmunes y alergias. Los niveles elevados de LPS en la sangre pueden provocar síndrome metabólico, lo que aumenta el riesgo de padecer enfermedades como diabetes, enfermedades cardíacas y problemas hepáticos. [58]
El LPS también desempeña un papel crucial en los síntomas causados por infecciones causadas por bacterias dañinas, incluidas enfermedades graves como el síndrome de Waterhouse-Friderichsen, la meningococemia y la meningitis. Ciertas bacterias pueden adaptar su LPS para causar infecciones duraderas en los sistemas respiratorio y digestivo. [58]
Estudios recientes han demostrado que el LPS altera los lípidos de la membrana celular, lo que afecta el colesterol y el metabolismo, lo que puede provocar colesterol alto, niveles anormales de lípidos en sangre y enfermedad del hígado graso no alcohólico. En algunos casos, el LPS puede interferir con la eliminación de toxinas, lo que puede estar relacionado con problemas neurológicos. [58]
En general, los efectos del LPS sobre la salud se deben a su capacidad como potente activador y modulador del sistema inmunitario, especialmente a su capacidad de inducir la inflamación. El LPS es directamente citotóxico y altamente inmunoestimulante: cuando las células inmunitarias del huésped reconocen el LPS, el complemento se activa fuertemente. La activación del complemento y una respuesta antiinflamatoria creciente pueden provocar disfunción de las células inmunitarias, inmunosupresión, coagulopatía generalizada, daño tisular grave y pueden progresar a una insuficiencia orgánica multisistémica y la muerte. [39]
La presencia de endotoxinas en la sangre se denomina endotoxemia. Un nivel elevado de endotoxemia puede provocar un shock séptico [60] o , más específicamente, un shock séptico endotóxico [5] , mientras que una concentración menor de endotoxinas en el torrente sanguíneo se denomina endotoxemia metabólica [61] . La endotoxemia está asociada con la obesidad, la dieta [62] , las enfermedades cardiovasculares [62] y la diabetes [61] , mientras que la genética del huésped también podría tener un efecto [63] .
Además, la endotoxemia de origen intestinal, especialmente en la interfaz huésped-patógeno , se considera un factor importante en el desarrollo de la hepatitis alcohólica, [64] que es probable que se desarrolle sobre la base del síndrome de sobrecrecimiento bacteriano del intestino delgado y una mayor permeabilidad intestinal . [65]
El lípido A puede causar una activación descontrolada de los sistemas inmunes de los mamíferos con la producción de mediadores inflamatorios que pueden conducir a un choque séptico endotóxico . [22] [5] Esta reacción inflamatoria está mediada principalmente por el receptor tipo Toll 4 , que es responsable de la activación de las células del sistema inmunológico. [22] El daño a la capa endotelial de los vasos sanguíneos causado por estos mediadores inflamatorios puede conducir al síndrome de fuga capilar , dilatación de los vasos sanguíneos y una disminución de la función cardíaca y puede empeorar aún más el choque. [66] El LPS también es un potente activador del complemento. [66] La activación descontrolada del complemento puede desencadenar un daño endotelial destructivo que conduce a una coagulación intravascular diseminada (CID) o un síndrome hemolítico urémico atípico (SHUa) con lesiones en varios órganos, como los riñones y los pulmones. [67] La piel puede mostrar los efectos del daño vascular a menudo acompañado de un agotamiento de los factores de coagulación en forma de petequias , púrpura y equimosis . Las extremidades también pueden verse afectadas, a veces con consecuencias devastadoras como el desarrollo de gangrena , que requiere amputación posterior . [66] La pérdida de la función de las glándulas suprarrenales puede causar insuficiencia suprarrenal y hemorragia adicional en las glándulas suprarrenales causa el síndrome de Waterhouse-Friderichsen , ambos pueden ser potencialmente mortales.
También se ha informado que el LOS gonocócico puede causar daños a las trompas de Falopio humanas . [51]
La toraymixina es una terapia de eliminación de endotoxinas extracorpórea ampliamente utilizada a través de la hemoadsorción directa (también conocida como hemoperfusión). Es un cartucho derivado de poliestireno con moléculas de polimixina B (PMX-B) unidas covalentemente a las fibras de malla contenidas en él. Las polimixinas son antibióticos polipeptídicos catiónicos cíclicos derivados de Bacillus polymyxa con una actividad antimicrobiana eficaz contra bacterias gramnegativas, pero su uso clínico intravenoso ha sido limitado debido a sus efectos secundarios de nefrotoxicidad y neurotoxicidad. [68] El uso extracorpóreo del cartucho de toraymixina permite que la PMX-B se una al lípido A con una interacción muy estable con sus residuos hidrofóbicos, neutralizando así las endotoxinas a medida que la sangre se filtra a través del circuito extracorpóreo dentro del cartucho, revirtiendo así la endotoxemia y evitando sus efectos sistémicos tóxicos. [69]
Se cree que el mimetismo molecular de algunas moléculas LOS causa respuestas del huésped basadas en el sistema autoinmune, como los brotes de esclerosis múltiple . [7] [44] Otros ejemplos de mimetismo bacteriano de las estructuras del huésped a través de LOS se encuentran con las bacterias Helicobacter pylori y Campylobacter jejuni , organismos que causan enfermedades gastrointestinales en humanos, y Haemophilus ducreyi que causa chancroide . Ciertos serotipos de LPS de C. jejuni (atribuidos a ciertas fracciones tetra- y pentasacáridas del oligosacárido central) también se han implicado con el síndrome de Guillain-Barré y una variante de Guillain-Barré llamada síndrome de Miller-Fisher . [7]
Los estudios epidemiológicos han demostrado que el aumento de la carga de endotoxinas, que puede ser el resultado de un aumento de las poblaciones de bacterias productoras de endotoxinas en el tracto intestinal, está asociado con ciertos grupos de pacientes relacionados con la obesidad. [8] [70] [71] Otros estudios han demostrado que la endotoxina purificada de Escherichia coli puede inducir obesidad y resistencia a la insulina cuando se inyecta en modelos de ratón libres de gérmenes . [72] Un estudio más reciente ha descubierto un papel potencialmente contribuyente de Enterobacter cloacae B29 hacia la obesidad y la resistencia a la insulina en un paciente humano. [73] El presunto mecanismo para la asociación de la endotoxina con la obesidad es que la endotoxina induce una vía mediada por inflamación que explica la obesidad y la resistencia a la insulina observadas. [72] Los géneros bacterianos asociados con los efectos de la obesidad relacionada con la endotoxina incluyen Escherichia y Enterobacter .
Existen evidencias experimentales y observacionales de que el LPS podría desempeñar un papel en la depresión. La administración de LPS a ratones puede provocar síntomas depresivos y parece que hay niveles elevados de LPS en algunas personas con depresión. La inflamación a veces puede desempeñar un papel en el desarrollo de la depresión y el LPS es proinflamatorio. [9]
La inflamación inducida por LPS puede inducir senescencia celular , como se ha demostrado para las células epiteliales pulmonares y las células microgliales (estas últimas conducen a la neurodegeneración ). [10]
Los lipopolisacáridos son contaminantes frecuentes en el ADN plasmídico preparado a partir de bacterias o proteínas expresadas a partir de bacterias, y deben eliminarse del ADN o la proteína para evitar experimentos contaminantes y evitar la toxicidad de los productos fabricados mediante fermentación industrial . [74]
La ovoalbúmina se contamina frecuentemente con endotoxinas. La ovoalbúmina es una de las proteínas ampliamente estudiadas en modelos animales y también un alérgeno modelo establecido para la hiperreactividad de las vías respiratorias (AHR). La ovoalbúmina disponible comercialmente que está contaminada con LPS puede falsificar los resultados de las investigaciones, ya que no refleja con precisión el efecto del antígeno proteico en la fisiología animal. [75]
En la producción farmacéutica es necesario eliminar todos los rastros de endotoxina de los envases de los medicamentos, ya que incluso pequeñas cantidades de endotoxina pueden causar enfermedades en los seres humanos. Para ello se utiliza un horno de despirogenación . Se requieren temperaturas superiores a los 300 °C para descomponer completamente los LPS. [76]
El ensayo estándar para detectar la presencia de endotoxina es el ensayo de lisado de amebocitos de Limulus (LAL), que utiliza sangre del cangrejo herradura ( Limulus polyphemus ). [77] Niveles muy bajos de LPS pueden causar la coagulación del lisado de Limulus debido a una potente amplificación a través de una cascada enzimática. Sin embargo, debido a la disminución de la población de cangrejos herradura y al hecho de que existen factores que interfieren con el ensayo LAL, se han realizado esfuerzos para desarrollar ensayos alternativos, siendo los más prometedores las pruebas ELISA que utilizan una versión recombinante de una proteína en el ensayo LAL, el factor C. [78]