El pirilio es un catión ( ion positivo ) con fórmula C 5 H 5 O + , que consta de un anillo de seis miembros de cinco átomos de carbono , cada uno con un átomo de hidrógeno y un átomo de oxígeno cargado positivamente . Los enlaces del anillo están conjugados como en el benceno , dándole un carácter aromático . En particular, debido a la carga positiva, el átomo de oxígeno es trivalente . El pirilio es un compuesto monocíclico y heterocíclico, uno de los iones oxonio .
El pirilio y sus derivados forman sales estables con una variedad de aniones. [2] [3] [4] [5] [6] [7]
Muchos cationes importantes se derivan formalmente del pirilio mediante la sustitución de varios grupos funcionales por algunos o todos los hidrógenos del anillo. El 2,4,6-trifenilpirilio, denominado sal de Katritzky (en honor a Alan R. Katritzky ) es un ejemplo importante utilizado en muchos ejemplos modernos de acoplamientos cruzados catalizados por metal . [8]
Como otros iones de oxonio , el pirilio es inestable en agua neutra. Sin embargo, el pirilio es mucho menos reactivo que los iones de oxonio ordinarios debido a la estabilización aromática. La sal de 2,4,6-trifenilo comúnmente reacciona con aminas alifáticas en la posición 1, formando sales de piridinio y activándolas hacia la adición oxidativa mediante complejos metálicos, más notablemente aquellos con níquel . [9] Los cationes de pirilio también reaccionan con nucleófilos en las posiciones 2, 4 y 6, lo que puede inducir una variedad de reacciones. La alta electronegatividad del oxígeno da como resultado una fuerte perturbación única por parte de un heteroátomo en el anillo de seis miembros.
Las sales de pirilio se producen fácilmente a partir de materiales de partida simples mediante una reacción de condensación .
Las sales de pirilio con sustituyentes aromáticos, como el tetrafluoroborato de 2,4,6-trifenilpirilio, se pueden obtener a partir de dos moles de acetofenona y un mol de benzaldehído en presencia de ácido tetrafluorobórico y un agente oxidante (síntesis de Dilthey). Para las sales de pirilio con sustituyentes alquilo, como las sales de 2,4,6-trimetilpirilio, el mejor método utiliza la síntesis de Balaban - Nenitzescu -Praill a partir de butanol terciario y anhídrido acético en presencia de ácidos tetrafluorobórico, perclórico o trifluorometanosulfónico. [10] [11] Las sales de 2,4,6-trifenilpirilio se convierten mediante bases en una 1,5-endiona estable (pseudobase), pero las sales de 2,4,6-trimetilpirilio al tratarlas con hidróxidos alcalinos calientes producen una pseudobase inestable que sufre una condensación intramolecular produciendo 3,5- dimetilfenol . En el óxido de deuterio caliente, las sales de 2,4,6-trimetilpirilio experimentan un intercambio isotópico de hidrógenos de 4-metilo más rápido que el de los grupos 2 y 6-metilo, lo que permite la síntesis de compuestos deuterados regioselectivamente.
La reactividad de las sales de pirilio hacia los nucleófilos las convierte en materiales útiles para producir otros compuestos con carácter aromático más fuerte. Las sales de pirilio producen piridinas con amoníaco , [12] sales de piridinio con aminas primarias, N- óxidos de piridina con hidroxilamina , fosfabencenos con derivados de fosfina , sales de tiopirilio con sulfuro de hidrógeno y derivados de benceno con acetonitrilo o nitrometano .
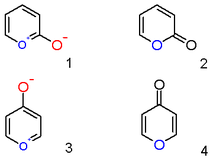
Un catión pirilio con un sustituyente anión hidroxilo en la posición 2 no es el compuesto aromático zwitteriónico ( 1 ), sino la lactona neutra insaturada 2-pirona o piran-2-ona ( 2 ). Representantes importantes de esta clase son las cumarinas . Asimismo, un compuesto de 4-hidroxipirilio es una γ-pirona o piran-4-ona ( 4 ), a cuyo grupo pertenecen compuestos como el maltol .

Se sabe que los 2-pironos reaccionan con alquinos en una reacción de Diels-Alder para formar compuestos areno con expulsión de dióxido de carbono , por ejemplo: [13]
Un ion pirilio bicíclico se llama ion benzopirilio ( IUPAC : ion cromenilo) (fórmula: C 9 H 7 O + , masa molar: 131,15 g/mol, masa exacta: 131,04968983). Puede verse como un derivado cargado de 2 H -1- benzopirano (IUPAC: 2 H -cromeno, C 9 H 8 O ), o un derivado heterocíclico sustituido (cargado) de naftaleno ( C 10 H 8 ).
En biología, el ion 2-fenilbenzopirilio (2-fenilcromenilio) se conoce como flavilio. Una clase de compuestos derivados del flavilio son las antocianidinas y antocianinas , pigmentos responsables de los colores de muchas flores. [ cita necesaria ]
También existen derivados policíclicos superiores del pirilio. Un buen ejemplo es el naftoxantenio. Este tinte es muy estable, aromático y plano. Absorbe en la región UV y azul y presenta propiedades fotofísicas excepcionales. Puede sintetizarse mediante reacciones químicas o fotoquímicas. [14]