Un espermatozoide ( / s p ər ˌ m æ t ə ˈ z oʊ . ən , ˌ s p ɜːr m ə t ə -/ ; [1] también se escribe espermatozoön ; pl. : espermatozoides ; del griego antiguo σπέρμα ( spérma ) 'semilla ', y ζῷον ( zôion ) ' animal ') es un espermatozoide móvil , o forma móvil de la célula haploide que es el gameto masculino . Un espermatozoide se une a un óvulo para formar un cigoto . (Un cigoto es una célula única, con un conjunto completo de cromosomas , que normalmente se desarrolla hasta convertirse en un embrión ).
Los espermatozoides aportan aproximadamente la mitad de la información genética nuclear a la descendencia diploide (excluyendo, en la mayoría de los casos, el ADN mitocondrial ). En los mamíferos, el sexo de la descendencia lo determina el espermatozoide: un espermatozoide con un cromosoma X dará lugar a una descendencia femenina (XX), mientras que uno con un cromosoma Y dará lugar a una descendencia masculina (XY). Los espermatozoides se observaron por primera vez en el laboratorio de Antonie van Leeuwenhoek en 1677. [2]
El espermatozoide humano es la célula reproductiva de los machos y sólo sobrevivirá en ambientes cálidos; Una vez que abandona el cuerpo masculino, la probabilidad de supervivencia del esperma se reduce y puede morir, disminuyendo así la calidad total del esperma . Los espermatozoides son de dos tipos: "femeninos" y "masculinos". Los espermatozoides que dan lugar a descendencia femenina (XX) después de la fertilización se diferencian en que portan un cromosoma X, mientras que los espermatozoides que dan lugar a descendencia masculina (XY) portan un cromosoma Y. [3]
Un espermatozoide humano consta de una cabeza plana en forma de disco de 5,1 µm por 3,1 µm y una cola conocida como flagelo de 50 µm de largo. [4] El flagelo impulsa el espermatozoide (a aproximadamente 1 a 3 mm/minuto en humanos) azotándolo en un cono elíptico. [5] Los espermatozoides tienen un mecanismo de guía olfativa y, después de llegar a las trompas de Falopio , deben pasar por un período de capacitación antes de la penetración del óvulo. [6]
Cabeza: Tiene un núcleo compacto con sustancia cromática únicamente y está rodeado únicamente por un fino borde de citoplasma. Por encima del núcleo se encuentra una estructura en forma de tapa llamada acrosoma , formada por modificación del cuerpo de Golgi, que secreta la enzima esperlisina ( hialuronidasa, enzima que penetra la corona, zona lisina o acrosina ), que es necesaria para la fertilización. A medida que el espermatozoide se acerca al óvulo, sufre la reacción acrosómica en la que la membrana que rodea el acrosoma se fusiona con la membrana plasmática de la cabeza del espermatozoide, exponiendo el contenido del acrosoma. [7]
Cuello: Es la parte más pequeña (.03 µm), y tiene un centríolo proximal paralelo a la base del núcleo y un centríolo distal perpendicular al anterior. El centríolo proximal también está presente en los espermatozoides maduros; el centríolo distal desaparece después del ensamblaje del axonema. El centríolo proximal entra en el óvulo durante la fertilización y comienza la primera división del óvulo, que no tiene centríolo. El centríolo distal da lugar al filamento axial que forma la cola y tiene una disposición (9+2). En la pieza intermedia se encuentra una membrana transitoria llamada Manchette .
Pieza intermedia: tiene de 10 a 14 espirales de mitocondrias que rodean el filamento axial en el citoplasma. Proporciona motilidad y, por lo tanto, se le llama la central eléctrica de los espermatozoides. También tiene un centríolo anular (anillo) que forma una barrera de difusión entre la pieza intermedia y la pieza principal y sirve como estructura estabilizadora para la rigidez de la cola. [8]
Cola: El flagelo es la parte más larga (50 µm), teniendo un filamento axial rodeado por citoplasma y membrana plasmática, pero en el extremo posterior el filamento axial está desnudo. El flagelo da movimiento a la célula.
El semen tiene una naturaleza alcalina y los espermatozoides no alcanzan la motilidad total (hipermotilidad) hasta que llegan a la vagina , donde el pH alcalino es neutralizado por los fluidos vaginales ácidos. Este proceso gradual dura entre 20 y 30 minutos. Durante este período, el fibrinógeno de las vesículas seminales forma un coágulo que asegura y protege los espermatozoides. Justo cuando se vuelven hipermotiles, la fibrinolisina de la próstata disuelve el coágulo, permitiendo que los espermatozoides progresen de manera óptima.
El espermatozoide se caracteriza por tener un mínimo de citoplasma y el ADN más denso conocido en eucariotas . En comparación con los cromosomas mitóticos de las células somáticas , el ADN del esperma está al menos seis veces más condensado. [9]
La muestra aporta ADN / cromatina , un centríolo y quizás también un factor activador de ovocitos (OAF). [10] También puede contribuir con el ARN mensajero paterno (ARNm), contribuyendo también al desarrollo embrionario. [10]
El espermatozoide humano contiene al menos 7.500 proteínas diferentes . [11]
La genética del esperma humano se ha asociado con la evolución humana , según un estudio de 2020. [12] [13] [14]
Los daños en el ADN presentes en los espermatozoides en el período posterior a la meiosis pero antes de la fertilización pueden repararse en el óvulo fertilizado, pero si no se reparan, pueden tener graves efectos nocivos sobre la fertilidad y el embrión en desarrollo. Los espermatozoides humanos son particularmente vulnerables al ataque de los radicales libres y a la generación de daño oxidativo en el ADN. [15] [16] (ver, por ejemplo, 8-Oxo-2'-desoxiguanosina )
La exposición de los hombres a ciertos estilos de vida, riesgos ambientales u ocupacionales puede aumentar el riesgo de espermatozoides aneuploides . [17] En particular, el riesgo de aneuploidía aumenta con el tabaquismo, [18] [19] y la exposición ocupacional al benceno, [20] insecticidas, [21] [22] y compuestos perfluorados. [23] El aumento de la aneuploidía de los espermatozoides a menudo ocurre en asociación con un mayor daño al ADN. La fragmentación del ADN y el aumento de la susceptibilidad in situ del ADN a la desnaturalización, características similares a las observadas durante la apoptosis de las células somáticas, caracterizan a los espermatozoides anormales en los casos de infertilidad masculina . [24] [25]
Las moléculas de glicoproteína en la superficie de los espermatozoides eyaculados son reconocidas por todos los sistemas inmunológicos femeninos humanos y se interpretan como una señal de que la célula no debe ser rechazada. De lo contrario, el sistema inmunológico femenino podría atacar a los espermatozoides en el tracto reproductivo . Las glicoproteínas específicas que recubren los espermatozoides también son utilizadas por algunas células cancerosas y bacterianas, algunos gusanos parásitos y glóbulos blancos infectados por el VIH, evitando así una respuesta inmune del organismo huésped . [26]
La barrera hematotesticular , mantenida por las uniones estrechas entre las células de Sertoli de los túbulos seminíferos, impide la comunicación entre los espermatozoides en formación en los testículos y los vasos sanguíneos (y las células inmunes que circulan dentro de ellos) dentro del espacio intersticial . Esto les impide provocar una respuesta inmune. La barrera hematotesticular también es importante para evitar que sustancias tóxicas alteren la espermatogénesis. [ cita necesaria ]

La fertilización depende de los espermatozoides en la mayoría de los animales sexualmente reproductivos.
Algunas especies de moscas de la fruta producen el espermatozoide más grande conocido que se encuentra en la naturaleza. [27] [28] Drosophila melanogaster produce espermatozoides que pueden medir hasta 1,8 mm, [29] mientras que su pariente Drosophila bifurca produce el espermatozoide más grande conocido, que mide más de 58 mm de longitud. [27] En Drosophila melanogaster, todo el espermatozoide, incluida la cola, se incorpora al citoplasma del ovocito ; sin embargo, en Drosophila bifurca solo una pequeña porción de la cola ingresa al ovocito. [30]
El ratón de campo Apodemus sylvaticus posee espermatozoides con morfología falciforme. Otra característica que hace únicos a estos gametocitos es la presencia de un gancho apical en la cabeza del espermatozoide. Este gancho se utiliza para fijarse a los ganchos o a los flagelos de otros espermatozoides. La agregación es causada por estos accesorios y el resultado son trenes móviles. Estos trenes proporcionan una mejor motilidad en el tracto reproductivo femenino y son un medio por el cual se promueve la fertilización. [31]
La fase posmeiótica de la espermatogénesis del ratón es muy sensible a los agentes genotóxicos ambientales , porque a medida que las células germinales masculinas forman espermatozoides maduros, pierden progresivamente la capacidad de reparar el daño del ADN. [32] La irradiación de ratones macho durante la espermatogénesis tardía puede inducir daños que persisten durante al menos 7 días en los espermatozoides fertilizadores, y la interrupción de las vías de reparación de roturas de doble hebra del ADN materno aumenta las aberraciones cromosómicas derivadas de los espermatozoides. [33] El tratamiento de ratones macho con melfalán , un agente alquilante bifuncional frecuentemente empleado en quimioterapia, induce lesiones en el ADN durante la meiosis que pueden persistir en un estado no reparado a medida que las células germinales progresan a través de fases de desarrollo espermatogénico competentes para la reparación del ADN. [34] Estos daños no reparados en el ADN de los espermatozoides, después de la fertilización, pueden dar lugar a descendencia con diversas anomalías.
Los erizos de mar como Arbacia punctulata son organismos ideales para utilizar en la investigación de esperma, ya que generan grandes cantidades de esperma en el mar, lo que los hace muy adecuados como organismos modelo para experimentos. [35]
Los espermatozoides de los marsupiales suelen ser más largos que los de los mamíferos placentarios . [36]
Los gametofitos de las briofitas , los helechos y algunas gimnospermas producen espermatozoides móviles , a diferencia de los granos de polen empleados en la mayoría de las gimnospermas y en todas las angiospermas . Esto hace que la reproducción sexual en ausencia de agua sea imposible, ya que el agua es un medio necesario para que el espermatozoide y el óvulo se encuentren. Las algas y los espermatozoides de las plantas inferiores suelen ser multiflagelados (ver imagen) y, por tanto, morfológicamente diferentes de los espermatozoides animales. [ cita necesaria ]
Algunas algas y hongos producen espermatozoides inmóviles, llamados espermatozoides. En las plantas superiores y en algunas algas y hongos, la fertilización implica la migración del núcleo del espermatozoide a través de un tubo de fertilización (por ejemplo, el tubo polínico en las plantas superiores) para llegar al óvulo. [ cita necesaria ]
Los espermatozoides se producen en los túbulos seminíferos de los testículos en un proceso llamado espermatogénesis . Las células redondas llamadas espermatogonias se dividen y diferencian con el tiempo para convertirse en espermatozoides. Durante la cópula , la cloaca o vagina se insemina y luego los espermatozoides se desplazan mediante quimiotaxis hasta el óvulo dentro de un oviducto .
En tecnología de reproducción asistida , la normozoospermia se refiere a una cantidad total de >39 millones de eyaculados , >32% con motilidad progresiva y >4% de morfología normal. Asimismo, una eyaculación normal en humanos debe tener un volumen superior a 1,5 ml, siendo un volumen excesivo de 6 ml por eyaculación ( hiperespermia ). Un volumen insuficiente se llama hipospermia . Estos problemas están relacionados con varias complicaciones en la producción de espermatozoides, por ejemplo:
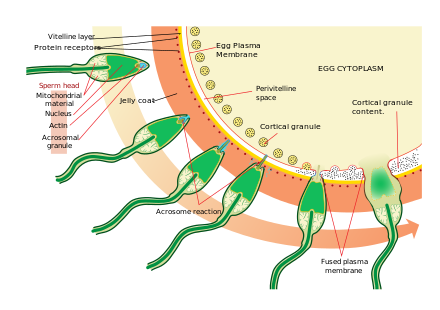
Acercarse al óvulo es un proceso bastante complejo de quimiotaxis de varios pasos guiado por diferentes sustancias/estímulos químicos en niveles individuales de filogenia. Uno de los signos de señalización más significativos y comunes del evento es que se ha demostrado en membrana superficial incluso en el caso de los espermatozoides humanos. [37] Los espermatozoides de los mamíferos se vuelven aún más activos cuando se acercan a un óvulo en un proceso llamado activación de los espermatozoides . Se ha demostrado que la activación de los espermatozoides es causada por ionóforos de calcio in vitro , progesterona liberada por las células del cúmulo cercanas y unión a ZP3 de la zona pelúcida . Las células del cúmulo están incrustadas en una sustancia similar a un gel hecha principalmente de ácido hialurónico y se desarrollan en el ovario con el óvulo y lo sostienen a medida que crece.
El cambio inicial se llama "hiperactivación", que provoca un cambio en la motilidad de los espermatozoides. Nadan más rápido y los movimientos de su cola se vuelven más contundentes y erráticos.
Un descubrimiento reciente vincula la hiperactivación con una entrada repentina de iones de calcio en las colas. La cola en forma de látigo (flagelo) del espermatozoide está repleta de canales iónicos formados por proteínas llamadas CatSper . Estos canales son selectivos y solo permiten el paso de iones de calcio. La apertura de los canales CatSper es responsable del ingreso de calcio. El aumento repentino de los niveles de calcio hace que el flagelo forme curvas más profundas, impulsando a los espermatozoides con más fuerza a través del ambiente viscoso. La hiperactividad de los espermatozoides es necesaria para romper dos barreras físicas que protegen al óvulo de la fertilización.
El segundo proceso en la activación de los espermatozoides es la reacción acrosómica . Esto implica la liberación del contenido del acrosoma, que se dispersa, y la exposición de las enzimas adheridas a la membrana acrosómica interna del espermatozoide. Esto ocurre después de que el espermatozoide se encuentra por primera vez con el óvulo. Este mecanismo de tipo cerradura y llave es específico de cada especie e impide que los espermatozoides y los óvulos de diferentes especies se fusionen. Existe cierta evidencia de que esta unión es lo que hace que el acrosoma libere las enzimas que permiten que el espermatozoide se fusione con el óvulo.
ZP3, una de las proteínas que forman la zona pelúcida, luego se une a una molécula asociada en el espermatozoide. Las enzimas de la membrana acrosómica interna digieren la zona pelúcida. Después de que el espermatozoide penetra la zona pelúcida, parte de la membrana celular del espermatozoide se fusiona con la membrana del óvulo y el contenido de la cabeza se difunde hacia el óvulo.
Tras la penetración, se dice que el ovocito se ha activado . Sufre su división meiótica secundaria y los dos núcleos haploides (paterno y materno) se fusionan para formar un cigoto . Para prevenir la polispermia y minimizar la posibilidad de producir un cigoto triploide , varios cambios en la zona pelúcida del óvulo los vuelven impenetrables poco después de que el primer espermatozoide ingresa al óvulo.
Los espermatozoides se pueden almacenar en diluyentes como el diluyente de temperatura variable Illini (IVT), que se ha informado que puede preservar la alta fertilidad de los espermatozoides durante más de siete días. [38] El diluyente IVT está compuesto de varias sales, azúcares y agentes antibacterianos y gaseado con CO 2 . [38]
La criopreservación de semen se puede utilizar durante períodos de almacenamiento mucho más prolongados. Para los espermatozoides humanos, el almacenamiento exitoso más prolongado con este método es de 21 años. [39]
La capacitación es la fase final del desarrollo de los espermatozoides, cuando estos adquieren la capacidad de fecundar el ovocito. In vivo, ocurre durante la eyaculación, cuando los espermatozoides salen de la vagina y llegan al tracto reproductor femenino superior. In vitro, ocurre cuando los espermatozoides son lavados y purificados. Casi el 30-40% de la infertilidad se debe al factor masculino, por lo que se han creado varias estrategias con el fin de recuperar los espermatozoides funcionales. La medida MMP (millones de células móviles progresivas por mililitro) es sinónimo de capacitación , y es un parámetro muy útil para decidir, junto con un espermiograma , el tipo de tratamiento necesario. representa la relación entre el % de espermatozoides con movilidad progresiva obtenidos en capacitados y el % de espermatozoides con movilidad progresiva obtenidos en eyaculados. Se basa en el porcentaje de recuperación. Dependiendo del porcentaje decidiremos la calidad de la recuperación de los espermatozoides móviles: 15 a 25 millones de espermatozoides/ml se considera óptimo, entre 5 y 15 millones se considera suficiente y menos de 5 millones se considera subóptimo o insuficiente. Respecto a los valores que hemos obtenido, junto con los resultados del espermiograma se mostrarán diferentes técnicas.
Por ejemplo, si se encuentran más de 1,0×10 6 espermatozoides móviles progresivos por mililitro, se recomendará tener relaciones sexuales, y si eso falla, el siguiente paso será la inseminación intrauterina y posteriormente la fecundación in vitro convencional .
Con menos de 1,0×10 6 espermatozoides móviles progresivos por mililitro, realizaremos una inyección intracitoplasmática de espermatozoides . En caso de azoospermia (ausencia de espermatozoides en el eyaculado), realizaremos una biopsia testicular para comprobar si hay espermatozoides en los testículos o si no se están produciendo espermatozoides.