El embarazo ectópico es una complicación del embarazo en la que el embrión se adhiere fuera del útero . [5] Los signos y síntomas clásicamente incluyen dolor abdominal y sangrado vaginal , pero menos del 50 por ciento de las mujeres afectadas tienen ambos síntomas. [1] El dolor puede describirse como agudo, sordo o tipo calambre. [1] El dolor también puede extenderse al hombro si se ha producido sangrado en el abdomen. [1] El sangrado intenso puede provocar un ritmo cardíaco rápido , desmayos o shock . [5] [1] Con muy raras excepciones, el feto no puede sobrevivir. [6]
En general, los embarazos ectópicos afectan anualmente a menos del 2% de los embarazos en todo el mundo. [5] Los factores de riesgo para el embarazo ectópico incluyen enfermedad inflamatoria pélvica , a menudo debido a una infección por clamidia ; fumar tabaco ; endometriosis ; cirugía tubárica previa; una historia de infertilidad ; y el uso de tecnología de reproducción asistida . [2] Quienes han tenido previamente un embarazo ectópico tienen un riesgo mucho mayor de tener otro. [2] La mayoría de los embarazos ectópicos (90%) ocurren en las trompas de Falopio , que se conocen como embarazos tubáricos, [2] pero la implantación también puede ocurrir en el cuello uterino , los ovarios , la cicatriz de la cesárea o dentro del abdomen . [1] La detección del embarazo ectópico generalmente se realiza mediante análisis de sangre para detectar gonadotropina coriónica humana (hCG) y ultrasonido . [1] Esto puede requerir pruebas en más de una ocasión. [1] Otras causas de síntomas similares incluyen: aborto espontáneo , torsión ovárica y apendicitis aguda . [1]
La prevención consiste en disminuir los factores de riesgo, como las infecciones por clamidia, mediante pruebas de detección y tratamiento. [7] Si bien algunos embarazos ectópicos abortan sin tratamiento, [2] el tratamiento estándar para el embarazo ectópico es un procedimiento para extraer el embrión de las trompas de Falopio o extirpar todas las trompas de Falopio. El uso del medicamento metotrexato funciona tan bien como la cirugía en algunos casos. [2] Específicamente funciona bien cuando la beta-HCG es baja y el tamaño del ectópico es pequeño. [2] Por lo general, todavía se recomienda una cirugía como la salpingectomía si la trompa se ha roto, hay latidos del corazón fetal o los signos vitales de la mujer son inestables. [2] La cirugía puede ser laparoscópica o mediante una incisión más grande, conocida como laparotomía . [5] La morbilidad y mortalidad maternas se reducen con tratamiento. [2]
La tasa de embarazo ectópico es de aproximadamente 11 a 20 por cada 1.000 nacidos vivos en los países desarrollados, aunque puede llegar al 4% entre quienes utilizan tecnología de reproducción asistida . [5] Es la causa más común de muerte entre las mujeres durante el primer trimestre, aproximadamente entre el 6 y el 13% del total. [2] En el mundo desarrollado los resultados han mejorado, mientras que en el mundo en desarrollo a menudo siguen siendo pobres. [7] El riesgo de muerte entre los habitantes del mundo desarrollado está entre el 0,1 y el 0,3 por ciento, mientras que en el mundo en desarrollo es entre el uno y el tres por ciento. [4] La primera descripción conocida de un embarazo ectópico es la de Al-Zahrawi en el siglo XI. [7] La palabra "ectópico" significa "fuera de lugar". [8]
Hasta el 10% de las personas con embarazo ectópico no presentan síntomas y un tercio no presenta signos médicos . [5] En muchos casos los síntomas tienen baja especificidad , y pueden ser similares a los de otros trastornos genitourinarios y gastrointestinales , como apendicitis , salpingitis , rotura de un quiste del cuerpo lúteo , aborto espontáneo, torsión ovárica o infección del tracto urinario . [5] La presentación clínica del embarazo ectópico ocurre en un promedio de 7,2 semanas después del último período menstrual normal, con un rango de cuatro a ocho semanas. Las presentaciones tardías son más comunes en comunidades privadas de la capacidad de diagnóstico moderna.
Los signos y síntomas del embarazo ectópico incluyen aumento de hCG, sangrado vaginal (en cantidades variables), dolor repentino en la parte inferior del abdomen, [5] dolor pélvico, dolor en el cuello uterino, una masa anexial o sensibilidad en los anexos. [1] En ausencia de una ecografía o una evaluación de hCG , el sangrado vaginal abundante puede llevar a un diagnóstico erróneo de aborto espontáneo. [5] Las náuseas , los vómitos y la diarrea son síntomas más raros del embarazo ectópico. [5]
La ruptura de un embarazo ectópico puede provocar síntomas como distensión abdominal , sensibilidad , peritonismo y shock hipovolémico . [5] Alguien con un embarazo ectópico roto puede experimentar dolor al acostarse y puede preferir mantener una postura erguida, ya que el flujo sanguíneo intrapélvico puede provocar hinchazón de la cavidad abdominal y causar dolor adicional. [9]
La complicación más común es la rotura con hemorragia interna que puede provocar un shock hipovolémico. El daño a las trompas de Falopio puede provocar dificultades para quedar embarazada en el futuro. La otra trompa de Falopio de la mujer puede funcionar lo suficiente para el embarazo. Después de la extirpación de una trompa de Falopio dañada, el embarazo sigue siendo posible en el futuro. Si se eliminan ambos, la fertilización in vitro sigue siendo una opción para las mujeres que esperan quedar embarazadas. [10] [11] [12]
Hay una serie de factores de riesgo para los embarazos ectópicos. Sin embargo, en entre un tercio [13] y la mitad [14] no se pueden identificar factores de riesgo. Los factores de riesgo incluyen: enfermedad inflamatoria pélvica , infertilidad, uso de un dispositivo intrauterino (DIU), exposición previa al dietilestilbestrol (DES), cirugía de trompas, cirugía intrauterina (por ejemplo, D&C ), tabaquismo , embarazo ectópico previo, endometriosis y ligadura de trompas . [15] [16] Un aborto inducido previo no parece aumentar el riesgo. [17] El DIU no aumenta el riesgo de embarazo ectópico, pero con un DIU, si se produce un embarazo, es más probable que sea ectópico que intrauterino. [18] El riesgo de embarazo ectópico después de una infección por clamidia es bajo. [19] El mecanismo exacto a través del cual la clamidia aumenta el riesgo de embarazo ectópico es incierto, aunque algunas investigaciones sugieren que la infección puede afectar la estructura de las trompas de Falopio. [20]

El embarazo tubárico es cuando el óvulo se implanta en las trompas de Falopio. Los cilios parecidos a pelos ubicados en la superficie interna de las trompas de Falopio transportan el óvulo fertilizado al útero. Los cilios de Falopio a veces se observan en cantidades reducidas después de un embarazo ectópico, lo que lleva a la hipótesis de que el daño de los cilios en las trompas de Falopio probablemente conduzca a un embarazo ectópico. [23] Las mujeres que fuman tienen una mayor probabilidad de tener un embarazo ectópico en las trompas de Falopio. Fumar conduce a factores de riesgo de dañar y destruir los cilios. [23] A medida que los cilios se degeneran, aumentará la cantidad de tiempo que tarda el óvulo fertilizado en llegar al útero. El óvulo fecundado, si no llega a tiempo al útero, eclosionará de la zona pelúcida no adhesiva y se implantará en el interior de la trompa de Falopio, provocando así el embarazo ectópico.
Las mujeres con enfermedad inflamatoria pélvica (EPI) tienen una alta incidencia de embarazos ectópicos. [24] Esto se debe a la acumulación de tejido cicatricial en las trompas de Falopio, lo que daña los cilios. [25] Sin embargo, si ambas trompas estuvieran completamente bloqueadas, de modo que el espermatozoide y el óvulo fueran físicamente incapaces de encontrarse, entonces la fertilización del óvulo sería naturalmente imposible y no se podría producir ni un embarazo normal ni un embarazo ectópico. Las adherencias intrauterinas (AIU) presentes en el síndrome de Asherman pueden causar un embarazo cervical ectópico o, si las adherencias bloquean parcialmente el acceso a las trompas a través de los ostia , un embarazo tubárico ectópico. [26] [27] [28] El síndrome de Asherman generalmente ocurre debido a una cirugía intrauterina, más comúnmente después de una dilatación y legrado . [26] La tuberculosis endometrial/pélvica/genital , otra causa del síndrome de Asherman, también puede provocar un embarazo ectópico, ya que la infección puede provocar adherencias tubáricas además de adherencias intrauterinas. [29]
La ligadura de trompas puede predisponer al embarazo ectópico. La reversión de la esterilización tubárica ( reversión tubárica ) conlleva un riesgo de embarazo ectópico. Esto es mayor si se han utilizado métodos de ligadura de trompas más destructivos (cauterio de trompas, extirpación parcial de las trompas) que métodos menos destructivos (clipado de trompas). Un antecedente de embarazo tubárico aumenta el riesgo de que ocurra en el futuro hasta aproximadamente un 10%. [25] Este riesgo no se reduce al extraer el tubo afectado, incluso si el otro tubo parece normal. El mejor método para diagnosticarlo es realizar una ecografía temprana.
La endometriosis es una enfermedad en la que células similares a las del endometrio , el tejido que recubre el interior del útero, crecen fuera del útero. Un embrión adherido a tales lesiones conduce a un embarazo ectópico. En el congreso anual de 2015 de la Sociedad Europea de Reproducción Humana y Embriología (ESHRE) se presentaron los resultados de un estudio de 30 años sobre resultados reproductivos y del embarazo, en el que participaron más de 14.000 mujeres en edad fértil. [22] El 39% del grupo de estudio tenía endometriosis confirmada quirúrgicamente. En comparación con sus pares, el subgrupo de endometriosis tenía un riesgo 76% mayor de aborto espontáneo y un riesgo 270% mayor de embarazo ectópico. Los mayores riesgos de endometriosis se atribuyeron al aumento de la inflamación pélvica y a los cambios estructurales y funcionales en el revestimiento del útero.
Aunque algunas investigaciones han demostrado que las pacientes pueden tener un mayor riesgo de embarazo ectópico a medida que avanza la edad, se cree que la edad es una variable que podría actuar como sustituto de otros factores de riesgo. Algunos creen que las duchas vaginales aumentan los embarazos ectópicos. [25] Las mujeres expuestas al DES en el útero (también conocidas como "hijas del DES") también tienen un riesgo elevado de embarazo ectópico. [30] Sin embargo, el DES no se ha utilizado desde 1971 en los Estados Unidos. [30] También se ha sugerido que la generación patológica de óxido nítrico a través del aumento de la producción de iNOS puede disminuir los latidos ciliares tubáricos y las contracciones del músculo liso y, por lo tanto, afectar el transporte de embriones, lo que en consecuencia puede resultar en un embarazo ectópico. [31] El bajo nivel socioeconómico puede ser un factor de riesgo para el embarazo ectópico. [32]
Un embarazo ectópico debe considerarse como la causa de dolor abdominal o sangrado vaginal en toda persona que tenga una prueba de embarazo positiva . [1] El objetivo principal de los procedimientos de diagnóstico en un posible embarazo ectópico es clasificar según el riesgo en lugar de establecer la ubicación del embarazo. [5]
Una ecografía que muestra un saco gestacional con corazón fetal en la trompa de Falopio tiene una especificidad muy alta de embarazo ectópico. Se trata de un transductor largo y delgado, cubierto con un gel conductor y una funda de plástico/látex y que se inserta en la vagina. [33] La ecografía transvaginal tiene una sensibilidad de al menos el 90% para el embarazo ectópico. [5] El hallazgo ecográfico diagnóstico en el embarazo ectópico es una masa anexial que se mueve por separado del ovario. En alrededor del 60% de los casos, se trata de una masa anexial no homogénea o no quística, a veces conocida como "signo de la mancha". Generalmente es esférico, pero se puede observar una apariencia más tubular en caso de hematosalpinx . Se ha estimado que este signo tiene una sensibilidad del 84% y una especificidad del 99% en el diagnóstico de embarazo ectópico. [5] En el estudio que estimó estos valores, el signo de la mancha tuvo un valor predictivo positivo del 96% y un valor predictivo negativo del 95%. [5] La visualización de un saco gestacional extrauterino vacío a veces se conoce como "signo del bagel" y está presente en alrededor del 20% de los casos. [5] En otro 20% de los casos, se visualiza un saco gestacional que contiene un saco vitelino o un embrión. [5] Los embarazos ectópicos en los que hay visualización de la actividad cardíaca a veces se denominan "ectópicos viables". [5]

La combinación de una prueba de embarazo positiva y la presencia de lo que parece ser un embarazo intrauterino normal no excluye un embarazo ectópico, ya que puede haber un embarazo heterotópico o un "pseudosaco ", que es una colección dentro de la cavidad endometrial que se puede observar hasta en el 20% de las mujeres. [5]
Una pequeña cantidad de líquido libre de anecogénesis en la bolsa rectouterina se encuentra comúnmente tanto en embarazos intrauterinos como en embarazos ectópicos. [5] La presencia de líquido ecogénico se estima entre el 28 y el 56% de las mujeres con un embarazo ectópico, e indica fuertemente la presencia de hemoperitoneo . [5] Sin embargo, no necesariamente es el resultado de una ruptura tubárica, sino que comúnmente es el resultado de una fuga desde la abertura tubárica distal . [5] Como regla general, el hallazgo de líquido libre es significativo si llega al fondo de ojo o está presente en la bolsa vesicouterina . [5] Otro marcador de hemorragia intraabdominal grave es la presencia de líquido en el receso hepatorrenal del espacio subhepático . [5]
Actualmente, no se considera que la ecografía Doppler contribuya significativamente al diagnóstico de embarazo ectópico. [5]
Un diagnóstico erróneo común es el de un embarazo intrauterino normal cuando el embarazo se implanta lateralmente en un útero arqueado , lo que potencialmente puede diagnosticarse erróneamente como un embarazo intersticial . [5]

Cuando no se observa embarazo intrauterino (IUP) en la ecografía, la medición de los niveles de β-gonadotropina coriónica humana (β-hCG) puede ayudar en el diagnóstico. La razón es que un nivel bajo de β-hCG puede indicar que el embarazo es intrauterino pero aún demasiado pequeño para ser visible en una ecografía. Mientras que algunos médicos consideran que el umbral en el que un embarazo intrauterino debería ser visible en una ecografía transvaginal es de alrededor de 1500 mUI/mL de β-hCG, una revisión de la serie de exámenes clínicos racionales de JAMA mostró que no existe un umbral único para la concentración de β-coriónico humano. gonadotropina que confirma un embarazo ectópico. En cambio, la mejor prueba en una mujer embarazada es una ecografía transvaginal de alta resolución. [1] La presencia de una masa anexial en ausencia de un embarazo intrauterino en la ecografía transvaginal aumenta 100 veces la probabilidad de un embarazo ectópico (LR+ 111). Cuando no hay anomalías anexiales en la ecografía transvaginal, la probabilidad de un embarazo ectópico disminuye (LR-0,12). Un útero vacío con niveles superiores a 1500 mUI/mL puede ser evidencia de un embarazo ectópico, pero también puede ser consistente con un embarazo intrauterino que simplemente es demasiado pequeño para ser visto en una ecografía. Si el diagnóstico es incierto, puede ser necesario esperar unos días y repetir el análisis de sangre. Esto se puede hacer midiendo el nivel de β-hCG aproximadamente 48 horas después y repitiendo la ecografía. Los índices de hCG sérica y los modelos de regresión logística parecen ser mejores que el nivel absoluto de hCG sérica única. [35] Si la β-hCG cae al repetir el examen, esto sugiere fuertemente un aborto espontáneo o ruptura. La caída de la hCG sérica durante 48 horas se puede medir como el índice de hCG, que se calcula como: [5]
Una proporción de hCG de 0,87, es decir, una disminución de hCG del 13 % en 48 horas, tiene una sensibilidad del 93 % y una especificidad del 97 % para predecir un embarazo fallido de ubicación desconocida (PUL). [5] La mayoría de los casos de embarazo ectópico tendrán niveles séricos seriados de hCG que aumentan más lentamente de lo que se esperaría con una IUP (es decir, un aumento subóptimo ), o disminuyen más lentamente de lo que se esperaría con una PUL fallida. Sin embargo, hasta el 20% de los casos de embarazo ectópico tienen tiempos de duplicación de la hCG sérica similares a los de una IUP, y alrededor del 10% de los casos de EP tienen patrones de hCG similares a los de una PUL fallida. [5]
También se puede realizar una laparoscopia o laparotomía para confirmar visualmente un embarazo ectópico. Esto generalmente se reserva para mujeres que presentan signos de abdomen agudo y shock hipovolémico . [5] A menudo, si se ha producido un aborto tubárico o una rotura de trompas, es difícil encontrar el tejido del embarazo. Una laparoscopia en un embarazo ectópico muy temprano rara vez muestra una trompa de Falopio de apariencia normal.
La culdocentesis , en la que se extrae líquido del espacio que separa la vagina y el recto, es una prueba que se realiza con menos frecuencia y que puede usarse para buscar hemorragia interna. En esta prueba, se inserta una aguja en el espacio en la parte superior de la vagina, detrás del útero y delante del recto. Cualquier sangre o líquido encontrado puede provenir de una ruptura de un embarazo ectópico. [ cita necesaria ]
Los niveles de progesterona inferiores a 20 nmol/L tienen un alto valor predictivo de embarazos fallidos, mientras que los niveles superiores a 25 nmol/L probablemente predicen embarazos viables, y los niveles superiores a 60 nmol/L lo son considerablemente. Esto puede ayudar a identificar PUL fallidos que tienen un riesgo bajo y, por lo tanto, necesitan menos seguimiento. [5] La inhibina A también puede ser útil para predecir la resolución espontánea de PUL, pero no es tan buena como la progesterona para este propósito. [5]
Existen varios modelos matemáticos, como los modelos de regresión logística y las redes bayesianas, para la predicción del resultado PUL en función de múltiples parámetros. [5] Los modelos matemáticos también tienen como objetivo identificar PUL que son de bajo riesgo , es decir, PUL y IUP que fallan. [5]
La dilatación y legrado (D&C) a veces se utiliza para diagnosticar la ubicación del embarazo con el objetivo de diferenciar entre un PE y un IUP no viable en situaciones en las que se puede descartar un IUP viable. Las indicaciones específicas para este procedimiento incluyen cualquiera de las siguientes: [5]
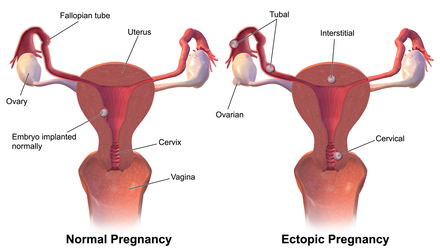
La gran mayoría de los embarazos ectópicos se implantan en la trompa de Falopio. Los embarazos pueden crecer en el extremo fimbrial (5% de todos los embarazos ectópicos), la sección ampular (80%), el istmo (12%) y la parte cornual e intersticial de la trompa (2%). [25] La mortalidad de un embarazo tubárico en el istmo o dentro del útero (embarazo intersticial) es mayor ya que hay un aumento de la vascularización que puede resultar más probable en una hemorragia interna importante y repentina. Una revisión publicada en 2010 respalda la hipótesis de que el embarazo ectópico tubárico es causado por una combinación de retención del embrión dentro de las trompas de Falopio debido a un transporte embrionario-tubárico deteriorado y alteraciones en el entorno tubárico que permiten que se produzca una implantación temprana. [36]
El dos por ciento de los embarazos ectópicos ocurren en el ovario, el cuello uterino o son intraabdominales. La ecografía transvaginal suele ser capaz de detectar un embarazo cervical . Un embarazo ovárico se diferencia de un embarazo tubárico mediante los criterios de Spiegelberg . [37]
Si bien un feto de un embarazo ectópico generalmente no es viable, en muy raras ocasiones un bebé vivo ha nacido de un embarazo abdominal . En tal situación, la placenta se asienta sobre los órganos intraabdominales o el peritoneo y ha encontrado suficiente suministro de sangre. Generalmente es el intestino o el mesenterio, pero se han descrito otros sitios, como la arteria renal (riñón), el hígado o la arteria hepática (hígado) o incluso la aorta. Ocasionalmente se ha descrito un apoyo a la casi viabilidad, pero incluso en los países del Tercer Mundo , el diagnóstico se realiza más comúnmente entre las 16 y 20 semanas de gestación. Un feto así tendría que nacer mediante laparotomía. La morbilidad y mortalidad maternas por embarazos extrauterinos son elevadas, ya que los intentos de extraer la placenta de los órganos a los que está unida suelen provocar una hemorragia incontrolable en el lugar de unión. Si el órgano al que está adherida la placenta es removible, como una sección de intestino, entonces la placenta debe extraerse junto con ese órgano. Esto es algo tan raro que no se dispone de datos verdaderos y se debe confiar en informes anecdóticos. [38] [39] [40] Sin embargo, la gran mayoría de los embarazos abdominales requieren una intervención mucho antes de la viabilidad fetal debido al riesgo de hemorragia.
Con el aumento de cesáreas realizadas en todo el mundo, [41] [42] los embarazos ectópicos por cesárea (CSP) son raros, pero se están volviendo más comunes. La incidencia de CSP no se conoce bien; sin embargo, se han realizado estimaciones basadas en diferentes poblaciones de 1:1800–1:2216. [43] [44] Los CSP se caracterizan por una implantación anormal en la cicatriz de una cesárea anterior, [45] y si se permiten continuar pueden causar complicaciones graves, como ruptura uterina y hemorragia. [44] Las pacientes con CSP generalmente se presentan sin síntomas; sin embargo, los síntomas pueden incluir sangrado vaginal que puede o no estar asociado con dolor. [46] [47] El diagnóstico de CSP se realiza mediante ecografía y se observan cuatro características: (1) Cavidad uterina vacía con una franja endometrial hiperecoica brillante (2) Canal cervical vacío (3) Masa intrauterina en la parte anterior del istmo uterino y (4) Ausencia de la capa muscular uterina anterior y/o ausencia o adelgazamiento entre la vejiga y el saco gestacional, que mida menos de 5 mm. [45] [48] [49] Dada la rareza del diagnóstico, las opciones de tratamiento tienden a describirse en informes y series de casos, que van desde médico con metotrexato o KCl [50] hasta quirúrgico con dilatación y legrado, [51] cuña uterina. resección, [ cita necesaria ] o histerectomía. [47] También se ha descrito una técnica de catéter de doble balón, [52] que permite la preservación del útero. Se desconoce el riesgo de recurrencia de CSP y se recomienda una ecografía temprana en el próximo embarazo. [45]
En casos raros de embarazo ectópico, puede haber dos óvulos fertilizados, uno fuera del útero y otro dentro. Esto se llama embarazo heterotópico . [1] A menudo, el embarazo intrauterino se descubre más tarde que el ectópico, principalmente debido a la dolorosa naturaleza de emergencia de los embarazos ectópicos. Dado que los embarazos ectópicos normalmente se descubren y eliminan muy temprano en el embarazo, es posible que una ecografía no encuentre el embarazo adicional dentro del útero. Cuando los niveles de hCG continúan aumentando después de la extirpación del embarazo ectópico, existe la posibilidad de que un embarazo dentro del útero aún sea viable. Esto normalmente se descubre mediante una ecografía.
Aunque son raros, los embarazos heterotópicos se están volviendo más comunes, probablemente debido al mayor uso de la FIV. La tasa de supervivencia del feto uterino de un embarazo heterotópico ronda el 70%. [53]
Un embarazo en un cuerno rudimentario se refiere a una condición rara y potencialmente mortal que ocurre cuando un óvulo fertilizado se implanta dentro del pequeño cuerno rudimentario de un útero unicorne , que es un tipo de anomalía uterina congénita causada por el desarrollo incompleto de uno de los cuernos müllerianos. conductos . Este tipo de embarazo ectópico suele provocar la rotura del cuerno rudimentario entre las semanas 10 y 15 de gestación, lo que conlleva un alto riesgo de morbilidad y mortalidad. [54]
Un embarazo ectópico persistente se refiere a la continuación del crecimiento trofoblástico después de una intervención quirúrgica para extirpar un embarazo ectópico. Después de un procedimiento conservador que intenta preservar la trompa de Falopio afectada, como una salpingotomía , en alrededor del 15 al 20% se puede haber eliminado la mayor parte del crecimiento ectópico, pero parte del tejido trofoblástico, quizás profundamente incrustado, no se ha eliminado y continúa crecer, generando un nuevo aumento en los niveles de hCG. [55] Después de semanas, esto puede provocar nuevos síntomas clínicos, incluido el sangrado. Por esta razón, es posible que sea necesario controlar los niveles de hCG después de la extirpación de un embarazo ectópico para asegurar su disminución; también se puede administrar metotrexato en el momento de la cirugía de forma profiláctica. [ cita necesaria ]
Embarazo de ubicación desconocida (PUL) es el término utilizado para un embarazo en el que hay una prueba de embarazo positiva pero no se ha visualizado ningún embarazo mediante ecografía transvaginal. [5] Los departamentos especializados en embarazo temprano han estimado que entre el 8% y el 10% de las mujeres que acuden para una evaluación ecográfica al inicio del embarazo serán clasificadas como con una PUL. [5] La verdadera naturaleza del embarazo puede ser un embarazo intrauterino viable en curso, un embarazo fallido, un embarazo ectópico o, rara vez, un PUL persistente. [5]
Debido a la frecuente ambigüedad en los exámenes de ecografía, se propone la siguiente clasificación: [5]
En mujeres con embarazo de localización desconocida, entre el 6% y el 20% tienen un embarazo ectópico. [5] En los casos de embarazo de ubicación desconocida y antecedentes de sangrado abundante, se ha estimado que aproximadamente el 6% tiene un embarazo ectópico subyacente. [5] Entre el 30% y el 47% de las mujeres con embarazo de ubicación desconocida finalmente se les diagnostica un embarazo intrauterino en curso, de los cuales la mayoría (50-70%) tendrán embarazos fallidos donde la ubicación nunca se confirma. [5]

PUL persistente es cuando el nivel de hCG no disminuye espontáneamente y no se identifica ningún embarazo intrauterino o ectópico en la ecografía transvaginal de seguimiento. [5] Un PUL persistente probablemente sea un embarazo ectópico pequeño que no se ha visualizado o un trofoblasto retenido en la cavidad endometrial. [5] El tratamiento sólo debe considerarse cuando se haya excluido definitivamente un embarazo intrauterino potencialmente viable. [5] Un PUL persistente tratado se define como uno manejado médicamente (generalmente con metotrexato) sin confirmación de la ubicación del embarazo, como mediante ultrasonido, laparoscopia o evacuación uterina. [5] Un PUL persistente resuelto se define como hCG sérica que alcanza un valor sin embarazo (generalmente menos de 5 UI/L) después de un manejo expectante o después de una evacuación uterina sin evidencia de vellosidades coriónicas en el examen histopatológico . [5] Por el contrario, un nivel relativamente bajo y no resuelto de hCG sérica indica la posibilidad de un tumor secretor de hCG. [5]
Otras condiciones que causan síntomas similares incluyen: aborto espontáneo, torsión ovárica y apendicitis aguda, rotura de quiste ovárico, cálculos renales y enfermedad inflamatoria pélvica, entre otras. [1]
A la mayoría de las mujeres con PUL se les realiza un seguimiento con mediciones de hCG sérica y se repiten los exámenes TVS hasta que se confirma un diagnóstico final. [5] Los casos de PUL de bajo riesgo que parecen ser embarazos fallidos pueden recibir seguimiento con una prueba de embarazo en orina después de dos semanas y recibir asesoramiento telefónico posterior. [5] Los casos de PUL de bajo riesgo que probablemente sean embarazos intrauterinos pueden tener otro TVS en dos semanas para acceder a la viabilidad. [5] Los casos de PUL de alto riesgo requieren una evaluación adicional, ya sea con una TVS dentro de las 48 horas o una medición adicional de hCG. [5]
El tratamiento temprano de un embarazo ectópico con metotrexato es una alternativa viable al tratamiento quirúrgico [56] que se desarrolló en la década de 1980. [57] Si se administra temprano en el embarazo, el metotrexato detiene el crecimiento del embrión en desarrollo; El embrión en desarrollo puede entonces ser reabsorbido por el cuerpo de la mujer o desaparecer con el período menstrual . Las contraindicaciones incluyen enfermedades hepáticas, renales o sanguíneas, así como una masa embrionaria ectópica > 3,5 cm.
Además, puede provocar la interrupción involuntaria de un embarazo intrauterino no detectado o una anomalía grave en cualquier embarazo superviviente. [5] Por lo tanto, se recomienda que el metotrexato sólo se administre cuando se haya monitorizado en serie la hCG con un aumento inferior al 35 % en 48 horas, lo que prácticamente excluye un embarazo intrauterino viable. [5]
Para el embarazo ectópico no tubárico, la evidencia de ensayos clínicos aleatorios en mujeres con CSP es incierta con respecto al éxito del tratamiento, las complicaciones y los efectos secundarios del metotrexato en comparación con la cirugía ( embolización arterial uterina o quimioembolización arterial uterina). [58]
Estados Unidos utiliza un protocolo de dosis múltiples de metotrexato (MTX) que implica cuatro dosis intramusculares junto con una inyección intramuscular de ácido folínico para proteger las células de los efectos de los medicamentos y reducir los efectos secundarios. En Francia se sigue el protocolo de dosis única, pero una dosis única tiene mayores posibilidades de fracasar. [59]


Si ya se ha producido sangrado, puede ser necesaria una intervención quirúrgica. Sin embargo, a menudo es una decisión difícil decidir si se debe realizar una intervención quirúrgica en un paciente estable con evidencia mínima de coágulo de sangre en la ecografía. [ cita necesaria ]
Los cirujanos usan laparoscopia o laparotomía para acceder a la pelvis y pueden hacer una incisión en la trompa de Falopio afectada y extirpar solo el embarazo ( salpingostomía ) o extirpar la trompa afectada con el embarazo ( salpingectomía ). La primera cirugía exitosa para un embarazo ectópico fue realizada por Robert Lawson Tait en 1883. [60] Se estima que una tasa aceptable de PUL que finalmente se someten a cirugía está entre el 0,5 y el 11 %. [5] Las personas que se someten a salpingectomía y salpingostomía tienen una tasa de embarazo ectópico recurrente similar del 5% y el 8% respectivamente. Además, sus tasas de embarazo intrauterino también son similares, 56% y 61%. [61]
La autotransfusión de la propia sangre de la mujer drenada durante la cirugía puede ser útil en aquellas personas que tienen mucho sangrado en el abdomen. [62]
Los informes publicados de que un embrión reimplantado sobrevivió hasta el nacimiento fueron refutados como falsos. [63]
Cuando se tratan los embarazos ectópicos, el pronóstico para la madre es muy bueno en los países occidentales; la muerte materna es rara, pero todos los fetos mueren o son abortados. Por ejemplo, en el Reino Unido, entre 2003 y 2005 hubo 32.100 embarazos ectópicos que resultaron en 10 muertes maternas (lo que significa que 1 de cada 3.210 mujeres con un embarazo ectópico murió). [64] En 2006-2008, la Investigación Confidencial sobre Muertes Maternas del Reino Unido encontró que el embarazo ectópico es la causa de 6 muertes maternas (0,26/100.000 embarazos). [18]
Sin embargo, en el mundo en desarrollo, especialmente en África, la tasa de mortalidad es muy alta y los embarazos ectópicos son una de las principales causas de muerte entre las mujeres en edad fértil.
En mujeres que han tenido un embarazo ectópico, el riesgo de sufrir otro en el siguiente embarazo ronda el 10%. [sesenta y cinco]
La fertilidad después de un embarazo ectópico depende de varios factores, el más importante de los cuales es un historial previo de infertilidad. [66] La elección del tratamiento no juega un papel importante; Un estudio aleatorizado realizado en 2013 concluyó que las tasas de embarazo intrauterino dos años después del tratamiento del embarazo ectópico son aproximadamente del 64 % con cirugía radical, del 67 % con medicación y del 70 % con cirugía conservadora. [67] En comparación, la tasa acumulada de embarazo de mujeres menores de 40 años en la población general durante dos años es superior al 90%. [68]
El metotrexato no afecta a futuros tratamientos de fertilidad. La cantidad de ovocitos que se recuperaron antes y después del tratamiento con metotrexato no cambia. [69]
En caso de embarazo ectópico ovárico, el riesgo de embarazo ectópico posterior o de infertilidad es bajo. [70]
No hay evidencia de que el masaje mejore la fertilidad después de un embarazo ectópico. [71]

La tasa de embarazo ectópico es aproximadamente del 1% al 2% de la de los nacidos vivos en los países desarrollados, aunque llega al 4% en embarazos que involucran tecnología de reproducción asistida. [5] Entre el 93% y el 97% de los embarazos ectópicos se localizan en una trompa de Falopio. [1] De estos, a su vez, el 13% se localiza en el istmo , el 75% en la ampolla , y el 12% en las fimbrias . [5] El embarazo ectópico es responsable del 6% de las muertes maternas durante el primer trimestre del embarazo, lo que lo convierte en la principal causa de muerte materna durante esta etapa del embarazo. [1]
Entre el 5% y el 42% de las mujeres atendidas para una evaluación ecográfica con una prueba de embarazo positiva tienen un embarazo de ubicación desconocida, es decir, una prueba de embarazo positiva pero no se visualiza ningún embarazo en la ecografía transvaginal. [5] Entre el 6% y el 20% de los embarazos de localización desconocida son diagnosticados posteriormente con embarazo ectópico real. [5]
La salpingectomía como tratamiento del embarazo ectópico es uno de los casos comunes en los que médicos y pacientes que se oponen abiertamente al aborto pueden utilizar el principio de doble efecto para justificar la aceleración de la muerte del embrión. [73]
En la Iglesia católica existen debates morales sobre determinados tratamientos. Un número importante de moralistas católicos consideran que el uso del metotrexato y la salpingostomía no son "moralmente permisibles", porque destruyen el embrión; sin embargo, se consideran de otra manera las situaciones en las que la salud de la madre está en peligro y se extrae toda la trompa de Falopio con el embrión en desarrollo en su interior. [74] [75]
Existen organizaciones que brindan información y apoyo para ayudar a quienes experimentan un embarazo ectópico. Los estudios demuestran que las personas pueden experimentar estrés postraumático, depresión y ansiedad para los cuales necesitarían terapias especializadas. [76] Las parejas también pueden experimentar estrés postraumático. [77]
Ha habido casos en los que el embarazo ectópico duró muchos meses y terminó con un bebé vivo nacido por laparotomía.
En julio de 1999, Lori Dalton dio a luz por cesárea en Ogden, Utah , Estados Unidos, a una niña sana, Saige, que se había desarrollado fuera del útero. Las ecografías anteriores no habían descubierto el problema. "El parto de [Dalton] estaba programado como una cesárea de rutina en el Centro Médico Regional de Ogden en Utah. Cuando el Dr. Naisbitt realizó la cesárea de Lori, se sorprendió al encontrar a Saige dentro de la membrana amniótica fuera del útero..." [78] "Pero lo que hace que este caso sea tan raro es que no solo la madre y el bebé sobrevivieron, sino que ambos gozan de perfecta salud. El padre, John Dalton, tomó un video casero dentro de la sala de partos. Saige salió extremadamente bien porque incluso aunque había sido implantada fuera del útero, un rico suministro de sangre procedente de un fibroma uterino a lo largo de la pared exterior del útero la había nutrido con una rica fuente de sangre". [79]
En septiembre de 1999 una mujer inglesa, Jane Ingram (32 años) dio a luz a trillizos: Olivia, Mary y Ronan, con un feto extrauterino (Ronan) debajo del útero y gemelos en el útero. Los tres sobrevivieron. Primero sacaron a los gemelos en el útero. [80]
El 29 de mayo de 2008, una mujer australiana, Meera Thangarajah (34 años), que tenía un embarazo ectópico en el ovario , dio a luz a una niña sana a término de 2,8 kg (6 libras y 3 onzas), Durga, mediante cesárea. No tuvo problemas ni complicaciones durante el embarazo de 38 semanas. [81] [82]
La gestación ectópica existe en otros mamíferos además de los humanos. En ovejas puede llegar a término, con preparación mamaria al parto y esfuerzos de expulsión . El feto se puede extirpar mediante cesárea. Imágenes de cesárea de una oveja sacrificada , cinco días después de los signos del parto.
{{cite book}}: Mantenimiento CS1: falta el editor de la ubicación ( enlace )