Los virus de inmunodeficiencia humana ( VIH ) son dos especies de lentivirus (un subgrupo de retrovirus ) que infectan a los seres humanos. Con el tiempo, causan el síndrome de inmunodeficiencia adquirida (SIDA), [1] [2] una afección en la que el fracaso progresivo del sistema inmunitario permite que las infecciones oportunistas y los cánceres potencialmente mortales prosperen. [3] Sin tratamiento, se estima que el tiempo medio de supervivencia después de la infección por VIH es de 9 a 11 años, según el subtipo de VIH . [4]
En la mayoría de los casos, el VIH es una infección de transmisión sexual y se produce por contacto o transferencia de sangre , líquido preseminal , semen y fluidos vaginales . [5] [6] La transmisión no sexual puede ocurrir de una madre infectada a su bebé durante el embarazo , durante el parto por exposición a su sangre o fluido vaginal y a través de la leche materna . [7] [8] [9] [10] Dentro de estos fluidos corporales, el VIH está presente tanto en forma de partículas virales libres como de virus dentro de las células inmunes infectadas. Las investigaciones han demostrado (tanto para parejas del mismo sexo como de sexos opuestos) que el VIH no es contagioso durante las relaciones sexuales sin condón si la pareja VIH positiva tiene una carga viral constantemente indetectable . [5] [6]
El VIH infecta células vitales en el sistema inmunológico humano, como las células T auxiliares (específicamente las células T CD4 + ), los macrófagos y las células dendríticas . [11] La infección por VIH conduce a niveles bajos de células T CD4 + a través de una serie de mecanismos, incluyendo la piroptosis de las células T infectadas abortivamente, [12] la apoptosis de las células espectadoras no infectadas, [13] la muerte viral directa de las células infectadas y la muerte de las células T CD4 + infectadas por los linfocitos citotóxicos CD8 + que reconocen las células infectadas. [14] Cuando el número de células T CD4 + disminuye por debajo de un nivel crítico, se pierde la inmunidad mediada por células y el cuerpo se vuelve progresivamente más susceptible a las infecciones oportunistas, lo que lleva al desarrollo del SIDA.
El VIH es un miembro del género Lentivirus , [15] parte de la familia Retroviridae . [16] Los lentivirus tienen muchas morfologías y propiedades biológicas en común. Muchas especies son infectadas por lentivirus, que son característicamente responsables de enfermedades de larga duración con un largo período de incubación . [17] Los lentivirus se transmiten como virus de ARN monocatenario , de sentido positivo y envuelto . Al ingresar a la célula diana, el genoma de ARN viral se convierte (transcripción inversa) en ADN bicatenario por una enzima codificada por el virus, la transcriptasa inversa , que se transporta junto con el genoma viral en la partícula viral. El ADN viral resultante luego se importa al núcleo celular y se integra en el ADN celular por una enzima codificada por el virus, la integrasa , y cofactores del huésped . [18] Una vez integrado, el virus puede volverse latente , lo que permite que el virus y su célula huésped eviten la detección por parte del sistema inmunológico, durante un período de tiempo indeterminado. [19] El virus puede permanecer latente en el cuerpo humano hasta diez años después de la infección primaria; durante este período, el virus no causa síntomas. Alternativamente, el ADN viral integrado puede transcribirse , produciendo nuevos genomas de ARN y proteínas virales, utilizando recursos de la célula huésped, que se empaquetan y se liberan de la célula como nuevas partículas virales que comenzarán nuevamente el ciclo de replicación.
Se han caracterizado dos tipos de VIH: VIH-1 y VIH-2. El VIH-1 es el virus que se descubrió inicialmente y se denominó virus asociado a la linfadenopatía (LAV) y virus linfotrópico de células T humanas 3 (HTLV-III). El VIH-1 es más virulento y más infeccioso que el VIH-2 [20] y es la causa de la mayoría de las infecciones por VIH a nivel mundial. La menor infectividad del VIH-2, en comparación con el VIH-1, implica que menos personas expuestas al VIH-2 se infectarán por exposición. Debido a su capacidad relativamente pobre de transmisión, el VIH-2 se limita en gran medida a África occidental [21] .

El VIH tiene una estructura similar a la de otros retrovirus. Es aproximadamente esférico [22] con un diámetro de unos 120 nm , alrededor de 100.000 veces más pequeño en volumen que un glóbulo rojo . [23] Está compuesto por dos copias de ARN monocatenario de sentido positivo que codifica los nueve genes del virus encerrados por una cápside cónica compuesta por 2.000 copias de la proteína viral p24 . [24] El ARN monocatenario está fuertemente unido a las proteínas de la nucleocápside, p7, y a las enzimas necesarias para el desarrollo del virión, como la transcriptasa inversa , las proteasas , la ribonucleasa y la integrasa . Una matriz compuesta por la proteína viral p17 rodea la cápside asegurando la integridad de la partícula del virión. [24]
Esta, a su vez, está rodeada por la envoltura viral , que está compuesta por la bicapa lipídica tomada de la membrana de una célula huésped humana cuando la partícula viral recién formada brota de la célula. La envoltura viral contiene proteínas de la célula huésped y relativamente pocas copias de la proteína de envoltura del VIH, [24] que consiste en una tapa hecha de tres moléculas conocidas como glicoproteína (gp) 120 , y un tallo que consiste en tres moléculas gp41 que anclan la estructura en la envoltura viral. [25] [26] La proteína de envoltura, codificada por el gen env del VIH , permite que el virus se adhiera a las células objetivo y fusione la envoltura viral con la membrana de la célula objetivo liberando el contenido viral en la célula e iniciando el ciclo infeccioso. [25]
.jpg/440px-Protein_Structure_Diagram_of_Fusion_Peptide_Epitope_on_HIV_Spike_(41863579304).jpg)
Como única proteína viral en la superficie del virus, la proteína de la envoltura es un objetivo importante para los esfuerzos de la vacuna contra el VIH . [27] Más de la mitad de la masa de la proteína de envoltura trimérica son glicanos ligados a N. La densidad es alta ya que los glicanos protegen a la proteína viral subyacente de la neutralización por anticuerpos. Esta es una de las moléculas más densamente glicosiladas conocidas y la densidad es suficientemente alta para evitar el proceso de maduración normal de los glicanos durante la biogénesis en el aparato endoplasmático y de Golgi. [28] [29] Por lo tanto, la mayoría de los glicanos se estancan como glicanos inmaduros de "alta manosa" que normalmente no están presentes en las glicoproteínas humanas que se secretan o están presentes en una superficie celular. [30] El procesamiento inusual y la alta densidad significan que casi todos los anticuerpos ampliamente neutralizantes que se han identificado hasta ahora (de un subconjunto de pacientes que han estado infectados durante muchos meses a años) se unen a, o están adaptados para lidiar con, estos glicanos de envoltura. [31]
La estructura molecular de la espiga viral ha sido determinada mediante cristalografía de rayos X [32] y microscopía electrónica criogénica . [33] Estos avances en biología estructural fueron posibles gracias al desarrollo de formas recombinantes estables de la espiga viral mediante la introducción de un enlace disulfuro entre subunidades y una mutación de isoleucina a prolina ( reemplazo radical de un aminoácido) en gp41. [34] Los llamados trímeros SOSIP no solo reproducen las propiedades antigénicas de la espiga viral nativa, sino que también muestran el mismo grado de glicanos inmaduros que se presenta en el virus nativo. [35] Las espículas virales triméricas recombinantes son candidatos prometedores para vacunas, ya que muestran menos epítopos no neutralizantes que la gp120 monomérica recombinante, que actúa para suprimir la respuesta inmune a los epítopos objetivo. [36]

El genoma del ARN consta de al menos siete puntos de referencia estructurales ( LTR , TAR , RRE , PE, SLIP, CRS e INS) y nueve genes ( gag , pol y env , tat , rev , nef , vif , vpr , vpu y, a veces, un décimo tev , que es una fusión de tat , env y rev ), que codifican 19 proteínas. Tres de estos genes, gag , pol y env , contienen información necesaria para fabricar las proteínas estructurales de las nuevas partículas virales. [24] Por ejemplo, env codifica una proteína llamada gp160 que se corta en dos por una proteasa celular para formar gp120 y gp41. Los seis genes restantes, tat , rev , nef , vif , vpr y vpu (o vpx en el caso del VIH-2), son genes reguladores de proteínas que controlan la capacidad del VIH de infectar células, producir nuevas copias del virus (replicarse) o causar enfermedades. [24]
Las dos proteínas tat (p16 y p14) son transactivadores transcripcionales para el promotor LTR que actúan uniéndose al elemento TAR del ARN. El TAR también puede procesarse en microARN que regulan los genes de apoptosis ERCC1 e IER3 . [37] [38] La proteína rev (p19) está involucrada en el transporte de ARN desde el núcleo y el citoplasma uniéndose al elemento RRE del ARN. La proteína vif (p23) previene la acción de APOBEC3G (una proteína celular que desamina la citidina a uridina en el ADN viral monocatenario y/o interfiere con la transcripción inversa [39] ). La proteína vpr (p14) detiene la división celular en G2/M . La proteína nef (p27) regula a la baja el CD4 (el principal receptor viral), así como las moléculas MHC de clase I y clase II . [40] [41] [42]
Nef también interactúa con los dominios SH3 . La proteína vpu (p16) influye en la liberación de nuevas partículas virales de las células infectadas. [24] Los extremos de cada hebra del ARN del VIH contienen una secuencia de ARN llamada repetición terminal larga (LTR). Las regiones en la LTR actúan como interruptores para controlar la producción de nuevos virus y pueden ser activadas por proteínas del VIH o de la célula huésped. El elemento Psi está involucrado en el empaquetamiento del genoma viral y es reconocido por las proteínas gag y rev . El elemento SLIP (TTTTTT) está involucrado en el cambio de marco de lectura gag - pol necesario para generar pol funcional . [24]
El término tropismo viral se refiere a los tipos de células que infecta un virus. El VIH puede infectar una variedad de células inmunes, como las células T CD4 + , los macrófagos y las células microgliales . La entrada del VIH-1 a los macrófagos y las células T CD4 + está mediada por la interacción de las glicoproteínas de la envoltura del virión (gp120) con la molécula CD4 en la membrana de las células diana y también con correceptores de quimiocinas . [25] [43]
Las cepas macrófago-trópicas (M-trópicas) del VIH-1, o cepas no inductoras de sincitios (NSI; ahora llamadas virus R5 [44] ) utilizan el receptor de quimiocina β , CCR5 , para la entrada y, por lo tanto, pueden replicarse tanto en macrófagos como en células T CD4 + . [45] Este correceptor CCR5 es utilizado por casi todos los aislados primarios del VIH-1 independientemente del subtipo genético viral. De hecho, los macrófagos desempeñan un papel clave en varios aspectos críticos de la infección por VIH. Parecen ser las primeras células infectadas por el VIH y quizás la fuente de producción del VIH cuando las células CD4 + se agotan en el paciente. Los macrófagos y las células microgliales son las células infectadas por el VIH en el sistema nervioso central . En las amígdalas y adenoides de los pacientes infectados por el VIH, los macrófagos se fusionan en células gigantes multinucleadas que producen enormes cantidades de virus.
Las cepas T-trópicas del VIH-1, o cepas inductoras de sincitios (SI; ahora llamadas virus X4 [44] ) se replican en células T CD4 + primarias así como en macrófagos y utilizan el receptor de quimiocina α , CXCR4 , para entrar. [45] [46] [47]
Se cree que las cepas dual-trópicas del VIH-1 son cepas transicionales del VIH-1 y, por lo tanto, pueden utilizar tanto CCR5 como CXCR4 como correceptores para la entrada del virus.
La α -quimiocina SDF-1 , un ligando para CXCR4, suprime la replicación de los aislados de VIH-1 con tropismo T. Lo hace regulando a la baja la expresión de CXCR4 en la superficie de las células diana del VIH. Los aislados de VIH-1 con tropismo M que utilizan solo el receptor CCR5 se denominan R5; los que utilizan solo CXCR4 se denominan X4, y los que utilizan ambos, X4R5. Sin embargo, el uso de correceptores por sí solo no explica el tropismo viral, ya que no todos los virus R5 pueden utilizar CCR5 en macrófagos para una infección productiva [45] y el VIH también puede infectar un subtipo de células dendríticas mieloides [48] , que probablemente constituyen un reservorio que mantiene la infección cuando el número de células T CD4 + ha disminuido a niveles extremadamente bajos.
Algunas personas son resistentes a ciertas cepas del VIH. [49] Por ejemplo, las personas con la mutación CCR5-Δ32 son resistentes a la infección por el virus R5, ya que la mutación deja al VIH incapaz de unirse a este correceptor, lo que reduce su capacidad de infectar células objetivo.
Las relaciones sexuales son el principal modo de transmisión del VIH. Tanto el VIH X4 como el R5 están presentes en el líquido seminal , lo que permite que el virus se transmita de un hombre a su pareja sexual . Los viriones pueden entonces infectar numerosos objetivos celulares y diseminarse por todo el organismo. Sin embargo, un proceso de selección [ se necesita más explicación ] conduce a una transmisión predominante del virus R5 a través de esta vía. [50] [51] [52] En pacientes infectados con el subtipo B del VIH-1, a menudo hay un cambio de correceptor en la enfermedad en etapa tardía y variantes T-trópicas que pueden infectar una variedad de células T a través de CXCR4. [53] Estas variantes luego se replican de forma más agresiva con una virulencia aumentada que causa un rápido agotamiento de las células T, colapso del sistema inmunológico e infecciones oportunistas que marcan el advenimiento del SIDA. [54] Los pacientes VIH positivos adquieren un espectro enormemente amplio de infecciones oportunistas, lo que era particularmente problemático antes del inicio de las terapias HAART ; Sin embargo, se han descrito las mismas infecciones en pacientes infectados por el VIH examinados post mortem tras el inicio de las terapias antirretrovirales. [3] Por lo tanto, durante el curso de la infección, la adaptación viral al uso de CXCR4 en lugar de CCR5 puede ser un paso clave en la progresión al SIDA. Varios estudios con individuos infectados por el subtipo B han determinado que entre el 40 y el 50 por ciento de los pacientes con SIDA pueden albergar virus del subtipo SI y, se presume, de los fenotipos X4. [55] [56]
El VIH-2 es mucho menos patógeno que el VIH-1 y su distribución mundial está restringida a África occidental . La adopción de "genes accesorios" por parte del VIH-2 y su patrón más promiscuo de uso de correceptores (incluida la independencia de CD4) puede ayudar al virus en su adaptación para evitar los factores de restricción innatos presentes en las células huésped. La adaptación para utilizar la maquinaria celular normal para permitir la transmisión y la infección productiva también ha ayudado al establecimiento de la replicación del VIH-2 en humanos. Una estrategia de supervivencia para cualquier agente infeccioso no es matar a su huésped, sino convertirse en última instancia en un organismo comensal . Una vez que se ha alcanzado una baja patogenicidad, con el tiempo se seleccionarán variantes que tengan más éxito en la transmisión. [57]
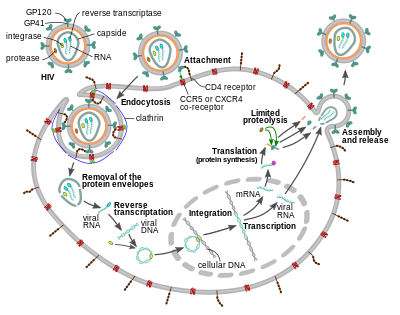

El virión del VIH ingresa a los macrófagos y a las células T CD4 + mediante la adsorción de las glicoproteínas de su superficie a los receptores de la célula diana, seguida de la fusión de la envoltura viral con la membrana de la célula diana y la liberación de la cápside del VIH en la célula. [58] [59]
La entrada a la célula comienza a través de la interacción del complejo de envoltura trimérico ( espiga gp160 ) en la envoltura viral del VIH y tanto CD4 como un correceptor de quimiocina (generalmente CCR5 o CXCR4 , pero se sabe que otros interactúan) en la superficie de la célula diana. [58] [59] Gp120 se une a la integrina α 4 β 7 activando LFA-1 , la integrina central involucrada en el establecimiento de sinapsis virológicas , que facilitan la propagación eficiente de célula a célula del VIH-1. [60] La espiga gp160 contiene dominios de unión tanto para CD4 como para receptores de quimiocinas. [58] [59]
El primer paso en la fusión implica la unión de alta afinidad de los dominios de unión de CD4 de gp120 a CD4. Una vez que gp120 se une a la proteína CD4, el complejo de la envoltura sufre un cambio estructural, exponiendo los dominios de unión del receptor de quimiocina de gp120 y permitiéndoles interactuar con el receptor de quimiocina objetivo. [58] [59] Esto permite una unión de dos puntas más estable, que permite que el péptido de fusión N-terminal gp41 penetre en la membrana celular. [58] [59] Las secuencias repetidas en gp41, HR1 y HR2 luego interactúan, causando el colapso de la porción extracelular de gp41 en una forma de horquilla. Esta estructura de bucle acerca el virus y las membranas celulares, lo que permite la fusión de las membranas y la posterior entrada a la cápside viral. [58] [59]
Una vez que el VIH se ha unido a la célula diana, el ARN del VIH y varias enzimas, incluidas la transcriptasa inversa, la integrasa, la ribonucleasa y la proteasa, se inyectan en la célula. [58] [ verificación fallida ] Durante el transporte basado en microtúbulos al núcleo, el genoma de ARN monocatenario viral se transcribe en ADN bicatenario, que luego se integra en un cromosoma huésped.
El VIH puede infectar células dendríticas (CD) por esta vía CD4-CCR5, pero también se puede utilizar otra vía que utiliza receptores de lectina de tipo C específicos de manosa, como DC-SIGN . [61] Las CD son una de las primeras células que encuentra el virus durante la transmisión sexual. Actualmente se cree que desempeñan un papel importante al transmitir el VIH a las células T cuando el virus es capturado en la mucosa por las CD. [61] Se cree que la presencia de FEZ-1 , que se produce de forma natural en las neuronas , previene la infección de células por el VIH. [62]

Desde hace tiempo se ha creído que la entrada del VIH-1, así como la entrada de muchos otros retrovirus, se produce exclusivamente en la membrana plasmática. Sin embargo, más recientemente también se ha informado de una infección productiva por endocitosis del VIH-1 mediada por clatrina e independiente del pH , y recientemente se ha sugerido que constituye la única vía de entrada productiva. [63] [64] [65] [66] [67]

Poco después de que la cápside viral entra en la célula, una enzima llamada transcriptasa inversa libera el genoma de ARN monocatenario de sentido positivo de las proteínas virales unidas y lo copia en una molécula de ADN complementario (ADNc). [68] El proceso de transcripción inversa es extremadamente propenso a errores, y las mutaciones resultantes pueden causar resistencia a los medicamentos o permitir que el virus evada el sistema inmunológico del cuerpo. La transcriptasa inversa también tiene actividad de ribonucleasa que degrada el ARN viral durante la síntesis de ADNc, así como actividad de ADN polimerasa dependiente de ADN que crea un ADN sentido a partir del ADNc antisentido . [69] Juntos, el ADNc y su complemento forman un ADN viral de doble cadena que luego se transporta al núcleo celular . La integración del ADN viral en el genoma de la célula huésped se lleva a cabo por otra enzima viral llamada integrasa . [68]
El ADN viral integrado puede entonces permanecer inactivo, en la etapa latente de la infección por VIH. [68] Para producir activamente el virus, ciertos factores de transcripción celular deben estar presentes, el más importante de los cuales es NF- κ B (factor nuclear kappa B), que se regula positivamente cuando las células T se activan. [70] Esto significa que las células que tienen más probabilidades de ser atacadas, penetradas y posteriormente destruidas por el VIH son las que luchan activamente contra la infección.
Durante la replicación viral, el ADN provirus integrado se transcribe en ARN. Los ARN genómicos de longitud completa (gRNA) se pueden empaquetar en nuevas partículas virales en una forma pseudodiploide . La selectividad en el empaquetamiento se explica por las propiedades estructurales del confórmero dimérico del gRNA. El dímero de gRNA se caracteriza por una unión de tres vías en tándem dentro del monómero de gRNA, en la que las horquillas SD y AUG , responsables del splicing y la traducción respectivamente, están secuestradas y la horquilla DIS (señal de inicio de la dimerización) está expuesta. La formación del dímero de gRNA está mediada por una interacción de "beso" entre los bucles de horquilla DIS de los monómeros de gRNA. Al mismo tiempo, ciertos residuos de guanosina en el gRNA se ponen a disposición para la unión de la proteína de la nucleocápside (NC) que conduce al posterior ensamblaje del virión. [71] También se ha informado que el dímero gRNA lábil logra una conformación más estable después de la unión NC, en la que tanto las regiones DIS como las U5:AUG del gRNA participan en un extenso apareamiento de bases. [72]
El ARN también puede procesarse para producir ARN mensajeros maduros (ARNm). En la mayoría de los casos, este procesamiento implica el empalme del ARN para producir ARNm más cortos que el genoma completo. La parte del ARN que se elimina durante el empalme del ARN determina cuál de las secuencias codificantes de la proteína del VIH se traduce. [73]
Los ARNm maduros del VIH se exportan desde el núcleo al citoplasma , donde se traducen para producir proteínas del VIH, incluida Rev. A medida que se produce la proteína Rev recién producida, se mueve al núcleo, donde se une a copias completas sin empalmar de los ARN del virus y les permite salir del núcleo. [74] Algunos de estos ARN de longitud completa funcionan como ARNm que se traducen para producir las proteínas estructurales Gag y Env. Las proteínas Gag se unen a copias del genoma del ARN del virus para empaquetarlas en nuevas partículas virales. [75] El VIH-1 y el VIH-2 parecen empaquetar su ARN de forma diferente. [76] [77] El VIH-1 se unirá a cualquier ARN apropiado. [78] El VIH-2 se unirá preferentemente al ARNm que se utilizó para crear la propia proteína Gag. [79]
Dos genomas de ARN están encapsidados en cada partícula del VIH-1 (véase Estructura y genoma del VIH ). Tras la infección y la replicación catalizada por la transcriptasa inversa, puede producirse la recombinación entre los dos genomas. [80] [81] La recombinación se produce cuando los genomas de ARN monocatenario de sentido positivo se transcriben de forma inversa para formar ADN. Durante la transcripción inversa, el ADN naciente puede cambiar varias veces entre las dos copias del ARN viral. Esta forma de recombinación se conoce como elección de copia. Los eventos de recombinación pueden ocurrir en todo el genoma. Pueden ocurrir entre dos y 20 eventos de recombinación por genoma en cada ciclo de replicación, y estos eventos pueden mezclar rápidamente la información genética que se transmite de los genomas parentales a los de la progenie. [81]
La recombinación viral produce una variación genética que probablemente contribuye a la evolución de la resistencia a la terapia antirretroviral . [82] La recombinación también puede contribuir, en principio, a superar las defensas inmunitarias del huésped. Sin embargo, para que se materialicen las ventajas adaptativas de la variación genética, los dos genomas virales empaquetados en partículas virales infectantes individuales deben haber surgido de virus progenitores separados de diferente constitución genética. Se desconoce con qué frecuencia se produce este empaquetamiento mixto en condiciones naturales. [83]
Bonhoeffer et al. [84] sugirieron que el cambio de plantilla por la transcriptasa inversa actúa como un proceso de reparación para tratar las roturas en el genoma de ARN monocatenario. Además, Hu y Temin [80] sugirieron que la recombinación es una adaptación para reparar el daño en los genomas de ARN. El cambio de hebra (recombinación por elección de copia) por la transcriptasa inversa podría generar una copia intacta del ADN genómico a partir de dos copias dañadas del genoma de ARN monocatenario. Esta visión del beneficio adaptativo de la recombinación en el VIH podría explicar por qué cada partícula del VIH contiene dos genomas completos, en lugar de uno. Además, la visión de que la recombinación es un proceso de reparación implica que el beneficio de la reparación puede ocurrir en cada ciclo de replicación, y que este beneficio puede realizarse independientemente de que los dos genomas difieran genéticamente o no. Desde la perspectiva de que la recombinación en el VIH es un proceso de reparación, la generación de variación recombinatoria sería una consecuencia, pero no la causa, de la evolución del cambio de plantilla. [84]
La infección por VIH-1 causa inflamación crónica y producción de especies reactivas de oxígeno . [85] Por lo tanto, el genoma del VIH puede ser vulnerable al daño oxidativo , incluidas las roturas en el ARN monocatenario. Para el VIH, así como para los virus en general, el éxito de la infección depende de la superación de las estrategias de defensa del huésped que a menudo incluyen la producción de especies reactivas de oxígeno que dañan el genoma. Por lo tanto, Michod et al. [86] sugirieron que la recombinación por parte de los virus es una adaptación para la reparación del daño del genoma, y que la variación recombinacional es un subproducto que puede proporcionar un beneficio separado.
El paso final del ciclo viral, el ensamblaje de nuevos viriones del VIH-1, comienza en la membrana plasmática de la célula huésped. La poliproteína Env (gp160) pasa a través del retículo endoplasmático y es transportada al aparato de Golgi , donde es escindida por la furina, dando lugar a las dos glicoproteínas de la envoltura del VIH, gp41 y gp120 . [87] Estas son transportadas a la membrana plasmática de la célula huésped, donde gp41 ancla gp120 a la membrana de la célula infectada. Las poliproteínas Gag (p55) y Gag-Pol (p160) también se asocian con la superficie interna de la membrana plasmática junto con el ARN genómico del VIH a medida que el virión en formación comienza a brotar de la célula huésped. El virión gemado aún es inmaduro, ya que las poliproteínas gag aún necesitan ser escindidas en las proteínas reales de la matriz, la cápside y la nucleocápside. Esta división está mediada por la proteasa viral empaquetada y puede ser inhibida por fármacos antirretrovirales de la clase de inhibidores de proteasa . Los diversos componentes estructurales se ensamblan para producir un virión de VIH maduro. [88] Solo los viriones maduros pueden infectar otra célula.

El proceso clásico de infección de una célula por un virión puede denominarse "propagación sin células" para distinguirlo de un proceso reconocido más recientemente llamado "propagación de célula a célula". [89] En la propagación sin células (véase la figura), las partículas del virus brotan de una célula T infectada, entran en la sangre o en el líquido extracelular y luego infectan a otra célula T tras un encuentro casual. [89] El VIH también puede diseminarse por transmisión directa de una célula a otra mediante un proceso de propagación de célula a célula, para el que se han descrito dos vías. En primer lugar, una célula T infectada puede transmitir el virus directamente a una célula T diana a través de una sinapsis virológica . [60] [90] En segundo lugar, una célula presentadora de antígenos (CPA), como un macrófago o una célula dendrítica, puede transmitir el VIH a las células T mediante un proceso que implica una infección productiva (en el caso de los macrófagos) o la captura y transferencia de viriones en trans (en el caso de las células dendríticas). [91] Cualquiera que sea la vía utilizada, se informa que la infección por transferencia de célula a célula es mucho más eficiente que la propagación del virus sin células. [92] Una serie de factores contribuyen a esta mayor eficiencia, incluida la gemación polarizada del virus hacia el sitio de contacto de célula a célula, la aposición cercana de células, que minimiza la difusión en fase fluida de los viriones, y la agrupación de los receptores de entrada del VIH en la célula objetivo hacia la zona de contacto. [90] Se cree que la propagación de célula a célula es particularmente importante en los tejidos linfoides , donde las células T CD4 + están densamente empaquetadas y es probable que interactúen con frecuencia. [89] Los estudios de imágenes intravitales han respaldado el concepto de la sinapsis virológica del VIH in vivo . [93] Los muchos mecanismos de diseminación disponibles para el VIH contribuyen a la replicación continua del virus a pesar de las terapias antirretrovirales. [89] [94]

El VIH se diferencia de muchos virus en que tiene una variabilidad genética muy alta . Esta diversidad es resultado de su rápido ciclo de replicación, con la generación de alrededor de 10 10 viriones cada día, junto con una alta tasa de mutación de aproximadamente 3 x 10 −5 por base de nucleótido por ciclo de replicación y propiedades recombinogénicas de la transcriptasa inversa. [95] [96] [97]
Este complejo escenario lleva a la generación de muchas variantes del VIH en un solo paciente infectado en el transcurso de un día. [95] Esta variabilidad se agrava cuando una sola célula es infectada simultáneamente por dos o más cepas diferentes del VIH. Cuando se produce una infección simultánea , el genoma de los viriones descendientes puede estar compuesto por cadenas de ARN de dos cepas diferentes. Este virión híbrido infecta entonces una nueva célula donde experimenta una replicación. Mientras esto sucede, la transcriptasa inversa, saltando de un lado a otro entre las dos plantillas de ARN diferentes, generará una secuencia de ADN retroviral recién sintetizada que es un recombinante entre los dos genomas parentales. [95] Esta recombinación es más obvia cuando ocurre entre subtipos. [95]
El virus de inmunodeficiencia de los simios (VIS), estrechamente relacionado con el virus, ha evolucionado en muchas cepas, clasificadas según la especie hospedadora natural. Se cree que las cepas de VIS del mono verde africano (VISagm) y del mangabey fuliginoso (VISsmm) tienen una larga historia evolutiva con sus hospedadores. Estos hospedadores se han adaptado a la presencia del virus [98] , que está presente en niveles elevados en la sangre del hospedador, pero solo provoca una respuesta inmunitaria leve [99] , no causa el desarrollo del SIDA en los simios [100] y no sufre la extensa mutación y recombinación típica de la infección por VIH en humanos [101] .
Por el contrario, cuando estas cepas infectan especies que no se han adaptado al SIV (huéspedes "heterólogos" o similares como los macacos rhesus o cynomologus ), los animales desarrollan SIDA y el virus genera una diversidad genética similar a la que se observa en la infección humana por VIH. [102] El SIV del chimpancé (SIVcpz), el pariente genético más cercano del VIH-1, está asociado con una mayor mortalidad y síntomas similares al SIDA en su huésped natural. [103] El SIVcpz parece haberse transmitido relativamente recientemente a las poblaciones de chimpancés y humanos, por lo que sus huéspedes aún no se han adaptado al virus. [98] Este virus también ha perdido una función del gen nef que está presente en la mayoría de los SIV. Para las variantes no patógenas del SIV, el nef suprime la activación de las células T a través del marcador CD3 . La función del nef en las formas no patógenas del SIV es regular a la baja la expresión de citocinas inflamatorias , MHC-1 y señales que afectan el tráfico de células T. En el VIH-1 y el SIVcpz, el nef no inhibe la activación de las células T y ha perdido esta función. Sin esta función, es más probable que se produzca una disminución de las células T, lo que conduce a una inmunodeficiencia. [103] [104]
Se han identificado tres grupos de VIH-1 sobre la base de las diferencias en la región de la envoltura ( env ): M, N y O. [105] El grupo M es el más frecuente y se subdivide en ocho subtipos (o clados ), basados en todo el genoma, que son geográficamente distintos. [106] Los más frecuentes son los subtipos B (que se encuentran principalmente en América del Norte y Europa), A y D (que se encuentran principalmente en África) y C (que se encuentran principalmente en África y Asia); estos subtipos forman ramas en el árbol filogenético que representan el linaje del grupo M del VIH-1. La coinfección con subtipos distintos da lugar a formas recombinantes circulantes (CRF). En 2000, el último año en el que se realizó un análisis de la prevalencia global de subtipos, el 47,2% de las infecciones en todo el mundo eran del subtipo C, el 26,7% del subtipo A/CRF02_AG, el 12,3% del subtipo B, el 5,3% del subtipo D, el 3,2% del CRF_AE y el 5,3% restante estaba compuesto por otros subtipos y CRF. [107] La mayoría de las investigaciones sobre el VIH-1 se centran en el subtipo B; pocos laboratorios se centran en los otros subtipos. [108] Se ha planteado la hipótesis de la existencia de un cuarto grupo, "P", basándose en un virus aislado en 2009. [109] [110] La cepa aparentemente deriva del SIV del gorila (SIVgor), aislado por primera vez de los gorilas de las tierras bajas occidentales en 2006. [109]
El pariente más cercano del VIH-2 es el SIVsm, una cepa del SIV que se encuentra en las abejas manganas. Dado que el VIH-1 se deriva del SIVcpz y el VIH-2 del SIVsm, la secuencia genética del VIH-2 es sólo parcialmente homóloga a la del VIH-1 y se parece más a la del SIVsm. [111] [112]
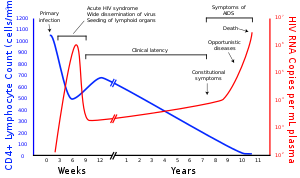
Muchas personas VIH positivas no saben que están infectadas con el virus. [113] Por ejemplo, en 2001, menos del 1% de la población urbana sexualmente activa de África se había sometido a pruebas, y esta proporción es aún menor en las poblaciones rurales. [113] Además, en 2001, sólo el 0,5% de las mujeres embarazadas que acudieron a centros de salud urbanos recibieron asesoramiento, se les realizó la prueba o recibieron los resultados de la prueba. [113] Una vez más, esta proporción es aún menor en los centros de salud rurales. [113] Por lo tanto, dado que los donantes pueden no saber que están infectados, la sangre de donantes y los productos sanguíneos utilizados en la medicina y la investigación médica se someten sistemáticamente a pruebas de detección del VIH. [114]
La prueba del VIH-1 se realiza inicialmente mediante un ensayo inmunoabsorbente ligado a enzimas (ELISA) para detectar anticuerpos contra el VIH-1. Las muestras con un resultado no reactivo del ELISA inicial se consideran VIH-negativas, a menos que haya ocurrido una nueva exposición a una pareja infectada o una pareja de estado serológico desconocido. Las muestras con un resultado reactivo del ELISA se vuelven a analizar por duplicado. [115] Si el resultado de cualquiera de las pruebas duplicadas es reactivo, la muestra se informa como repetidamente reactiva y se somete a una prueba confirmatoria con una prueba complementaria más específica (p. ej., una reacción en cadena de la polimerasa (PCR), inmunotransferencia o, con menos frecuencia, un ensayo de inmunofluorescencia (IFA)). Solo las muestras que son repetidamente reactivas por ELISA y positivas por IFA o PCR o reactivas por inmunotransferencia se consideran VIH-positivas e indicativas de infección por VIH. Las muestras que reaccionan repetidamente a la prueba ELISA a veces dan un resultado indeterminado en la prueba Western blot, que puede ser una respuesta incompleta de anticuerpos al VIH en una persona infectada o reacciones no específicas en una persona no infectada. [116]
Muertes por VIH en 2014 excluyendo EE. UU.: [117]
Aunque la inmunofluorescencia inducida por el VIH puede utilizarse para confirmar la infección en estos casos ambiguos, este ensayo no se utiliza ampliamente. En general, se debe recoger una segunda muestra más de un mes después y volver a analizarla en personas con resultados indeterminados en la prueba Western blot. Aunque es mucho menos común, las pruebas de ácidos nucleicos (por ejemplo, el método de amplificación del ARN viral o del ADN proviral) también pueden ayudar al diagnóstico en ciertas situaciones. [115] Además, algunas muestras analizadas pueden proporcionar resultados no concluyentes debido a una cantidad baja de muestra. En estas situaciones, se recoge una segunda muestra y se analiza para detectar la infección por VIH.
Las pruebas modernas de detección del VIH son extremadamente precisas si se tiene en cuenta el período de ventana . Una sola prueba de detección es correcta en más del 99 % de los casos. [118] Se estima que la probabilidad de un resultado falso positivo en un protocolo de prueba estándar de dos pasos es de aproximadamente 1 en 250 000 en una población de bajo riesgo. [119] Se recomienda realizar pruebas posteriores a la exposición inmediatamente y luego a las seis semanas, a los tres meses y a los seis meses. [120]
Las últimas recomendaciones de los Centros para el Control y la Prevención de Enfermedades de Estados Unidos (CDC) indican que la prueba del VIH debe comenzar con un inmunoensayo combinado para detectar anticuerpos contra el VIH-1 y el VIH-2 y el antígeno p24 . Un resultado negativo descarta la exposición al VIH, mientras que un resultado positivo debe ir seguido de un inmunoensayo de diferenciación de anticuerpos contra el VIH-1/2 para detectar qué anticuerpos están presentes. Esto da lugar a cuatro posibles escenarios:
La investigación sobre el VIH/SIDA incluye toda la investigación médica que intenta prevenir, tratar o curar el VIH/SIDA , así como la investigación fundamental sobre la naturaleza del VIH como agente infeccioso y el SIDA como la enfermedad causada por el VIH.
Muchos gobiernos e instituciones de investigación participan en la investigación sobre el VIH/SIDA. Esta investigación incluye intervenciones de salud conductual , como la investigación sobre educación sexual , y el desarrollo de medicamentos , como la investigación sobre microbicidas para enfermedades de transmisión sexual , vacunas contra el VIH y medicamentos antirretrovirales . [122] Otras áreas de investigación médica incluyen los temas de profilaxis previa a la exposición , profilaxis posterior a la exposición , circuncisión y efectos del envejecimiento acelerado .
El tratamiento del VIH/SIDA suele implicar el uso de múltiples fármacos antirretrovirales . En muchas partes del mundo, el VIH se ha convertido en una enfermedad crónica y la progresión al SIDA es cada vez más rara.
La latencia del VIH y el reservorio viral resultante en las células T CD4 + , las células dendríticas y los macrófagos son la principal barrera para la erradicación del virus. [19] [123]
Si bien el VIH es altamente virulento, la transmisión a través del contacto sexual no ocurre cuando una persona VIH positiva mantiene una carga viral consistentemente indetectable (<50 copias/ml) debido al tratamiento antirretroviral. Este concepto fue propuesto por primera vez por la Comisión Federal Suiza para el SIDA/VIH en 2008 en lo que se conoce como la Declaración Suiza . [124] [125] Aunque inicialmente fue controvertido, estudios posteriores han confirmado que el riesgo de transmisión del VIH a través del sexo es efectivamente cero cuando la persona VIH positiva tiene una carga viral consistentemente indetectable, un concepto ahora ampliamente conocido como I=I, o "Indetectable = Intransmisible". [126] [127]
Los estudios que establecieron el principio I=I incluyen Opposites Attract, [128] PARTNER 1, [129] PARTNER 2 [5] [130] (que se centró en parejas de hombre-hombre), [131] y HPTN052 [132] (que se centró en parejas heterosexuales). [131] Estos estudios involucraron parejas donde un miembro de la pareja era VIH positivo y el otro VIH negativo, e incluyeron pruebas regulares de VIH. En estos cuatro estudios, participaron un total de 4.097 parejas de cuatro continentes, que informaron 151.880 actos de sexo sin condón con cero transmisiones de VIH vinculadas filogenéticamente cuando el miembro de la pareja positivo tenía una carga viral indetectable. [133] Después de estos hallazgos, la declaración de consenso I=U que abogaba por el uso del término "riesgo cero" fue respaldada por numerosas personas y organizaciones, incluidos los CDC , la Asociación Británica del VIH y la revista médica The Lancet . [134]
Además, la reactivación del virus del herpes simple tipo 2 (HSV-2) en personas con herpes genital se asocia con un aumento de las células T CD4 + enriquecidas con CCR-5 y de las células dendríticas inflamatorias en la dermis de la piel genital ulcerada, que persiste incluso después de la curación de la úlcera. El tropismo del VIH por las células positivas para CCR-5 contribuye al aumento de dos a tres veces del riesgo de contraer el VIH en personas con herpes genital. En particular, la medicación antiviral diaria, como el aciclovir , no reduce la inflamación subclínica posterior a la reactivación y, por lo tanto, no disminuye el riesgo de contraer el VIH. [135] [136]
La primera noticia sobre "una nueva enfermedad exótica" apareció el 18 de mayo de 1981 en el periódico gay New York Native . [137]
El SIDA se observó clínicamente por primera vez en 1981 en los Estados Unidos. [138] Los casos iniciales fueron un grupo de usuarios de drogas inyectables y hombres homosexuales sin causa conocida de inmunidad deteriorada que mostraron síntomas de neumonía por Pneumocystis (PCP o PJP, el último término reconoce que el agente causal ahora se llama Pneumocystis jirovecii ), una infección oportunista rara que se sabía que ocurría en personas con sistemas inmunológicos muy comprometidos. [139] Poco después, investigadores de la Facultad de Medicina de la Universidad de Nueva York estudiaron a hombres homosexuales que desarrollaban un cáncer de piel previamente raro llamado sarcoma de Kaposi (KS). [140] [141] Surgieron muchos más casos de PJP y KS, alertando a los Centros para el Control y la Prevención de Enfermedades (CDC) de EE. UU. y se formó un grupo de trabajo de los CDC para monitorear el brote. [142] Se cree que el primer caso de SIDA descrito retrospectivamente fue en Noruega a principios de 1966. [143]
Al principio, los CDC no tenían un nombre oficial para la enfermedad, a menudo se referían a ella por medio de las enfermedades que estaban asociadas con ella, por ejemplo, linfadenopatía , la enfermedad después de la cual los descubridores del VIH originalmente nombraron al virus. [144] [145] También utilizaron Sarcoma de Kaposi e Infecciones Oportunistas , el nombre con el que se había creado un grupo de trabajo en 1981. [146] En la prensa general, se había acuñado el término GRID , que significaba inmunodeficiencia relacionada con los homosexuales . [147] Los CDC, en busca de un nombre y observando a las comunidades infectadas, acuñaron "la enfermedad 4H", ya que parecía distinguir a los homosexuales, los consumidores de heroína, los hemofílicos y los haitianos . [148] [149] Sin embargo, después de determinar que el SIDA no estaba limitado a la comunidad gay , [146] se comprendió que el término GRID era engañoso y se introdujo el SIDA en una reunión en julio de 1982. [150] En septiembre de 1982, el CDC comenzó a utilizar el nombre SIDA. [151]
En 1983, dos grupos de investigación separados dirigidos por el estadounidense Robert Gallo y los investigadores franceses Françoise Barré-Sinoussi y Luc Montagnier declararon independientemente que un nuevo retrovirus podría haber estado infectando a pacientes con SIDA, y publicaron sus hallazgos en el mismo número de la revista Science . [152] [145] [153] Gallo afirmó que un virus que su grupo había aislado de una persona con SIDA era sorprendentemente similar en forma a otros virus linfotrópicos T humanos (HTLV) que su grupo había sido el primero en aislar. Gallo admitió en 1987 que el virus que afirmó haber descubierto en 1984 era en realidad un virus que le habían enviado desde Francia el año anterior. [154] El grupo de Gallo llamó a su virus recién aislado HTLV-III. El grupo de Montagnier aisló un virus de un paciente que presentaba hinchazón de los ganglios linfáticos del cuello y debilidad física , dos síntomas clásicos de la infección primaria por VIH. En contradicción con el informe del grupo de Gallo, Montagnier y sus colegas demostraron que las proteínas centrales de este virus eran inmunológicamente diferentes de las del HTLV-I. El grupo de Montagnier denominó al virus aislado virus asociado a la linfadenopatía (LAV). [142] Como estos dos virus resultaron ser el mismo, en 1986 el LAV y el HTLV-III fueron rebautizados como VIH. [155]
Otro grupo que trabajó simultáneamente con los grupos de Montagnier y Gallo fue el de Jay A. Levy en la Universidad de California en San Francisco . En 1983, Levy descubrió de forma independiente el virus del SIDA y lo denominó retrovirus asociado al SIDA (ARV). [156] Este virus era muy diferente del virus informado por los grupos de Montagnier y Gallo. Las cepas del ARV indicaron, por primera vez, la heterogeneidad de los aislamientos del VIH y varios de ellos siguen siendo ejemplos clásicos del virus del SIDA que se encuentra en los Estados Unidos. [157]
Se cree que tanto el VIH-1 como el VIH-2 se originaron en primates no humanos en África central y occidental, y se cree que se transfirieron a los humanos (un proceso conocido como zoonosis ) a principios del siglo XX. [158] [159]
El VIH-1 parece haberse originado en el sur de Camerún a través de la evolución de SIVcpz, un virus de inmunodeficiencia en simios (VIS) que infecta a los chimpancés salvajes (el VIH-1 desciende del SIVcpz endémico en la subespecie de chimpancé Pan troglodytes troglodytes ). [160] [161] El pariente más cercano del VIH-2 es el SIVsmm, un virus del mangabey hollín ( Cercocebus atys atys ), un mono del Viejo Mundo que vive en el litoral de África occidental (desde el sur de Senegal hasta el oeste de Costa de Marfil ). [21] Los monos del Nuevo Mundo, como el mono búho , son resistentes a la infección por VIH-1, posiblemente debido a una fusión genómica de dos genes de resistencia viral. [162]
Se cree que el VIH-1 ha saltado la barrera de las especies en al menos tres ocasiones distintas, dando origen a los tres grupos del virus: M, N y O. [163]

Hay evidencia de que los humanos que participan en actividades de caza de animales silvestres , ya sea como cazadores o como vendedores de carne de animales silvestres, comúnmente contraen el SIV. [164] Sin embargo, el SIV es un virus débil y, por lo general, el sistema inmunológico humano lo suprime en cuestión de semanas después de la infección. Se cree que son necesarias varias transmisiones del virus de un individuo a otro en rápida sucesión para permitirle suficiente tiempo para mutar en VIH. [165] Además, debido a su tasa de transmisión de persona a persona relativamente baja, solo puede propagarse en toda la población en presencia de uno o más canales de transmisión de alto riesgo, que se cree que no existían en África antes del siglo XX.
Los canales de transmisión de alto riesgo específicos propuestos, que permiten que el virus se adapte a los humanos y se propague por toda la sociedad, dependen del momento propuesto del cruce de animal a humano. Los estudios genéticos del virus sugieren que el ancestro común más reciente del grupo M del VIH-1 se remonta a c. 1910. [ 166] Los defensores de esta datación vinculan la epidemia del VIH con el surgimiento del colonialismo y el crecimiento de las grandes ciudades coloniales africanas, lo que llevó a cambios sociales, incluidos diferentes patrones de contacto sexual (especialmente asociaciones múltiples y concurrentes), la propagación de la prostitución y la alta frecuencia concomitante de enfermedades de úlcera genital (como la sífilis ) en las ciudades coloniales nacientes. [167] Si bien las tasas de transmisión del VIH durante las relaciones sexuales vaginales suelen ser bajas, aumentan muchas veces si uno de los miembros de la pareja tiene una infección de transmisión sexual que resulta en úlceras genitales. Las ciudades coloniales de principios del siglo XX se destacaron por su alta prevalencia de prostitución y úlceras genitales, hasta el punto de que en 1928 se pensaba que hasta el 45% de las mujeres residentes en el este de Leopoldville (actualmente Kinshasa) eran prostitutas y en 1933 alrededor del 15% de todos los residentes de la misma ciudad estaban infectados por una de las formas de sífilis . [167]
El caso más antiguo y bien documentado de VIH en un ser humano se remonta a 1959 en el Congo Belga . [168] El virus puede haber estado presente en los Estados Unidos ya a mediados o fines de la década de 1960, cuando un joven de dieciséis años llamado Robert Rayford presentó síntomas en 1966 y murió en 1969. [169]
Una hipótesis alternativa y probablemente complementaria apunta al uso generalizado de prácticas médicas inseguras en África durante los años posteriores a la Segunda Guerra Mundial, como la reutilización no esterilizada de jeringas de un solo uso durante las campañas masivas de vacunación, antibióticos y tratamiento contra la malaria. [165] [170] [171] La investigación sobre el momento del ancestro común más reciente de los grupos M y O del VIH-1, así como sobre los grupos A y B del VIH-2, indica que el SIV ha dado lugar a linajes transmisibles del VIH a lo largo del siglo XX. [172] La dispersión temporal de estas transmisiones a los humanos implica que no se necesita un único factor externo para explicar la transmisión cruzada del VIH. Esta observación es coherente con las dos opiniones predominantes sobre el origen de las epidemias del VIH, a saber, la transmisión del SIV a los humanos durante la matanza o despiece de primates infectados y la expansión colonial de las ciudades del África subsahariana. [172]
{{cite web}}: CS1 maint: URL no apta ( enlace ){{cite web}}: CS1 maint: URL no apta ( enlace )El director del NIAID, Anthony S. Fauci, MD, y sus colegas resumen los resultados de grandes ensayos clínicos y estudios de cohorte que validan I=I. El ensayo clínico de referencia HPTN 052 financiado por los NIH mostró que no se produjeron transmisiones vinculadas del VIH entre parejas heterosexuales serodiferentes al VIH cuando la pareja que vivía con el VIH tenía una carga viral suprimida de forma duradera. Posteriormente, los estudios PARTNER y Opposites Attract confirmaron estos hallazgos y los extendieron a parejas de hombre-hombre. ... El éxito de I=I como método de prevención del VIH depende de lograr y mantener una carga viral indetectable tomando TAR diariamente según lo prescrito.
El Dr. Marx cree que el evento crucial fue la introducción en África de millones de jeringas baratas y producidas en masa en la década de 1950. ... sospechan que el crecimiento de las ciudades coloniales es el culpable. Antes de 1910, ninguna ciudad centroafricana tenía más de 10.000 habitantes. Pero la migración urbana aumentó, lo que aumentó los contactos sexuales y dio lugar a los distritos de luz roja.