La endocarditis infecciosa es una infección de la superficie interna del corazón ( endocardio ), generalmente las válvulas . [1] Los signos y síntomas pueden incluir fiebre , pequeñas áreas de sangrado en la piel , soplo cardíaco , sensación de cansancio y bajo recuento de glóbulos rojos . [1] [8] Las complicaciones pueden incluir flujo sanguíneo retrógrado en el corazón , insuficiencia cardíaca (el corazón lucha por bombear una cantidad suficiente de sangre para satisfacer las necesidades del cuerpo), conducción eléctrica anormal en el corazón , accidente cerebrovascular e insuficiencia renal . [1] [2] [8] [9]
La causa es típicamente una infección bacteriana y con menos frecuencia una infección fúngica . [1] Los factores de riesgo incluyen la enfermedad cardíaca valvular , incluyendo enfermedad reumática , enfermedad cardíaca congénita , válvulas artificiales , hemodiálisis , uso de drogas intravenosas y marcapasos electrónicos . [6] [7] [5] Las bacterias más comúnmente involucradas son estreptococos o estafilococos . [1] El diagnóstico se sospecha en base a los síntomas y respaldado por cultivos de sangre o ecografía del corazón. [1] También existe una forma no infecciosa de endocarditis . [1]
La utilidad de los antibióticos después de los procedimientos dentales para la prevención no está clara. [10] Algunos los recomiendan para personas con alto riesgo. [1] El tratamiento es generalmente con antibióticos intravenosos . [1] La elección de los antibióticos se basa en los resultados de los cultivos de sangre. [1] Ocasionalmente se requiere cirugía cardíaca . [1] El número de personas afectadas es de aproximadamente 5 por 100.000 por año. [6] Las tasas, sin embargo, varían entre las regiones del mundo. [6] La endocarditis infecciosa se presenta en hombres con más frecuencia que en mujeres. [1] El riesgo de muerte entre los infectados es de aproximadamente el 25%. [6] Sin tratamiento, es casi universalmente fatal. [1] La mejora del diagnóstico y las opciones de tratamiento han mejorado significativamente la esperanza de vida de los pacientes con endocarditis infecciosa, en particular con cardiopatía congénita. [5]
La endocarditis infecciosa se divide en tres categorías: aguda, subaguda y crónica, según la duración de los síntomas. [11] La endocarditis infecciosa aguda se refiere a la presencia de signos y síntomas de endocarditis infecciosa que están presentes durante días hasta seis semanas. [11] Si estos signos y síntomas persisten durante más de seis semanas pero menos de tres meses, se trata de endocarditis infecciosa subaguda. [11] La endocarditis infecciosa crónica se refiere a la presencia de dichos signos y síntomas cuando persisten durante más de tres meses. [11]
Actualmente, no se recomienda esta clasificación porque las asociaciones atribuidas (en términos de organismo y pronóstico) no eran lo suficientemente sólidas como para confiar en ellas clínicamente. Se prefieren los términos incubación corta (es decir, menos de unas seis semanas) e incubación larga (más de unas seis semanas). [13]
La endocarditis infecciosa también puede clasificarse como con cultivo positivo o negativo . La causa más común de endocarditis con "cultivo negativo" es la administración previa de antibióticos y puede ocurrir en hasta el 31% de los casos. [14] [7]
En ocasiones, los microorganismos pueden tardar más tiempo en crecer en los medios de cultivo, por ejemplo, Cutibacterium spp. [15] y el grupo de bacterias HACEK. Se dice que algunos organismos son exigentes porque tienen requisitos de crecimiento exigentes. Algunos ejemplos incluyen patógenos como especies de Aspergillus , especies de Brucella , Coxiella burnetii y especies de Chlamydia . Debido al retraso en el crecimiento y la identificación en estos casos, los pacientes pueden ser clasificados erróneamente como endocarditis "cultivo negativo". [16]
La endocarditis también se puede clasificar según el lado del corazón afectado:
Otra forma de endocarditis es la endocarditis asociada a la atención médica, en la que se cree que el organismo infeccioso se transmite en un entorno de atención médica, como un hospital, una unidad de diálisis o una residencia de ancianos. La endocarditis nosocomial es una forma de endocarditis asociada a la atención médica en la que el organismo infeccioso se adquiere durante una estancia en un hospital y suele ser secundaria a la presencia de catéteres intravenosos, líneas de nutrición parenteral total , marcapasos , etc. [17]
Por último, la distinción entre endocarditis de válvula nativa y endocarditis de válvula protésica es clínicamente importante. La endocarditis de válvula protésica puede ser temprana (dentro del año posterior a la cirugía) o tardía (> 1 año después de la cirugía valvular). [7]
La endocarditis de válvulas protésicas es causada comúnmente por Staphylococcus epidermidis , ya que es capaz de crecer como una biopelícula en superficies plásticas. [18] Cutibacterium acnes causa casi exclusivamente endocarditis en válvulas cardíacas protésicas. [15]
Muchos microorganismos pueden causar endocarditis infecciosa. Estos generalmente se aíslan mediante un hemocultivo , en el que se extrae sangre del paciente y se anota e identifica cualquier crecimiento. El término endocarditis bacteriana (EB) se utiliza comúnmente, lo que refleja el hecho de que la mayoría de los casos de EI se deben a bacterias; sin embargo, endocarditis infecciosa (EI) se ha convertido en el término preferido. [7]
El Staphylococcus aureus es la principal causa de endocarditis infecciosa en la mayor parte del mundo y es responsable de aproximadamente el 31% de los casos. [11] El Staphylococcus aureus es la causa más común de endocarditis en personas que usan drogas intravenosas. [23] Los estreptococos viridans y los enterococos son el segundo y tercer organismo más común responsable de la endocarditis infecciosa. [11] Los estreptococos viridans son una causa común de endocarditis infecciosa en América del Sur. Otros estreptococos también son una causa frecuente. La endocarditis infecciosa debido a Streptococcus bovis ocurre con mayor frecuencia en Europa que en América del Norte. [11] El grupo de bacterias HACEK también son causas raras de endocarditis infecciosa en América del Norte. [24]
El grupo viridans incluye S. oralis , S. mitis , S. sanguis , S. gordonii y S. parasanguis . Los hábitats primarios de estos organismos son la cavidad oral y el tracto respiratorio superior. [25] Estas bacterias están presentes en la flora oral normal y entran al torrente sanguíneo debido a la alteración de los tejidos en la boca cuando se realizan procedimientos quirúrgicos dentales (extracciones dentales) o manipulación genitourinaria. De manera similar, los organismos HACEK son un grupo de bacterias que viven en las encías dentales y se pueden ver en personas que se inyectan drogas y contaminan sus agujas con saliva. Los pacientes también pueden tener antecedentes de mala higiene dental o enfermedad valvular preexistente. [26]
Los estreptococos alfa-hemolíticos viridans , que están presentes en la boca, son los microorganismos que se aíslan con mayor frecuencia cuando la infección se adquiere en un entorno comunitario. Por el contrario, las infecciones del torrente sanguíneo por Staphylococcus se adquieren con frecuencia en un entorno de atención médica, donde pueden ingresar al torrente sanguíneo a través de procedimientos que causan roturas en la integridad de la piel, como cirugía, cateterización o durante el acceso de catéteres permanentes de largo plazo o secundarios a la inyección intravenosa de drogas recreativas. [ cita requerida ]
El enterococo puede ingresar al torrente sanguíneo como consecuencia de anomalías en el tracto gastrointestinal o genitourinario. [ cita requerida ]
Algunos organismos, cuando se aíslan, dan pistas valiosas sobre la causa, ya que tienden a ser específicos.
Se han publicado múltiples informes de casos de endocarditis infecciosa causada por organismos inusuales. Cutibacterium spp., que son flora cutánea normal, han sido responsables de endocarditis infecciosa, preferentemente en pacientes con válvulas cardíacas protésicas, en casos raros que han llevado a la muerte. [31] Tropheryma whipplei ha causado endocarditis sin afectación gastrointestinal. [32] Citrobacter koseri se encontró en un adulto inmunocompetente. [33] Neisseria bacilliformis se encontró en una persona con una válvula aórtica bicúspide . [34]
Se cree que uno de cada ocho casos de endocarditis infecciosa es causado por una infección por S. viridans asociada a procedimientos dentales como limpieza o extracción de dientes [25] [ fuente obsoleta ] . Se pensaba que esto era más significativo clínicamente de lo que es [ cita requerida ] . Sin embargo, es importante que se informe a un dentista o higienista dental sobre cualquier problema cardíaco antes de comenzar el tratamiento. Se administraban antibióticos profilácticos regularmente a pacientes con ciertas afecciones cardíacas como medida de precaución, aunque esta práctica ha cambiado en los EE. UU., con las nuevas pautas de la Asociación Estadounidense del Corazón publicadas en 2007, [35] y en el Reino Unido a partir de marzo de 2008 debido a las nuevas pautas del NICE .
La endocarditis fúngica (EF) suele ser mortal y una de las formas más graves de endocarditis infecciosa. Los tipos de hongos que se observan con mayor frecuencia asociados con esta enfermedad son:
Candida albicans se presenta como una levadura esférica u ovalada en ciernes . Se asocia con endocarditis en personas que se inyectan drogas, pacientes con válvulas protésicas y pacientes inmunodeprimidos . Forma biopelículas alrededor de estructuras en reposo de paredes gruesas como válvulas cardíacas protésicas y, además, coloniza y penetra las paredes endoteliales . [25] C. albicans es responsable del 24-46% de todos los casos de endocarditis infecciosa y su tasa de mortalidad es del 46,6-50%. [36]
Otros hongos que se ha demostrado que causan endocarditis son Histoplasma capsulatum y Aspergillus . [30] Aspergillus contribuye a aproximadamente el 25% de los casos de EF. [36] También se ha informado de endocarditis por Tricosporon asahii en un informe de caso. [37]
Los factores de riesgo de la endocarditis infecciosa se basan en la premisa de que en un individuo sano, la bacteriemia (entrada de bacterias en el torrente sanguíneo) se elimina rápidamente sin consecuencias adversas. [38] Sin embargo, si una válvula cardíaca está dañada, las bacterias pueden adherirse a ella, lo que da lugar a una endocarditis infecciosa. Además, en personas con sistemas inmunitarios debilitados, la concentración de bacterias en la sangre puede alcanzar niveles lo suficientemente altos como para aumentar la probabilidad de que algunas se adhieran a la válvula. A continuación se enumeran algunos factores de riesgo importantes: [11] [38]

Las válvulas y el endocardio dañados contribuyen al desarrollo de la endocarditis infecciosa. [38] En concreto, la parte dañada de una válvula cardíaca forma un coágulo sanguíneo local , una afección conocida como endocarditis trombótica no bacteriana (ETNB) . Los depósitos de plaquetas y fibrina que se forman como parte del proceso de coagulación sanguínea permiten que las bacterias se afiancen y formen vegetaciones . Como se mencionó anteriormente, el cuerpo no tiene métodos directos para combatir las vegetaciones valvulares porque las válvulas no tienen un suministro de sangre dedicado. Esta combinación de válvulas dañadas, crecimiento bacteriano y falta de una respuesta inmunitaria fuerte da como resultado la endocarditis infecciosa. [ cita requerida ]
Los daños a las válvulas y al endocardio pueden ser causados por: [38]
Los factores de riesgo de la endocarditis infecciosa proporcionan una lista más extensa de afecciones que pueden dañar el corazón.
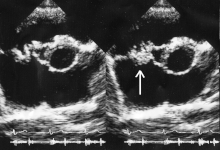
En general, se deben cumplir los criterios de Duke para establecer el diagnóstico de endocarditis. [11] [39] Aunque los criterios de Duke se utilizan ampliamente, tienen limitaciones significativas. [11] Por ejemplo, la sensibilidad de los criterios de Duke para detectar endocarditis infecciosa disminuye cuando hay válvulas cardíacas protésicas. [11]
Como los criterios de Duke dependen en gran medida de los resultados de la ecocardiografía, la investigación ha abordado cuándo solicitar un ecocardiograma utilizando signos y síntomas para predecir la endocarditis oculta entre personas que se inyectan drogas [40] [41] [42] y entre pacientes que no abusan de drogas. [43] [44] Sin embargo, esta investigación tiene más de veinte años y es posible que los cambios en la epidemiología de la endocarditis y bacterias como los estafilococos hagan que las siguientes estimaciones sean incorrectas.
No se ha demostrado que los análisis de sangre de proteína C reactiva (PCR) y procalcitonina sean particularmente útiles para ayudar a realizar o descartar el diagnóstico. [45]
La ecocardiografía es el principal tipo de diagnóstico por imágenes que se utiliza para establecer el diagnóstico de endocarditis infecciosa. [11] Hay dos tipos principales de ecocardiografía que se utilizan para ayudar con el diagnóstico de EI: la ecocardiografía transtorácica (ETT) y la ecocardiografía transesofágica (ETE). [11]
El ecocardiograma transtorácico tiene una sensibilidad y especificidad de aproximadamente el 65% y el 95% si el ecocardiografista cree que hay evidencia "probable" o "casi segura" de endocarditis. [46] [47] Sin embargo, en la endocarditis que involucra una válvula protésica, la ETT tiene una sensibilidad de aproximadamente el 50%, mientras que la ETE tiene una sensibilidad que excede el 90%. [11] La ETE también tiene un papel diagnóstico importante cuando la ETT no revela EI pero la sospecha diagnóstica sigue siendo alta, ya que la ETE es más sensible para la endocarditis infecciosa y es más capaz de caracterizar el daño relacionado con la infección a las válvulas cardíacas y los tejidos circundantes. [11]
Las pautas respaldan el uso inicial de ETT en lugar de ETE en personas con hemocultivos anormales, un soplo cardíaco nuevo y sospecha de endocarditis infecciosa. [11] La ETE es la forma inicial preferida de diagnóstico por imágenes en personas con sospecha de endocarditis infecciosa que tienen una probabilidad moderada a alta de endocarditis infecciosa antes de la prueba, incluidas las personas con válvulas cardíacas protésicas, hemocultivos con crecimiento de Staphylococcus o que tienen un dispositivo intracardíaco (como un marcapasos ). [11]
Los criterios de Duke, establecidos en 1994 por el Servicio de Endocarditis de Duke y revisados en 2000, son una colección de criterios mayores y menores utilizados para establecer un diagnóstico de endocarditis infecciosa. [39] [50] Según los criterios de Duke, el diagnóstico de endocarditis infecciosa puede ser definitivo, posible o rechazado. [38] Un diagnóstico de endocarditis infecciosa es definitivo si se cumplen los siguientes criterios patológicos o clínicos:
Uno de estos criterios patológicos:
Una de estas combinaciones de criterios clínicos
El diagnóstico de endocarditis infecciosa es posible si se cumple una de las siguientes combinaciones de criterios clínicos:
Cultivo de sangre positivo con microorganismo típico de IE, definido como uno de los siguientes: [38]
La evidencia de compromiso endocárdico con ecocardiograma positivo se define como
Criterios de Duke modificados actualizados (2023) para la endocarditis infecciosa: la endocarditis infecciosa (EI) es una afección potencialmente mortal y los criterios de Duke (establecidos en 1994 y revisados en 2000) han sido fundamentales para el diagnóstico de la enfermedad. Sin embargo, el panorama de la microbiología, el diagnóstico, la epidemiología y el tratamiento de la EI ha evolucionado significativamente a lo largo de los años. Los criterios de Duke modificados de 2023 abordan estos cambios: Criterios de Duke modificados actualizados (2023) para la endocarditis infecciosa
Entre las personas que no usan drogas intravenosas y tienen fiebre en el departamento de emergencias , hay una probabilidad de endocarditis oculta de menos del 5%. Mellors en 1987 no encontró casos de endocarditis ni de bacteriemia estafilocócica entre 135 pacientes febriles en la sala de emergencias . [44] El intervalo de confianza superior para el 0% de 135 es del 5%, por lo que solo por razones estadísticas, hay hasta un 5% de probabilidad de endocarditis entre estos pacientes. En contraste, Leibovici encontró que entre 113 adultos no seleccionados ingresados en el hospital debido a fiebre hubo dos casos (1,8% con IC del 95%: 0% a 7%) de endocarditis. [43]
Entre las personas que usan drogas intravenosas y tienen fiebre en el departamento de emergencias, hay una prevalencia de endocarditis de alrededor del 10% al 15%. Esta estimación no cambia sustancialmente si el médico cree que el paciente tiene una explicación trivial para su fiebre. [42] Weisse encontró que el 13% de 121 pacientes tenían endocarditis. [40] Marantz también encontró una prevalencia de endocarditis del 13% entre dichos pacientes en el departamento de emergencias con fiebre. [42] Samet encontró una incidencia del 6% entre 283 de esos pacientes, pero después de excluir a los pacientes con una enfermedad importante aparentemente inicial para explicar la fiebre (incluidos 11 casos de endocarditis manifiesta), hubo una prevalencia de endocarditis del 7%. [41] Durante la epidemia de opioides en los Estados Unidos , los hospitales observaron un aumento en los accidentes cerebrovasculares asociados con la endocarditis infecciosa. [51]
Entre las personas con bacteriemia estafilocócica (BSA), un estudio encontró una prevalencia de endocarditis del 29% en la BSA adquirida en la comunidad frente al 5% en la BSA nosocomial. [52] Sin embargo, solo el 2% de las cepas fueron resistentes a la meticilina, por lo que estos números pueden ser bajos en áreas de mayor resistencia. [ cita requerida ]
No todas las personas con cardiopatías necesitan antibióticos para prevenir la endocarditis infecciosa. Las cardiopatías se han clasificado en riesgo alto, medio y bajo de desarrollar endocarditis infecciosa. Las que entran en la categoría de alto riesgo necesitan profilaxis de la endocarditis infecciosa antes de las endoscopias y los procedimientos del tracto urinario. Las enfermedades que se enumeran como de alto riesgo incluyen: [7]
Los siguientes son los regímenes de antibióticos recomendados por la Asociación Estadounidense del Corazón para la profilaxis con antibióticos: [35]
En el Reino Unido, las directrices clínicas del NICE ya no recomiendan la profilaxis porque no hay evidencia clínica de que reduzca la incidencia de EI y hay efectos negativos (por ejemplo, alergia y mayor resistencia bacteriana) de tomar antibióticos que pueden superar los beneficios. [53]
Históricamente, los antibióticos se recomendaban comúnmente para prevenir la endocarditis infecciosa en pacientes con problemas cardíacos que se sometían a procedimientos dentales (conocidos como profilaxis antibiótica dental ). Sin embargo, no hay evidencia suficiente para respaldar si los antibióticos son efectivos o ineficaces para prevenir la endocarditis infecciosa cuando se administran antes de un procedimiento dental en personas con alto riesgo. [54] Se recomiendan con menos frecuencia para este procedimiento. [55]
En algunos países, como los EE. UU., a los pacientes de alto riesgo se les pueden administrar antibióticos profilácticos como penicilina o clindamicina para personas alérgicas a la penicilina antes de los procedimientos dentales. [25] Los profilácticos deben ser bactericidas en lugar de bacteriostáticos . [25] Tales medidas no se toman en ciertos países, como Escocia, debido al temor a la resistencia a los antibióticos . [56] Debido a que las bacterias son la causa más común de endocarditis infecciosa, se utilizan antibióticos como penicilina [25] y amoxicilina (para bacterias productoras de betalactamasa ) en la profilaxis. [ cita requerida ]
Los antibióticos en dosis altas son la piedra angular del tratamiento de la endocarditis infecciosa. Estos antibióticos se administran por vía intravenosa (IV) para maximizar la difusión de las moléculas de antibióticos hacia la vegetación desde la sangre que llena las cámaras del corazón. Esto es necesario porque ni las válvulas cardíacas ni las vegetaciones adheridas a ellas reciben irrigación de los vasos sanguíneos. Los antibióticos suelen continuar durante dos a seis semanas, según las características de la infección y los microorganismos causantes . El tratamiento con antibióticos reduce el riesgo de complicaciones embólicas en personas con endocarditis infecciosa. [11]
En la endocarditis aguda, debido a la inflamación fulminante, se inicia una terapia antibiótica empírica inmediatamente después de que se haya extraído la sangre para el cultivo con el fin de aclarar los organismos bacterianos responsables de la infección. Esto generalmente incluye infusiones intravenosas de vancomicina y ceftriaxona hasta que se identifique el organismo infectante y esté disponible el informe de susceptibilidad con la concentración inhibitoria mínima . Una vez que se dispone de esta información, esto permite al profesional de la salud supervisor modificar la terapia antimicrobiana para dirigirse al microorganismo infectante específico. El uso rutinario de gentamicina para tratar la endocarditis ha caído en desuso debido a la falta de evidencia que respalde su uso (excepto en infecciones causadas por Enterococcus y estreptococos variantes nutricionales ) y la alta tasa de complicaciones. [57] En los casos de endocarditis subaguda, donde el estado hemodinámico de la persona suele ser estable, el tratamiento antibiótico puede retrasarse hasta que se pueda identificar el microorganismo causante. [ cita requerida ]
Los estreptococos del grupo viridans y Streptococcus bovis suelen ser muy susceptibles a la penicilina y pueden tratarse con penicilina o ceftriaxona. [58] Las cepas relativamente resistentes de estreptococos del grupo viridans y Streptococcus bovis se tratan con penicilina o ceftriaxona junto con un tratamiento más corto de dos semanas con un aminoglucósido durante la fase inicial del tratamiento. [58] Las cepas altamente resistentes a la penicilina de estreptococos del grupo viridans, estreptococos nutricionalmente variantes como Granulicatella sp. , Gemella sp. , Abiotrophia defectiva , [59] y Enterococci suelen tratarse con una terapia combinada que consiste en penicilina y un aminoglucósido durante toda la duración de 4 a 6 semanas. [58]
Algunas personas pueden recibir un tratamiento relativamente más corto [58] (dos semanas) con bencilpenicilina IV si la infección es causada por estreptococos del grupo viridans o Streptococcus bovis , siempre que se cumplan las siguientes condiciones:
Además, la endocarditis valvular nativa del lado derecho causada por Staphylococcus aureus sensible a la oxacilina también se puede tratar con un tratamiento corto de dos semanas con un antibiótico betalactámico como la nafcilina, con o sin aminoglucósidos.

La principal indicación para el tratamiento quirúrgico es la regurgitación o estenosis . En la endocarditis infecciosa activa, la cirugía debe eliminar suficiente tejido de las valvas para asegurar la erradicación del proceso infeccioso. [60] La reparación posterior de la válvula se puede realizar en la enfermedad limitada. [60] El reemplazo de la válvula con una válvula cardíaca artificial mecánica o bioprotésica es necesario en ciertas situaciones: [61]
Las directrices fueron actualizadas recientemente por el Colegio Americano de Cardiología y la Sociedad Europea de Cardiología . Se publicó recientemente un metanálisis que mostró que la intervención quirúrgica a los siete días o menos se asocia con una menor mortalidad. [62]
La endocarditis infecciosa se asocia con una mortalidad hospitalaria del 18 %. [24] Sin embargo, los pacientes adultos con cardiopatía congénita pueden tener una mortalidad relativamente menor, de hasta el 5 %, debido a su menor edad, la endocarditis derecha y el tratamiento por parte de equipos multidisciplinarios. Hasta el 50 % de las personas con endocarditis infecciosa pueden experimentar complicaciones embólicas. [11]
En los países desarrollados , la incidencia anual de endocarditis infecciosa es de 3 a 9 casos por cada 100.000 personas. [38] La endocarditis infecciosa se presenta con mayor frecuencia en hombres que en mujeres. [11] Hay una mayor incidencia de endocarditis infecciosa en personas de 65 años o más, lo que probablemente se debe a que las personas de este grupo de edad tienen un mayor número de factores de riesgo de endocarditis infecciosa. En los últimos años, más de un tercio de los casos de endocarditis infecciosa en los Estados Unidos estaban asociados a la atención médica . [38] Otra tendencia observada en los países desarrollados es que la cardiopatía reumática crónica representa menos del 10% de los casos. Aunque los antecedentes de enfermedad valvular tienen una asociación significativa con la endocarditis infecciosa, el 50% de todos los casos se desarrollan en personas sin antecedentes conocidos de enfermedad valvular. [ cita requerida ]
Pocas enfermedades presentan mayores dificultades para su diagnóstico que la endocarditis maligna, dificultades que en muchos casos son prácticamente insuperables. No es desmerecer a los numerosos médicos expertos que han dejado constancia de sus casos si se dice que en la mitad de los casos el diagnóstico se hizo post mortem.
—William Osler, 1885
Lazare Riviére describió por primera vez la endocarditis infecciosa que afectaba a la válvula aórtica en 1616. [11] En 1806, Jean-Nicolas Corvisart acuñó el término vegetación para describir las acumulaciones de desechos que se encontraban en una válvula mitral afectada por endocarditis infecciosa. [11] El médico británico Joseph Hodgson fue el primero en describir las complicaciones embólicas de la endocarditis infecciosa en 1815. [11] No fue hasta 1878 que Theodor Klebs sugirió por primera vez que la endocarditis infecciosa tenía un origen infeccioso microbiano. [11] En 1909, William Osler señaló que las válvulas cardíacas que experimentaban degeneración y estaban escleróticas o funcionaban mal tenían un mayor riesgo de verse afectadas. [11] Más tarde, en 1924, Emanuel Libman y Benjamin Sacks describieron casos de endocarditis vegetativa que carecían de un origen microbiano claro y que a menudo se asociaban con la enfermedad autoinmune lupus eritematoso sistémico . [11] En 1944, los médicos informaron sobre el primer uso exitoso de penicilina para tratar un caso de endocarditis infecciosa. [11]
{{cite journal}}: CS1 maint: DOI inactive as of September 2024 (link)