Streptococcus es un género de bacterias grampositivas ( pl.: cocos ) o esféricas que pertenece a la familia Streptococcaceae , dentro del orden Lactobacillales (bacterias del ácido láctico), en el filo Bacillota . [2] La división celular en los estreptococos ocurre a lo largo de un solo eje , por lo que cuando crecen tienden a formar pares o cadenas, que pueden aparecer dobladas o retorcidas. Esto difiere de los estafilococos , que se dividen a lo largo de múltiples ejes, generando así racimos de células irregulares, similares a uvas. La mayoría de los estreptococos son oxidasa-negativos y catalasa-negativos , y muchos son anaerobios facultativos (capaces de crecer tanto aeróbicamente como anaeróbicamente).
El término fue acuñado en 1877 por el cirujano vienés Albert Theodor Billroth (1829-1894), [3] combinando el prefijo "strepto-" (del griego antiguo : στρεπτός , romanizado : streptós , lit. 'fácilmente retorcido, flexible' [4] ), junto con el sufijo "-coccus" (del latín moderno : coccus , del griego antiguo: κόκκος , romanizado: kókkos , lit. 'grano, semilla, baya'. [5] ) En 1984, muchas bacterias anteriormente agrupadas en el género Streptococcus se separaron en los géneros Enterococcus y Lactococcus . [6] Actualmente, se reconocen más de 50 especies en este género. Se ha descubierto que este género forma parte del microbioma salival . [7]
Además de la faringitis estreptocócica (faringitis estreptocócica), ciertas especies de Streptococcus son responsables de muchos casos de conjuntivitis , [8] meningitis , neumonía bacteriana , endocarditis , erisipela y fascitis necrosante (infecciones bacterianas "carnívoras"). Sin embargo, muchas especies de estreptococos no son patógenas y forman parte de la microbiota humana comensal de la boca, la piel, el intestino y el tracto respiratorio superior. Los estreptococos también son un ingrediente necesario en la producción de queso emmental ("suizo") . [9]
Las especies de estreptococos se clasifican según sus propiedades hemolíticas . [10] Las especies alfa-hemolíticas causan la oxidación del hierro en las moléculas de hemoglobina dentro de los glóbulos rojos, lo que le da un color verdoso en agar sangre. Las especies beta-hemolíticas causan la ruptura completa de los glóbulos rojos. En agar sangre, esto aparece como áreas amplias libres de células sanguíneas que rodean las colonias bacterianas. Las especies gamma-hemolíticas no causan hemólisis. [11]
Los estreptococos beta-hemolíticos se clasifican además mediante el agrupamiento de Lancefield , una clasificación de serotipos (es decir, que describe los carbohidratos específicos presentes en la pared celular bacteriana). [6] Los 21 serotipos descritos se denominan grupos de Lancefield A a W (excluidos E, I y J). Este sistema de clasificación fue desarrollado por Rebecca Lancefield , científica de la Universidad Rockefeller . [12]
En el ámbito médico, los grupos más importantes son los estreptococos alfa-hemolíticos de los grupos S. pneumoniae y Streptococcus viridans , y los estreptococos beta-hemolíticos de los grupos Lancefield A y B (también conocidos como "estreptococos del grupo A" y "estreptococos del grupo B").
Tabla: Estreptococos de relevancia médica [10]
Cuando hay alfa-hemólisis (α-hemólisis), el agar debajo de la colonia se verá oscuro y verdoso debido a la conversión de hemoglobina en biliverdina verde . Streptococcus pneumoniae y un grupo de estreptococos orales ( Streptococcus viridans o estreptococos viridans) presentan alfa-hemólisis. La alfa-hemólisis también se denomina hemólisis incompleta o hemólisis parcial porque las membranas celulares de los glóbulos rojos quedan intactas. A esto también se le llama a veces hemólisis verde debido al cambio de color en el agar. [ cita requerida ]
La beta-hemólisis (β-hemólisis), a veces llamada hemólisis completa , es una lisis completa de los glóbulos rojos en el medio alrededor y debajo de las colonias: el área aparece aclarada (amarilla) y transparente. La estreptolisina, una exotoxina, es la enzima producida por la bacteria que causa la lisis completa de los glóbulos rojos. Hay dos tipos de estreptolisina: estreptolisina O (SLO) y estreptolisina S (SLS). La estreptolisina O es una citotoxina sensible al oxígeno, secretada por la mayoría de los estreptococos del grupo A (GAS), e interactúa con el colesterol en la membrana de las células eucariotas (principalmente glóbulos rojos y blancos, macrófagos y plaquetas), y generalmente da como resultado beta-hemólisis debajo de la superficie del agar sangre. La estreptolisina S es una citotoxina estable al oxígeno también producida por la mayoría de las cepas de GAS que da como resultado un aclaramiento en la superficie del agar sangre. El SLS afecta a las células inmunitarias, incluidos los leucocitos polimorfonucleares y los linfocitos, y se cree que impide que el sistema inmunitario del huésped elimine la infección. Streptococcus pyogenes , o GAS, presenta betahemólisis.
Algunas especies débilmente beta-hemolíticas causan una hemólisis intensa cuando se cultivan junto con una cepa de Staphylococcus . Esta es la llamada prueba CAMP . Streptococcus agalactiae muestra esta propiedad. Clostridium perfringens se puede identificar de manera presuntiva con esta prueba. Listeria monocytogenes también es positiva en agar sangre de carnero.

El S. pyogenes del grupo A es el agente causal de una amplia gama de infecciones por estreptococos del grupo A (EGA). Estas infecciones pueden ser invasivas o no invasivas. Las infecciones no invasivas tienden a ser más comunes y menos graves. Las más comunes de estas infecciones incluyen la faringitis estreptocócica (faringitis estreptocócica) y el impétigo . [13] La escarlatina es otro ejemplo de infección no invasiva del grupo A.
Las infecciones invasivas causadas por estreptococos beta-hemolíticos del grupo A tienden a ser más graves y menos comunes. Esto ocurre cuando la bacteria es capaz de infectar áreas en las que no se encuentra habitualmente, como la sangre y los órganos . [14] Las enfermedades que pueden ser causadas incluyen el síndrome de choque tóxico estreptocócico , la fascitis necrosante , la neumonía y la bacteriemia . [13] A nivel mundial, se ha estimado que el GAS causa más de 500.000 muertes cada año, lo que lo convierte en uno de los principales patógenos del mundo . [13]
El GAS puede causar complicaciones adicionales, a saber, fiebre reumática aguda y glomerulonefritis aguda . La fiebre reumática , una enfermedad que afecta las articulaciones , los riñones y las válvulas cardíacas , es una consecuencia de una infección por estreptococo A no tratada causada no por la bacteria en sí, sino por los anticuerpos creados por el sistema inmunológico para combatir la infección que reaccionan de forma cruzada con otras proteínas del cuerpo. Esta "reacción cruzada" hace que el cuerpo se ataque esencialmente a sí mismo y conduce al daño mencionado anteriormente. Se plantea la hipótesis de que un mecanismo autoinmune similar iniciado por la infección por estreptococo beta-hemolítico del grupo A (GABHS) causa trastornos neuropsiquiátricos autoinmunes pediátricos asociados con infecciones estreptocócicas (PANDAS) , en los que los anticuerpos autoinmunes afectan los ganglios basales, lo que provoca la aparición rápida de síntomas psiquiátricos, motores, del sueño y otros en pacientes pediátricos.
La infección por GAS generalmente se diagnostica con una prueba rápida de estreptococos o mediante cultivo.
S. agalactiae , o estreptococo del grupo B, GBS , causa neumonía y meningitis en recién nacidos y ancianos , con bacteriemia sistémica ocasional . Es importante destacar que Streptococcus agalactiae es la causa más común de meningitis en bebés de uno a tres meses de edad. También pueden colonizar los intestinos y el tracto reproductivo femenino, lo que aumenta el riesgo de ruptura prematura de membranas durante el embarazo y la transmisión del organismo al bebé. El Colegio Estadounidense de Obstetras y Ginecólogos , la Academia Estadounidense de Pediatría y los Centros para el Control de Enfermedades recomiendan que todas las mujeres embarazadas entre 35 y 37 semanas de gestación se realicen la prueba del GBS. Las mujeres que resulten positivas deben recibir antibióticos profilácticos durante el parto, lo que generalmente evitará la transmisión al bebé. [15] Las vacunas de polisacáridos del grupo III han demostrado ser eficaces para prevenir la transmisión del GBS de la madre al bebé. [16]
El Reino Unido ha optado por adoptar un protocolo basado en factores de riesgo, en lugar del protocolo basado en el cultivo que se sigue en los EE. UU. [17] Las pautas actuales establecen que si está presente uno o más de los siguientes factores de riesgo, la mujer debe recibir tratamiento con antibióticos durante el parto :
Este protocolo permite la administración de antibióticos durante el parto a entre el 15 y el 20 % de las mujeres embarazadas y previene entre el 65 y el 70 % de los casos de sepsis por SGB de aparición temprana. [18]
Este grupo incluye S. equi , que causa estrangulamientos en caballos, [19] y S. zooepidemicus — S. equi es un descendiente clonal o biovar del ancestral S. zooepidemicus — que causa infecciones en varias especies de mamíferos, incluidos el ganado y los caballos. S. dysgalactiae subsp. dysgalactiae [20] también es miembro del grupo C, estreptococos beta-hemolíticos que pueden causar faringitis y otras infecciones piógenas similares a los estreptococos del grupo A. Las bacterias estreptocócicas del grupo C se consideran patógenos zoonóticos, lo que significa que la infección puede transmitirse de animales a humanos. [21]
Muchos antiguos estreptococos del grupo D han sido reclasificados y colocados en el género Enterococcus (incluidos E. faecalis , E. faecium , E. durans y E. avium ). [22] Por ejemplo, Streptococcus faecalis es ahora Enterococcus faecalis . E. faecalis es a veces alfa-hemolítico y E. faecium es a veces beta-hemolítico. [23]
Las cepas restantes del grupo D no enterocócicas incluyen Streptococcus gallolyticus , Streptococcus bovis , Streptococcus equinus y Streptococcus suis .
Los estreptococos no hemolíticos rara vez causan enfermedades. Sin embargo, los estreptococos betahemolíticos del grupo D débilmente hemolíticos y Listeria monocytogenes (que en realidad es un bacilo grampositivo ) no deben confundirse con los estreptococos no hemolíticos.
Los estreptococos del grupo F fueron descritos por primera vez en 1934 por Long y Bliss entre los "estreptococos hemolíticos diminutos". [24] También se les conoce como Streptococcus anginosus (según el sistema de clasificación de Lancefield) o como miembros del grupo S. milleri (según el sistema europeo).
Estos estreptococos son generalmente, pero no exclusivamente, beta-hemolíticos. Streptococcus dysgalactiae subsp. canis [20] es la subespecie predominante encontrada. Es un GGS particularmente común en humanos, aunque típicamente se encuentra en animales. S. phocae es una subespecie de GGS que se ha encontrado en mamíferos marinos y especies de peces marinos. En mamíferos marinos se ha asociado principalmente con meningoencefalitis , sepsis y endocarditis , pero también se asocia con muchas otras patologías. Su reservorio ambiental y medios de transmisión en mamíferos marinos no están bien caracterizados. Los estreptococos del grupo G también se consideran patógenos zoonóticos.
Los estreptococos del grupo H causan infecciones en caninos de tamaño mediano. Los estreptococos del grupo H rara vez causan enfermedades humanas, a menos que una persona tenga contacto directo con la boca de un canino. Una de las formas más comunes de propagación es el contacto boca a boca entre humanos y caninos. Sin embargo, el canino puede lamer la mano del humano y también puede transmitir la infección. [25]
En la práctica clínica, los grupos más comunes de Streptococcus se pueden distinguir mediante pruebas de laboratorio sencillas, como la prueba PYR para estreptococos del grupo A. También existen kits de aglutinación de látex que pueden distinguir cada uno de los principales grupos observados en la práctica clínica.
Las infecciones estreptocócicas se pueden tratar con antibióticos de la familia de las penicilinas . La penicilina o la amoxicilina son los antibióticos más utilizados para tratar las infecciones estreptocócicas. Estos antibióticos actúan interrumpiendo la producción de peptidoglicano en la pared celular. [26] El tratamiento suele consistir en un ciclo de antibióticos orales de 10 días. En el caso de los pacientes alérgicos a la penicilina y los que sufren infecciones cutáneas, se puede utilizar clindamicina. La clindamicina actúa interrumpiendo la síntesis de proteínas dentro de la célula.

Los estreptococos se han dividido en seis grupos sobre la base de sus secuencias de ADNr 16S : S. anginosus, S. gallolyticus, S. mitis, S. mutans, S. pyogenes y S. salivarius . [28] Los grupos 16S se han confirmado mediante secuenciación del genoma completo (ver figura). Los patógenos importantes S. pneumoniae y S. pyogenes pertenecen a los grupos S. mitis y S. pyogenes , respectivamente, [29] mientras que el agente causante de la caries dental , Streptococcus mutans , es basal al grupo Streptococcus .

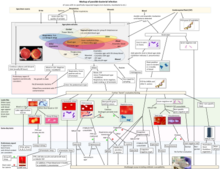
Los avances tecnológicos recientes han dado como resultado un aumento de las secuencias genómicas disponibles para las especies de Streptococcus , lo que permite realizar análisis filogenéticos y genómicos comparativos más sólidos y confiables. [30] En 2018, Patel y Gupta reexaminaron las relaciones evolutivas dentro de Streptococcus a través del análisis de árboles filogenéticos integrales construidos con base en cuatro conjuntos de datos diferentes de proteínas y la identificación de 134 firmas moleculares altamente específicas (en forma de indeles de firmas conservadas ) que son compartidas exclusivamente por todo el género o sus subclados distintos. [30]
Los resultados revelaron la presencia de dos clados principales en el nivel más alto dentro de Streptococcus , denominados clados "Mitis-Suis" y "Pyogenes-Equinus-Mutans". [30] El clado principal "Mitis-Suis" comprende el subclado Suis y el clado Mitis, que abarca los subclados Angiosus, Pneumoniae, Gordonii y Parasanguinis. El segundo clado principal, "Pyogenes-Equinus-Mutans", incluye los subclados Pyogenes, Mutans, Salivarius, Equinus, Sobrinus, Halotolerans, Porci, Entericus y Orisratti. En total, se han identificado 14 subclados distintos dentro del género Streptococcus , cada uno respaldado por patrones de ramificación confiables en árboles filogenéticos y por la presencia de múltiples indeles de firma conservados en diferentes proteínas que son características distintivas de los miembros de estos 14 clados. [30] En una figura de esta página se muestra un diagrama resumido que muestra las relaciones generales entre los Streptococcus según estos estudios.

Se han secuenciado los genomas de cientos de especies. [32] La mayoría de los genomas de Streptococcus tienen un tamaño de entre 1,8 y 2,3 Mb y codifican entre 1700 y 2300 proteínas. Algunos genomas importantes se enumeran en la tabla. [33] Las cuatro especies que se muestran en la tabla ( S. pyogenes, S. agalactiae, S. pneumoniae y S. mutans ) tienen una identidad de secuencia de proteínas por pares promedio de aproximadamente el 70%. [33]
Se han descrito bacteriófagos para muchas especies de Streptococcus . Se han descrito 18 profagos en S. pneumoniae que varían en tamaño de 38 a 41 kb, codificando de 42 a 66 genes cada uno. [34] Algunos de los primeros fagos de Streptococcus descubiertos fueron Dp-1 [35] [36] y ω1 (alias ω-1). [37] [38] [39] En 1981 se descubrió la familia Cp (fago complutense 1, oficialmente virus Streptococcus Cp1 , Picovirinae ) con Cp-1 como su primer miembro. [40] Dp-1 y Cp-1 infectan tanto a S. pneumoniae como a S. mitis . [41] Sin embargo, los rangos de hospedadores de la mayoría de los fagos de Streptococcus no se han investigado sistemáticamente.
La transformación genética natural implica la transferencia de ADN de una bacteria a otra a través del medio circundante. La transformación es un proceso complejo que depende de la expresión de numerosos genes. Para ser capaz de transformarse, una bacteria debe entrar en un estado fisiológico especial denominado competencia . S. pneumoniae , S. mitis y S. oralis pueden volverse competentes y, como resultado, adquirir activamente ADN homólogo para la transformación mediante un mecanismo fratricida depredador [42]. Este mecanismo fratricida explota principalmente a hermanos no competentes presentes en el mismo nicho [43]. Entre los aislados altamente competentes de S. pneumoniae , Li et al. [44] demostraron que la aptitud para la colonización nasal y la virulencia (infectividad pulmonar) dependen de un sistema de competencia intacto. La competencia puede permitir que el patógeno estreptocócico utilice ADN homólogo externo para la reparación recombinatoria de los daños del ADN causados por el ataque oxidativo del huésped. [45]