Los macrófagos (abreviados como M φ , MΦ o MP ) ( griego : grandes comedores , del griego μακρός ( makrós ) = grande, φαγεῖν ( fageína ) = comer) son un tipo de glóbulos blancos del sistema inmunológico innato que engullen y digieren. patógenos, como células cancerosas , microbios , desechos celulares y sustancias extrañas, que no tienen proteínas específicas de las células sanas del cuerpo en su superficie. [1] [2] Este proceso se llama fagocitosis , que actúa para defender al huésped contra infecciones y lesiones. [3]
Los macrófagos se encuentran esencialmente en todos los tejidos, [4] donde patrullan en busca de patógenos potenciales mediante el movimiento ameboide . Toman diversas formas (con varios nombres) en todo el cuerpo (p. ej., histiocitos , células de Kupffer , macrófagos alveolares , microglía y otros), pero todos forman parte del sistema fagocitario mononuclear . Además de la fagocitosis, desempeñan un papel fundamental en la defensa no específica ( inmunidad innata ) y también ayudan a iniciar mecanismos de defensa específicos ( inmunidad adaptativa ) mediante el reclutamiento de otras células inmunitarias, como los linfocitos . Por ejemplo, son importantes como presentadores de antígenos para las células T. En los seres humanos, los macrófagos disfuncionales causan enfermedades graves, como la enfermedad granulomatosa crónica , que provocan infecciones frecuentes.
Más allá de aumentar la inflamación y estimular el sistema inmunológico, los macrófagos también desempeñan un importante papel antiinflamatorio y pueden disminuir las reacciones inmunes mediante la liberación de citocinas . Los macrófagos que estimulan la inflamación se denominan macrófagos M1, mientras que los que disminuyen la inflamación y fomentan la reparación de tejidos se denominan macrófagos M2. [5] Esta diferencia se refleja en su metabolismo; Los macrófagos M1 tienen la capacidad única de metabolizar la arginina a la molécula "asesina" de óxido nítrico , mientras que los macrófagos M2 tienen la capacidad única de metabolizar la arginina a la molécula "reparadora" ornitina . [6] Sin embargo, esta dicotomía ha sido cuestionada recientemente a medida que se ha descubierto una mayor complejidad. [7]
Los macrófagos humanos tienen aproximadamente 21 micrómetros (0,00083 pulgadas) de diámetro [8] y se producen mediante la diferenciación de monocitos en los tejidos. Se pueden identificar mediante citometría de flujo o tinción inmunohistoquímica por su expresión específica de proteínas como CD14 , CD40 , CD11b , CD64 , F4/80 (ratones)/ EMR1 (humano), lisozima M, MAC-1 /MAC-3 y CD68. . [9]
Los macrófagos fueron descubiertos y nombrados por primera vez por Élie Metchnikoff , un zoólogo del Imperio ruso, en 1884. [10] [11]
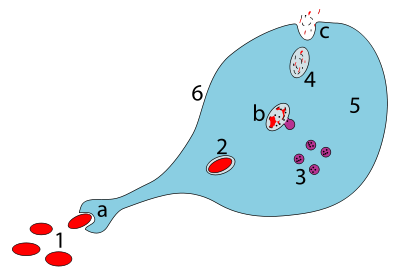
La mayoría de los macrófagos están estacionados en puntos estratégicos donde es probable que se produzca una invasión microbiana o una acumulación de partículas extrañas. Estas células juntas como grupo se conocen como sistema fagocítico mononuclear y anteriormente se conocían como sistema reticuloendotelial. Cada tipo de macrófago, determinado por su localización, tiene un nombre específico:
Las investigaciones sobre las células de Kupffer se ven obstaculizadas porque en los seres humanos, las células de Kupffer sólo son accesibles para análisis inmunohistoquímicos a partir de biopsias o autopsias. De ratas y ratones, son difíciles de aislar y, después de la purificación, sólo se pueden obtener aproximadamente 5 millones de células de un ratón.
Los macrófagos pueden expresar funciones paracrinas dentro de órganos que son específicas de la función de ese órgano. En los testículos , por ejemplo, se ha demostrado que los macrófagos pueden interactuar con las células de Leydig secretando 25-hidroxicolesterol , un oxisterol que las células de Leydig vecinas pueden convertir en testosterona . [16] Además, los macrófagos testiculares pueden participar en la creación de un ambiente inmune privilegiado en los testículos y en la mediación de la infertilidad durante la inflamación de los testículos.
Los macrófagos residentes cardíacos participan en la conducción eléctrica a través de la comunicación por unión abierta con los miocitos cardíacos . [17]
Los macrófagos se pueden clasificar según su función fundamental y su activación. Según esta agrupación, existen macrófagos activados clásicamente (M1) , macrófagos que cicatrizan heridas (también conocidos como macrófagos activados alternativamente (M2) ) y macrófagos reguladores (Mreg). [18]
Los macrófagos que residen en tejidos adultos sanos derivan de monocitos circulantes o se establecen antes del nacimiento y luego se mantienen durante la vida adulta independientemente de los monocitos. [19] [20] Por el contrario, la mayoría de los macrófagos que se acumulan en los sitios enfermos generalmente derivan de monocitos circulantes. [21] La extravasación de leucocitos describe la entrada de monocitos al tejido dañado a través del endotelio de los vasos sanguíneos a medida que se convierten en macrófagos. Los monocitos son atraídos a un sitio dañado por sustancias químicas a través de quimiotaxis , provocada por una variedad de estímulos que incluyen células dañadas, patógenos y citoquinas liberadas por macrófagos que ya se encuentran en el sitio. En algunos sitios, como los testículos, se ha demostrado que los macrófagos pueblan el órgano mediante proliferación. [22] A diferencia de los neutrófilos de vida corta , los macrófagos sobreviven más tiempo en el cuerpo, hasta varios meses.
Los macrófagos son fagocitos profesionales y están altamente especializados en la eliminación de células moribundas o muertas y restos celulares. Este papel es importante en la inflamación crónica, ya que las primeras etapas de la inflamación están dominadas por los neutrófilos, que son ingeridos por los macrófagos cuando alcanzan la mayoría de edad (consulte el CD31 para obtener una descripción de este proceso). [23]
Al principio, los neutrófilos son atraídos a un sitio, donde realizan su función y mueren, antes de que ellos o sus trampas extracelulares de neutrófilos sean fagocitados por los macrófagos. [23] [24] Cuando está en el sitio, la primera ola de neutrófilos, después del proceso de envejecimiento y después de las primeras 48 horas, estimula la aparición de macrófagos, por lo que estos macrófagos luego ingerirán los neutrófilos envejecidos. [23]
La eliminación de las células moribundas es, en mayor medida, manejada por macrófagos fijos , que permanecerán en lugares estratégicos como los pulmones, el hígado, el tejido neural , los huesos, el bazo y el tejido conectivo, ingiriendo materiales extraños como patógenos y reclutando macrófagos adicionales. si es necesario. [25]
Cuando un macrófago ingiere un patógeno, éste queda atrapado en un fagosoma , que luego se fusiona con un lisosoma . Dentro del fagolisosoma , las enzimas y los peróxidos tóxicos digieren el patógeno. Sin embargo, algunas bacterias, como Mycobacterium tuberculosis , se han vuelto resistentes a estos métodos de digestión. Las Salmonellae tifoideas inducen su propia fagocitosis por los macrófagos del huésped in vivo e inhiben la digestión por acción lisosomal, utilizando así los macrófagos para su propia replicación y provocando la apoptosis de los macrófagos. [26] Los macrófagos pueden digerir más de 100 bacterias antes de que finalmente mueran debido a sus propios compuestos digestivos.
Cuando un patógeno invade, los macrófagos residentes en el tejido se encuentran entre las primeras células en responder. [27] Dos de las funciones principales de los macrófagos residentes en los tejidos son fagocitar el antígeno entrante y secretar citocinas proinflamatorias que inducen inflamación y reclutan otras células inmunitarias en el sitio. [28]

Los macrófagos pueden internalizar antígenos mediante fagocitosis mediada por receptores. [29] Los macrófagos tienen una amplia variedad de receptores de reconocimiento de patrones (PRR) que pueden reconocer patrones moleculares asociados a microbios (MAMP) de patógenos. Muchos PRR, como los receptores tipo peaje (TLR), los receptores carroñeros (SR), los receptores de lectina tipo C, entre otros, reconocen patógenos para la fagocitosis. [29] Los macrófagos también pueden reconocer patógenos para la fagocitosis indirectamente a través de opsoninas , que son moléculas que se adhieren a los patógenos y los marcan para la fagocitosis. [30] Las opsoninas pueden causar una adhesión más fuerte entre los macrófagos y el patógeno durante la fagocitosis, por lo que las opsoninas tienden a mejorar la actividad fagocítica de los macrófagos. [31] Tanto las proteínas del complemento como los anticuerpos pueden unirse a los antígenos y opsonizarlos. Los macrófagos tienen receptores del complemento 1 (CR1) y 3 (CR3) que reconocen las proteínas del complemento C3b e iC3b unidas al patógeno, respectivamente, así como receptores γ de fragmentos cristalizables (FcγR) que reconocen la región del fragmento cristalizable (Fc) de la inmunoglobulina unida a antígeno. Anticuerpos G (IgG). [30] [32] Al fagocitar y digerir patógenos, los macrófagos pasan por un estallido respiratorio donde se consume más oxígeno para suministrar la energía necesaria para producir especies reactivas de oxígeno (ROS) y otras moléculas antimicrobianas que digieren los patógenos consumidos. [28] [33]
El reconocimiento de MAMP por parte de PRR puede activar los macrófagos residentes en los tejidos para que secreten citocinas proinflamatorias que reclutan otras células inmunitarias. Entre los PRR, los TLR desempeñan un papel importante en la transducción de señales que conducen a la producción de citocinas. [29] La unión de MAMP a TLR desencadena una serie de eventos posteriores que eventualmente activan el factor de transcripción NF-κB y dan como resultado la transcripción de genes para varias citocinas proinflamatorias, incluidas IL-1β , IL-6 , TNF-α , IL- 12B , e interferones de tipo I tales como IFN-α e IFN-β. [34] Sistémicamente, IL-1β, IL-6 y TNF-α inducen fiebre e inician la respuesta de fase aguda en la que el hígado secreta proteínas de fase aguda . [27] [28] [35] A nivel local, la IL-1β y el TNF-α causan vasodilatación, donde los espacios entre las células epiteliales de los vasos sanguíneos se ensanchan, y una regulación positiva de las moléculas de adhesión a la superficie celular de las células epiteliales para inducir la extravasación de leucocitos . [27] [28]
Los neutrófilos se encuentran entre las primeras células inmunitarias reclutadas por los macrófagos para salir de la sangre mediante extravasación y llegar al sitio de la infección. [35] Los macrófagos secretan muchas quimiocinas como CXCL1 , CXCL2 y CXCL8 (IL-8) que atraen a los neutrófilos al sitio de la infección. [27] [35] Después de que los neutrófilos han terminado de fagocitar y eliminar el antígeno al final de la respuesta inmune, experimentan apoptosis y se reclutan macrófagos de los monocitos sanguíneos para ayudar a eliminar los desechos apoptóticos. [36]
Los macrófagos también reclutan otras células inmunes como monocitos, células dendríticas, células asesinas naturales, basófilos, eosinófilos y células T a través de quimiocinas como CCL2 , CCL4 , CCL5 , CXCL8 , CXCL9 , CXCL10 y CXCL11 . [27] [35] Junto con las células dendríticas, los macrófagos ayudan a activar las células asesinas naturales (NK) mediante la secreción de interferones tipo I (IFN-α e IFN-β) e IL-12 . La IL-12 actúa con la IL-18 para estimular la producción de la citoquina proinflamatoria interferón gamma (IFN-γ) por parte de las células NK, que sirve como una fuente importante de IFN-γ antes de que se active el sistema inmunológico adaptativo. [35] [37] El IFN-γ mejora la respuesta inmune innata al inducir un fenotipo más agresivo en los macrófagos, lo que les permite matar patógenos de manera más eficiente. [35]
Algunos de los quimioatrayentes de células T secretados por macrófagos incluyen CCL5 , CXCL9 , CXCL10 y CXCL11 . [27]

Los macrófagos son células presentadoras de antígenos (APC) profesionales, lo que significa que pueden presentar péptidos de antígenos fagocitados en moléculas del complejo mayor de histocompatibilidad (MHC) II en su superficie celular para las células T colaboradoras. [39] Los macrófagos no son activadores primarios de las células T auxiliares vírgenes que nunca se han activado previamente, ya que los macrófagos residentes en los tejidos no viajan a los ganglios linfáticos donde residen las células T auxiliares vírgenes. [40] [41] Aunque los macrófagos también se encuentran en órganos linfoides secundarios como los ganglios linfáticos, no residen en zonas de células T y no son eficaces para activar las células T auxiliares vírgenes. [40] Los macrófagos en los tejidos linfoides participan más en la ingestión de antígenos y en evitar que ingresen a la sangre, así como en la absorción de desechos de los linfocitos apoptóticos. [40] [42] Por lo tanto, los macrófagos interactúan principalmente con células T auxiliares previamente activadas que abandonaron el ganglio linfático y llegaron al sitio de la infección o con células T de memoria residentes en el tejido. [41]
Los macrófagos suministran ambas señales necesarias para la activación de las células T colaboradoras: 1) Los macrófagos presentan una molécula MHC clase II unida al péptido antigénico para ser reconocida por el correspondiente receptor de células T (TCR), y 2) el reconocimiento de patógenos por los PRR induce a los macrófagos a regular positivamente la co -moléculas estimulantes CD80 y CD86 (también conocidas como B7 ) que se unen a CD28 en las células T auxiliares para suministrar la señal coestimuladora. [35] [39] Estas interacciones permiten que las células T colaboradoras alcancen una función efectora completa y proporcionan a las células T colaboradoras señales de supervivencia y diferenciación continuas que les impiden sufrir apoptosis debido a la falta de señalización de TCR. [39] Por ejemplo, la señalización de IL-2 en las células T regula positivamente la expresión de la proteína antiapoptótica Bcl-2 , pero la producción de IL-2 por parte de las células T y el receptor de IL-2RA de alta afinidad, IL-2RA , requieren una señal continua de Reconocimiento por TCR del antígeno unido al MHC. [35] [43]
Los macrófagos pueden lograr diferentes fenotipos de activación a través de interacciones con diferentes subconjuntos de células T auxiliares, como TH 1 y TH 2. [ 18] Aunque existe un amplio espectro de fenotipos de activación de macrófagos, hay dos fenotipos principales que se reconocen comúnmente. [18] Son los macrófagos activados clásicamente, o macrófagos M1, y los macrófagos activados alternativamente, o macrófagos M2. Los macrófagos M1 son proinflamatorios, mientras que los macrófagos M2 son en su mayoría antiinflamatorios. [18]
Las células Th 1 desempeñan un papel importante en la activación clásica de los macrófagos como parte de la respuesta inmune tipo 1 contra patógenos intracelulares (como las bacterias intracelulares ) que pueden sobrevivir y replicarse dentro de las células huésped, especialmente aquellos patógenos que se replican incluso después de haber sido fagocitados por macrófagos. [44] Después de que el TCR de las células TH 1 reconoce moléculas MHC de clase II unidas a péptidos antigénicos específicos en los macrófagos, las células TH 1 1) secretan IFN-γ y 2) regulan positivamente la expresión del ligando CD40 (CD40L), que se une a CD40 en macrófagos. [45] [35] Estas 2 señales activan los macrófagos y mejoran su capacidad para matar patógenos intracelulares mediante una mayor producción de moléculas antimicrobianas como el óxido nítrico (NO) y el superóxido (O 2- ). [27] [35] Esta mejora de la capacidad antimicrobiana de los macrófagos por parte de las células TH 1 se conoce como activación de macrófagos clásica, y los macrófagos activados se conocen como macrófagos activados clásicamente o macrófagos M1. Los macrófagos M1, a su vez, regulan positivamente las moléculas B7 y la presentación de antígenos a través de moléculas MHC de clase II para proporcionar señales que sustentan la ayuda de las células T. [45] La activación de los macrófagos TH 1 y M1 es un circuito de retroalimentación positiva, en el que el IFN-γ de las células TH 1 regula positivamente la expresión de CD40 en los macrófagos; la interacción entre CD40 en los macrófagos y CD40L en las células T activa a los macrófagos para que secreten IL-12; y la IL-12 promueve una mayor secreción de IFN-γ por parte de las células TH 1 . [35] [45] El contacto inicial entre el MHC II unido al antígeno de macrófagos y el TCR sirve como punto de contacto entre las dos células donde se concentra la mayor parte de la secreción de IFN-γ y CD-40L en las células T, por lo que solo los macrófagos interactúan directamente. con células T H 1 probablemente se activen. [35]
Además de activar los macrófagos M1, las células TH 1 expresan el ligando Fas (FasL) y la linfotoxina beta (LT-β) para ayudar a matar macrófagos infectados crónicamente que ya no pueden matar patógenos. [35] La muerte de macrófagos infectados crónicamente libera patógenos al espacio extracelular que luego pueden ser eliminados por otros macrófagos activados. [35] Las células TH 1 también ayudan a reclutar más monocitos, el precursor de los macrófagos, en el sitio de la infección. Secreción de TH 1 TNF-α y LT-α para facilitar la unión y salida de los monocitos a los vasos sanguíneos. [35] Secreción de TH 1 de CCL2 como quimioatrayente para monocitos. La IL-3 y el GM-CSF liberados por las células TH 1 estimulan una mayor producción de monocitos en la médula ósea. [35]
Cuando los patógenos intracelulares no pueden eliminarse, como en el caso de Mycobacterium tuberculosis , el patógeno se contiene mediante la formación de granuloma , una agregación de macrófagos infectados rodeados de células T activadas. [46] Los macrófagos que bordean los linfocitos activados a menudo se fusionan para formar células gigantes multinucleadas que parecen tener una mayor capacidad antimicrobiana debido a su proximidad a las células TH 1 , pero con el tiempo, las células del centro comienzan a morir y forman tejido necrótico. [41] [46]
Las células TH 2 desempeñan un papel importante en la activación alternativa de los macrófagos como parte de la respuesta inmune tipo 2 contra grandes patógenos extracelulares como los helmintos . [35] [47] Las células T H 2 secretan IL-4 e IL-13, que activan los macrófagos para convertirse en macrófagos M2, también conocidos como macrófagos alternativamente activados. [47] [48] Los macrófagos M2 expresan arginasa-1 , una enzima que convierte la arginina en ornitina y urea . [47] La ornitina ayuda a aumentar la contracción del músculo liso para expulsar el gusano y también participa en la reparación de tejidos y heridas. La ornitina puede metabolizarse aún más a prolina , que es esencial para sintetizar colágeno . [47] Los macrófagos M2 también pueden disminuir la inflamación al producir antagonistas del receptor de IL-1 (IL-1RA) y receptores de IL-1 que no conducen a la señalización inflamatoria posterior (IL-1RII). [35] [49]
Otra parte de la activación de la inmunidad adaptativa implica la estimulación de CD8 + mediante la presentación cruzada de péptidos antígenos en moléculas del MHC de clase I. Los estudios han demostrado que los macrófagos proinflamatorios son capaces de realizar una presentación cruzada de antígenos en moléculas del MHC de clase I, pero aún no está claro si la presentación cruzada de los macrófagos desempeña un papel en la activación de las células T CD8 + vírgenes o de memoria . [28] [50] [42]
Se ha demostrado que los macrófagos secretan citocinas BAFF y APRIL, que son importantes para el cambio de isotipo de las células plasmáticas. APRIL y la IL-6 secretadas por precursores de macrófagos en la médula ósea ayudan a mantener la supervivencia de las células plasmáticas alojadas en la médula ósea. [51]
Hay varias formas activadas de macrófagos. [18] A pesar de un espectro de formas de activar macrófagos, hay dos grupos principales denominados M1 y M2 . Macrófagos M1: como se mencionó anteriormente (anteriormente denominados macrófagos activados clásicamente), [53] los macrófagos "asesinos" M1 son activados por LPS e IFN-gamma y secretan niveles altos de IL-12 y niveles bajos de IL-10 . Los macrófagos M1 tienen funciones proinflamatorias, bactericidas y fagocíticas. [54] Por el contrario, la designación de "reparación" M2 (también conocida como macrófagos activados alternativamente) se refiere ampliamente a los macrófagos que funcionan en procesos constructivos como la curación de heridas y la reparación de tejidos, y aquellos que desactivan la activación dañina del sistema inmunológico al producir anti- citocinas inflamatorias como la IL-10 . M2 es el fenotipo de los macrófagos tisulares residentes y puede elevarse aún más mediante IL-4 . Los macrófagos M2 producen niveles altos de IL-10, TGF-beta y niveles bajos de IL-12. Los macrófagos asociados a tumores son principalmente del fenotipo M2 y parecen promover activamente el crecimiento tumoral. [55]
Los macrófagos existen en una variedad de fenotipos que están determinados por el papel que desempeñan en la maduración de las heridas. Los fenotipos se pueden separar predominantemente en dos categorías principales; M1 y M2. Los macrófagos M1 son el fenotipo dominante observado en las primeras etapas de la inflamación y son activados por cuatro mediadores clave: interferón-γ (IFN-γ), factor de necrosis tumoral (TNF) y patrones moleculares asociados al daño (DAMP). Estas moléculas mediadoras crean una respuesta proinflamatoria que a cambio produce citoquinas proinflamatorias como la interleucina-6 y el TNF. A diferencia de los macrófagos M1, los macrófagos M2 secretan una respuesta antiinflamatoria mediante la adición de interleucina-4 o interleucina-13. También desempeñan un papel en la cicatrización de heridas y son necesarios para la revascularización y la reepitelización. Los macrófagos M2 se dividen en cuatro tipos principales según sus funciones: M2a, M2b, M2c y M2d. Aún está en discusión cómo se determinan los fenotipos M2, pero los estudios han demostrado que su entorno les permite adaptarse al fenotipo que sea más apropiado para curar la herida de manera eficiente. [54]
Los macrófagos M2 son necesarios para la estabilidad vascular. Producen factor de crecimiento endotelial vascular A y TGF-β1 . [54] Hay un cambio fenotípico de los macrófagos M1 a M2 en las heridas agudas; sin embargo, este cambio se ve afectado en las heridas crónicas. Esta desregulación da como resultado una cantidad insuficiente de macrófagos M2 y sus correspondientes factores de crecimiento que ayudan en la reparación de heridas. Con una falta de estos factores de crecimiento/citocinas antiinflamatorias y una sobreabundancia de citocinas proinflamatorias de los macrófagos M1, las heridas crónicas no pueden sanar de manera oportuna. Normalmente, después de que los neutrófilos ingieren desechos/patógenos, realizan apoptosis y se eliminan. En este punto, la inflamación no es necesaria y M1 cambia a M2 (antiinflamatorio). Sin embargo, la desregulación se produce cuando los macrófagos M1 no pueden o no fagocitan a los neutrófilos que han sufrido apoptosis, lo que conduce a una mayor migración de macrófagos e inflamación. [54]
Tanto los macrófagos M1 como M2 desempeñan un papel en la promoción de la aterosclerosis . Los macrófagos M1 promueven la aterosclerosis por inflamación. Los macrófagos M2 pueden eliminar el colesterol de los vasos sanguíneos, pero cuando el colesterol se oxida, los macrófagos M2 se convierten en células espumosas apoptóticas que contribuyen a la placa de ateroma de la aterosclerosis. [56] [57]
El primer paso para comprender la importancia de los macrófagos en la reparación, el crecimiento y la regeneración muscular es que hay dos "olas" de macrófagos con el inicio del uso muscular dañado: subpoblaciones que tienen y no tienen influencia directa en la reparación del músculo. La ola inicial es una población fagocítica que aparece durante períodos de mayor uso muscular que son suficientes para causar lisis e inflamación de la membrana muscular, que pueden ingresar y degradar el contenido de las fibras musculares lesionadas. [58] [59] [60] Estos macrófagos fagocíticos de invasión temprana alcanzan su concentración más alta aproximadamente 24 horas después del inicio de alguna forma de lesión o recarga de las células musculares. [61] Su concentración disminuye rápidamente después de 48 horas. [59] El segundo grupo son los tipos no fagocíticos que se distribuyen cerca de las fibras regenerativas. Estos alcanzan su punto máximo entre dos y cuatro días y permanecen elevados durante varios días mientras se reconstruye el tejido muscular. [59] La primera subpoblación no tiene ningún beneficio directo para la reparación del músculo, mientras que el segundo grupo no fagocítico sí lo tiene.
Se cree que los macrófagos liberan sustancias solubles que influyen en la proliferación, diferenciación, crecimiento, reparación y regeneración del músculo, pero en este momento se desconoce el factor que se produce para mediar estos efectos. [61] Se sabe que la participación de los macrófagos en la promoción de la reparación de tejidos no es específica del músculo; se acumulan en numerosos tejidos durante la fase del proceso de curación después de una lesión. [62]
Los macrófagos son esenciales para la cicatrización de heridas . [63] Reemplazan a los neutrófilos polimorfonucleares como células predominantes en la herida al segundo día después de la lesión. [64] Atraídos al sitio de la herida por factores de crecimiento liberados por las plaquetas y otras células, los monocitos del torrente sanguíneo ingresan al área a través de las paredes de los vasos sanguíneos. [65] El número de monocitos en la herida alcanza su punto máximo entre uno y un día y medio después de que se produce la lesión. Una vez que están en el sitio de la herida, los monocitos maduran y se convierten en macrófagos. El bazo contiene la mitad de los monocitos del cuerpo en reserva, listos para ser utilizados en el tejido lesionado. [66] [67]
La función principal de los macrófagos es fagocitar bacterias y tejido dañado, [63] y también desbridan el tejido dañado mediante la liberación de proteasas. [68] Los macrófagos también secretan una serie de factores, como factores de crecimiento y otras citoquinas, especialmente durante el tercer y cuarto día después de la herida. Estos factores atraen a la zona las células implicadas en la etapa de proliferación de la curación. [69] Los macrófagos también pueden restringir la fase de contracción. [70] Los macrófagos son estimulados por el bajo contenido de oxígeno de su entorno para producir factores que inducen y aceleran la angiogénesis [71] y también estimulan las células que reepitelizan la herida, crean tejido de granulación y establecen una nueva matriz extracelular . [72] [ se necesita mejor fuente ] Al secretar estos factores, los macrófagos contribuyen a impulsar el proceso de curación de heridas a la siguiente fase.
Los científicos han descubierto que, además de devorar restos de material, los macrófagos participan en la típica regeneración de las extremidades de la salamandra. [73] [74] Descubrieron que la eliminación de los macrófagos de una salamandra provocaba un fallo en la regeneración de las extremidades y una respuesta de cicatrización. [73] [74]
Como se describió anteriormente, los macrófagos desempeñan un papel clave en la eliminación de células moribundas o muertas y desechos celulares. Los eritrocitos tienen una vida media de 120 días y, por lo tanto, los macrófagos del bazo y el hígado los destruyen constantemente. Los macrófagos también fagocitan macromoléculas , por lo que desempeñan un papel clave en la farmacocinética del hierro parenteral . [ cita necesaria ]
El hierro que se libera de la hemoglobina se almacena internamente en ferritina o se libera a la circulación a través de ferroportina . En los casos en los que aumentan los niveles sistémicos de hierro, o en los que hay inflamación, los niveles elevados de hepcidina actúan sobre los canales de ferroportina de los macrófagos, lo que hace que el hierro permanezca dentro de los macrófagos. [ cita necesaria ]

Los melanófagos son un subconjunto de macrófagos residentes en tejidos capaces de absorber pigmentos, ya sean nativos del organismo o exógenos (como los tatuajes ), del espacio extracelular. A diferencia de los melanocitos dendríticos de unión , que sintetizan melanosomas y contienen varias etapas de su desarrollo, los melanófagos solo acumulan melanina fagocitada en fagosomas similares a lisosomas. [75] [76] Esto ocurre repetidamente a medida que el pigmento de los macrófagos dérmicos muertos es fagocitado por sus sucesores, preservando el tatuaje en el mismo lugar. [77]
Cada tejido alberga su propia población especializada de macrófagos residentes, que mantienen interconexiones recíprocas con el estroma y el tejido funcional. [78] [79] Estos macrófagos residentes son sésiles (no migratorios), proporcionan factores de crecimiento esenciales para respaldar la función fisiológica del tejido (p. ej., interferencia entre macrófagos y neuronas en los intestinos), [80] y pueden proteger activamente el tejido contra daño inflamatorio. [81]
Los macrófagos asociados a nervios o NAM son aquellos macrófagos residentes en tejidos que están asociados con los nervios. Se sabe que algunos de ellos tienen una morfología alargada de hasta 200 μm [82]
Debido a su papel en la fagocitosis, los macrófagos participan en muchas enfermedades del sistema inmunológico. Por ejemplo, participan en la formación de granulomas , lesiones inflamatorias que pueden ser provocadas por una gran cantidad de enfermedades. Se han descrito, por ejemplo, algunos trastornos, en su mayoría raros, de fagocitosis y función de macrófagos ineficaces. [83]
En su papel como célula inmune fagocítica, los macrófagos son responsables de fagocitar a los patógenos para destruirlos. Algunos patógenos subvierten este proceso y viven dentro de los macrófagos. Esto proporciona un entorno en el que el patógeno queda oculto al sistema inmunológico y le permite replicarse. [ cita necesaria ]
Las enfermedades con este tipo de comportamiento incluyen la tuberculosis (provocada por Mycobacterium tuberculosis ) y la leishmaniasis (provocada por especies de Leishmania ). [ cita necesaria ]
Para minimizar la posibilidad de convertirse en huéspedes de una bacteria intracelular, los macrófagos han desarrollado mecanismos de defensa como la inducción de óxido nítrico e intermediarios reactivos de oxígeno, [84] que son tóxicos para los microbios. Los macrófagos también han desarrollado la capacidad de restringir el suministro de nutrientes del microbio e inducir la autofagia . [85]
Una vez engullido por un macrófago, el agente causante de la tuberculosis, Mycobacterium tuberculosis , [86] evita las defensas celulares y utiliza la célula para replicarse. La evidencia reciente sugiere que en respuesta a la infección pulmonar por Mycobacterium tuberculosis , los macrófagos periféricos maduran hasta el fenotipo M1. El fenotipo del macrófago M1 se caracteriza por una mayor secreción de citocinas proinflamatorias (IL-1β, TNF-α e IL-6) y un aumento de las actividades glucolíticas esenciales para la eliminación de la infección. [1]
Tras la fagocitosis por un macrófago, el parásito Leishmania se encuentra en una vacuola fagocítica. En circunstancias normales, esta vacuola fagocítica se convertiría en un lisosoma y su contenido sería digerido. Leishmania altera este proceso y evita ser destruida; en cambio, forman un hogar dentro de la vacuola. [ cita necesaria ]
La infección de macrófagos en las articulaciones se asocia con inflamación local durante y después de la fase aguda de Chikungunya (causada por CHIKV o virus Chikungunya). [87]
El adenovirus (la causa más común de conjuntivitis) puede permanecer latente en un macrófago del huésped y la diseminación viral continúa entre 6 y 18 meses después de la infección inicial. [ cita necesaria ]
Brucella spp. puede permanecer latente en un macrófago mediante la inhibición de la fusión fagosoma - lisosoma ; Causa brucelosis (fiebre ondulante). [ cita necesaria ]
Legionella pneumophila , el agente causante de la enfermedad del legionario , también establece residencia dentro de los macrófagos. [ cita necesaria ]
Los macrófagos son las células predominantes implicadas en la creación de las lesiones progresivas en placa de la aterosclerosis . [88]
El reclutamiento focal de macrófagos se produce después del inicio del infarto agudo de miocardio . Estos macrófagos funcionan para eliminar desechos, células apoptóticas y prepararse para la regeneración de tejidos . [89] Los macrófagos protegen contra la taquicardia ventricular inducida por isquemia en ratones hipopotasémicos. [90]
Los macrófagos también desempeñan un papel en la infección por el virus de la inmunodeficiencia humana (VIH). Al igual que las células T , los macrófagos pueden infectarse con el VIH e incluso convertirse en un reservorio de replicación continua del virus en todo el cuerpo. El VIH puede ingresar a los macrófagos mediante la unión de gp120 a CD4 y al segundo receptor de membrana, CCR5 (un receptor de quimiocinas). Tanto los monocitos como los macrófagos circulantes sirven como reservorio del virus. [91] Los macrófagos son más capaces de resistir la infección por VIH-1 que las células T CD4+, aunque la susceptibilidad a la infección por VIH difiere entre los subtipos de macrófagos. [92]
Los macrófagos pueden contribuir al crecimiento y la progresión del tumor al promover la proliferación e invasión de las células tumorales, fomentar la angiogénesis tumoral y suprimir las células inmunes antitumorales. [93] [94] Los compuestos inflamatorios, como el factor de necrosis tumoral (TNF) alfa liberado por los macrófagos, activan el factor nuclear de conmutación genética kappa B. Luego, NF-κB ingresa al núcleo de una célula tumoral y activa la producción de proteínas que detienen la apoptosis y promueven la proliferación celular y la inflamación. [95] Además, los macrófagos sirven como fuente de muchos factores proangiogénicos, incluido el factor endotelial vascular (VEGF), el factor de necrosis tumoral alfa (TNF-alfa), el factor estimulante de colonias de macrófagos (M-CSF/CSF1) y la IL- 1 e IL-6 , [96] contribuyendo aún más al crecimiento del tumor.
Se ha demostrado que los macrófagos se infiltran en varios tumores. Su número se correlaciona con un mal pronóstico en ciertos cánceres, incluidos los de mama, cuello uterino, vejiga, cerebro y próstata. [97] [98] Algunos tumores también pueden producir factores, incluidos M-CSF/CSF1, MCP-1/CCL2 y angiotensina II , que desencadenan la amplificación y movilización de macrófagos en los tumores. [99] [100] [101] Además, los macrófagos de los senos subcapsulares en los ganglios linfáticos que drenan tumores pueden suprimir la progresión del cáncer al contener la diseminación de materiales derivados de tumores. [102]
Los estudios experimentales indican que los macrófagos pueden afectar todas las modalidades terapéuticas, incluidas la cirugía , la quimioterapia , la radioterapia , la inmunoterapia y la terapia dirigida . [94] [103] [104] Los macrófagos pueden influir en los resultados del tratamiento tanto positiva como negativamente. Los macrófagos pueden ser protectores de diferentes maneras: pueden eliminar células tumorales muertas (en un proceso llamado fagocitosis ) después de tratamientos que matan estas células; pueden servir como depósitos de medicamentos para algunos medicamentos contra el cáncer; [105] también pueden activarse mediante algunas terapias para promover la inmunidad antitumoral. [106] Los macrófagos también pueden ser perjudiciales de varias maneras: por ejemplo, pueden suprimir diversas quimioterapias, [107] [108] radioterapias [109] [110] e inmunoterapias. [111] [112] Debido a que los macrófagos pueden regular la progresión tumoral, actualmente se están probando estrategias terapéuticas para reducir la cantidad de estas células o manipular sus fenotipos en pacientes con cáncer. [113] [114] Sin embargo, los macrófagos también participan en la citotoxicidad mediada por anticuerpos (ADCC) y se ha propuesto que este mecanismo es importante para ciertos anticuerpos de inmunoterapia contra el cáncer. [115]
Se ha observado que un mayor número de macrófagos proinflamatorios dentro del tejido adiposo obeso contribuye a las complicaciones de la obesidad, incluida la resistencia a la insulina y la diabetes tipo 2. [116]
Por tanto, la modulación del estado inflamatorio de los macrófagos del tejido adiposo se ha considerado una posible diana terapéutica para tratar enfermedades relacionadas con la obesidad. [117] Aunque los macrófagos del tejido adiposo están sujetos a un control homeostático antiinflamatorio mediante inervación simpática, los experimentos con ratones knockout para el gen ADRB2 indican que este efecto se ejerce indirectamente a través de la modulación de la función de los adipocitos, y no a través de la activación directa del receptor adrenérgico Beta-2 . lo que sugiere que la estimulación adrenérgica de los macrófagos puede ser insuficiente para afectar la inflamación o la función del tejido adiposo en la obesidad. [118]
Dentro del tejido graso ( adiposo ) de ratones con deficiencia de CCR2 , hay un mayor número de eosinófilos , una mayor activación alternativa de macrófagos y una propensión a la expresión de citoquinas tipo 2 . Además, este efecto se exageró cuando los ratones se volvieron obesos debido a una dieta rica en grasas. [119] Esto se debe en parte a un cambio de fenotipo de los macrófagos inducido por la necrosis de las células grasas ( adipocitos ). En un individuo obeso, algunos adipocitos estallan y sufren muerte necrótica, lo que hace que los macrófagos residenciales M2 cambien al fenotipo M1. Esta es una de las causas de un estado inflamatorio crónico sistémico de bajo grado asociado con la obesidad. [120] [121]
Aunque tienen una estructura muy similar a la de los macrófagos tisulares, los macrófagos intestinales han desarrollado características y funciones específicas dado su entorno natural, que se encuentra en el tracto digestivo. Los macrófagos y macrófagos intestinales tienen una alta plasticidad provocando que su fenotipo se vea alterado por su entorno. [122] Al igual que los macrófagos, los macrófagos intestinales son monocitos diferenciados, aunque los macrófagos intestinales tienen que coexistir con el microbioma en los intestinos. Este es un desafío considerando que las bacterias que se encuentran en el intestino no se reconocen como "propias" y podrían ser objetivos potenciales para la fagocitosis por parte de los macrófagos. [123]
Para evitar la destrucción de las bacterias intestinales, los macrófagos intestinales han desarrollado diferencias clave en comparación con otros macrófagos. Principalmente, los macrófagos intestinales no inducen respuestas inflamatorias. Mientras que los macrófagos tisulares liberan diversas citocinas inflamatorias, como IL-1, IL-6 y TNF-α, los macrófagos intestinales no producen ni secretan citocinas inflamatorias. Este cambio es causado directamente por el entorno de los macrófagos intestinales. Las células epiteliales intestinales circundantes liberan TGF-β , que induce el cambio de macrófagos proinflamatorios a macrófagos no inflamatorios. [123]
Aunque la respuesta inflamatoria está regulada negativamente en los macrófagos intestinales, todavía se lleva a cabo la fagocitosis. No hay una disminución en la eficiencia de la fagocitosis, ya que los macrófagos intestinales pueden fagocitar eficazmente las bacterias S. typhimurium y E. coli , pero los macrófagos intestinales aún no liberan citocinas, incluso después de la fagocitosis. Además, los macrófagos intestinales no expresan receptores de lipopolisacáridos (LPS), IgA o IgG. [124] La falta de receptores de LPS es importante para el intestino ya que los macrófagos intestinales no detectan los patrones moleculares asociados a microbios (MAMPS/PAMPS) del microbioma intestinal. Tampoco expresan receptores del factor de crecimiento IL-2 e IL-3. [123]
Se ha demostrado que los macrófagos intestinales desempeñan un papel en la enfermedad inflamatoria intestinal (EII), como la enfermedad de Crohn (EC) y la colitis ulcerosa (CU). En un intestino sano, los macrófagos intestinales limitan la respuesta inflamatoria en el intestino, pero en un estado de enfermedad, el número y la diversidad de los macrófagos intestinales se alteran. Esto provoca inflamación del intestino y síntomas de enfermedad de EII. Los macrófagos intestinales son fundamentales para mantener la homeostasis intestinal . La presencia de inflamación o patógeno altera esta homeostasis y, al mismo tiempo, altera los macrófagos intestinales. [125] Aún no se ha determinado un mecanismo para la alteración de los macrófagos intestinales mediante el reclutamiento de nuevos monocitos o cambios en los macrófagos intestinales ya presentes. [124]
Además, un nuevo estudio revela que los macrófagos limitan el acceso del hierro a las bacterias mediante la liberación de vesículas extracelulares, lo que mejora los resultados de la sepsis. [126]
Los macrófagos fueron descubiertos por primera vez a finales del siglo XIX por Élie Metchnikoff . [127]
Los macrófagos están presentes esencialmente en todos los tejidos, comenzando con el desarrollo embrionario y, además de su papel en la defensa del huésped y en la eliminación de células apoptóticas, se reconocen cada vez más por su función trófica y su papel en la regeneración.
=Monocitos/macrófagos. A menos que persistan los estímulos para el reclutamiento de neutrófilos en el sitio de la herida, la infiltración de neutrófilos cesa después de unos días y los neutrófilos gastados son fagocitados por los macrófagos, que están presentes en el lado de la herida dentro de los dos días posteriores a la lesión.
Los investigadores han identificado una célula que ayuda a que las salamandras vuelvan a crecer las extremidades. Los macrófagos son un tipo de célula reparadora que devora células muertas y patógenos, y activa otras células inmunes para que respondan a los patógenos.