El berilio es un elemento químico ; su símbolo es Be y su número atómico es 4. Es un metal alcalinotérreo de color gris acero, duro, fuerte, ligero y quebradizo . Es un elemento divalente que se produce de forma natural solo en combinación con otros elementos para formar minerales. Las piedras preciosas con alto contenido de berilio incluyen el berilo ( aguamarina , esmeralda , berilo rojo ) y el crisoberilo . Es un elemento relativamente raro en el universo , que suele aparecer como producto de la espalación de núcleos atómicos de mayor tamaño que han colisionado con rayos cósmicos . Dentro de los núcleos de las estrellas, el berilio se agota a medida que se fusiona en elementos más pesados. El berilio constituye aproximadamente el 0,0004 por ciento en masa de la corteza terrestre. La producción anual mundial de berilio, de 220 toneladas, suele fabricarse mediante la extracción del mineral berilo , un proceso difícil porque el berilio se une fuertemente al oxígeno .
En aplicaciones estructurales, la combinación de alta rigidez a la flexión , estabilidad térmica , conductividad térmica y baja densidad (1,85 veces la del agua) hacen del berilio un material aeroespacial deseable para componentes de aeronaves, misiles , naves espaciales y satélites . [9] Debido a su baja densidad y masa atómica , el berilio es relativamente transparente a los rayos X y otras formas de radiación ionizante ; por lo tanto, es el material de ventana más común para equipos de rayos X y componentes de detectores de partículas . [9] Cuando se agrega como elemento de aleación al aluminio , cobre (notablemente la aleación de cobre-berilio ), hierro o níquel , el berilio mejora muchas propiedades físicas. [9] Por ejemplo, las herramientas y los componentes hechos de aleaciones de cobre-berilio son fuertes y duros y no crean chispas cuando golpean una superficie de acero. En el aire, la superficie del berilio se oxida fácilmente a temperatura ambiente para formar una capa de pasivación de 1 a 10 nm de espesor que lo protege de una mayor oxidación y corrosión. [10] El metal se oxida en masa (más allá de la capa de pasivación ) cuando se calienta a más de 500 °C (932 °F), [11] y arde brillantemente cuando se calienta a aproximadamente 2500 °C (4530 °F). [12]
El uso comercial del berilio requiere el uso de equipos de control de polvo adecuados y controles industriales en todo momento debido a la toxicidad de los polvos que contienen berilio inhalados, que pueden causar una enfermedad alérgica crónica potencialmente mortal, la beriliosis , en algunas personas. [13] La beriliosis se manifiesta típicamente por fibrosis pulmonar crónica y, en casos graves, insuficiencia cardíaca derecha y muerte. [14]
El berilio es un metal gris acerado y duro que es frágil a temperatura ambiente y tiene una estructura cristalina hexagonal compacta . [9] Tiene una rigidez excepcional ( módulo de Young 287 GPa) y un punto de fusión de 1287 °C. El módulo de elasticidad del berilio es aproximadamente un 35% mayor que el del acero. La combinación de este módulo y una densidad relativamente baja da como resultado una velocidad de conducción del sonido inusualmente rápida en el berilio, aproximadamente 12,9 km/s en condiciones ambientales . Otras propiedades significativas son el alto calor específico (1925 J·kg −1 ·K −1 ) y conductividad térmica (216 W·m −1 ·K −1 ), lo que hace del berilio el metal con las mejores características de disipación de calor por unidad de peso. En combinación con el coeficiente de expansión térmica lineal relativamente bajo (11,4×10 −6 K −1 ), estas características dan como resultado una estabilidad única en condiciones de carga térmica. [15]
El berilio que se encuentra en la naturaleza, salvo una ligera contaminación por radioisótopos cosmogénicos , es berilio-9 isotópicamente puro, que tiene un espín nuclear de 3/2El berilio tiene una gran sección transversal de dispersión para neutrones de alta energía, alrededor de 6 barns para energías superiores a aproximadamente 10 keV. Por lo tanto, funciona como un reflector de neutrones y moderador de neutrones , frenando eficazmente los neutrones al rango de energía térmica de menos de 0,03 eV, donde la sección transversal total es al menos un orden de magnitud menor; el valor exacto depende en gran medida de la pureza y el tamaño de los cristalitos en el material.
El isótopo primordial único de berilio, 9 Be, también experimenta una reacción neutrónica (n,2n) con energías neutrónicas superiores a 1,9 MeV, para producir 8 Be , que se descompone casi inmediatamente en dos partículas alfa. Por lo tanto, para los neutrones de alta energía, el berilio es un multiplicador de neutrones, que libera más neutrones de los que absorbe. Esta reacción nuclear es: [16]
Los neutrones se liberan cuando los núcleos de berilio son golpeados por partículas alfa energéticas [15] produciendo la reacción nuclear.
dónde4
2Él
es una partícula alfa y12
6do
es un núcleo de carbono-12 . [16]
El berilio también libera neutrones cuando es bombardeado por rayos gamma. Por lo tanto, el berilio natural bombardeado con rayos alfa o gamma de un radioisótopo adecuado es un componente clave de la mayoría de las fuentes de neutrones de reacción nuclear alimentadas con radioisótopos para la producción de neutrones libres en el laboratorio.
Se liberan pequeñas cantidades de tritio cuando9
4Ser
Los núcleos absorben neutrones de baja energía en la reacción nuclear de tres pasos.
6
2Él
tiene una vida media de sólo 0,8 segundos, β − es un electrón y6
3Li
Tiene una sección transversal de absorción de neutrones alta. El tritio es un radioisótopo preocupante en los flujos de desechos de los reactores nucleares. [17]
Como metal, el berilio es transparente o translúcido a la mayoría de las longitudes de onda de los rayos X y gamma , lo que lo hace útil para las ventanas de salida de los tubos de rayos X y otros aparatos similares. [18]
En las estrellas se crean isótopos estables e inestables de berilio, pero los radioisótopos no duran mucho. Se cree que la mayor parte del berilio estable del universo se creó originalmente en el medio interestelar cuando los rayos cósmicos indujeron la fisión en elementos más pesados que se encuentran en el gas y el polvo interestelar. [19] El berilio primordial contiene solo un isótopo estable, el 9Be , y por lo tanto el berilio es, de manera única entre todos los elementos estables con un número atómico par, un elemento monoisotópico y mononucleídico .

El 10 Be cosmogénico radiactivo se produce en la atmósfera de la Tierra por la espalación del oxígeno por rayos cósmicos . [20] El 10 Be se acumula en la superficie del suelo , donde su vida media relativamente larga (1,36 millones de años) permite un largo tiempo de residencia antes de descomponerse en boro -10. Por lo tanto, el 10 Be y sus productos derivados se utilizan para examinar la erosión natural del suelo , la formación del suelo y el desarrollo de suelos lateríticos , y como un indicador para la medición de las variaciones en la actividad solar y la edad de los núcleos de hielo . [21] La producción de 10 Be es inversamente proporcional a la actividad solar, porque el aumento del viento solar durante los períodos de alta actividad solar disminuye el flujo de rayos cósmicos galácticos que llegan a la Tierra. [20] Las explosiones nucleares también forman 10 Be por la reacción de neutrones rápidos con 13 C en el dióxido de carbono del aire. Este es uno de los indicadores de la actividad pasada en los sitios de prueba de armas nucleares . [22] El isótopo 7 Be (vida media de 53 días) también es cosmogénico y muestra una abundancia atmosférica vinculada a las manchas solares, muy similar al 10 Be.
El 8Be tiene una vida media muy corta de aproximadamente 8 × 10−17 s que contribuye a su importante papel cosmológico, ya que los elementos más pesados que el berilio no podrían haberse producido por fusión nuclear en el Big Bang . [23] Esto se debe a la falta de tiempo suficiente durante la fase de nucleosíntesis del Big Bang para producir carbono mediante la fusión de núcleos de 4 He y las concentraciones muy bajas de berilio-8 disponible. El astrónomo británico Sir Fred Hoyle demostró por primera vez que los niveles de energía de 8 Be y 12 C permiten la producción de carbono mediante el llamado proceso triple-alfa en estrellas alimentadas por helio donde hay más tiempo disponible para la nucleosíntesis. Este proceso permite que se produzca carbono en las estrellas, pero no en el Big Bang. El carbono creado por las estrellas (la base de la vida basada en el carbono ) es, por tanto, un componente de los elementos del gas y el polvo expulsados por las estrellas AGB y las supernovas (véase también nucleosíntesis del Big Bang ), así como de la creación de todos los demás elementos con números atómicos mayores que el del carbono. [24]
Los electrones 2s del berilio pueden contribuir a la formación de enlaces químicos. Por lo tanto, cuando el 7Be se desintegra por captura de electrones L , lo hace tomando electrones de sus orbitales atómicos que pueden estar participando en la formación de enlaces. Esto hace que su tasa de desintegración dependa en un grado mensurable de su entorno químico, algo poco frecuente en la desintegración nuclear. [25]
El isótopo conocido de vida más corta del berilio es el 16Be , que se desintegra mediante emisión de neutrones con una vida media de6,5 × 10 −22 s . [26] Se sabe que los isótopos exóticos 11 Be y 14 Be exhiben un halo nuclear . [27] Este fenómeno puede entenderse ya que los núcleos de 11 Be y 14 Be tienen, respectivamente, 1 y 4 neutrones orbitando sustancialmente fuera del modelo clásico de "gota de agua" de Fermi del núcleo.


El Sol tiene una concentración de 0,1 partes por billón (ppb) de berilio. [28] El berilio tiene una concentración de 2 a 6 partes por millón (ppm) en la corteza terrestre y es el 47º elemento más abundante. [29] [30] Está más concentrado en los suelos a 6 ppm. [30] Se encuentran trazas de 9Be en la atmósfera de la Tierra. [30] La concentración de berilio en el agua de mar es de 0,2 a 0,6 partes por billón . [30] [31] En el agua de los arroyos, sin embargo, el berilio es más abundante con una concentración de 0,1 ppb. [32]
El berilio se encuentra en más de 100 minerales, [33] pero la mayoría son poco comunes o raros. Los minerales que contienen berilio más comunes incluyen: bertrandita (Be 4 Si 2 O 7 (OH) 2 ), berilo (Al 2 Be 3 Si 6 O 18 ), crisoberilo (Al 2 BeO 4 ) y fenakita (Be 2 SiO 4 ). Las formas preciosas de berilo son aguamarina , berilo rojo y esmeralda . [15] [34] [35] El color verde en formas de berilo de calidad gema proviene de cantidades variables de cromo (alrededor del 2% para la esmeralda). [36]
Los dos principales minerales de berilio, el berilo y la bertrandita, se encuentran en Argentina, Brasil, India, Madagascar, Rusia y Estados Unidos. [36] Las reservas mundiales totales de mineral de berilio son superiores a 400.000 toneladas. [36]
La extracción de berilio a partir de sus compuestos es un proceso difícil debido a su alta afinidad por el oxígeno a temperaturas elevadas y su capacidad para reducir el agua cuando se elimina su película de óxido. En la actualidad, Estados Unidos, China y Kazajstán son los únicos tres países que participan en la extracción de berilio a escala industrial. [37] Kazajstán produce berilio a partir de un concentrado almacenado antes de la desintegración de la Unión Soviética alrededor de 1991. Este recurso se había agotado casi por completo a mediados de la década de 2010. [38]
La producción de berilio en Rusia se detuvo en 1997 y está previsto que se reanude en la década de 2020. [39] [40]
El berilio se extrae más comúnmente del mineral berilo , que se sinteriza utilizando un agente de extracción o se funde en una mezcla soluble. El proceso de sinterización implica mezclar berilo con fluorosilicato de sodio y soda a 770 °C (1420 °F) para formar fluoroberilato de sodio , óxido de aluminio y dióxido de silicio . [9] El hidróxido de berilio se precipita a partir de una solución de fluoroberilato de sodio e hidróxido de sodio en agua. La extracción de berilio mediante el método de fusión implica moler berilo en un polvo y calentarlo a 1650 °C (3000 °F). [9] La fusión se enfría rápidamente con agua y luego se recalienta de 250 a 300 °C (482 a 572 °F) en ácido sulfúrico concentrado , produciendo principalmente sulfato de berilio y sulfato de aluminio . [9] Luego se utiliza amoníaco acuoso para eliminar el aluminio y el azufre, dejando hidróxido de berilio.
El hidróxido de berilio creado mediante el método de sinterización o de fusión se convierte luego en fluoruro de berilio o cloruro de berilio . Para formar el fluoruro, se agrega fluoruro de hidrógeno de amonio acuoso al hidróxido de berilio para producir un precipitado de tetrafluoroberilato de amonio, que se calienta a 1000 °C (1830 °F) para formar fluoruro de berilio. [9] Calentando el fluoruro a 900 °C (1650 °F) con magnesio se forma berilio finamente dividido, y calentándolo adicionalmente a 1300 °C (2370 °F) se crea el metal compacto. [9] Calentando el hidróxido de berilio se forma el óxido, que se convierte en cloruro de berilio cuando se combina con carbono y cloro. Luego se utiliza la electrólisis del cloruro de berilio fundido para obtener el metal. [9]
El berilio tiene una alta electronegatividad en comparación con otros elementos del grupo 2; por lo tanto, los enlaces C-Be están menos polarizados que otros enlaces CM II , [41] aunque el carbono unido todavía tiene un momento dipolar negativo .
Un átomo de berilio tiene la configuración electrónica [He] 2s 2 . El estado de oxidación predominante del berilio es +2; el átomo de berilio ha perdido ambos electrones de valencia. Los complejos de berilio con estados de oxidación más bajos son extremadamente raros. Por ejemplo, se han reportado compuestos de bis(carbeno) que se propone que contienen berilio en el estado de oxidación 0 y +1, aunque estas afirmaciones han resultado controvertidas. [42] [43] Se ha descrito un complejo estable con un enlace Be-Be, que presenta formalmente berilio en el estado de oxidación +1. [44] El comportamiento químico del berilio es en gran parte el resultado de sus pequeños radios atómicos e iónicos . Por lo tanto, tiene potenciales de ionización muy altos y una fuerte polarización mientras está unido a otros átomos, por lo que todos sus compuestos son covalentes . Su química tiene similitudes con la del aluminio, un ejemplo de una relación diagonal .
A temperatura ambiente, la superficie del berilio forma una capa de pasivación de óxido de 1 a 10 nm de espesor que impide más reacciones con el aire, excepto por el engrosamiento gradual del óxido hasta aproximadamente 25 nm. Cuando se calienta por encima de aproximadamente 500 °C, la oxidación en el metal a granel progresa a lo largo de los límites de grano. [11] Una vez que el metal se enciende en el aire calentando por encima del punto de fusión del óxido alrededor de 2500 °C, el berilio arde brillantemente, [12] formando una mezcla de óxido de berilio y nitruro de berilio . El berilio se disuelve fácilmente en ácidos no oxidantes , como HCl y H 2 SO 4 diluido , pero no en ácido nítrico o agua ya que esto forma el óxido. Este comportamiento es similar al del aluminio. El berilio también se disuelve en soluciones alcalinas. [9] [45]
Los compuestos binarios de berilio (II) son poliméricos en estado sólido. BeF 2 tiene una estructura similar a la sílice con tetraedros BeF 4 compartidos en los vértices. BeCl 2 y BeBr 2 tienen estructuras en cadena con tetraedros compartidos en los bordes. El óxido de berilio , BeO, es un sólido refractario blanco que tiene una estructura cristalina de wurtzita y una conductividad térmica tan alta como la de algunos metales. BeO es anfótero . Se conocen sulfuro , seleniuro y telururo de berilio, todos con la estructura de blenda de cinc . [46] El nitruro de berilio , Be 3 N 2 , es un compuesto de alto punto de fusión que se hidroliza fácilmente. Se conoce la azida de berilio, BeN 6 y el fosfuro de berilio, Be 3 P 2 tiene una estructura similar a Be 3 N 2 . Se conocen varios boruros de berilio , como Be 5 B, Be 4 B, Be 2 B, BeB 2 , BeB 6 y BeB 12 . El carburo de berilio , Be 2 C, es un compuesto refractario de color rojo ladrillo que reacciona con el agua para dar metano . [46] No se ha identificado ningún siliciuro de berilio . [45]
Los haluros BeX 2 (X = F, Cl, Br e I) tienen una estructura molecular monomérica lineal en fase gaseosa. [45] Los complejos de los haluros se forman con uno o más ligandos que donan un total de dos pares de electrones. Tales compuestos obedecen la regla del octeto . Otros complejos de 4 coordenadas, como el ion agua [Be(H 2 O) 4 ] 2+ también obedecen la regla del octeto.
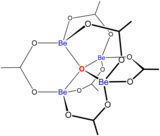
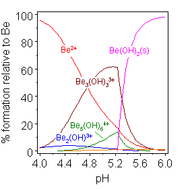
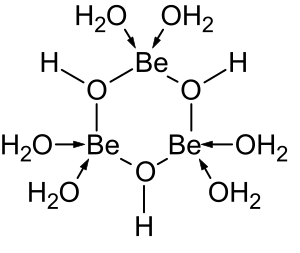
Las soluciones de sales de berilio, como el sulfato de berilio y el nitrato de berilio , son ácidas debido a la hidrólisis del ion [Be(H 2 O) 4 ] 2+ . La concentración del primer producto de hidrólisis, [Be(H 2 O) 3 (OH)] + , es inferior al 1% de la concentración de berilio. El producto de hidrólisis más estable es el ion trimérico [Be 3 (OH) 3 (H 2 O) 6 ] 3+ . El hidróxido de berilio , Be(OH) 2 , es insoluble en agua a un pH de 5 o más. En consecuencia, los compuestos de berilio son generalmente insolubles a un pH biológico. Debido a esto, la inhalación de polvo de metal de berilio por parte de las personas conduce al desarrollo de la condición fatal de beriliosis . Be(OH) 2 se disuelve en soluciones fuertemente alcalinas . [47]
El berilio(II) forma pocos complejos con ligandos monodentados porque las moléculas de agua en el ión aquo, [Be(H 2 O) 4 ] 2+ están unidas muy fuertemente al ión berilio. Excepciones notables son la serie de complejos solubles en agua con el ión fluoruro : [48]
El berilio (II) forma muchos complejos con ligandos bidentados que contienen átomos donantes de oxígeno. [47] La especie [Be 3 O(H 2 PO 4 ) 6 ] 2- se destaca por tener un ion óxido 3-coordinado en su centro. El acetato de berilio básico , Be 4 O(OAc) 6 , tiene un ion óxido rodeado por un tetraedro de átomos de berilio.
En el caso de ligandos orgánicos, como el ion malonato , el ácido se desprotona al formar el complejo. Los átomos donantes son dos oxígenos. La formación de un complejo compite con la reacción de hidrólisis del ion metálico y también se forman complejos mixtos con el anión y el ion hidróxido. Por ejemplo, se conocen derivados del trímero cíclico, en los que un ligando bidentado reemplaza uno o más pares de moléculas de agua. [49]
Los ácidos hidroxicarboxílicos alifáticos , como el ácido glicólico, forman complejos monodentados bastante débiles en solución, en los que el grupo hidroxilo permanece intacto. En estado sólido, el grupo hidroxilo puede desprotonarse: hace mucho tiempo se aisló un hexámero, . [49] [50] Los ligandos hidroxi aromáticos (es decir, fenoles ) forman complejos relativamente fuertes. Por ejemplo, se han informado valores de log K 1 y log K 2 de 12,2 y 9,3 para complejos con tiron . [49] [51]
El berilio tiene generalmente una afinidad bastante pobre por los ligandos de amina . [49] [52] Los ligandos como el EDTA se comportan como ácidos dicarboxílicos. [ cita requerida ] Hay muchos informes tempranos de complejos con aminoácidos, pero desafortunadamente no son confiables ya que las reacciones de hidrólisis concomitantes no se comprendían en el momento de la publicación. Se han informado valores para log β de ca. 6 a 7. El grado de formación es pequeño debido a la competencia con las reacciones de hidrólisis. [49] [52]
La química del organoberilio se limita a la investigación académica debido al costo y la toxicidad del berilio, los derivados del berilio y los reactivos necesarios para la introducción del berilio, como el cloruro de berilio . Se sabe que los compuestos organometálicos de berilio son altamente reactivos [53] Ejemplos de compuestos de organoberilio conocidos son dineopentilberilio , [54] beriloceno (Cp 2 Be), [55] [56] [57] [58] dialilberilio (por reacción de intercambio de dietilberilio con trialilboro), [59] bis(1,3-trimetilsililalil)berilio, [60] Be(mes) 2 , [53] y (complejo de berilio(I)) diberiloceno . [44] Los ligandos también pueden ser arilos [61] y alquinilos. [62]
El mineral berilo , que contiene berilio, se ha utilizado al menos desde la dinastía ptolemaica de Egipto. [63] En el siglo I d. C. , el naturalista romano Plinio el Viejo mencionó en su enciclopedia Historia Natural que el berilo y la esmeralda ("smaragdus") eran similares. [64] El Papiro Graecus Holmiensis , escrito en el siglo III o IV d. C., contiene notas sobre cómo preparar esmeralda y berilo artificiales. [64]

Los primeros análisis de esmeraldas y berilos realizados por Martin Heinrich Klaproth , Torbern Olof Bergman , Franz Karl Achard y Johann Jakob Bindheim siempre arrojaron elementos similares, lo que llevó a la conclusión errónea de que ambas sustancias son silicatos de aluminio . [65] El mineralogista René Just Haüy descubrió que ambos cristales son geométricamente idénticos y le pidió al químico Louis-Nicolas Vauquelin un análisis químico. [63]
En un artículo de 1798 leído ante el Institut de France , Vauquelin informó que había encontrado una nueva "tierra" disolviendo hidróxido de aluminio de esmeralda y berilo en un álcali adicional . [66] Los editores de la revista Annales de Chimie et de Physique llamaron a la nueva tierra "glucina" por el sabor dulce de algunos de sus compuestos. [67] Klaproth prefirió el nombre "beryllina" debido al hecho de que la itria también formaba sales dulces. [68] [69] El nombre "berilio" fue utilizado por primera vez por Wöhler en 1828. [70]

Friedrich Wöhler [71] y Antoine Bussy [72] aislaron independientemente el berilio en 1828 mediante la reacción química del potasio metálico con cloruro de berilio , de la siguiente manera:
Utilizando una lámpara de alcohol, Wöhler calentó capas alternas de cloruro de berilio y potasio en un crisol de platino cerrado con alambre. La reacción anterior se produjo inmediatamente y provocó que el crisol se pusiera al rojo vivo. Al enfriar y lavar el polvo gris-negro resultante, vio que estaba hecho de partículas finas con un brillo metálico oscuro. [73] El potasio altamente reactivo se había producido por electrólisis de sus compuestos, un proceso descubierto 21 años antes. El método químico que utilizaba potasio producía solo pequeños granos de berilio de los que no se podía fundir ni martillar ningún lingote de metal.
La electrólisis directa de una mezcla fundida de fluoruro de berilio y fluoruro de sodio por Paul Lebeau en 1898 dio como resultado las primeras muestras puras (99,5 a 99,8%) de berilio. [73] Sin embargo, la producción industrial comenzó solo después de la Primera Guerra Mundial. La participación industrial original incluía subsidiarias y científicos relacionados con Union Carbide and Carbon Corporation en Cleveland, Ohio, y Siemens & Halske AG en Berlín. En los EE. UU., el proceso estaba dirigido por Hugh S. Cooper, director de The Kemet Laboratories Company. En Alemania, el primer proceso comercialmente exitoso para producir berilio fue desarrollado en 1921 por Alfred Stock y Hans Goldschmidt . [74]
Una muestra de berilio fue bombardeada con rayos alfa provenientes de la desintegración del radio en un experimento de 1932 realizado por James Chadwick que descubrió la existencia del neutrón . [36] Este mismo método se utiliza en una clase de fuentes de neutrones de laboratorio basadas en radioisótopos que producen 30 neutrones por cada millón de partículas α. [29]
La producción de berilio aumentó rápidamente durante la Segunda Guerra Mundial debido a la creciente demanda de aleaciones duras de berilio y cobre y de fósforos para luces fluorescentes . La mayoría de las primeras lámparas fluorescentes utilizaban ortosilicato de cinc con un contenido variable de berilio para emitir luz verdosa. Pequeñas adiciones de tungstato de magnesio mejoraron la parte azul del espectro para producir una luz blanca aceptable. Los fósforos basados en halofosfato reemplazaron a los fósforos basados en berilio después de que se descubriera que el berilio era tóxico. [75]
Durante el siglo XIX se utilizó la electrólisis de una mezcla de fluoruro de berilio y fluoruro de sodio para aislar el berilio. El alto punto de fusión del metal hace que este proceso consuma más energía que los procesos correspondientes utilizados para los metales alcalinos . A principios del siglo XX, se investigó la producción de berilio mediante la descomposición térmica del yoduro de berilio tras el éxito de un proceso similar para la producción de circonio , pero este proceso resultó poco económico para la producción en masa. [76]
El berilio puro no se volvió fácilmente disponible hasta 1957, a pesar de que se había utilizado como metal de aleación para endurecer y endurecer el cobre mucho antes. [36] El berilio se podía producir reduciendo compuestos de berilio como el cloruro de berilio con potasio o sodio metálicos. Actualmente, la mayor parte del berilio se produce reduciendo el fluoruro de berilio con magnesio . [77] El precio en el mercado estadounidense de los lingotes de berilio fundidos al vacío era de aproximadamente $338 por libra ($745 por kilogramo) en 2001. [78]
Entre 1998 y 2008, la producción mundial de berilio disminuyó de 343 a aproximadamente 200 toneladas . Luego aumentó a 230 toneladas métricas en 2018, de las cuales 170 toneladas procedían de los Estados Unidos. [79] [80]
El berilio recibió su nombre del mineral semiprecioso berilo , del que se aisló por primera vez. [81] [82] [83] El nombre berilio fue introducido por Wöhler en 1828.
Aunque Humphry Davy no logró aislarlo, propuso el nombre glucium para el nuevo metal, derivado del nombre glucina para la tierra en la que se encontraba; formas alteradas de este nombre, glucunio o glucinum (símbolo Gl) continuaron utilizándose hasta el siglo XX. [84] Tanto el berilio como el glucinum se utilizaron simultáneamente hasta 1949, cuando la IUPAC adoptó el berilio como el nombre estándar del elemento. [85]


Debido a su bajo número atómico y su muy baja absorción de rayos X, la aplicación más antigua y aún una de las más importantes del berilio es en ventanas de radiación para tubos de rayos X. [36] Se imponen exigencias extremas a la pureza y limpieza del berilio para evitar artefactos en las imágenes de rayos X. Se utilizan láminas delgadas de berilio como ventanas de radiación para detectores de rayos X, y su absorción extremadamente baja minimiza los efectos de calentamiento causados por los rayos X de alta intensidad y baja energía típicos de la radiación de sincrotrón . Las ventanas herméticas al vacío y los tubos de haz para experimentos de radiación en sincrotrones se fabrican exclusivamente a partir de berilio. En configuraciones científicas para varios estudios de emisión de rayos X (por ejemplo, espectroscopia de rayos X de energía dispersiva ), el portamuestras generalmente está hecho de berilio porque sus rayos X emitidos tienen energías mucho más bajas (≈100 eV) que los rayos X de la mayoría de los materiales estudiados. [15]
El bajo número atómico también hace que el berilio sea relativamente transparente a las partículas energéticas . Por lo tanto, se utiliza para construir el tubo de haz alrededor de la región de colisión en configuraciones de física de partículas , como los cuatro experimentos de detectores principales en el Gran Colisionador de Hadrones ( ALICE , ATLAS , CMS , LHCb ), [86] el Tevatron y en SLAC . La baja densidad del berilio permite que los productos de colisión alcancen los detectores circundantes sin una interacción significativa, su rigidez permite que se produzca un poderoso vacío dentro del tubo para minimizar la interacción con los gases, su estabilidad térmica le permite funcionar correctamente a temperaturas de solo unos pocos grados por encima del cero absoluto , y su naturaleza diamagnética evita que interfiera con los complejos sistemas de imanes multipolares utilizados para dirigir y enfocar los haces de partículas . [87]
Debido a su rigidez, peso ligero y estabilidad dimensional en un amplio rango de temperaturas, el metal berilio se utiliza para componentes estructurales ligeros en las industrias de defensa y aeroespacial en aviones de alta velocidad , misiles guiados , naves espaciales y satélites , incluido el telescopio espacial James Webb . Varios cohetes de combustible líquido han utilizado toberas de cohetes hechas de berilio puro. [88] [89] El polvo de berilio se estudió como combustible para cohetes , pero este uso nunca se ha materializado. [36] Se han construido una pequeña cantidad de cuadros de bicicletas de gama alta con berilio. [90] De 1998 a 2000, el equipo de Fórmula Uno McLaren utilizó motores Mercedes-Benz con pistones de aleación de berilio y aluminio . [91] El uso de componentes de motor de berilio fue prohibido tras una protesta de la Scuderia Ferrari . [92]
Mezclando alrededor de 2,0% de berilio en cobre se forma una aleación llamada cobre-berilio que es seis veces más fuerte que el cobre solo. [93] Las aleaciones de berilio se utilizan en muchas aplicaciones debido a su combinación de elasticidad, alta conductividad eléctrica y conductividad térmica , alta resistencia y dureza , propiedades no magnéticas, así como buena resistencia a la corrosión y a la fatiga . [36] [9] Estas aplicaciones incluyen herramientas antichispas que se utilizan cerca de gases inflamables (níquel-berilio) en resortes y membranas (níquel-berilio y hierro-berilio) utilizadas en instrumentos quirúrgicos y dispositivos de alta temperatura. [36] [9] Tan solo 50 partes por millón de berilio aleado con magnesio líquido conduce a un aumento significativo de la resistencia a la oxidación y una disminución de la inflamabilidad. [9]

La alta rigidez elástica del berilio ha llevado a su uso extensivo en instrumentación de precisión, por ejemplo en sistemas de guía inercial y en los mecanismos de soporte para sistemas ópticos. [15] Las aleaciones de berilio y cobre también se aplicaron como agente endurecedor en las " pistolas Jason ", que se usaban para quitar la pintura de los cascos de los barcos. [94]
En los sistemas de amplificación de sonido, la velocidad a la que viaja el sonido afecta directamente a la frecuencia de resonancia del amplificador , influyendo así en el rango de sonidos audibles de alta frecuencia. El berilio destaca por su velocidad de propagación del sonido excepcionalmente alta en comparación con otros metales. [95] Esta propiedad única permite que el berilio alcance frecuencias de resonancia más altas, lo que lo convierte en un material ideal para su uso como diafragma en altavoces de alta calidad. [96]
El berilio también se utilizó para los voladizos de las agujas de los cartuchos de fonógrafo de alto rendimiento, donde su extrema rigidez y baja densidad permitieron reducir los pesos de seguimiento a 1 gramo mientras se seguían rastreando pasajes de alta frecuencia con una distorsión mínima. [97]
Una de las principales aplicaciones anteriores del berilio fue en los frenos de los aviones militares debido a su dureza, su alto punto de fusión y su capacidad excepcional para disipar el calor . Las consideraciones medioambientales han llevado a su sustitución por otros materiales. [15]
Para reducir los costos, el berilio se puede alear con cantidades significativas de aluminio , lo que da como resultado la aleación AlBeMet (un nombre comercial). Esta mezcla es más económica que el berilio puro, pero aún conserva muchas propiedades deseables.
Los espejos de berilio son de particular interés. Los espejos de gran superficie, frecuentemente con una estructura de soporte en forma de panal , se utilizan, por ejemplo, en satélites meteorológicos donde el bajo peso y la estabilidad dimensional a largo plazo son críticos. Los espejos de berilio más pequeños se utilizan en sistemas de guía óptica y en sistemas de control de tiro , por ejemplo, en los tanques de batalla principales Leopard 1 y Leopard 2 de fabricación alemana . En estos sistemas, se requiere un movimiento muy rápido del espejo, lo que nuevamente dicta baja masa y alta rigidez. Por lo general, el espejo de berilio está recubierto con un revestimiento de níquel electrolítico duro que se puede pulir más fácilmente hasta obtener un acabado óptico más fino que el berilio. Sin embargo, en algunas aplicaciones, el blanco de berilio se pule sin ningún revestimiento. Esto es particularmente aplicable a la operación criogénica donde el desajuste de expansión térmica puede hacer que el revestimiento se deforme. [15]
El telescopio espacial James Webb tiene 18 secciones hexagonales de berilio como espejos, cada una recubierta de una fina capa de oro. [98] Debido a que el JWST se enfrentará a una temperatura de 33 K, el espejo está hecho de berilio recubierto de oro, que es capaz de soportar el frío extremo mejor que el vidrio. El berilio se contrae y se deforma menos que el vidrio y permanece más uniforme, a tales temperaturas. [99] Por la misma razón, la óptica del telescopio espacial Spitzer está construida completamente de metal berilio. [100]

El berilio no es magnético, por lo que los equipos de desactivación de artefactos explosivos navales o militares utilizan herramientas fabricadas con materiales a base de berilio para trabajar en minas navales o cerca de ellas , ya que estas minas suelen tener espoletas magnéticas . [102] También se encuentran en materiales de mantenimiento y construcción cerca de máquinas de resonancia magnética (MRI) debido a los altos campos magnéticos generados. [103] En los campos de las comunicaciones por radio y los radares potentes (normalmente militares) , se utilizan herramientas manuales hechas de berilio para sintonizar los klistrones , magnetrones , tubos de ondas viajeras , etc., altamente magnéticos, que se utilizan para generar altos niveles de potencia de microondas en los transmisores . [ cita requerida ]
En los diseños de armas nucleares se utilizan a veces láminas o placas delgadas de berilio como capa exterior de los núcleos de plutonio en las etapas primarias de las bombas termonucleares , colocadas para rodear el material fisible . Estas capas de berilio son buenos "empujadores" para la implosión del plutonio-239 y son buenos reflectores de neutrones , al igual que en los reactores nucleares moderados por berilio . [104]
El berilio también se utiliza habitualmente en algunas fuentes de neutrones en dispositivos de laboratorio en los que se necesitan relativamente pocos neutrones (en lugar de tener que utilizar un reactor nuclear o un generador de neutrones alimentado por un acelerador de partículas ). Para este propósito, un objetivo de berilio-9 se bombardea con partículas alfa energéticas de un radioisótopo como el polonio -210, el radio -226, el plutonio -238 o el americio -241. En la reacción nuclear que se produce, un núcleo de berilio se transmuta en carbono-12 y se emite un neutrón libre, que viaja aproximadamente en la misma dirección en la que se dirigía la partícula alfa. Estas fuentes de neutrones de berilio impulsadas por la desintegración alfa , llamadas iniciadores de neutrones "erizos" , se utilizaron en algunas de las primeras bombas atómicas . [104] Las fuentes de neutrones en las que el berilio se bombardea con rayos gamma de un radioisótopo de desintegración gamma , también se utilizan para producir neutrones de laboratorio. [105]
El berilio también se utiliza en la fabricación de combustible para reactores CANDU . Los elementos combustibles tienen pequeños apéndices que se sueldan por resistencia al revestimiento del combustible mediante un proceso de soldadura por inducción con Be como material de relleno de la soldadura. Se sueldan almohadillas de apoyo en su lugar para evitar el contacto entre el haz de combustible y el tubo de presión que lo contiene, y se sueldan almohadillas espaciadoras entre elementos para evitar el contacto entre elementos.
El berilio también se utiliza en el laboratorio de investigación nuclear de fusión Joint European Torus , y se utilizará en el más avanzado ITER para acondicionar los componentes que se enfrentan al plasma. [106] El berilio también se ha propuesto como material de revestimiento para barras de combustible nuclear , debido a su buena combinación de propiedades mecánicas, químicas y nucleares. [15] El fluoruro de berilio es una de las sales constituyentes de la mezcla de sales eutécticas FLiBe , que se utiliza como disolvente, moderador y refrigerante en muchos diseños hipotéticos de reactores de sal fundida , incluido el reactor de torio con fluoruro líquido (LFTR). [107]
El bajo peso y la alta rigidez del berilio lo hacen útil como material para controladores de altavoces de alta frecuencia . Debido a que el berilio es caro (muchas veces más que el titanio ), difícil de moldear debido a su fragilidad y tóxico si se manipula incorrectamente, los tweeters de berilio se limitan a aplicaciones de alta gama para el hogar, [108] [109] [110] audio profesional y megafonía . [111] [112] Se ha afirmado fraudulentamente que algunos productos de alta fidelidad están hechos de este material. [113]
Algunos cartuchos fonográficos de alta gama usaban voladizos de berilio para mejorar el seguimiento al reducir la masa. [114]
El berilio es un dopante de tipo p en semiconductores compuestos III-V . Se utiliza ampliamente en materiales como GaAs , AlGaAs , InGaAs e InAlAs cultivados por epitaxia de haz molecular (MBE). [115] La lámina de berilio laminada en cruz es un excelente soporte estructural para placas de circuito impreso en tecnología de montaje superficial . En aplicaciones electrónicas críticas, el berilio es tanto un soporte estructural como un disipador de calor . La aplicación también requiere un coeficiente de expansión térmica que se adapte bien a los sustratos de alúmina y vidrio de poliimida . Los compuestos de óxido de berilio-berilio " E-Materials " se han diseñado especialmente para estas aplicaciones electrónicas y tienen la ventaja adicional de que el coeficiente de expansión térmica se puede adaptar para adaptarse a diversos materiales de sustrato. [15]
El óxido de berilio es útil para muchas aplicaciones que requieren las propiedades combinadas de un aislante eléctrico y un excelente conductor de calor, con alta resistencia y dureza y un punto de fusión muy alto. El óxido de berilio se utiliza con frecuencia como placa base aislante en transistores de alta potencia en transmisores de radiofrecuencia para telecomunicaciones. El óxido de berilio también se está estudiando para su uso en el aumento de la conductividad térmica de las pastillas de combustible nuclear de dióxido de uranio . [116] Los compuestos de berilio se utilizaron en tubos de iluminación fluorescente , pero este uso se interrumpió debido a la enfermedad beriliosis que desarrollaron los trabajadores que fabricaban los tubos. [117]
El berilio es un componente de varias aleaciones dentales . [118] [119] El berilio se utiliza en ventanas de rayos X porque es transparente a los rayos X, lo que permite obtener imágenes más claras y eficientes. [120] En equipos de imágenes médicas, como escáneres de TC y máquinas de mamografía, la resistencia y el peso ligero del berilio mejoran la durabilidad y el rendimiento. [121] El berilio también se utiliza en equipos analíticos para sangre, VIH y otras enfermedades. [122] Además, las aleaciones de berilio se utilizan en instrumentos quirúrgicos, espejos ópticos y sistemas láser para tratamientos médicos. [123] [124]
En el cuerpo humano promedio se encuentran aproximadamente 35 microgramos de berilio, una cantidad que no se considera dañina. [126] El berilio es químicamente similar al magnesio y, por lo tanto, puede desplazarlo de las enzimas , lo que hace que funcionen mal. [126] Debido a que Be 2+ es un ion pequeño y altamente cargado, puede ingresar fácilmente a muchos tejidos y células, donde se dirige específicamente a los núcleos celulares, inhibiendo muchas enzimas, incluidas las que se utilizan para sintetizar ADN. Su toxicidad se ve agravada por el hecho de que el cuerpo no tiene medios para controlar los niveles de berilio y, una vez dentro del cuerpo, el berilio no se puede eliminar. [127]
La enfermedad crónica por berilio (ECB), o beriliosis , es una enfermedad granulomatosa pulmonar y sistémica causada por la inhalación de polvo o humos contaminados con berilio; tanto grandes cantidades durante un corto período de tiempo como pequeñas cantidades durante un largo período de tiempo pueden provocar esta dolencia. Los síntomas de la enfermedad pueden tardar hasta cinco años en desarrollarse; alrededor de un tercio de los pacientes que la padecen mueren y los supervivientes quedan discapacitados. [126] La Agencia Internacional para la Investigación sobre el Cáncer (IARC) clasifica el berilio y los compuestos de berilio como carcinógenos de categoría 1. [128]
En los EE. UU., la Administración de Seguridad y Salud Ocupacional (OSHA) ha designado un límite de exposición permisible (PEL) para el berilio y los compuestos de berilio de 0,2 μg/m 3 como promedio ponderado en el tiempo (TWA) de 8 horas y 2,0 μg/m 3 como límite de exposición a corto plazo durante un período de muestreo de 15 minutos. El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) ha establecido un umbral superior de límite de exposición recomendado (REL) de 0,5 μg/m 3 . El valor IDLH (inmediatamente peligroso para la vida y la salud) es de 4 mg/m 3 . [129] La toxicidad del berilio está a la par con otros metaloides/metales tóxicos, como el arsénico y el mercurio . [130] [131]
La exposición al berilio en el lugar de trabajo puede provocar una respuesta inmunitaria sensibilizada y, con el tiempo, desarrollar beriliosis. [132] El Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH) de los Estados Unidos investiga estos efectos en colaboración con un importante fabricante de productos de berilio. El NIOSH también lleva a cabo investigaciones genéticas sobre la sensibilización y el CBD, independientemente de esta colaboración. [132]
La enfermedad aguda por berilio en forma de neumonitis química se informó por primera vez en Europa en 1933 y en los Estados Unidos en 1943. Una encuesta encontró que alrededor del 5% de los trabajadores en plantas que fabricaban lámparas fluorescentes en 1949 en los Estados Unidos tenían enfermedades pulmonares relacionadas con el berilio. [133] La beriliosis crónica se parece a la sarcoidosis en muchos aspectos, y el diagnóstico diferencial suele ser difícil. Mató a algunos de los primeros trabajadores en el diseño de armas nucleares, como Herbert L. Anderson . [134]
El berilio puede encontrarse en la escoria de carbón. Cuando la escoria se convierte en un agente abrasivo para eliminar pintura y óxido de superficies duras, el berilio puede pasar al aire y convertirse en una fuente de exposición. [135]
Aunque el uso de compuestos de berilio en tubos de iluminación fluorescente se interrumpió en 1949, existe potencial de exposición al berilio en las industrias nuclear y aeroespacial, en el refinado del metal berilio y la fusión de aleaciones que contienen berilio, en la fabricación de dispositivos electrónicos y en la manipulación de otros materiales que contienen berilio. [136]
Los primeros investigadores emprendieron la práctica altamente peligrosa de identificar el berilio y sus diversos compuestos a partir de su sabor dulce. Se ha desarrollado y publicado una prueba moderna para el berilio en el aire y en superficies como una norma de consenso voluntaria internacional, ASTM D7202. El procedimiento utiliza bifluoruro de amonio diluido para la disolución y detección de fluorescencia con berilio unido a hidroxibenzoquinolina sulfonada, lo que permite una detección hasta 100 veces más sensible que el límite recomendado para la concentración de berilio en el lugar de trabajo. La fluorescencia aumenta con el aumento de la concentración de berilio. El nuevo procedimiento se ha probado con éxito en una variedad de superficies y es eficaz para la disolución y detección de óxido de berilio refractario y berilio silíceo en concentraciones mínimas (ASTM D7458). [137] [138] El Manual de métodos analíticos del NIOSH contiene métodos para medir las exposiciones ocupacionales al berilio. [139]