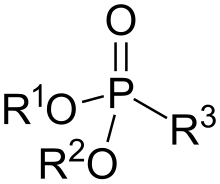
En química orgánica , los fosfonatos o ácidos fosfónicos son compuestos organofosforados que contienen grupos C−PO(OR) 2 , donde R es un grupo orgánico ( alquilo , arilo ). Si R es hidrógeno, entonces el compuesto es un fosfito de dialquilo , que es un grupo funcional diferente. Los ácidos fosfónicos, que normalmente se manejan como sales, son generalmente sólidos no volátiles que son poco solubles en solventes orgánicos , pero solubles en agua y alcoholes comunes .
Muchos compuestos de importancia comercial son fosfonatos, entre ellos el glifosato (la molécula activa del herbicida Roundup ) y el etefón , un regulador del crecimiento de las plantas muy utilizado. Los bifosfonatos son fármacos populares para el tratamiento de la osteoporosis . [1]
En bioquímica y química médica , los grupos fosfonato se utilizan como bioisósteros estables para el fosfato, como en el análogo de nucleótido antiviral, Tenofovir , una de las piedras angulares de la terapia contra el VIH . Y hay indicios de que los derivados de fosfonato son "ligandos prometedores para la medicina nuclear ". [2]
Los fosfonatos tienen centros de fósforo tetraédricos y están estructuralmente relacionados con el ácido fosforoso (y a menudo se preparan a partir de él) . [3]

Las sales de fosfonato son el resultado de la desprotonación de los ácidos fosfónicos, que son ácidos dipróticos:
Los ésteres de fosfonato son el resultado de la condensación de ácidos fosfónicos con alcoholes.
Existen varios métodos para la preparación de ácidos fosfónicos y sus sales.
La mayoría de los procesos comienzan con ácido fosforoso (también conocido como ácido fosfónico, H 3 PO 3 ), aprovechando su enlace reactivo P−H. [1] [3]
El ácido fosfónico se puede alquilar mediante la reacción de Kabachnik-Fields o la reacción de Pudovik para dar aminofosfonatos , que son útiles como agentes quelantes . Un ejemplo es la preparación industrial de nitrilotris(ácido metilenfosfónico) :
El ácido fosfónico también se puede alquilar con derivados del ácido acrílico para obtener ácidos fosfónicos funcionalizados con carboxilo. Esta reacción es una variante de la adición de Michael :
En el acoplamiento de Hirao, los fosfitos de dialquilo (que también pueden considerarse diésteres del ácido fosfónico: (O=PH(OR) 2 ) experimentan una reacción de acoplamiento catalizada por paladio con un haluro de arilo para formar un fosfonato.
Los ésteres fosfónicos se preparan mediante la reacción de Michaelis-Arbuzov . Por ejemplo, el yoduro de metilo cataliza la conversión de trimetilfosfito en el éster de fosfonato dimetilmetilfosfonato :
Estos ésteres pueden hidrolizarse al ácido (Me = metilo):
En la reacción de Michaelis-Becker , primero se desprotona un diéster de fosfonato de hidrógeno y el anión resultante se alquila.
El ácido vinilfosfónico se puede preparar mediante la reacción de PCl3 y acetaldehído :
Este aducto reacciona con el ácido acético:
Este cloruro sufre deshidrocloración para obtener el objetivo:
En la reacción de Kinnear-Perren, los dicloruros y ésteres de alquilfosfonilo se generan mediante la alquilación del tricloruro de fósforo en presencia de tricloruro de aluminio . Las sales de alquiltriclorofosfonio son intermediarios: [1]
El RPCl+
3El producto puede luego descomponerse con agua para producir un dicloruro de alquilfosfónico RP(=O)Cl 2 .
Los ésteres de fosfonato son generalmente susceptibles a la hidrólisis tanto en condiciones ácidas como básicas. La ruptura del enlace PC es más difícil, pero se puede lograr en condiciones agresivas.
En la reacción de Horner-Wadsworth-Emmons, los dialquil-fosfonatos se desprotonan para dar carbaniones estabilizados , que reaccionan con aldehídos para dar E-alquenos con eliminación de un dialquil- fosfato . [4]

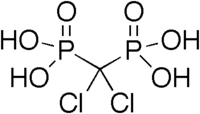
Los compuestos que contienen dos grupos fosfonato geminales se conocen como bisfosfonatos . Fueron sintetizados por primera vez en 1897 por Von Baeyer y Hofmann y ahora forman la base de una clase importante de medicamentos, utilizados para tratar la osteoporosis y enfermedades similares. Algunos ejemplos incluyen HEDP (ácido etidrónico o Didronel), que se prepara a partir de ácido fosforoso y anhídrido acético : [1]
Un grupo tiofosfonato es un grupo funcional relacionado con el fosfonato por la sustitución de un átomo de oxígeno por un átomo de azufre. Son un componente reactivo de muchos pesticidas y agentes nerviosos . Los tiofosfonatos sustituidos pueden tener dos isómeros estructurales principales que se unen a través de grupos O o S para dar las formas tiona y tiol respectivamente. Esta es una propiedad que comparten con grupos funcionales relacionados, como los ácidos tiocarboxílicos y los organotiofosfatos .
Los fosfoamidatos están relacionados con los fosfonatos por la sustitución de un átomo de oxígeno por un átomo de nitrógeno. Son un grupo funcional que rara vez se encuentra. El agente nervioso Tabun es un ejemplo.

Los fosfonatos son una de las tres fuentes de ingesta de fosfato en las células biológicas. [ cita requerida ] Los otros dos son el fosfato inorgánico y los organofosforados.
El ácido 2-aminoetilfosfónico, un fosfonato natural, se identificó por primera vez en 1959 en plantas y muchos animales, donde se encuentra en las membranas. Los fosfonatos son bastante comunes entre diferentes organismos, desde procariotas hasta eubacterias y hongos , moluscos , insectos y otros. Newman y Tate (1980) los informaron por primera vez en suelos naturales. El papel biológico de los fosfonatos naturales aún se comprende poco. No se ha encontrado que los bisfosfonatos o polifosfonatos se produzcan de forma natural.
Se han identificado varias sustancias fosfonadas de productos naturales con propiedades antibióticas . [5] Los antibióticos fosfonatos de productos naturales incluyen fosfomicina que está aprobada por la FDA para el tratamiento de infecciones del tracto urinario no complicadas , así como varias sustancias investigadas preclínicamente como fosmidomicina (inhibidor de la isoprenil sintasa), SF-2312 (inhibidor de la enzima glucolítica enolasa , [6] y sustancias de modo de acción desconocido como alahopcina. Aunque los fosfonatos son profundamente impermeables a las células, los antibióticos fosfonatos de productos naturales son eficaces contra varios organismos, porque muchas especies bacterianas expresan importadores de glicerol-3-fosfato y glucosa-6-fosfato, que pueden ser secuestrados por antibióticos fosfonatos. Las cepas bacterianas resistentes a la fosfomicina con frecuencia tienen mutaciones que inactivan estos transportadores; sin embargo, dichas mutaciones no se mantienen en ausencia de antibióticos debido al costo de aptitud que imponen.
En 1998, el consumo mundial de fosfonatos ascendió a 56.000 toneladas: 40.000 toneladas en los EE.UU., 15.000 toneladas en Europa y menos de 800 toneladas en Japón. La demanda de fosfonatos crece de forma constante a un ritmo del 3% anual.
Desde el trabajo de Gerold Schwarzenbach en 1949, los ácidos fosfónicos son conocidos como agentes quelantes eficaces . La introducción de un grupo amina en la molécula para obtener −NH 2 −C−PO(OH) 2 aumenta las capacidades de unión de metales del fosfonato. Ejemplos de tales compuestos son NTMP, EDTMP y DTPMP. Estos fosfonatos son los análogos estructurales del conocido aminopolicarboxilato como el EDTA . La estabilidad de los complejos metálicos aumenta con el aumento del número de grupos de ácido fosfónico. Los fosfonatos son altamente solubles en agua mientras que los ácidos fosfónicos lo son solo escasamente.
Los fosfonatos son agentes quelantes eficaces. Es decir, se unen fuertemente a iones metálicos divalentes y trivalentes, lo que resulta útil para ablandar el agua . De esta manera, evitan la formación de precipitados insolubles (incrustaciones). La unión de estos ligandos también suprime las propiedades catalíticas de los iones metálicos. Son estables en condiciones duras. Por estas razones, un uso industrial importante de los fosfonatos es en aguas de refrigeración, sistemas de desalinización y en campos petrolíferos para inhibir la formación de incrustaciones. Los fosfonatos también se utilizan regularmente en sistemas de ósmosis inversa como antiincrustantes. Los fosfonatos en los sistemas de agua de refrigeración también sirven para controlar la corrosión del hierro y el acero. En la fabricación de pulpa y papel y en la industria textil sirven como "estabilizadores de blanqueador de peróxido", al quelar metales que podrían inactivar el peróxido. En detergentes se utilizan como una combinación de agente quelante, inhibidor de incrustaciones y estabilizador de blanqueador. Los fosfonatos también se utilizan cada vez más en medicina para tratar trastornos asociados con la formación ósea y el metabolismo del calcio. Además, sirven como portadores de radionucleidos en tratamientos contra el cáncer de huesos (véase fosfonato de tetrametilendiamina-153-samario ).
Los fosfonatos también se utilizan como retardantes del hormigón. [7] [8] Retrasan el tiempo de fraguado del cemento, permitiendo un mayor tiempo para colocar el hormigón o para distribuir el calor de hidratación del cemento en un período de tiempo más largo para evitar una temperatura demasiado alta y las grietas resultantes. También tienen propiedades dispersantes favorables y por eso se investigan como una posible nueva clase de superplastificantes. Sin embargo, actualmente, los fosfonatos no están disponibles comercialmente como superplastificantes. Los superplastificantes son aditivos para hormigón diseñados para aumentar la fluidez y trabajabilidad del hormigón o para disminuir su relación agua-cemento (a/c). Al reducir el contenido de agua en el hormigón, disminuye su porosidad, mejorando así las propiedades mecánicas (resistencia a la compresión y a la tracción) y la durabilidad del hormigón (propiedades de transporte de agua, gases y solutos más bajas). [9]
En medicina, los fosfonatos y bifosfonatos se utilizan habitualmente como inhibidores de enzimas que utilizan fosfatos y difosfatos como sustratos. En particular, estas enzimas incluyen aquellas que producen los intermediarios de la biosíntesis del colesterol. [10]
Los análogos de nucleótidos fosfonatos como tenofovir , cidofovir y adefovir son medicamentos antivirales fundamentales, que en diversas formas de profármacos se utilizan para el tratamiento del VIH , la hepatitis B y otros.
En combinación con organosilicatos, los fosfonatos también se utilizan para tratar la "muerte súbita del roble", que es causada por el hongo eucariota Phytophthora ramorum .
La toxicidad de los fosfonatos para los organismos que viven en el agua es baja. Los valores de CL50 de 48 horas notificados para peces se encuentran entre 0,1 y 1,1 mM. Además, el factor de bioconcentración para peces es muy bajo.
En la naturaleza, las bacterias desempeñan un papel importante en la degradación de los fosfonatos. [11] Debido a la presencia de fosfonatos naturales en el medio ambiente, las bacterias han desarrollado la capacidad de metabolizar los fosfonatos como fuentes de nutrientes. Algunas bacterias utilizan los fosfonatos como fuente de fósforo para el crecimiento. Algunas bacterias también pueden utilizar los aminofosfonatos como única fuente de nitrógeno. Los polifosfonatos utilizados en la industria difieren en gran medida de los fosfonatos naturales, como el ácido 2-aminoetilfosfónico, porque son mucho más grandes, tienen una carga negativa alta y están complejos con metales. Las pruebas de biodegradación con lodos de plantas de tratamiento de aguas residuales municipales con HEDP y NTMP no mostraron ninguna indicación de degradación. Una investigación de HEDP, NTMP, EDTMP y DTPMP en pruebas de biodegradación estándar tampoco identificó ninguna biodegradación. Sin embargo, se observó que en algunas pruebas, debido a la alta relación lodo-fosfonato, se observó la eliminación de la sustancia de prueba de la solución como pérdida de DOC. Este factor se atribuyó a la adsorción más que a la biodegradación. Sin embargo, se han aislado cepas bacterianas capaces de degradar aminopolifosfonatos y HEDP en condiciones limitadas de fósforo en suelos, lagos, aguas residuales, lodos activados y compost.
"Durante el tratamiento del agua no se observa biodegradación de los fosfonatos, pero la fotodegradación de los complejos de Fe(III) es rápida. Los aminopolifosfonatos también se oxidan rápidamente en presencia de Mn(II) y oxígeno, y se forman productos de descomposición estables que se han detectado en aguas residuales. La falta de información sobre los fosfonatos en el medio ambiente está relacionada con problemas analíticos de su determinación en concentraciones traza en aguas naturales. Los fosfonatos están presentes principalmente en forma de complejos de Ca y Mg en aguas naturales y, por lo tanto, no afectan a la especiación ni al transporte de metales". [12] Los fosfonatos interactúan fuertemente con algunas superficies, lo que da como resultado una eliminación significativa en sistemas técnicos y naturales.