
La fertilización o fertilización (ver diferencias ortográficas ), también conocida como fertilización generativa , singamia e impregnación , [1] es la fusión de gametos para dar lugar a un cigoto e iniciar su desarrollo hacia un nuevo organismo individual o descendencia. [2] Si bien procesos como la inseminación o la polinización , que ocurren antes de la fusión de los gametos, a veces también se denominan informalmente fertilización, [3] estos son procesos técnicamente separados. El ciclo de fecundación y desarrollo de nuevos individuos se llama reproducción sexual . Durante la doble fertilización en las angiospermas , el gameto masculino haploide se combina con dos núcleos polares haploides para formar un núcleo de endospermo primario triploide mediante el proceso de fertilización vegetativa.
En la antigüedad, Aristóteles concebía la formación de nuevos individuos mediante la fusión de fluidos masculinos y femeninos, emergiendo forma y función gradualmente, en un modo denominado por él epigenético . [4]
En 1784, Spallanzani estableció la necesidad de interacción entre el óvulo de la hembra y el esperma del macho para formar un cigoto en las ranas. [5] En 1827, von Baer observó por primera vez un huevo de mamífero therian . [4] Oscar Hertwig (1876), en Alemania, describió la fusión de núcleos de espermatozoides y de óvulos de erizo de mar . [5]
La evolución de la fecundación está relacionada con el origen de la meiosis , pues ambas forman parte de la reproducción sexual , originada en los eucariotas . Una hipótesis afirma que la meiosis se originó a partir de la mitosis. [6]

Los gametos que participan en la fertilización de las plantas son el espermatozoide (masculino) y el óvulo (femenino). Varios grupos de plantas tienen diferentes métodos mediante los cuales los gametos producidos por los gametofitos masculinos y femeninos se unen y son fertilizados. En las plantas terrestres briofitas y pteridofíticas , la fertilización del esperma y el óvulo tiene lugar dentro del arquegonio . En las plantas con semillas , el gametofito masculino se forma dentro de un grano de polen . Después de la polinización , el grano de polen germina y crece un tubo polínico que penetra en el óvulo a través de un pequeño poro llamado micropilo . Los espermatozoides se transfieren desde el polen a través del tubo polínico hasta el óvulo donde se fertiliza el óvulo. En las plantas con flores , se liberan dos espermatozoides del tubo polínico y se produce un segundo evento de fertilización que involucra al segundo espermatozoide y la célula central del óvulo, que es un segundo gameto femenino. [7]
A diferencia del esperma animal, que es móvil, el esperma de la mayoría de las plantas con semillas es inmóvil y depende del tubo polínico para llevarlo al óvulo, donde se libera el esperma. [8] El tubo polínico penetra el estigma y se alarga a través de la matriz extracelular del estilo antes de llegar al ovario. Luego, cerca del receptáculo, atraviesa el óvulo a través del micropilo (una abertura en la pared del óvulo) y el tubo polínico "estalla" en el saco embrionario, liberando esperma. [9] Se creía que el crecimiento del tubo polínico dependía de señales químicas del pistilo; sin embargo, estos mecanismos no se conocían bien hasta 1995. El trabajo realizado en plantas de tabaco reveló una familia de glicoproteínas llamadas proteínas TTS que mejoraban el crecimiento de los tubos polínicos. [9] Crecieron tubos polínicos en un medio de germinación de polen sin azúcar y en un medio con proteínas TTS purificadas. Sin embargo, en el medio TTS, los tubos crecieron a un ritmo 3 veces mayor que en el medio sin azúcar. [9] También se colocaron proteínas TTS en varias ubicaciones de pistilos polinizados semi in vivo , y se observó que los tubos polínicos se extendían inmediatamente hacia las proteínas. Las plantas transgénicas que carecían de la capacidad de producir proteínas TTS exhibieron un crecimiento más lento del tubo polínico y una fertilidad reducida. [9]
Se ha demostrado que la ruptura del tubo polínico para liberar esperma en Arabidopsis depende de una señal del gametofito femenino. Proteínas específicas llamadas proteínas quinasas FER presentes en el óvulo controlan la producción de derivados altamente reactivos del oxígeno llamados especies reactivas de oxígeno (ROS). Se ha demostrado que los niveles de ROS a través de GFP son más altos durante las etapas florales, cuando el óvulo es más receptivo a los tubos polínicos, y más bajos durante las épocas de desarrollo y después de la fertilización. [8] Altas cantidades de ROS activan los canales de iones de calcio en el tubo polínico, lo que hace que estos canales absorban iones de calcio en grandes cantidades. Esta mayor absorción de calcio hace que el tubo polínico se rompa y libere su esperma en el óvulo. [8] Los ensayos de alimentación de pistilos en los que las plantas fueron alimentadas con cloruro de difenilyodonio (DPI) suprimieron las concentraciones de ROS en Arabidopsis , lo que a su vez evitó la ruptura del tubo polínico. [8]
Después de ser fertilizado, el ovario comienza a hincharse y convertirse en fruto . [10] En el caso de frutos con múltiples semillas, se necesitan múltiples granos de polen para la singamia con cada óvulo. El crecimiento del tubo polínico está controlado por el citoplasma vegetativo (o tubular). El tubo polínico secreta enzimas hidrolíticas que digieren el tejido femenino a medida que el tubo crece hacia abajo por el estigma y el estilo; el tejido digerido se utiliza como fuente de nutrientes para el tubo polínico a medida que crece. Durante el crecimiento del tubo polínico hacia el ovario, el núcleo generativo se divide para producir dos núcleos de esperma separados (número haploide de cromosomas) [11] ; por lo tanto, un tubo polínico en crecimiento contiene tres núcleos separados, dos espermatozoides y un tubo. [12] Los espermatozoides están interconectados y son dimórficos, el grande, en varias plantas, también está vinculado al núcleo del tubo y el espermatozoide interconectado y el núcleo del tubo forman la "unidad germinal masculina". [13]
La doble fertilización es el proceso en las angiospermas (plantas con flores) en el que dos espermatozoides de cada tubo polínico fertilizan dos células en un gametofito femenino (a veces llamado saco embrionario) que se encuentra dentro de un óvulo. Después de que el tubo polínico ingresa al gametofito, el núcleo del tubo polínico se desintegra y se liberan los dos espermatozoides; uno de los dos espermatozoides fertiliza el óvulo (en la parte inferior del gametofito cerca del micrópilo), formando un cigoto diploide (2n) . Este es el punto en el que realmente ocurre la fertilización; la polinización y la fertilización son dos procesos separados. El núcleo del otro espermatozoide se fusiona con dos núcleos polares haploides (contenidos en la célula central) en el centro del gametofito. La célula resultante es triploide (3n). Esta célula triploide se divide mediante mitosis y forma el endospermo , un tejido rico en nutrientes , dentro de la semilla . [7] Los dos núcleos maternos de células centrales (núcleos polares) que contribuyen al endospermo surgen por mitosis del único producto meiótico que también dio origen al óvulo. Por tanto, la contribución materna a la constitución genética del endospermo triploide es el doble que la del embrión.
Una especie primitiva de planta con flores, Nuphar polysepala , tiene un endospermo diploide, resultante de la fusión de un espermatozoide con uno, en lugar de dos, núcleos maternos. Se cree que en las primeras etapas del desarrollo de los linajes de angiospermas, hubo una duplicación en este modo de reproducción, produciendo gametofitos femeninos de siete células y ocho núcleos y endospermas triploides con una proporción de genoma materno a paterno de 2:1. [14]
En muchas plantas, el desarrollo de la pulpa del fruto es proporcional al porcentaje de óvulos fecundados. Por ejemplo, en el caso de la sandía , se deben entregar alrededor de mil granos de polen y distribuirlos uniformemente en los tres lóbulos del estigma para obtener una fruta de tamaño y forma normales. [ cita necesaria ]
El cruzamiento , o fertilización cruzada, y la autofertilización representan diferentes estrategias con diferentes beneficios y costos. Se estima que el 48,7% de las especies de plantas son dioicas o cruzadas obligadas autoincompatibles. [15] También se estima que alrededor del 42% de las plantas con flores exhiben un sistema de apareamiento mixto en la naturaleza. [dieciséis]
En el tipo más común de sistema de apareamiento mixto, las plantas individuales producen un solo tipo de flor y los frutos pueden contener tipos de progenie autofecundados, cruzados o una mezcla de ellos. La transición de la fertilización cruzada a la autofertilización es la transición evolutiva más común en las plantas y ha ocurrido repetidamente en muchos linajes independientes. [17] Alrededor del 10-15% de las plantas con flores son predominantemente autofertilizantes. [17]
En circunstancias en las que los polinizadores o las parejas son escasos, la autofecundación ofrece la ventaja de garantizar la reproducción . [17] Por lo tanto, la autofecundación puede mejorar la capacidad de colonización. En algunas especies, la autofecundación ha persistido durante muchas generaciones. Capsella rubella es una especie autofertilizante que se volvió autocompatible hace 50.000 a 100.000 años. [18] Arabidopsis thaliana es una planta predominantemente autofertilizante con una tasa de cruzamiento en la naturaleza de menos del 0,3%; [19] un estudio sugirió que la autofertilización evolucionó hace aproximadamente un millón de años o más en A. thaliana . [20] En plantas autofertilizantes establecidas desde hace mucho tiempo, el enmascaramiento de mutaciones perjudiciales y la producción de variabilidad genética es poco frecuente y, por lo tanto, es poco probable que proporcione un beneficio suficiente durante muchas generaciones para mantener el aparato meiótico. En consecuencia, se podría esperar que la autofertilización fuera reemplazada en la naturaleza por una forma de reproducción asexual ameiótica que sería menos costosa. Sin embargo, la persistencia real de la meiosis y la autofertilización como forma de reproducción en plantas autofertilizantes establecidas desde hace mucho tiempo puede estar relacionada con el beneficio inmediato de la reparación recombinacional eficiente del daño del ADN durante la formación de células germinales proporcionada por la meiosis en cada generación. [ cita necesaria ]
La mecánica detrás de la fertilización se ha estudiado ampliamente en erizos de mar y ratones. Esta investigación aborda la cuestión de cómo se encuentran el esperma y el óvulo apropiado y la cuestión de cómo solo un espermatozoide ingresa al óvulo y entrega su contenido. Hay tres pasos para la fertilización que garantizan la especificidad de la especie:
La consideración de si un animal (más específicamente un vertebrado) utiliza fertilización interna o externa a menudo depende del método de nacimiento. Los animales ovíparos que ponen huevos con gruesas cáscaras de calcio, como las gallinas , o gruesas cáscaras coriáceas generalmente se reproducen mediante fertilización interna, de modo que el espermatozoide fertiliza el óvulo sin tener que atravesar la capa terciaria gruesa y protectora del óvulo. Los animales ovovivíparos y vivíparos también utilizan la fertilización interna. Aunque algunos organismos se reproducen a través de amplexus , aún pueden utilizar fertilización interna, como ocurre con algunas salamandras. Las ventajas de la fertilización interna incluyen un desperdicio mínimo de gametos, una mayor probabilidad de fertilización individual de óvulos, un período más largo de protección de los óvulos y una fertilización selectiva. Muchas hembras tienen la capacidad de almacenar esperma durante largos períodos de tiempo y pueden fertilizar sus óvulos cuando lo deseen. [ cita necesaria ]
Los animales ovíparos que producen huevos con membranas terciarias delgadas o sin membranas, por otro lado, utilizan métodos de fertilización externa. Estos animales pueden denominarse más precisamente ovulíparos. [21] La fertilización externa es ventajosa porque minimiza el contacto (lo que disminuye el riesgo de transmisión de enfermedades) y una mayor variación genética.
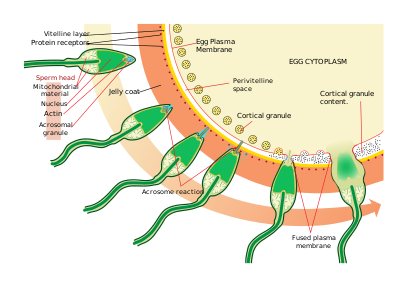
Los espermatozoides encuentran los óvulos mediante quimiotaxis , un tipo de interacción ligando/receptor. Resact es un péptido de 14 aminoácidos purificado de la capa gelatinosa de A. punctulata que atrae la migración de los espermatozoides.
Después de encontrar el óvulo, los espermatozoides penetran la capa gelatinosa mediante un proceso llamado activación de los espermatozoides. En otra interacción ligando/receptor, un componente oligosacárido del óvulo se une y activa un receptor en el espermatozoide y provoca la reacción acrosómica . Las vesículas acrosómicas de los espermatozoides se fusionan con la membrana plasmática y se liberan. En este proceso, las moléculas unidas a la membrana de la vesícula acrosómica, como la bindina, quedan expuestas en la superficie del espermatozoide. Estos contenidos digieren la capa gelatinosa y, finalmente, la membrana vitelina. Además de la liberación de vesículas acrosómicas, se produce una polimerización explosiva de actina para formar una punta delgada en la cabeza del esperma llamada proceso acrosómico .
El espermatozoide se une al óvulo mediante otra reacción de ligando entre los receptores de la membrana vitelina . La proteína de la superficie del esperma, bindina, se une a un receptor en la membrana vitelina identificado como EBR1.
La fusión de las membranas plasmáticas del espermatozoide y del óvulo probablemente esté mediada por la bindina. En el lugar de contacto, la fusión provoca la formación de un cono de fertilización.
Los mamíferos fertilizan internamente mediante la cópula . Después de que un hombre eyacula , muchos espermatozoides se mueven hacia la parte superior de la vagina (a través de contracciones de la vagina) a través del cuello uterino y a lo largo del útero para encontrarse con el óvulo. En los casos en que se produce la fecundación, la hembra suele ovular durante un periodo que se extiende desde horas antes de la cópula hasta unos días después; por lo tanto, en la mayoría de los mamíferos es más común que la eyaculación preceda a la ovulación que al revés.
Cuando los espermatozoides se depositan en la parte anterior de la vagina, no son capaces de fertilizar (es decir, no están capacitados) [ se necesita aclaración ] y se caracterizan por patrones de motilidad lineal lenta. Esta motilidad, combinada con las contracciones musculares, permite el transporte de espermatozoides hacia el útero y los oviductos . [22] Hay un gradiente de pH dentro del microambiente del tracto reproductivo femenino tal que el pH cerca de la abertura vaginal es más bajo (aproximadamente 5) que el de los oviductos (aproximadamente 8). [23] La proteína transportadora de calcio sensible al pH específica de los espermatozoides llamada CatSper aumenta la permeabilidad de los espermatozoides al calcio a medida que avanzan hacia el tracto reproductivo. La entrada de calcio intracelular contribuye a la capacitación e hiperactivación de los espermatozoides, provocando un patrón de motilidad no lineal más violento y rápido a medida que los espermatozoides se acercan al ovocito. El espermatozoide capacitado y el ovocito se encuentran e interactúan en la ampolla de la trompa de Falopio . La reotaxis, la termotaxis y la quimiotaxis son mecanismos conocidos que guían a los espermatozoides hacia el óvulo durante la etapa final de la migración de los espermatozoides. [24] Los espermatozoides responden (ver Termotaxis de espermatozoides ) al gradiente de temperatura de ~2 °C entre el oviducto y la ampolla, [25] y se ha confirmado que los gradientes quimiotácticos de progesterona son la señal que emana de las células del cúmulo de oóforo que rodean a conejos y seres humanos. ovocitos. [26] Los espermatozoides capacitados e hiperactivados responden a estos gradientes cambiando su comportamiento y moviéndose hacia el complejo cúmulo-ovocito. Otras señales quimiotácticas como el formil Met-Leu-Phe (fMLF) también pueden guiar a los espermatozoides. [27]
La zona pelúcida , una gruesa capa de matriz extracelular que rodea el óvulo y que es similar a la función de la membrana vitelina en los erizos de mar, une los espermatozoides. A diferencia de los erizos de mar, el espermatozoide se une al óvulo antes de la reacción acrosómica. ZP3 , una glicoproteína de la zona pelúcida, es responsable de la adhesión óvulo/espermatozoide en humanos. El receptor galactosiltransferasa (GalT) se une a los residuos de N-acetilglucosamina en la ZP3 y es importante para unirse con los espermatozoides y activar la reacción acrosómica. ZP3 es suficiente aunque innecesario para la unión de espermatozoide y óvulo. Existen dos receptores de esperma adicionales: una proteína de 250 kD que se une a una proteína secretada por el oviducto y SED1, que se une de forma independiente a la zona. Después de la reacción acrosómica, se cree que los espermatozoides permanecen unidos a la zona pelúcida a través de los receptores ZP2 expuestos. Estos receptores se desconocen en ratones pero se han identificado en cobayas. [ cita necesaria ]
En los mamíferos, la unión del espermatozoide a la GalT inicia la reacción acrosómica . Este proceso libera la hialuronidasa que digiere la matriz de ácido hialurónico en las vestiduras que rodean el ovocito. Además, cerca del ovocito se liberan glucosaminoglucanos similares a la heparina (GAG) que promueven la reacción acrosómica. [28] Sigue la fusión entre las membranas plasmáticas del ovocito y el esperma y permite que el núcleo del espermatozoide, el centríolo típico y el centríolo atípico que está adherido al flagelo , pero no a las mitocondrias , ingresen al ovocito. [29] La proteína CD9 probablemente media esta fusión en ratones (el homólogo de unión). El óvulo se " activa " al fusionarse con un solo espermatozoide y, por lo tanto, cambia su membrana celular para evitar la fusión con otros espermatozoides. Durante esta activación se liberan átomos de zinc . [ cita necesaria ]
Este proceso finalmente conduce a la formación de una célula diploide llamada cigoto . El cigoto se divide para formar un blastocisto y, al entrar al útero, se implanta en el endometrio, comenzando el embarazo . La implantación embrionaria fuera de la pared uterina produce un embarazo ectópico que puede matar a la madre.
En animales como los conejos, el coito induce la ovulación al estimular la liberación de la hormona pituitaria gonadotropina; esta liberación aumenta en gran medida la probabilidad de embarazo.

La fertilización en humanos es la unión de un óvulo y un espermatozoide humanos , que generalmente ocurre en la ampolla de la trompa de Falopio , produciendo un cigoto unicelular , la primera etapa de la vida en el desarrollo de un organismo genéticamente único, [30] e iniciando el desarrollo embrionario. . Los científicos descubrieron la dinámica de la fertilización humana en el siglo XIX.
El término concepción comúnmente se refiere al "proceso de quedar embarazada que implica fertilización o implantación o ambas". [31] Su uso lo convierte en tema de argumentos semánticos sobre el inicio del embarazo , típicamente en el contexto del debate sobre el aborto . Tras la gastrulación , que se produce unos 16 días después de la fecundación, el blastocisto implantado desarrolla tres capas germinales, el endodermo, el ectodermo y el mesodermo, y el código genético del padre se implica plenamente en el desarrollo del embrión; el hermanamiento posterior es imposible. Además, los híbridos entre especies sobreviven sólo hasta la gastrulación y no pueden desarrollarse más. Sin embargo, parte de la literatura sobre biología del desarrollo humano se refiere al producto de la concepción y dicha literatura médica se refiere a los "productos de la concepción" como el embrión posterior a la implantación y sus membranas circundantes. [32] El término "concepción" no se utiliza habitualmente en la literatura científica debido a su definición y connotación variables.

Los insectos de diferentes grupos, incluidos los Odonata ( libélulas y caballitos del diablo ) y los himenópteros ( hormigas , abejas y avispas ), practican una fertilización retardada. Entre los Odonata, las hembras pueden aparearse con varios machos y almacenar esperma hasta que se pongan los huevos. El macho puede flotar sobre la hembra durante la puesta de huevos (oviposición) para evitar que ella se aparee con otros machos y reemplace su esperma; en algunos grupos, como los dardos, el macho continúa agarrando a la hembra con sus pinzas durante la puesta de huevos, y la pareja vuela en tándem. [33] Entre los himenópteros sociales, las abejas reinas se aparean sólo en vuelos de apareamiento, en un corto período que dura algunos días; una reina puede aparearse con ocho o más zánganos . Luego almacena el esperma por el resto de su vida, tal vez durante cinco años o más. [34] [35]
En muchos hongos (excepto quitridios ), como en algunos protistas, la fertilización es un proceso de dos pasos. En primer lugar, los citoplasmas de las dos células gametas se fusionan (lo que se denomina plasmogamia ), produciendo una célula dicariótica o heterocariótica con múltiples núcleos. Esta célula puede luego dividirse para producir hifas dicarióticas o heterocarióticas . El segundo paso de la fertilización es la cariogamia , la fusión de los núcleos para formar un cigoto diploide.
En los hongos quitridios la fecundación se produce en un solo paso con la fusión de gametos, al igual que en los animales y las plantas.
Hay tres tipos de procesos de fertilización en los protozoos: [36]
Las algas, como algunas plantas terrestres, sufren alternancia de generaciones . Algunas algas son isomorfas, donde tanto el esporofito (2n) como el gameteofito (n) son iguales morfológicamente. Cuando la reproducción de las algas se describe como oógama, los gametos masculinos y femeninos son morfológicamente diferentes, donde hay un huevo grande e inmóvil para los gametos femeninos y los gametos masculinos son uniflagelados (móviles). Mediante el proceso de singamia, estos formarán un nuevo cigoto, regenerando nuevamente la generación del esporofito.
La meiosis da como resultado una segregación aleatoria de los genes que aporta cada padre. Cada organismo padre suele ser idéntico salvo por una fracción de sus genes; Por tanto, cada gameto es genéticamente único. En la fertilización, los cromosomas de los padres se combinan. En los seres humanos , (2²²)² = 17,6x10 12 cigotos cromosómicamente diferentes son posibles para los cromosomas no sexuales, incluso suponiendo que no haya cruce cromosómico . Si el cruce ocurre una vez, entonces en promedio (4²²)² = 309x10 24 cigotos genéticamente diferentes son posibles para cada pareja, sin considerar que los eventos de cruce pueden tener lugar en la mayoría de los puntos a lo largo de cada cromosoma. Los cromosomas X e Y no sufren eventos de cruce [ cita necesaria ] y, por lo tanto, están excluidos del cálculo. El ADN mitocondrial sólo se hereda del progenitor materno.
Poco después de que los espermatozoides se fusionen con el óvulo, los dos centríolos de los espermatozoides forman el primer centrosoma del embrión y el áster de microtúbulos . [39] El centríolo del espermatozoide, que se encuentra cerca del pronúcleo masculino, recluta proteínas del material pericentriolar del óvulo que forman el primer centrosoma del cigoto. [40] Este centrosoma nuclea microtúbulos en forma de estrellas llamados microtúbulos astrales. Los microtúbulos abarcan todo el óvulo, lo que permite que el pronúcleo del óvulo utilice los cables para llegar al pronúcleo masculino. A medida que los pronúcleos masculino y femenino se acercan, el centrosoma único se divide en dos centrosomas ubicados en la interfase entre los pronúcleos. Luego, el centrosoma a través de los microtúbulos astrales polariza el genoma dentro de los pronúcleos. [41]
Los organismos que normalmente se reproducen sexualmente también pueden reproducirse mediante partenogénesis , en la que un gameto femenino no fertilizado produce descendencia viable. Estos descendientes pueden ser clones de la madre o, en algunos casos, diferir genéticamente de ella pero heredar solo una parte de su ADN. La partenogénesis ocurre en muchas plantas y animales y puede ser inducida en otros mediante un estímulo químico o eléctrico al óvulo. En 2004, investigadores japoneses dirigidos por Tomohiro Kono lograron, después de 457 intentos, fusionar los óvulos de dos ratones bloqueando ciertas proteínas que normalmente impedirían esa posibilidad; el embrión resultante normalmente se desarrolló hasta convertirse en un ratón. [42]
La alogamia , también conocida como fertilización cruzada, se refiere a la fertilización de un óvulo de un individuo con el gameto masculino de otro.
La autogamia, también conocida como autofecundación, se produce en organismos hermafroditas como las plantas y los platelmintos; en él, dos gametos de un fusible individual.
Algunas formas de reproducción relativamente inusuales son: [43] [44]
Ginogénesis : Un espermatozoide estimula el desarrollo del óvulo sin fecundación ni singamia. Los espermatozoides pueden entrar al óvulo.
Hibridogénesis : se elimina un genoma para producir óvulos haploides.
Meiosis canina : (a veces llamada "poliploidía impar permanente") un genoma se transmite de forma mendeliana, otros se transmiten clonalmente.
Generalmente se cree que el principal beneficio de la fertilización cruzada es evitar la depresión endogámica . Charles Darwin , en su libro de 1876 Los efectos de la fertilización cruzada y la autofecundación en el reino vegetal (páginas 466-467) resumió sus hallazgos de la siguiente manera. [45]
"En el presente volumen se ha demostrado que los descendientes de la unión de dos individuos distintos, especialmente si sus progenitores han sido sometidos a condiciones muy diferentes, tienen una inmensa ventaja en altura, peso, vigor constitucional y fertilidad sobre los autofecundados. descendencia de uno de los mismos padres. Y este hecho es ampliamente suficiente para explicar el desarrollo de los elementos sexuales, es decir, la génesis de los dos sexos."
Además, algunos piensan [46] que una ventaja a largo plazo del cruzamiento en la naturaleza es una mayor variabilidad genética que promueve la adaptación o evita la extinción (ver Variabilidad genética ).