La transducción de señales es el proceso por el cual una señal química o física se transmite a través de una célula como una serie de eventos moleculares . Las proteínas responsables de detectar estímulos generalmente se denominan receptores , aunque en algunos casos se utiliza el término sensor. [1] Los cambios provocados por la unión del ligando (o detección de señales) en un receptor dan lugar a una cascada bioquímica , que es una cadena de eventos bioquímicos conocida como vía de señalización .
Cuando las vías de señalización interactúan entre sí, forman redes que permiten coordinar las respuestas celulares, a menudo mediante eventos de señalización combinatoria. [2] A nivel molecular, dichas respuestas incluyen cambios en la transcripción o traducción de genes y cambios postraduccionales y conformacionales en las proteínas, así como cambios en su ubicación. Estos eventos moleculares son los mecanismos básicos que controlan el crecimiento celular , la proliferación, el metabolismo y muchos otros procesos. [3] En los organismos multicelulares, las vías de transducción de señales regulan la comunicación celular de una amplia variedad de formas.
Cada componente (o nodo) de una vía de señalización se clasifica según el papel que desempeña con respecto al estímulo inicial. Los ligandos se denominan primeros mensajeros , mientras que los receptores son los transductores de señales , que luego activan los efectores primarios . Dichos efectores son típicamente proteínas y a menudo están vinculados a segundos mensajeros , que pueden activar efectores secundarios , y así sucesivamente. Dependiendo de la eficiencia de los nodos, una señal puede amplificarse (un concepto conocido como ganancia de señal), de modo que una molécula de señalización puede generar una respuesta que involucra de cientos a millones de moléculas. [4] Al igual que con otras señales, la transducción de señales biológicas se caracteriza por retraso, ruido, retroalimentación y retroalimentación de señal e interferencia, que pueden variar desde insignificantes a patológicos. [5] Con el advenimiento de la biología computacional , el análisis de las vías y redes de señalización se ha convertido en una herramienta esencial para comprender las funciones celulares y las enfermedades , incluidos los mecanismos de recableado de señalización que subyacen a las respuestas a la resistencia farmacológica adquirida. [6]


La base de la transducción de señales es la transformación de un determinado estímulo en una señal bioquímica. La naturaleza de dichos estímulos puede variar ampliamente, desde señales extracelulares, como la presencia de EGF , hasta eventos intracelulares, como el daño del ADN resultante de la atrición replicativa de los telómeros . [7] Tradicionalmente, las señales que llegan al sistema nervioso central se clasifican como sentidos . Estas se transmiten de neurona a neurona en un proceso llamado transmisión sináptica . Existen muchos otros mecanismos de retransmisión de señales intercelulares en los organismos multicelulares, como los que rigen el desarrollo embrionario. [8]
La mayoría de las vías de transducción de señales implican la unión de moléculas de señalización, conocidas como ligandos, a receptores que desencadenan eventos dentro de la célula. La unión de una molécula de señalización con un receptor provoca un cambio en la conformación del receptor, conocido como activación del receptor . La mayoría de los ligandos son moléculas solubles del medio extracelular que se unen a los receptores de la superficie celular . Estos incluyen factores de crecimiento , citocinas y neurotransmisores . Los componentes de la matriz extracelular como la fibronectina y el hialuronano también pueden unirse a dichos receptores ( integrinas y CD44 , respectivamente). Además, algunas moléculas como las hormonas esteroides son solubles en lípidos y, por lo tanto, atraviesan la membrana plasmática para alcanzar los receptores citoplasmáticos o nucleares . [9] En el caso de los receptores de hormonas esteroides , su estimulación conduce a la unión a la región promotora de genes sensibles a esteroides. [10]
No todas las clasificaciones de las moléculas de señalización tienen en cuenta la naturaleza molecular de cada miembro de la clase. Por ejemplo, los odorantes pertenecen a una amplia gama de clases moleculares, [11] al igual que los neurotransmisores, que varían en tamaño desde moléculas pequeñas como la dopamina [12] hasta neuropéptidos como las endorfinas . [13] Además, algunas moléculas pueden encajar en más de una clase, por ejemplo, la epinefrina es un neurotransmisor cuando es secretada por el sistema nervioso central y una hormona cuando es secretada por la médula suprarrenal .
Algunos receptores, como el HER2, son capaces de activarse independientemente del ligando cuando se sobreexpresan o mutan. Esto conduce a una activación constitutiva de la vía, que puede o no ser anulada por mecanismos de compensación. En el caso del HER2, que actúa como un socio de dimerización de otros EGFR , la activación constitutiva conduce a la hiperproliferación y al cáncer . [14]
La prevalencia de membranas basales en los tejidos de los eumetazoos significa que la mayoría de los tipos de células requieren unión para sobrevivir. Este requisito ha llevado al desarrollo de vías complejas de mecanotransducción, que permiten a las células detectar la rigidez del sustrato. Dicha señalización se orquesta principalmente en adherencias focales , regiones donde el citoesqueleto de actina unido a la integrina detecta cambios y los transmite corriente abajo a través de YAP1 . [15] Las moléculas de adhesión celular dependientes del calcio, como las cadherinas y las selectinas , también pueden mediar la mecanotransducción. [16] Las formas especializadas de mecanotransducción dentro del sistema nervioso son responsables de la mecanosensación : audición , tacto , propiocepción y equilibrio . [17]
El control celular y sistémico de la presión osmótica (la diferencia de osmolaridad entre el citosol y el medio extracelular) es fundamental para la homeostasis. Hay tres formas en las que las células pueden detectar los estímulos osmóticos: como cambios en la concentración de macromoléculas, la fuerza iónica y los cambios en las propiedades de la membrana plasmática o el citoesqueleto (siendo este último una forma de mecanotransducción). [18] Estos cambios son detectados por proteínas conocidas como osmosensores u osmorreceptores. En los seres humanos, los osmosensores mejor caracterizados son los canales de potencial receptor transitorio presentes en el cilio primario de las células humanas. [18] [19] En la levadura, la vía HOG ha sido ampliamente caracterizada. [20]
La detección de temperatura en las células se conoce como termocepción y está mediada principalmente por canales de potencial receptor transitorio . [21] Además, las células animales contienen un mecanismo conservado para evitar que las altas temperaturas provoquen daño celular, la respuesta de choque térmico . Dicha respuesta se desencadena cuando las altas temperaturas provocan la disociación de HSF1 inactivo de los complejos con las proteínas de choque térmico Hsp40 / Hsp70 y Hsp90 . Con la ayuda del ncRNA hsr1 , HSF1 luego se trimeriza, se activa y regula positivamente la expresión de sus genes diana. [22] Existen muchos otros mecanismos termosensoriales tanto en procariotas como en eucariotas . [21]
En los mamíferos, la luz controla el sentido de la vista y el reloj circadiano mediante la activación de proteínas sensibles a la luz en las células fotorreceptoras de la retina del ojo . En el caso de la visión, la luz es detectada por la rodopsina en las células de los bastones y los conos . [23] En el caso del reloj circadiano, un fotopigmento diferente , la melanopsina , es responsable de detectar la luz en las células ganglionares de la retina intrínsecamente fotosensibles . [24]
Los receptores se pueden dividir aproximadamente en dos clases principales: receptores intracelulares y extracelulares .
Los receptores extracelulares son proteínas transmembrana integrales y constituyen la mayoría de los receptores. Se extienden a lo largo de la membrana plasmática de la célula, con una parte del receptor en el exterior de la célula y la otra en el interior. La transducción de señales se produce como resultado de la unión de un ligando a la región externa del receptor (el ligando no pasa a través de la membrana). La unión del ligando al receptor induce un cambio en la conformación de la parte interna del receptor, un proceso que a veces se denomina "activación del receptor". [25] Esto da como resultado la activación de un dominio enzimático del receptor o la exposición de un sitio de unión para otras proteínas de señalización intracelular dentro de la célula, que finalmente propagan la señal a través del citoplasma.
En las células eucariotas , la mayoría de las proteínas intracelulares activadas por una interacción ligando/receptor poseen una actividad enzimática; los ejemplos incluyen tirosina quinasa y fosfatasas . A menudo, estas enzimas están unidas covalentemente al receptor. Algunas de ellas crean segundos mensajeros como el AMP cíclico y el IP3 , este último controlando la liberación de depósitos intracelulares de calcio al citoplasma. Otras proteínas activadas interactúan con proteínas adaptadoras que facilitan las interacciones de proteínas de señalización y la coordinación de complejos de señalización necesarios para responder a un estímulo particular. Tanto las enzimas como las proteínas adaptadoras responden a varias moléculas de segundos mensajeros.
Muchas proteínas adaptadoras y enzimas activadas como parte de la transducción de señales poseen dominios proteicos especializados que se unen a moléculas mensajeras secundarias específicas. Por ejemplo, los iones de calcio se unen a los dominios de la mano EF de la calmodulina , lo que le permite unirse y activar la quinasa dependiente de calmodulina . PIP 3 y otros fosfoinosítidos hacen lo mismo con los dominios de homología de pleckstrina de proteínas como la proteína quinasa AKT .
Los receptores acoplados a proteína G (GPCR) son una familia de proteínas transmembrana integrales que poseen siete dominios transmembrana y están vinculados a una proteína G heterotrimérica . Con casi 800 miembros, esta es la familia más grande de proteínas y receptores de membrana en mamíferos. Contando todas las especies animales, suman más de 5000. [26] Los GPCR de mamíferos se clasifican en 5 familias principales: similares a rodopsina , similares a secretina , glutamato metabotrópico , adhesión y frizzled / smoothened , con algunos grupos de GPCR que son difíciles de clasificar debido a la baja similitud de secuencia, por ejemplo, los receptores vomeronasales . [26] Existen otras clases en eucariotas, como los receptores de AMP cíclico de Dictyostelium y los receptores de feromonas de apareamiento de hongos . [26]
La transducción de señales por un GPCR comienza con una proteína G inactiva acoplada al receptor; la proteína G existe como un heterotrímero que consiste en subunidades Gα, Gβ y Gγ. [27] Una vez que el GPCR reconoce un ligando, la conformación del receptor cambia para activar la proteína G, lo que hace que Gα se una a una molécula de GTP y se disocie de las otras dos subunidades de proteína G. La disociación expone sitios en las subunidades que pueden interactuar con otras moléculas. [28] Las subunidades de proteína G activadas se desprenden del receptor e inician la señalización de muchas proteínas efectoras posteriores, como las fosfolipasas y los canales iónicos , lo que permite la liberación de moléculas de segundo mensajero. [29] La fuerza total de la amplificación de la señal por un GPCR está determinada por la vida útil del complejo ligando-receptor y el complejo receptor-proteína efectora y el tiempo de desactivación del receptor activado y los efectores a través de la actividad enzimática intrínseca; por ejemplo, a través de la fosforilación de la proteína quinasa o la internalización dependiente de b-arrestina.
Se realizó un estudio en el que se insertó una mutación puntual en el gen que codifica el receptor de quimiocinas CXCR2; las células mutadas sufrieron una transformación maligna debido a la expresión de CXCR2 en una conformación activa a pesar de la ausencia de unión a quimiocinas. Esto significó que los receptores de quimiocinas pueden contribuir al desarrollo del cáncer. [30]
Las tirosina quinasas receptoras (RTK) son proteínas transmembrana con un dominio quinasa intracelular y un dominio extracelular que se une a ligandos ; los ejemplos incluyen receptores de factores de crecimiento como el receptor de insulina . [31] Para realizar la transducción de señales, las RTK necesitan formar dímeros en la membrana plasmática ; [32] el dímero se estabiliza mediante ligandos que se unen al receptor. La interacción entre los dominios citoplasmáticos estimula la autofosforilación de residuos de tirosina dentro de los dominios quinasa intracelulares de las RTK, lo que provoca cambios conformacionales. Posteriormente, se activan los dominios quinasa de los receptores, lo que inicia cascadas de señalización de fosforilación de moléculas citoplasmáticas descendentes que facilitan varios procesos celulares como la diferenciación celular y el metabolismo . [31] Muchas quinasas de proteína Ser/Thr y de especificidad dual son importantes para la transducción de señales, ya sea actuando aguas abajo de las [quinasas de tirosina receptoras], o como versiones incrustadas en la membrana o solubles en células por derecho propio. El proceso de transducción de señales involucra alrededor de 560 quinasas de proteína y pseudoquinasas conocidas, codificadas por el cinoma humano [33] [34]
Al igual que en el caso de los GPCR, las proteínas que se unen a GTP desempeñan un papel importante en la transducción de señales desde el RTK activado hacia la célula. En este caso, las proteínas G son miembros de las familias Ras , Rho y Raf, denominadas colectivamente como proteínas G pequeñas . Actúan como interruptores moleculares generalmente atados a las membranas por grupos isoprenilo unidos a sus extremos carboxilo. Tras la activación, asignan proteínas a subdominios específicos de la membrana donde participan en la señalización. Los RTK activados a su vez activan proteínas G pequeñas que activan factores de intercambio de nucleótidos de guanina como SOS1 . Una vez activados, estos factores de intercambio pueden activar más proteínas G pequeñas, amplificando así la señal inicial del receptor. La mutación de ciertos genes RTK, como ocurre con los GPCR, puede dar lugar a la expresión de receptores que existen en un estado constitutivamente activado; dichos genes mutados pueden actuar como oncogenes . [35]
Las proteínas quinasas específicas de histidina son estructuralmente distintas de otras proteínas quinasas y se encuentran en procariotas, hongos y plantas como parte de un mecanismo de transducción de señales de dos componentes: primero se agrega un grupo fosfato de ATP a un residuo de histidina dentro de la quinasa, luego se transfiere a un residuo de aspartato en un dominio receptor en una proteína diferente o la propia quinasa, activando así el residuo de aspartato. [36]

Las integrinas son producidas por una amplia variedad de células; desempeñan un papel en la unión de las células a otras células y a la matriz extracelular y en la transducción de señales de los componentes de la matriz extracelular como la fibronectina y el colágeno . La unión del ligando al dominio extracelular de las integrinas cambia la conformación de la proteína, agrupándola en la membrana celular para iniciar la transducción de señales. Las integrinas carecen de actividad quinasa; por lo tanto, la transducción de señales mediada por integrinas se logra a través de una variedad de proteínas quinasas intracelulares y moléculas adaptadoras, siendo el principal coordinador la quinasa ligada a la integrina . [37] Como se muestra en la imagen adyacente, la señalización cooperativa integrina-RTK determina el momento de la supervivencia celular, la apoptosis , la proliferación y la diferenciación .
Existen diferencias importantes entre la señalización de integrinas en las células sanguíneas circulantes y las células no circulantes, como las células epiteliales ; las integrinas de las células circulantes normalmente están inactivas. Por ejemplo, las integrinas de la membrana celular en los leucocitos circulantes se mantienen en un estado inactivo para evitar la adhesión a las células epiteliales; se activan solo en respuesta a estímulos como los recibidos en el sitio de una respuesta inflamatoria . De manera similar, las integrinas en la membrana celular de las plaquetas circulantes normalmente se mantienen inactivas para evitar la trombosis . Las células epiteliales (que no circulan) normalmente tienen integrinas activas en su membrana celular, lo que ayuda a mantener su adhesión estable a las células del estroma subyacentes que proporcionan señales para mantener el funcionamiento normal. [38]
En las plantas, no se han identificado hasta la fecha receptores de integrina auténticos; sin embargo, se han propuesto varias proteínas similares a las integrinas basándose en la homología estructural con los receptores de los metazoos. [39] Las plantas contienen quinasas ligadas a integrinas que son muy similares en su estructura primaria a las ILK animales. En la planta modelo experimental Arabidopsis thaliana , se ha demostrado que uno de los genes de la quinasa ligada a la integrina, ILK1 , es un elemento crítico en la respuesta inmune de la planta a las moléculas de señal de los patógenos bacterianos y la sensibilidad de la planta a la sal y al estrés osmótico. [40] La proteína ILK1 interactúa con el transportador de potasio de alta afinidad HAK5 y con el sensor de calcio CML9. [40] [41]
Cuando se activan, los receptores tipo Toll (TLR) toman moléculas adaptadoras dentro del citoplasma de las células para propagar una señal. Se sabe que cuatro moléculas adaptadoras están involucradas en la señalización, que son Myd88 , TIRAP , TRIF y TRAM . [42] [43] [44] Estos adaptadores activan otras moléculas intracelulares como IRAK1 , IRAK4 , TBK1 e IKKi que amplifican la señal, lo que eventualmente conduce a la inducción o supresión de genes que causan ciertas respuestas. Miles de genes son activados por la señalización TLR, lo que implica que este método constituye una puerta de entrada importante para la modulación genética.
Un canal iónico controlado por ligando, al unirse con un ligando, cambia de conformación para abrir un canal en la membrana celular a través del cual pueden pasar los iones que transmiten señales. Un ejemplo de este mecanismo se encuentra en la célula receptora de una sinapsis neuronal . La afluencia de iones que se produce en respuesta a la apertura de estos canales induce potenciales de acción , como los que viajan a lo largo de los nervios, al despolarizar la membrana de las células postsinápticas, lo que da como resultado la apertura de canales iónicos controlados por voltaje.
Un ejemplo de un ion que se permite que ingrese a la célula durante la apertura de un canal iónico controlado por ligando es el Ca 2+ ; actúa como un segundo mensajero que inicia cascadas de transducción de señales y altera la fisiología de la célula que responde. Esto da como resultado la amplificación de la respuesta sináptica entre células sinápticas mediante la remodelación de las espinas dendríticas involucradas en la sinapsis.
Los receptores intracelulares, como los receptores nucleares y los receptores citoplasmáticos , son proteínas solubles localizadas dentro de sus respectivas áreas. Los ligandos típicos para los receptores nucleares son hormonas no polares como las hormonas esteroides testosterona y progesterona y derivados de las vitaminas A y D. Para iniciar la transducción de señales, el ligando debe atravesar la membrana plasmática por difusión pasiva. Al unirse con el receptor, los ligandos atraviesan la membrana nuclear hacia el núcleo , alterando la expresión génica.
Los receptores nucleares activados se unen al ADN en las secuencias de elementos sensibles a hormonas (HRE) específicos del receptor, ubicados en la región promotora de los genes activados por el complejo hormona-receptor. Debido a que permiten la transcripción génica, se los llama alternativamente inductores de la expresión génica . Todas las hormonas que actúan regulando la expresión génica tienen dos consecuencias en su mecanismo de acción: sus efectos se producen después de un período de tiempo característicamente largo y sus efectos persisten durante otro largo período de tiempo, incluso después de que su concentración se haya reducido a cero, debido a una renovación relativamente lenta de la mayoría de las enzimas y proteínas que desactivarían o terminarían la unión del ligando al receptor.
Los receptores nucleicos tienen dominios de unión al ADN que contienen dedos de cinc y un dominio de unión al ligando; los dedos de cinc estabilizan la unión al ADN al mantener su cadena principal de fosfato. Las secuencias de ADN que coinciden con el receptor suelen ser repeticiones hexaméricas de cualquier tipo; las secuencias son similares, pero su orientación y distancia las diferencian. El dominio de unión al ligando es además responsable de la dimerización de los receptores nucleicos antes de la unión y de proporcionar estructuras para la transactivación que se utilizan para la comunicación con el aparato de traducción.
Los receptores de esteroides son una subclase de receptores nucleares ubicados principalmente dentro del citosol. En ausencia de esteroides, se asocian en un complejo aporreceptor que contiene chaperonas o proteínas de choque térmico (HSP). Las HSP son necesarias para activar el receptor al ayudar a la proteína a plegarse de manera tal que la secuencia de señal que permite su paso al núcleo sea accesible. Los receptores de esteroides, por otro lado, pueden reprimir la expresión génica cuando su dominio de transactivación está oculto. La actividad del receptor puede mejorarse mediante la fosforilación de residuos de serina en su extremo N-terminal como resultado de otra vía de transducción de señales, un proceso llamado diafonía .
Los receptores de ácido retinoico son otro subconjunto de receptores nucleares. Pueden ser activados por un ligando sintetizado endocrino que entró en la célula por difusión, un ligando sintetizado a partir de un precursor como el retinol que llega a la célula a través del torrente sanguíneo o un ligando sintetizado completamente intracelularmente como la prostaglandina . Estos receptores están ubicados en el núcleo y no están acompañados por HSP. Reprimen su gen uniéndose a su secuencia de ADN específica cuando ningún ligando se une a ellos, y viceversa.
Ciertos receptores intracelulares del sistema inmunitario son receptores citoplasmáticos; los receptores similares a NOD (NLR) identificados recientemente residen en el citoplasma de algunas células eucariotas e interactúan con ligandos utilizando un motivo de repetición rico en leucina (LRR) similar a los TLR. Algunas de estas moléculas, como NOD2, interactúan con la quinasa RIP2 que activa la señalización de NF-κB , mientras que otras, como NALP3, interactúan con caspasas inflamatorias e inician el procesamiento de citocinas particulares como la interleucina-1 β. [45] [46]
Los primeros mensajeros son las moléculas de señalización (hormonas, neurotransmisores y agentes paracrinos/autocrinos) que llegan a la célula desde el líquido extracelular y se unen a sus receptores específicos. Los segundos mensajeros son las sustancias que entran en el citoplasma y actúan dentro de la célula para desencadenar una respuesta. En esencia, los segundos mensajeros sirven como relés químicos desde la membrana plasmática hasta el citoplasma, llevando a cabo así la transducción de señales intracelulares.
La liberación de iones de calcio del retículo endoplasmático al citosol da como resultado su unión a proteínas de señalización que luego se activan; luego es secuestrado en el retículo endoplasmático liso [47] y las mitocondrias . Dos proteínas combinadas de receptor/canal iónico controlan el transporte de calcio: el receptor InsP 3 que transporta calcio al interactuar con el trifosfato de inositol en su lado citosólico; y el receptor de rianodina llamado así por el alcaloide rianodina , similar al receptor InsP 3 pero que tiene un mecanismo de retroalimentación que libera más calcio al unirse con él. La naturaleza del calcio en el citosol significa que está activo solo por un tiempo muy corto, lo que significa que su concentración en estado libre es muy baja y está principalmente unida a moléculas de orgánulos como la calreticulina cuando está inactiva.
El calcio se utiliza en muchos procesos, entre ellos la contracción muscular, la liberación de neurotransmisores de las terminaciones nerviosas y la migración celular . Las tres vías principales que conducen a su activación son las vías GPCR, las vías RTK y los canales iónicos controlados; regula las proteínas ya sea directamente o mediante la unión a una enzima.
Las moléculas lipofílicas de segundo mensajero se derivan de los lípidos que residen en las membranas celulares; las enzimas estimuladas por los receptores activados activan los lípidos modificándolos. Algunos ejemplos son el diacilglicerol y la ceramida , el primero necesario para la activación de la proteína quinasa C.
El óxido nítrico (NO) actúa como un segundo mensajero porque es un radical libre que puede difundirse a través de la membrana plasmática y afectar a las células cercanas. Se sintetiza a partir de arginina y oxígeno por la NO sintasa y funciona a través de la activación de la guanilil ciclasa soluble , que cuando se activa produce otro segundo mensajero, cGMP. El NO también puede actuar a través de la modificación covalente de proteínas o sus cofactores metálicos; algunos tienen un mecanismo redox y son reversibles. Es tóxico en altas concentraciones y causa daños durante el accidente cerebrovascular , pero es la causa de muchas otras funciones como la relajación de los vasos sanguíneos, la apoptosis y las erecciones del pene .
Además del óxido nítrico, otras especies activadas electrónicamente también son agentes transductores de señales en un proceso llamado señalización redox . Algunos ejemplos son el superóxido , el peróxido de hidrógeno , el monóxido de carbono y el sulfuro de hidrógeno . La señalización redox también incluye la modulación activa de los flujos electrónicos en macromoléculas biológicas semiconductoras . [48]
Las activaciones genéticas [49] y las alteraciones metabólicas [50] son ejemplos de respuestas celulares a la estimulación extracelular que requieren la transducción de señales. La activación genética conduce a otros efectos celulares, ya que los productos de los genes que responden incluyen instigadores de la activación; los factores de transcripción producidos como resultado de una cascada de transducción de señales pueden activar incluso más genes. Por lo tanto, un estímulo inicial puede desencadenar la expresión de una gran cantidad de genes, lo que conduce a eventos fisiológicos como el aumento de la captación de glucosa del torrente sanguíneo [50] y la migración de neutrófilos a los sitios de infección. El conjunto de genes y su orden de activación a ciertos estímulos se conoce como programa genético . [51]
Las células de los mamíferos necesitan estimulación para su división y supervivencia; en ausencia de factores de crecimiento , se produce la apoptosis . Estos requisitos de estimulación extracelular son necesarios para controlar el comportamiento celular en organismos unicelulares y multicelulares; se considera que las vías de transducción de señales son tan fundamentales para los procesos biológicos que se atribuyen una gran cantidad de enfermedades a su desregulación. Tres señales básicas determinan el crecimiento celular:
La combinación de estas señales se integra en una maquinaria citoplasmática alterada que conduce a un comportamiento celular alterado.
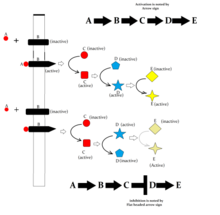
A continuación se presentan algunas vías de señalización importantes que demuestran cómo los ligandos que se unen a sus receptores pueden afectar a los segundos mensajeros y eventualmente provocar respuestas celulares alteradas.

La primera noción de transducción de señales se remonta a 1855, cuando Claude Bernard propuso que las glándulas sin conductos, como el bazo , la tiroides y las glándulas suprarrenales , eran responsables de la liberación de "secreciones internas" con efectos fisiológicos. [56] Las "secreciones" de Bernard fueron posteriormente denominadas " hormonas " por Ernest Starling en 1905. [57] Junto con William Bayliss , Starling había descubierto la secretina en 1902. [56] Aunque en los años siguientes se descubrieron muchas otras hormonas, sobre todo la insulina , los mecanismos siguieron siendo en gran medida desconocidos.
El descubrimiento del factor de crecimiento nervioso por Rita Levi-Montalcini en 1954, y el factor de crecimiento epidérmico por Stanley Cohen en 1962, condujeron a conocimientos más detallados sobre la base molecular de la señalización celular, en particular los factores de crecimiento . [58] Su trabajo, junto con el descubrimiento del AMP cíclico por Earl Wilbur Sutherland en 1956, impulsó la redefinición de la señalización endocrina para incluir solo la señalización de las glándulas, mientras que los términos autocrino y paracrino comenzaron a usarse. [59] Sutherland recibió el Premio Nobel de Fisiología o Medicina de 1971 , mientras que Levi-Montalcini y Cohen lo compartieron en 1986.
En 1970, Martin Rodbell examinó los efectos del glucagón en el receptor de membrana de las células del hígado de una rata. Observó que el trifosfato de guanosina disocia el glucagón de este receptor y estimula la proteína G , lo que influye fuertemente en el metabolismo de la célula. Así, dedujo que la proteína G es un transductor que acepta moléculas de glucagón y afecta a la célula. [60] Por ello, compartió el Premio Nobel de Fisiología o Medicina de 1994 con Alfred G. Gilman . Así, la caracterización de las RTK y los GPCR condujo a la formulación del concepto de "transducción de señales", palabra utilizada por primera vez en 1972. [61] Algunos artículos tempranos utilizaron los términos transmisión de señales y transducción sensorial . [62] [63] En 2007, se publicaron un total de 48.377 artículos científicos, incluidos 11.211 artículos de revisión , sobre el tema. El término apareció por primera vez en el título de un artículo en 1979. [64] [65] El uso generalizado del término se remonta a un artículo de revisión de Rodbell de 1980: [60] [66] Los artículos de investigación centrados en la transducción de señales aparecieron por primera vez en gran número a fines de la década de 1980 y principios de la de 1990. [46]
El propósito de esta sección es describir brevemente algunos avances en inmunología en las décadas de 1960 y 1970, relevantes para las etapas iniciales de la transducción de señales transmembrana, y cómo impactaron nuestra comprensión de la inmunología y, en última instancia, de otras áreas de la biología celular.
Los eventos relevantes comienzan con la secuenciación de las cadenas ligeras de las proteínas del mieloma , que se encuentran en abundancia en la orina de individuos con mieloma múltiple . Los experimentos bioquímicos revelaron que estas llamadas proteínas de Bence Jones consistían en 2 dominios discretos: uno que variaba de una molécula a la siguiente (el dominio V) y uno que no (el dominio Fc o la región cristalizable del fragmento ). [67] Un análisis de múltiples secuencias de la región V por Wu y Kabat [68] identificó ubicaciones dentro de la región V que eran hipervariables y que, según su hipótesis, se combinaban en la proteína plegada para formar el sitio de reconocimiento del antígeno. Por lo tanto, en un tiempo relativamente corto se desarrolló un modelo plausible para la base molecular de la especificidad inmunológica y para la mediación de la función biológica a través del dominio Fc. Pronto siguió la cristalización de una molécula de IgG [69] ) confirmando las inferencias basadas en la secuenciación y proporcionando una comprensión de la especificidad inmunológica al más alto nivel de resolución.
La importancia biológica de estos avances se resume en la teoría de la selección clonal [70] , que sostiene que una célula B tiene en su superficie receptores de inmunoglobulina cuyo sitio de unión al antígeno es idéntico al de los anticuerpos que secreta la célula cuando encuentra un antígeno y, más específicamente, un clon particular de célula B secreta anticuerpos con secuencias idénticas. La pieza final de la historia, el modelo de mosaico fluido de la membrana plasmática, proporcionó todos los ingredientes para un nuevo modelo para el inicio de la transducción de señales; es decir, la dimerización del receptor.
Los primeros indicios de esto fueron obtenidos por Becker et al [71], quienes demostraron que el grado en que los basófilos humanos (para los cuales la inmunoglobulina E bivalente (IgE) funciona como un receptor de superficie) se desgranulan, depende de la concentración de anticuerpos anti IgE a los que están expuestos, y da como resultado una redistribución de las moléculas de superficie, que está ausente cuando se utiliza un ligando monovalente . La última observación fue consistente con hallazgos anteriores de Fanger et al. [72] Estas observaciones vincularon una respuesta biológica a eventos y detalles estructurales de las moléculas en la superficie celular. Pronto se desarrolló una preponderancia de evidencia de que la dimerización del receptor inicia respuestas (revisadas en [73] ) en una variedad de tipos de células, incluidas las células B.
Estas observaciones dieron lugar a una serie de desarrollos teóricos (matemáticos). El primero de ellos fue un modelo simple propuesto por Bell [74] que resolvió una aparente paradoja: la agrupación forma redes estables; es decir, la unión es esencialmente irreversible, mientras que las afinidades de los anticuerpos secretados por las células B aumentan a medida que progresa la respuesta inmunitaria. DeLisi y Perelson [75] desarrollaron una teoría de la dinámica de la agrupación de la superficie celular en las membranas de los linfocitos , quienes hallaron la distribución del tamaño de las agrupaciones en función del tiempo y su dependencia de la afinidad y la valencia del ligando. Goldstein y Sobotka y sus colaboradores desarrollaron teorías posteriores para los basófilos y los mastocitos [76] [77], todas ellas orientadas al análisis de los patrones de dosis-respuesta de las células inmunitarias y sus correlatos biológicos [78] . Para una revisión reciente de la agrupación en sistemas inmunológicos, véase [79] .
La unión de ligandos a los receptores de la superficie celular también es fundamental para la motilidad, un fenómeno que se entiende mejor en organismos unicelulares. Un ejemplo es la detección y respuesta a gradientes de concentración por parte de las bacterias [80] –la teoría matemática clásica que aparece en. [81] Se puede encontrar un relato reciente en [82]