El acetaldehído (nombre sistemático IUPAC etanal ) es un compuesto químico orgánico con la fórmula CH3CHO , a veces abreviado como MeCHO . Es un líquido o gas incoloro, que hierve cerca de la temperatura ambiente. Es uno de los aldehídos más importantes , que se encuentra ampliamente en la naturaleza y se produce a gran escala en la industria. El acetaldehído se encuentra naturalmente en el café, el pan y la fruta madura, [11] y es producido por las plantas. También se produce por la oxidación parcial del etanol por la enzima hepática alcohol deshidrogenasa y es una causa que contribuye a la resaca después del consumo de alcohol . [12] Las vías de exposición incluyen el aire, el agua, la tierra o las aguas subterráneas, así como la bebida y el humo. [13] El consumo de disulfiram inhibe la acetaldehído deshidrogenasa , la enzima responsable del metabolismo del acetaldehído, lo que hace que se acumule en el cuerpo.
La Agencia Internacional para la Investigación sobre el Cáncer ( IARC) ha clasificado el acetaldehído como un carcinógeno del Grupo 1. [14] El acetaldehído es "una de las toxinas del aire que se encuentran con mayor frecuencia, con un riesgo de cáncer superior a uno en un millón". [15]
El acetaldehído fue observado por primera vez por el farmacéutico y químico sueco Carl Wilhelm Scheele (1774); [16] luego fue investigado por los químicos franceses Antoine François, conde de Fourcroy y Louis Nicolas Vauquelin (1800), [17] y los químicos alemanes Johann Wolfgang Döbereiner (1821, 1822, 1832) [18] y Justus von Liebig (1835). [19] [20] En 1835, Liebig lo denominó "aldehído"; [21] el nombre fue posteriormente modificado a "acetaldehído". [22]
En 2003, la producción mundial fue de aproximadamente 1 millón de toneladas. [ cita requerida ] Antes de 1962, el etanol y el acetileno eran las principales fuentes de acetaldehído. Desde entonces, el etileno es la materia prima dominante . [23]
El principal método de producción es la oxidación del eteno mediante el proceso Wacker , que implica la oxidación del eteno utilizando un sistema catalizador homogéneo de paladio/cobre:
En la década de 1970, la capacidad mundial del proceso de oxidación directa de Wacker-Hoechst superó los 2 millones de toneladas anuales.
Se pueden preparar cantidades más pequeñas mediante la oxidación parcial del etanol en una reacción exotérmica. Este proceso se lleva a cabo normalmente sobre un catalizador de plata a unos 500–650 °C. [23]
Este método es una de las rutas más antiguas para la preparación industrial de acetaldehído.
Antes del proceso Wacker y de la disponibilidad de etileno barato, el acetaldehído se producía mediante la hidratación del acetileno . [24] Esta reacción es catalizada por sales de mercurio (II) :
El mecanismo implica la intermediación del alcohol vinílico , que se tautomeriza a acetaldehído. La reacción se lleva a cabo a 90–95 °C, y el acetaldehído formado se separa del agua y el mercurio y se enfría a 25–30 °C. En el proceso de oxidación húmeda , se utiliza sulfato de hierro (III) para reoxidar el mercurio de nuevo a la sal de mercurio (II). El sulfato de hierro (II) resultante se oxida en un reactor separado con ácido nítrico . [23]
La enzima acetileno hidratasa descubierta en la bacteria estrictamente anaeróbica Pelobacter acetylenicus puede catalizar una reacción análoga sin involucrar ningún compuesto de mercurio. [25] Sin embargo, hasta ahora no se ha utilizado en gran escala ni de forma comercial.
Tradicionalmente, el acetaldehído se producía mediante la deshidrogenación parcial del etanol:
En este proceso endotérmico, el vapor de etanol pasa a 260–290 °C sobre un catalizador a base de cobre. El proceso alguna vez fue atractivo debido al valor del coproducto de hidrógeno, [23] pero en la actualidad no es económicamente viable.
La hidroformilación del metanol con catalizadores como sales de cobalto, níquel o hierro también produce acetaldehído, aunque este proceso no tiene importancia industrial. El acetaldehído, que no es competitivo, surge del gas de síntesis con una selectividad modesta. [23]

Al igual que muchos otros compuestos carbonílicos , el acetaldehído se tautomeriza para dar un enol ( alcohol vinílico ; nombre IUPAC: etenol):
La constante de equilibrio es 6 × 10 −7 a temperatura ambiente, por lo que la cantidad relativa de la forma enol en una muestra de acetaldehído es muy pequeña. [26] A temperatura ambiente, el acetaldehído ( CH 3 CH=O ) es más estable que el alcohol vinílico ( CH 2 =CHOH ) en 42,7 kJ/mol: [27] En general, la tautomerización ceto-enólica ocurre lentamente pero es catalizada por ácidos.
La tautomerización de cetoenol fotoinducida es viable en condiciones atmosféricas o estratosféricas. Esta fototautomerización es relevante para la atmósfera terrestre, porque se cree que el alcohol vinílico es un precursor de los ácidos carboxílicos en la atmósfera. [28] [29]
El acetaldehído es un electrófilo común en la síntesis orgánica . [30] Además , el acetaldehído es proquiral . Se utiliza principalmente como fuente del sintón " CH 3 C + H(OH) " en reacciones aldólicas y reacciones de condensación relacionadas . [31] Los reactivos de Grignard y los compuestos de organolitio reaccionan con MeCHO para dar derivados de hidroxietilo . [32] En una de las reacciones de adición más espectaculares, el formaldehído en presencia de hidróxido de calcio se añade a MeCHO para dar pentaeritritol , C(CH 2 OH) 4 y formato . [33]
En una reacción de Strecker , el acetaldehído se condensa con cianuro y amoníaco para dar, después de la hidrólisis , el aminoácido alanina . [34] El acetaldehído puede condensarse con aminas para producir iminas ; por ejemplo, con ciclohexilamina para dar N -etilidenciclohexilamina. Estas iminas se pueden utilizar para dirigir reacciones posteriores como una condensación aldólica. [35]
También es un componente básico en la síntesis de compuestos heterocíclicos . En un ejemplo, se convierte, tras el tratamiento con amoníaco , en 5-etil-2-metilpiridina ("aldehído-colidina"). [36]
Tres moléculas de acetaldehído se condensan para formar " paraldehído ", un trímero cíclico que contiene enlaces simples de CO. De manera similar, la condensación de cuatro moléculas de acetaldehído da la molécula cíclica metaldehído . El paraldehído se puede producir con buenos rendimientos, utilizando un catalizador de ácido sulfúrico. El metaldehído solo se obtiene con un rendimiento de un pequeño porcentaje y con enfriamiento, a menudo utilizando HBr en lugar de H 2 SO 4 como catalizador. A −40 °C en presencia de catalizadores ácidos, se produce poliacetaldehído. [23] Hay dos estereómeros de paraldehído y cuatro de metaldehído.
El químico alemán Valentin Hermann Weidenbusch (1821-1893) sintetizó el paraldehído en 1848 tratando el acetaldehído con ácido (sulfúrico o nítrico) y enfriándolo a 0 °C. Le pareció bastante sorprendente que, cuando se calentaba el paraldehído con una pequeña cantidad del mismo ácido, la reacción se desarrollaba en sentido contrario, es decir, se volvía a generar el acetaldehído. [37]
Aunque el alcohol vinílico es una forma polimérica del acetaldehído (§ Tautomerización de alcohol vinílico), el alcohol polivinílico no se puede producir a partir de acetaldehído.

El acetaldehído forma un acetal estable tras la reacción con etanol en condiciones que favorecen la deshidratación. El producto, CH 3 CH(OCH 2 CH 3 ) 2 , se denomina formalmente 1,1-dietoxietano, pero se le conoce comúnmente como "acetal". [38] Esto puede causar confusión, ya que "acetal" se utiliza más comúnmente para describir compuestos con los grupos funcionales RCH(OR') 2 o RR'C(OR'') 2 en lugar de referirse a este compuesto específico; de hecho, el 1,1-dietoxietano también se describe como el acetal dietílico del acetaldehído.
El acetaldehído es un precursor del ácido vinilfosfónico , que se utiliza para fabricar adhesivos y membranas conductoras de iones . La secuencia de síntesis comienza con una reacción con tricloruro de fósforo : [39]
En el hígado , la enzima alcohol deshidrogenasa oxida el etanol en acetaldehído, que luego se oxida aún más en ácido acético inofensivo por la acetaldehído deshidrogenasa . Estas dos reacciones de oxidación están acopladas con la reducción de NAD + a NADH . [40] En el cerebro, la enzima catalasa es principalmente responsable de oxidar el etanol a acetaldehído, y la alcohol deshidrogenasa juega un papel menor. [40] Los últimos pasos de la fermentación alcohólica en bacterias, plantas y levaduras involucran la conversión de piruvato en acetaldehído y dióxido de carbono por la enzima piruvato descarboxilasa , seguida de la conversión de acetaldehído en etanol. La última reacción es nuevamente catalizada por una alcohol deshidrogenasa, ahora operando en la dirección opuesta.
Muchas personas del este de Asia tienen una mutación de ALDH2 que las hace significativamente menos eficientes en la oxidación del acetaldehído. Al consumir alcohol, sus cuerpos tienden a acumular cantidades excesivas de acetaldehído, lo que provoca la llamada reacción de rubor alcohólico . [41] Desarrollan un rubor característico en la cara y el cuerpo, junto con "náuseas, dolor de cabeza y malestar físico general". [42] La ingestión del fármaco disulfiram , que inhibe la ALDH2, provoca una reacción similar. Consulte la sección #Factores agravantes a continuación. [43]
Tradicionalmente, el acetaldehído se utilizaba principalmente como precursor del ácido acético. Esta aplicación ha disminuido debido a que el ácido acético se produce de manera más eficiente a partir del metanol mediante los procesos Monsanto y Cativa . El acetaldehído es un precursor importante de los derivados de piridina , pentaeritritol y crotonaldehído . La urea y el acetaldehído se combinan para dar una resina útil . El anhídrido acético reacciona con el acetaldehído para dar diacetato de etilideno , un precursor del acetato de vinilo , que se utiliza para producir acetato de polivinilo . [23]
El mercado mundial de acetaldehído está en declive. La demanda se ha visto afectada por los cambios en la producción de alcoholes plastificantes, que ha cambiado porque el n -butiraldehído se produce con menos frecuencia a partir de acetaldehído, y en su lugar se genera por hidroformilación de propileno . Del mismo modo, el ácido acético , que alguna vez se produjo a partir de acetaldehído, se fabrica predominantemente mediante el proceso de carbonilación de metanol, de menor costo. [44] El impacto en la demanda ha llevado a un aumento de los precios y, por lo tanto, a una desaceleración del mercado.

China es el mayor consumidor de acetaldehído del mundo, representando casi la mitad del consumo global en 2012. El principal uso ha sido la producción de ácido acético. Se espera que otros usos, como las piridinas y el pentaeritritol, crezcan más rápido que el ácido acético, pero los volúmenes no son lo suficientemente grandes como para compensar la disminución del ácido acético. Como consecuencia, el consumo general de acetaldehído en China puede crecer ligeramente a un 1,6% anual hasta 2018. Europa occidental es el segundo mayor consumidor de acetaldehído en todo el mundo, representando el 20% del consumo mundial en 2012. Al igual que con China, se espera que el mercado de acetaldehído de Europa occidental aumente solo muy ligeramente a un 1% anual durante 2012-2018. Sin embargo, Japón podría surgir como un consumidor potencial de acetaldehído en los próximos cinco años debido al nuevo uso en la producción comercial de butadieno . El suministro de butadieno ha sido volátil en Japón y el resto de Asia. Esto debería proporcionar el impulso tan necesario al mercado de la vivienda plana a partir de 2013. [45]
El valor límite umbral es de 25 ppm (valor límite STEL) y la MAK (concentración máxima en el lugar de trabajo) es de 50 ppm. A 50 ppm de acetaldehído, no se observa irritación ni daño tisular local en la mucosa nasal . Cuando es absorbido por el organismo, el acetaldehído se metaboliza rápidamente en el hígado a ácido acético. Solo una pequeña proporción se exhala sin cambios. Después de la inyección intravenosa , la vida media en la sangre es de aproximadamente 90 segundos. [23]
Se han registrado muchos casos graves de intoxicación aguda. [23] El acetaldehído se descompone de forma natural en el cuerpo humano. [13] [46]
El acetaldehído es un irritante de la piel, los ojos, las mucosas, la garganta y el tracto respiratorio. Esto ocurre en concentraciones tan bajas como 1000 ppm. Los síntomas de exposición a este compuesto incluyen náuseas , vómitos y dolor de cabeza . Estos síntomas pueden no aparecer de inmediato. El umbral de percepción del acetaldehído en el aire está en el rango entre 0,07 y 0,25 ppm. [23] En tales concentraciones, el olor afrutado del acetaldehído es evidente. Se han observado irritaciones conjuntivales después de una exposición de 15 minutos a concentraciones de 25 y 50 ppm, pero se han reportado conjuntivitis transitoria e irritación del tracto respiratorio después de la exposición a 200 ppm de acetaldehído durante 15 minutos.
El acetaldehído es cancerígeno en humanos. [47] [48] En 1988, la Agencia Internacional para la Investigación sobre el Cáncer declaró: "Existe evidencia suficiente de la carcinogenicidad del acetaldehído (el principal metabolito del etanol) en animales de experimentación ". [49] En octubre de 2009, la Agencia Internacional para la Investigación sobre el Cáncer actualizó la clasificación del acetaldehído indicando que el acetaldehído incluido y generado endógenamente a partir de bebidas alcohólicas es un carcinógeno humano del Grupo I. [50] Además, el acetaldehído es dañino para el ADN [51] y causa un desarrollo muscular anormal ya que se une a las proteínas. [52]
El acetaldehído induce enlaces cruzados entre cadenas de ADN, una forma de daño al ADN. Estos pueden repararse mediante cualquiera de las dos vías de reparación del ADN acopladas a la replicación. [53] La primera se conoce como vía FA, porque utiliza productos genéticos defectuosos en pacientes con anemia de Fanconi . Esta vía de reparación da como resultado una mayor frecuencia de mutación y un espectro mutacional alterado. [53] La segunda vía de reparación requiere la convergencia de la horquilla de replicación, la rotura del enlace cruzado de acetaldehído, la síntesis de translesión por una ADN polimerasa de la familia Y y la recombinación homóloga. [53]
Las personas con una deficiencia genética de la enzima responsable de la conversión del acetaldehído en ácido acético pueden tener un mayor riesgo de padecer la enfermedad de Alzheimer . “Estos resultados indican que la deficiencia de ALDH2 es un factor de riesgo para la enfermedad de Alzheimer de aparición tardía (LOAD)…” [54]
Un estudio de 818 grandes bebedores descubrió que aquellos expuestos a más acetaldehído de lo normal a través de una variante genética del gen que codifica para ADH1C , ADH1C*1, tienen mayor riesgo de desarrollar cánceres del tracto gastrointestinal superior y del hígado. [55]
El fármaco disulfiram (Antabuse) inhibe la acetaldehído deshidrogenasa, una enzima que oxida el compuesto en ácido acético. El metabolismo del etanol forma acetaldehído antes de que la acetaldehído deshidrogenasa forme ácido acético, pero al inhibir la enzima, el acetaldehído se acumula. Si se consume etanol mientras se toma disulfiram, el efecto de resaca del etanol se siente más rápida e intensamente ( reacción disulfiram-alcohol ). Por ello, el disulfiram se utiliza a veces como un elemento disuasorio para los alcohólicos que desean mantenerse sobrios. [43]
El acetaldehído es un contaminante potencial en los lugares de trabajo, en espacios interiores y en ambientes ambientales. Además, la mayoría de los seres humanos pasan más del 90% de su tiempo en ambientes interiores, lo que aumenta la exposición y el riesgo para la salud humana. [56]
En un estudio realizado en Francia , la concentración media de acetaldehídos en el interior de 16 hogares fue aproximadamente siete veces mayor que la concentración de acetaldehído en el exterior. La sala de estar tenía una media de 18,1 ± 17,5 μg m −3 y el dormitorio , de 18,2 ± 16,9 μg m −3 , mientras que el aire exterior tenía una concentración media de 2,3 ± 2,6 μg m −3 . [ cita requerida ]
Se ha llegado a la conclusión de que los compuestos orgánicos volátiles (COV), como el benceno, el formaldehído, el acetaldehído, el tolueno y los xilenos , deben considerarse contaminantes prioritarios en lo que respecta a sus efectos sobre la salud. Se ha señalado que en los edificios renovados o completamente nuevos, los niveles de concentración de COV suelen ser varios órdenes de magnitud superiores. Las principales fuentes de acetaldehído en los hogares son los materiales de construcción, los suelos laminados, los suelos de PVC, los suelos de madera barnizada y los suelos de corcho o pino barnizados (se encuentran en el barniz, no en la madera). También se encuentra en plásticos, pinturas a base de aceite y de agua, en techos de madera compuesta, tableros de partículas, madera contrachapada, madera de pino tratada y muebles de aglomerado laminado. [57]
El uso de acetaldehído está muy extendido en diferentes industrias y puede liberarse en aguas residuales o en el aire durante la producción, el uso, el transporte y el almacenamiento. Las fuentes de acetaldehído incluyen las emisiones de la combustión de combustibles de motores de combustión interna estacionarios y plantas de energía que queman combustibles fósiles, madera o basura, la extracción de petróleo y gas, las refinerías, los hornos de cemento, los aserraderos y las fábricas de madera y las fábricas de papel. [58] El acetaldehído también está presente en los gases de escape de los automóviles y los motores diésel . [59] Como resultado, el acetaldehído es "uno de los tóxicos del aire que se encuentran con mayor frecuencia, con un riesgo de cáncer superior a uno en un millón". [15]
Se ha demostrado que los polisacáridos naturales del tabaco , incluida la celulosa , son los precursores primarios que hacen del acetaldehído un componente significativo del humo del tabaco . [60] [61] Se ha demostrado que tiene un efecto sinérgico con la nicotina en estudios sobre la adicción en roedores . [62] [63] El acetaldehído también es el carcinógeno más abundante en el humo del tabaco; se disuelve en la saliva mientras se fuma.
Se ha encontrado acetaldehído en el humo del cannabis . Este hallazgo surgió gracias al uso de nuevas técnicas químicas que demostraron que el acetaldehído presente causaba daños en el ADN en entornos de laboratorio. [64]
Muchos microbios producen acetaldehído a partir del etanol, pero tienen una menor capacidad para eliminar el acetaldehído, lo que puede provocar la acumulación de acetaldehído en la saliva, el ácido estomacal y el contenido intestinal. Los alimentos fermentados y muchas bebidas alcohólicas también pueden contener cantidades significativas de acetaldehído. El acetaldehído, derivado de la oxidación mucosa o microbiana del etanol, el humo del tabaco y la dieta, parece actuar como un carcinógeno acumulativo en el tracto digestivo superior de los seres humanos. [65] Según el "Dictamen sobre el acetaldehído" (2012) del Comité Científico de Seguridad de los Consumidores (CCSC) de la Comisión Europea, el límite de riesgo especial de los productos cosméticos es de 5 mg/L y el acetaldehído no debe utilizarse en productos para enjuagar la boca . [66]
El acetaldehído se puede producir mediante la fotooxidación del tereftalato de polietileno (PET), a través de una reacción de Norrish tipo II . [67]
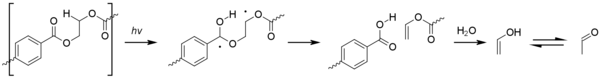
Aunque los niveles producidos por este proceso son minúsculos, el acetaldehído tiene un umbral de sabor/olor extremadamente bajo de alrededor de 20 a 40 ppb y puede causar un sabor desagradable en el agua embotellada. [68] El nivel en el que un consumidor promedio podría detectar el acetaldehído es aún considerablemente más bajo que cualquier toxicidad. [69]
Se ha demostrado que Candida albicans en pacientes con enfermedades bucales potencialmente cancerígenas produce acetaldehído en cantidades suficientes para causar problemas. [70]
Je le décrirai dans ce mémoire sous le nom
d'aldehyde
; ce nom est formé de
alcohol deshidrogenado
. [Lo describiré en estas memorias con el nombre de
aldehído
; este nombre se forma a partir
del alcohol deshidrogenatus
.]