La nanotecnología del ADN es el diseño y fabricación de estructuras artificiales de ácidos nucleicos para usos tecnológicos. En este campo, los ácidos nucleicos se utilizan como materiales de ingeniería no biológicos para la nanotecnología más que como portadores de información genética en células vivas . Los investigadores en este campo han creado estructuras estáticas como redes cristalinas bidimensionales y tridimensionales , nanotubos , poliedros y formas arbitrarias, y dispositivos funcionales como máquinas moleculares y computadoras de ADN . El campo está comenzando a utilizarse como herramienta para resolver problemas científicos básicos en biología estructural y biofísica , incluidas aplicaciones en cristalografía de rayos X y espectroscopia de resonancia magnética nuclear de proteínas para determinar estructuras. También se están investigando posibles aplicaciones en electrónica a escala molecular y nanomedicina .
Nadrian Seeman estableció por primera vez las bases conceptuales de la nanotecnología del ADN a principios de la década de 1980, y el campo comenzó a atraer un interés generalizado a mediados de la década de 2000. Este uso de ácidos nucleicos está permitido por sus estrictas reglas de emparejamiento de bases , que hacen que sólo porciones de hebras con secuencias de bases complementarias se unan para formar estructuras de doble hélice rígidas y fuertes . Esto permite el diseño racional de secuencias de bases que se ensamblarán selectivamente para formar estructuras objetivo complejas con características a nanoescala controladas con precisión . Se utilizan varios métodos de ensamblaje para crear estas estructuras, incluidas estructuras basadas en mosaicos que se ensamblan a partir de estructuras más pequeñas, estructuras plegables utilizando el método de origami de ADN y estructuras reconfigurables dinámicamente utilizando métodos de desplazamiento de hebras. El nombre del campo hace referencia específicamente al ADN , pero los mismos principios se han utilizado también con otros tipos de ácidos nucleicos, lo que ha llevado al uso ocasional del nombre alternativo nanotecnología de ácidos nucleicos .
La base conceptual de la nanotecnología del ADN fue establecida por primera vez por Nadrian Seeman a principios de los años 1980. [2] La motivación original de Seeman era crear una red de ADN tridimensional para orientar otras moléculas grandes, lo que simplificaría su estudio cristalográfico al eliminar el difícil proceso de obtención de cristales puros. Según se informa, esta idea se le ocurrió a finales de 1980, después de darse cuenta de la similitud entre el grabado en madera Depth de MC Escher y una serie de uniones de ADN de seis brazos. [3] [4] En ese momento se conocían varias estructuras naturales de ADN ramificado, incluida la bifurcación de replicación del ADN y la unión móvil de Holliday , pero la idea de Seeman fue que se podían crear uniones de ácido nucleico inmóviles diseñando adecuadamente las secuencias de las cadenas para eliminar la simetría en la molécula ensamblada, y que estas uniones inmóviles podrían, en principio, combinarse en redes cristalinas rígidas. El primer artículo teórico que proponía este esquema se publicó en 1982, y al año siguiente se publicó la primera demostración experimental de una unión de ADN inmóvil. [5] [6]

En 1991, el laboratorio de Seeman publicó un informe sobre la síntesis de un cubo hecho de ADN, la primera nanoestructura sintética tridimensional de ácido nucleico, por el que recibió el Premio Feynman de Nanotecnología en 1995 . A esto le siguió un octaedro truncado de ADN . Pronto quedó claro que estas estructuras, formas poligonales con uniones flexibles como vértices , no eran lo suficientemente rígidas para formar redes tridimensionales extendidas. Seeman desarrolló el motivo estructural de doble cruce (DX) más rígido y, en 1998, en colaboración con Erik Winfree , publicó la creación de celosías bidimensionales de mosaicos DX. [3] [2] [7] Estas estructuras basadas en mosaicos tenían la ventaja de que proporcionaban la capacidad de implementar la computación de ADN, como lo demostraron Winfree y Paul Rothemund en su artículo de 2004 sobre el autoensamblaje algorítmico de una estructura de junta de Sierpinski. , y por el que compartieron el Premio Feynman de Nanotecnología 2006. La idea clave de Winfree fue que los mosaicos DX podrían usarse como mosaicos Wang , lo que significa que su ensamblaje podría realizar cálculos. [2] Seeman finalmente publicó la síntesis de una red tridimensional en 2009, casi treinta años después de que se propusiera lograrla. [8]
A lo largo de la década de 2000 se siguieron descubriendo nuevas capacidades para estructuras de ADN diseñadas. Seeman demostró en 1999 la primera nanomáquina de ADN , un motivo que cambia su estructura en respuesta a una entrada. En 2000, Bernard Yurke demostró un sistema mejorado, que fue el primer dispositivo de ácido nucleico que utilizó el desplazamiento de hebras mediado por el punto de apoyo. [9] El siguiente avance fue traducir esto en movimiento mecánico, y en 2004 y 2005, varios Los grupos de Seeman, Niles Pierce , Andrew Turberfield y Chengde Mao demostraron los sistemas de caminantes de ADN . [10] La idea de utilizar matrices de ADN para modelar el ensamblaje de otras moléculas, como nanopartículas y proteínas, sugerida por primera vez por Bruche Robinson y Seeman en 1987, [11] fue demostrada en 2002 por Seeman, Kiehl et al. [12] y posteriormente por muchos otros grupos.
En 2006, Rothemund demostró por primera vez el método del origami de ADN para formar de forma fácil y robusta estructuras de ADN plegadas de forma arbitraria. Rothemund había concebido este método como conceptualmente intermedio entre las redes DX de Seeman, que utilizaban muchas hebras cortas, y el octaedro de ADN de William Shih, que consistía principalmente en una hebra muy larga. El origami de ADN de Rothemund contiene una hebra larga cuyo plegado es asistido por varias hebras cortas. Este método permitió formar estructuras mucho más grandes de lo que antes era posible, y que son menos exigentes técnicamente para diseñar y sintetizar. [7] El origami de ADN fue el artículo de portada de Nature el 15 de marzo de 2006. [13] La investigación de Rothemund que demostró estructuras de origami de ADN bidimensional fue seguida por la demostración de origami de ADN tridimensional sólido por Douglas et al. en 2009, [14] mientras que los laboratorios de Jørgen Kjems y Yan demostraron estructuras tridimensionales huecas hechas de caras bidimensionales. [8]
La nanotecnología del ADN fue recibida inicialmente con cierto escepticismo debido al inusual uso no biológico de ácidos nucleicos como materiales para construir estructuras y realizar cálculos, y a la preponderancia de pruebas de experimentos principales que ampliaban las capacidades del campo pero estaban lejos de sus aplicaciones reales. El artículo de Seeman de 1991 sobre la síntesis del cubo de ADN fue rechazado por la revista Science después de que un crítico elogiara su originalidad mientras que otro lo criticara por su falta de relevancia biológica. [15] A principios de la década de 2010, se consideraba que el campo había aumentado sus capacidades hasta el punto de que comenzaban a realizarse aplicaciones para la investigación en ciencias básicas y que las aplicaciones prácticas en medicina y otros campos comenzaban a considerarse factibles. [8] [16] El campo había crecido de muy pocos laboratorios activos en 2001 a al menos 60 en 2010, lo que aumentó el grupo de talentos y, por lo tanto, el número de avances científicos en el campo durante esa década. [17]


La nanotecnología se define a menudo como el estudio de materiales y dispositivos con características en una escala inferior a 100 nanómetros . La nanotecnología del ADN, específicamente, es un ejemplo de autoensamblaje molecular ascendente , en el que los componentes moleculares se organizan espontáneamente en estructuras estables; La forma particular de estas estructuras es inducida por las propiedades físicas y químicas de los componentes seleccionados por los diseñadores. [19] En la nanotecnología del ADN, los materiales componentes son hebras de ácidos nucleicos como el ADN; Estas hebras suelen ser sintéticas y casi siempre se utilizan fuera del contexto de una célula viva. El ADN se adapta bien a la construcción a nanoescala porque la unión entre dos cadenas de ácido nucleico depende de reglas simples de emparejamiento de bases que se comprenden bien y forman la estructura específica a nanoescala de la doble hélice del ácido nucleico . Estas cualidades hacen que el ensamblaje de estructuras de ácidos nucleicos sea fácil de controlar mediante el diseño de ácidos nucleicos . Esta propiedad está ausente en otros materiales utilizados en nanotecnología, incluidas las proteínas , para las cuales el diseño de proteínas es muy difícil, y las nanopartículas , que carecen de la capacidad de ensamblaje específico por sí solas. [5]
La estructura de una molécula de ácido nucleico consta de una secuencia de nucleótidos que se distinguen por la nucleobase que contienen. En el ADN, las cuatro bases presentes son adenina (A), citosina (C), guanina (G) y timina (T). Los ácidos nucleicos tienen la propiedad de que dos moléculas solo se unirán entre sí para formar una doble hélice si las dos secuencias son complementarias , lo que significa que forman secuencias coincidentes de pares de bases, donde A solo se une a T y C solo a G. 5] [20] Debido a que la formación de pares de bases correctamente emparejados es energéticamente favorable , se espera que en la mayoría de los casos las cadenas de ácido nucleico se unan entre sí en la conformación que maximiza el número de bases correctamente emparejadas. De este modo, las secuencias de bases en un sistema de cadenas determinan el patrón de unión y la estructura general de una manera fácilmente controlable. En la nanotecnología del ADN, los investigadores diseñan racionalmente las secuencias de bases de las hebras para que las interacciones de emparejamiento de bases hagan que las hebras se unan en la conformación deseada. [3] [5] Si bien el ADN es el material dominante utilizado, también se han construido estructuras que incorporan otros ácidos nucleicos como el ARN y el ácido peptídico nucleico (PNA). [21] [22]
La nanotecnología del ADN a veces se divide en dos subcampos superpuestos: la nanotecnología del ADN estructural y la nanotecnología del ADN dinámico. La nanotecnología del ADN estructural, a veces abreviada como SDN, se centra en sintetizar y caracterizar complejos y materiales de ácidos nucleicos que se ensamblan en un estado final de equilibrio estático . Por otro lado, la nanotecnología dinámica del ADN se centra en complejos con un comportamiento útil de no equilibrio, como la capacidad de reconfigurarse en función de un estímulo químico o físico. Algunos complejos, como los dispositivos nanomecánicos de ácidos nucleicos, combinan características de los subcampos estructurales y dinámicos. [23] [24]
Los complejos construidos con nanotecnología de ADN estructural utilizan estructuras de ácidos nucleicos topológicamente ramificadas que contienen uniones. (Por el contrario, la mayor parte del ADN biológico existe como una doble hélice no ramificada). Una de las estructuras ramificadas más simples es una unión de cuatro brazos que consta de cuatro hebras de ADN individuales, algunas de las cuales son complementarias en un patrón específico. A diferencia de las uniones Holliday naturales , cada brazo en la unión artificial inmóvil de cuatro brazos tiene una secuencia de bases diferente , lo que hace que el punto de unión se fije en una posición determinada. Se pueden combinar múltiples uniones en el mismo complejo, como en el ampliamente utilizado motivo estructural de doble cruce (DX) , que contiene dos dominios de doble hélice paralelos con hebras individuales que se cruzan entre los dominios en dos puntos de cruce. Cada punto de cruce es, topológicamente, una unión de cuatro brazos, pero está limitada a una orientación, en contraste con la unión flexible de cuatro brazos, lo que proporciona una rigidez que hace que el motivo DX sea adecuado como bloque de construcción estructural para complejos de ADN más grandes. [3] [5]
La nanotecnología dinámica del ADN utiliza un mecanismo llamado desplazamiento de hebra mediado por el punto de apoyo para permitir que los complejos de ácido nucleico se reconfiguren en respuesta a la adición de una nueva hebra de ácido nucleico. En esta reacción, la hebra entrante se une a una región monocatenaria de un complejo bicatenario y luego desplaza una de las hebras unidas en el complejo original a través de un proceso de migración de ramificaciones . El efecto general es que una de las hebras del complejo se reemplaza por otra. [23] Además, se pueden fabricar estructuras y dispositivos reconfigurables utilizando ácidos nucleicos funcionales como desoxirribozimas y ribozimas , que pueden realizar reacciones químicas, y aptámeros , que pueden unirse a proteínas específicas o moléculas pequeñas. [25]
La nanotecnología del ADN estructural, a veces abreviada como SDN, se centra en sintetizar y caracterizar complejos y materiales de ácidos nucleicos donde el ensamblaje tiene un punto final de equilibrio estático. La doble hélice del ácido nucleico tiene una geometría tridimensional definida y robusta que permite simular, [26] predecir y diseñar las estructuras de complejos de ácidos nucleicos más complicados. Se han creado muchas de estas estructuras, incluidas estructuras bidimensionales y tridimensionales, y estructuras periódicas, aperiódicas y discretas. [24]

Los pequeños complejos de ácidos nucleicos pueden equiparse con extremos adhesivos y combinarse en redes periódicas bidimensionales más grandes que contienen un patrón teselado específico de los mosaicos moleculares individuales. [24] El primer ejemplo de esto utilizó complejos de doble cruce (DX) como mosaicos básicos, cada uno de los cuales contenía cuatro extremos adhesivos diseñados con secuencias que causaban que las unidades DX se combinaran en láminas planas bidimensionales periódicas que son esencialmente bidimensionales rígidas. cristales de ADN. [30] [31] También se han creado matrices bidimensionales a partir de otros motivos, incluida la red de rombos de unión de Holliday , [32] y varias matrices basadas en DX que utilizan un esquema de doble cohesión. [33] [34] Las dos imágenes superiores a la derecha muestran ejemplos de redes periódicas basadas en mosaicos.
Se pueden hacer matrices bidimensionales para exhibir estructuras aperiódicas cuyo ensamblaje implementa un algoritmo específico, exhibiendo una forma de computación del ADN. [17] Se pueden elegir las secuencias finales adhesivas de los mosaicos DX para que actúen como mosaicos Wang , lo que les permite realizar cálculos. Se ha demostrado una matriz DX cuyo ensamblaje codifica una operación XOR ; esto permite que la matriz de ADN implemente un autómata celular que genera un fractal conocido como junta de Sierpinski . La tercera imagen a la derecha muestra este tipo de matriz. [29] Otro sistema tiene la función de un contador binario , que muestra una representación de números binarios crecientes a medida que crece. Estos resultados muestran que la computación se puede incorporar al ensamblaje de matrices de ADN. [35]
Se han creado matrices DX para formar nanotubos huecos de 4 a 20 nm de diámetro, esencialmente redes bidimensionales que se curvan sobre sí mismas. [36] Estos nanotubos de ADN son algo similares en tamaño y forma a los nanotubos de carbono , y aunque carecen de la conductancia eléctrica de los nanotubos de carbono, los nanotubos de ADN se modifican y conectan más fácilmente a otras estructuras. Uno de los muchos esquemas para construir nanotubos de ADN utiliza una red de mosaicos DX curvos que se enrollan sobre sí mismos y se cierran formando un tubo. [37] En un método alternativo que permite especificar la circunferencia de una manera simple y modular utilizando tejas monocatenarias, la rigidez del tubo es una propiedad emergente . [38]
Formar redes tridimensionales de ADN fue el primer objetivo de la nanotecnología del ADN, pero resultó ser uno de los más difíciles de realizar. En 2009 finalmente se informó del éxito del uso de un motivo basado en el concepto de tensegridad , un equilibrio entre las fuerzas de tensión y compresión. [17] [39]
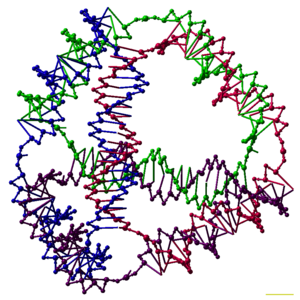
Los investigadores han sintetizado muchos complejos de ADN tridimensionales, cada uno de los cuales tiene la conectividad de un poliedro , como un cubo o un octaedro , lo que significa que los dúplex de ADN trazan los bordes de un poliedro con una unión de ADN en cada vértice. [6] Las primeras demostraciones de poliedros de ADN requirieron mucho trabajo y requirieron múltiples ligaduras y pasos de síntesis en fase sólida para crear poliedros catenados . [40] El trabajo posterior produjo poliedros cuya síntesis fue mucho más fácil. Estos incluyen un octaedro de ADN hecho de una sola hebra larga diseñada para plegarse en la conformación correcta, [41] y un tetraedro que se puede producir a partir de cuatro hebras de ADN en un solo paso, como se muestra en la parte superior de este artículo. [1]
Las nanoestructuras de formas arbitrarias y no regulares generalmente se crean mediante el método del origami de ADN . Estas estructuras consisten en una cadena de virus natural larga como un "andamio", que se dobla en la forma deseada mediante cadenas cortas "grapas" diseñadas computacionalmente. Este método tiene la ventaja de ser fácil de diseñar, ya que la secuencia de bases está predeterminada por la secuencia de la cadena del andamio, y no requiere una alta pureza de la cadena ni una estequiometría precisa , como lo hacen la mayoría de los otros métodos de nanotecnología de ADN. El origami de ADN se demostró por primera vez para formas bidimensionales, como una carita sonriente , un mapa tosco del hemisferio occidental y la pintura de Mona Lisa. [6] [13] [42] Se pueden crear estructuras tridimensionales sólidas utilizando hélices de ADN paralelas dispuestas en un patrón de panal, [14] y se pueden hacer estructuras con caras bidimensionales para plegarlas en un espacio tridimensional general hueco. forma, similar a una caja de cartón. Estos pueden programarse para abrirse y revelar o liberar una carga molecular en respuesta a un estímulo, lo que los hace potencialmente útiles como jaulas moleculares programables . [43] [44]
Se pueden hacer estructuras de ácidos nucleicos para incorporar moléculas distintas de los ácidos nucleicos, a veces llamadas heteroelementos, incluidas proteínas, nanopartículas metálicas, puntos cuánticos , aminas , [45] y fullerenos . Esto permite la construcción de materiales y dispositivos con una gama de funcionalidades mucho mayor de la que es posible con los ácidos nucleicos solos. El objetivo es utilizar el autoensamblaje de las estructuras de ácidos nucleicos para modelar el ensamblaje de las nanopartículas alojadas en ellas, controlando su posición y, en algunos casos, su orientación. [6] [46] Muchos de estos esquemas utilizan un esquema de unión covalente, utilizando oligonucleótidos con grupos funcionales amida o tiol como un mango químico para unir los heteroelementos. Este esquema de unión covalente se ha utilizado para organizar nanopartículas de oro en una matriz basada en DX [47] y para organizar moléculas de proteína estreptavidina en patrones específicos en una matriz DX. [48] Se utilizó un esquema de alojamiento no covalente que utiliza poliamidas Dervan en una matriz DX para organizar las proteínas estreptavidina en un patrón específico en una matriz DX. [49] Los nanotubos de carbono se han alojado en matrices de ADN en un patrón que permite que el conjunto actúe como un dispositivo electrónico molecular , un transistor de efecto de campo de nanotubos de carbono . [50] Además, existen métodos de metalización de ácidos nucleicos, en los que el ácido nucleico se reemplaza por un metal que asume la forma general de la estructura del ácido nucleico original, [51] y esquemas para usar nanoestructuras de ácidos nucleicos como máscaras de litografía , transfiriendo su patrón en una superficie sólida. [52]
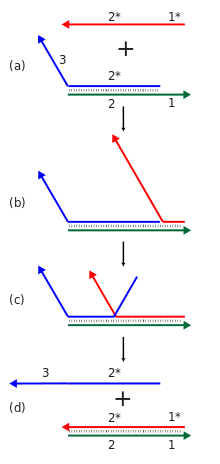
La nanotecnología dinámica del ADN se centra en la formación de sistemas de ácidos nucleicos con funcionalidades dinámicas diseñadas relacionadas con sus estructuras generales, como la computación y el movimiento mecánico. Existe cierta superposición entre la nanotecnología de ADN estructural y dinámica, ya que las estructuras pueden formarse mediante recocido y luego reconfigurarse dinámicamente, o pueden hacerse para que se formen dinámicamente en primer lugar. [6] [10]
Se han creado complejos de ADN que cambian su conformación ante algún estímulo, lo que los convierte en una forma de nanorobótica . Estas estructuras se forman inicialmente de la misma manera que las estructuras estáticas creadas con nanotecnología de ADN estructural, pero están diseñadas para que la reconfiguración dinámica sea posible después del ensamblaje inicial. [23] [10] El primer dispositivo de este tipo hacía uso de la transición entre las formas B-DNA y Z-DNA para responder a un cambio en las condiciones del buffer mediante un movimiento de torsión. [53] Esta dependencia de las condiciones del búfer provocó que todos los dispositivos cambiaran de estado al mismo tiempo. Los sistemas posteriores podrían cambiar de estado según la presencia de hilos de control, lo que permitiría operar múltiples dispositivos de forma independiente en la solución. Algunos ejemplos de tales sistemas son un diseño de "pinzas moleculares" que tiene un estado abierto y cerrado, [54] un dispositivo que podría cambiar de una conformación de cruce paranémico (PX) a una conformación (JX2) con dos yuxtaposiciones sin unión. de la columna vertebral del ADN, que sufre un movimiento de rotación en el proceso, [55] y una matriz bidimensional que podría expandirse y contraerse dinámicamente en respuesta a las hebras de control. [56] También se han creado estructuras que se abren o cierran dinámicamente, actuando potencialmente como una jaula molecular para liberar o revelar una carga funcional al abrirse. [43] [57] [58] En otro ejemplo, una nanoestructura de origami de ADN se acopló a la ARN polimerasa T7 y, por lo tanto, podría funcionar como un motor impulsado por energía química que se puede acoplar a un seguidor pasivo, que luego impulsa. [59]
Los caminantes de ADN son una clase de nanomáquinas de ácido nucleico que exhiben un movimiento direccional a lo largo de una pista lineal. Se han demostrado una gran cantidad de esquemas. [10] Una estrategia es controlar el movimiento del caminante a lo largo de la pista utilizando hilos de control que deben agregarse manualmente en secuencia. [60] [61] También es posible controlar los pasos individuales de un caminante de ADN mediante irradiación con luz de diferentes longitudes de onda. [62] Otro enfoque es hacer uso de enzimas de restricción o desoxirribozimas para escindir las hebras y hacer que el caminante avance, lo que tiene la ventaja de correr de forma autónoma. [63] [64] Un sistema posterior podría caminar sobre una superficie bidimensional en lugar de una pista lineal, y demostró la capacidad de recoger y mover selectivamente carga molecular. [65] En 2018, se demostró que un ADN catenado que utiliza la transcripción en círculo rodante mediante una ARN polimerasa T7 adjunta camina a lo largo de una ruta de ADN, guiado por la cadena de ARN generada. [66] Además, se ha demostrado que un caminante lineal realiza síntesis con plantilla de ADN a medida que avanza a lo largo de la pista, lo que permite una síntesis química autónoma de varios pasos dirigida por el caminante. [67] La función de los caminantes de ADN sintéticos es similar a la de las proteínas dineína y cinesina. [68]
Las cascadas de reacciones de desplazamiento de hebras se pueden utilizar con fines computacionales o estructurales. Una reacción de desplazamiento de hebra individual implica revelar una nueva secuencia en respuesta a la presencia de alguna hebra iniciadora. Muchas de estas reacciones se pueden vincular en una cascada donde la secuencia de salida recientemente revelada de una reacción puede iniciar otra reacción de desplazamiento de hebra en otro lugar. Esto, a su vez, permite la construcción de redes de reacciones químicas con muchos componentes, que exhiben complejas capacidades computacionales y de procesamiento de información. Estas cascadas se vuelven energéticamente favorables mediante la formación de nuevos pares de bases y la ganancia de entropía de las reacciones de desmontaje. Las cascadas de desplazamiento de hebras permiten el funcionamiento isotérmico del ensamblaje o del proceso computacional, en contraste con el requisito del ensamblaje de ácido nucleico tradicional de un paso de recocido térmico, donde la temperatura se eleva y luego se reduce lentamente para garantizar la formación adecuada de la estructura deseada. También pueden respaldar la función catalítica de la especie iniciadora, donde menos de un equivalente del iniciador puede hacer que la reacción se complete. [23] [69]
Los complejos de desplazamiento de hebras se pueden utilizar para crear puertas lógicas moleculares capaces de realizar cálculos complejos. [70] A diferencia de las computadoras electrónicas tradicionales, que utilizan corriente eléctrica como entradas y salidas, las computadoras moleculares utilizan las concentraciones de especies químicas específicas como señales. En el caso de los circuitos de desplazamiento de hebras de ácido nucleico, la señal es la presencia de hebras de ácido nucleico que se liberan o consumen mediante eventos de unión y desunión a otras hebras en complejos de desplazamiento. Este enfoque se ha utilizado para crear puertas lógicas como puertas AND, OR y NOT. [71] Más recientemente, se demostró un circuito de cuatro bits que puede calcular la raíz cuadrada de los números enteros del 0 al 15, utilizando un sistema de puertas que contiene 130 cadenas de ADN. [72]
Otro uso de las cascadas de desplazamiento de hilos es realizar estructuras ensambladas dinámicamente. Estos utilizan una estructura de horquilla para los reactivos, de modo que cuando la cadena de entrada se une, la secuencia recién revelada está en la misma molécula en lugar de desensamblarse. Esto permite agregar nuevas horquillas abiertas a un complejo en crecimiento. Este enfoque se ha utilizado para crear estructuras simples como dendrímeros y uniones de tres y cuatro brazos . [69]
La nanotecnología del ADN proporciona una de las pocas formas de formar estructuras complejas diseñadas con un control preciso sobre las características a nanoescala. Este campo está empezando a ver aplicaciones para resolver problemas científicos básicos en biología estructural y biofísica . La primera aplicación de este tipo prevista para este campo, y que aún está en desarrollo, es la cristalografía , donde las moléculas que son difíciles de cristalizar de forma aislada podrían disponerse dentro de una red tridimensional de ácido nucleico, lo que permitiría determinar su estructura. Otra aplicación es el uso de varillas de origami de ADN para reemplazar cristales líquidos en experimentos de acoplamiento dipolar residual en espectroscopia de RMN de proteínas ; El uso de origami de ADN es ventajoso porque, a diferencia de los cristales líquidos, toleran los detergentes necesarios para suspender las proteínas de la membrana en solución. Los caminantes de ADN se han utilizado como líneas de ensamblaje a nanoescala para mover nanopartículas y dirigir la síntesis química . Además, las estructuras de origami de ADN han ayudado en los estudios biofísicos de la función enzimática y el plegamiento de proteínas . [24] [8]
La nanotecnología del ADN avanza hacia posibles aplicaciones en el mundo real. La capacidad de las matrices de ácidos nucleicos para organizar otras moléculas indica sus posibles aplicaciones en la electrónica a escala molecular. El ensamblaje de una estructura de ácido nucleico podría usarse como plantilla para el ensamblaje de elementos electrónicos moleculares, como cables moleculares , proporcionando un método para el control a escala nanométrica de la ubicación y la arquitectura general del dispositivo análogo a una placa molecular . [24] [6] La nanotecnología del ADN se ha comparado con el concepto de materia programable debido al acoplamiento de la computación a sus propiedades materiales. [73]
En un estudio realizado por un grupo de científicos de los centros iNANO y CDNA de la Universidad de Aarhus , los investigadores pudieron construir una pequeña caja de ADN Origami 3D multiconmutable. La nanopartícula propuesta se caracterizó mediante microscopía de fuerza atómica (AFM), microscopía electrónica de transmisión (TEM) y transferencia de energía por resonancia de Förster (FRET). Se demostró que la caja construida tenía un mecanismo de cierre único, que le permitía abrirse y cerrarse repetidamente en respuesta a un conjunto único de claves de ADN o ARN. Los autores propusieron que este "dispositivo de ADN puede usarse potencialmente para una amplia gama de aplicaciones, como el control de la función de moléculas individuales, la administración controlada de fármacos y la computación molecular". [74]
Existen aplicaciones potenciales para la nanotecnología del ADN en nanomedicina, aprovechando su capacidad para realizar cálculos en un formato biocompatible para fabricar "fármacos inteligentes" para la administración selectiva de fármacos , así como para aplicaciones de diagnóstico . Uno de esos sistemas que se está investigando utiliza una caja de ADN hueca que contiene proteínas que inducen la apoptosis , o muerte celular, que sólo se abrirá cuando esté cerca de una célula cancerosa . [8] [75] Además, ha habido interés en expresar estas estructuras artificiales en células bacterianas vivas diseñadas, muy probablemente usando el ARN transcrito para el ensamblaje, aunque se desconoce si estas estructuras complejas son capaces de plegarse o ensamblarse eficientemente en la célula. citoplasma . Si tiene éxito, esto podría permitir la evolución dirigida de nanoestructuras de ácidos nucleicos. [6] Científicos de la Universidad de Oxford informaron sobre el autoensamblaje de cuatro hebras cortas de ADN sintético en una jaula que puede ingresar a las células y sobrevivir durante al menos 48 horas. Se descubrió que los tetraedros de ADN marcados con fluorescencia permanecían intactos en células de riñón humano cultivadas en laboratorio a pesar del ataque de enzimas celulares después de dos días. Este experimento mostró el potencial de la administración de fármacos dentro de las células vivas utilizando la "jaula" de ADN. [76] [77] Se utilizó un tetraedro de ADN para administrar interferencia de ARN (ARNi) en un modelo de ratón, informó un equipo de investigadores del MIT . La administración del ARN de interferencia para el tratamiento ha mostrado cierto éxito utilizando polímeros o lípidos , pero existen límites de seguridad y una orientación imprecisa, además de una vida útil corta en el torrente sanguíneo. La nanoestructura de ADN creada por el equipo consta de seis hebras de ADN para formar un tetraedro, con una hebra de ARN fijada a cada uno de los seis bordes. El tetraedro está además equipado con una proteína objetivo, tres moléculas de folato , que conducen las nanopartículas de ADN a los abundantes receptores de folato que se encuentran en algunos tumores. El resultado mostró que la expresión genética a la que se dirige la ARNi, la luciferasa , se redujo a más de la mitad. Este estudio es prometedor en el uso de la nanotecnología del ADN como una herramienta eficaz para administrar tratamientos utilizando la tecnología emergente de interferencia de ARN. [78] [79] El tetraedro de ADN también se utilizó en un esfuerzo por superar el fenómeno de resistencia a múltiples fármacos . doxorrubicina(DOX) se conjugó con el tetraedro y se cargó en células de cáncer de mama MCF-7 que contenían la bomba de eflujo del fármaco de glicoproteína P. Los resultados del experimento mostraron que no se bombeaba DOX y se logró la apoptosis de las células cancerosas. El tetraedro sin DOX se cargó en las células para probar su biocompatibilidad y la estructura no mostró citotoxicidad en sí misma. [80] El tetraedro de ADN también se utilizó como código de barras para perfilar la expresión subcelular y la distribución de proteínas en las células con fines de diagnóstico. La nanoestructura tetraédrica mostró una señal mejorada debido a una mayor eficiencia y estabilidad del etiquetado. [81]
Las aplicaciones de la nanotecnología del ADN en nanomedicina también se centran en imitar la estructura y función de proteínas de membrana naturales con nanoestructuras de ADN diseñadas. En 2012, Langecker et al. [82] introdujeron una estructura de origami de ADN en forma de poro que puede autoinsertarse en las membranas lipídicas mediante modificaciones hidrofóbicas del colesterol e inducir corrientes iónicas a través de la membrana. Esta primera demostración de un canal iónico de ADN sintético fue seguida por una variedad de diseños inductores de poros que van desde un único dúplex de ADN , [83] hasta pequeñas estructuras basadas en mosaicos, [84] [85] [86] [87] [88 ] y grandes porinas transmembrana de origami de ADN . [89] De manera similar a los canales iónicos de proteínas que ocurren naturalmente , este conjunto de contrapartes sintéticas hechas de ADN abarca múltiples órdenes de magnitud en conductancia. El estudio del dúplex de ADN único que inserta la membrana mostró que la corriente también debe fluir en la interfaz ADN-lípido, ya que en el diseño no hay un lumen de canal central que permita que los iones pasen a través de la bicapa lipídica . Esto indicó que el poro lipídico inducido por el ADN tiene una forma toroidal , en lugar de cilíndrica, a medida que los grupos de cabeza de lípidos se reorientan para mirar hacia la parte del ADN insertada en la membrana. [83] Investigadores de la Universidad de Cambridge y la Universidad de Illinois en Urbana-Champaign demostraron que un poro toroidal inducido por el ADN puede facilitar un rápido cambio de lípidos entre las valvas de la bicapa lipídica. Utilizando este efecto, diseñaron una enzima sintética construida en ADN que invierte los lípidos en las membranas biológicas en órdenes de magnitud más rápido que las proteínas naturales llamadas scrablasas . [90] Este desarrollo destaca el potencial de las nanoestructuras de ADN sintético para fármacos y terapias personalizadas.
Las nanoestructuras de ADN deben diseñarse racionalmente para que las hebras individuales de ácido nucleico se unan en las estructuras deseadas. Este proceso generalmente comienza con la especificación de una estructura o función objetivo deseada. Luego, se determina la estructura secundaria general del complejo diana, especificando la disposición de las hebras de ácido nucleico dentro de la estructura y qué partes de esas hebras deben unirse entre sí. El último paso es el diseño de la estructura primaria , que es la especificación de las secuencias de bases reales de cada cadena de ácido nucleico. [36] [91]
El primer paso en el diseño de una nanoestructura de ácido nucleico es decidir cómo debe representarse una estructura determinada mediante una disposición específica de hebras de ácido nucleico. Este paso de diseño determina la estructura secundaria, o las posiciones de los pares de bases que mantienen juntas las hebras individuales en la forma deseada. [36] Se han demostrado varios enfoques:
Después de utilizar cualquiera de los enfoques anteriores para diseñar la estructura secundaria de un complejo objetivo, se debe idear una secuencia real de nucleótidos que formará la estructura deseada. El diseño de ácidos nucleicos es el proceso de asignar una secuencia de bases de ácido nucleico específica a cada una de las hebras constituyentes de una estructura para que se asocien en una conformación deseada. La mayoría de los métodos tienen el objetivo de diseñar secuencias de modo que la estructura objetivo tenga la energía más baja y, por lo tanto, sea la más termodinámicamente favorable, mientras que las estructuras ensambladas incorrectamente tengan energías más altas y, por lo tanto, estén desfavorecidas. Esto se hace mediante métodos heurísticos simples y más rápidos , como la minimización de la simetría de secuencia, o mediante el uso de un modelo termodinámico completo del vecino más cercano , que es más preciso pero más lento y requiere más cálculo. Se utilizan modelos geométricos para examinar la estructura terciaria de las nanoestructuras y garantizar que los complejos no estén demasiado tensos . [91] [93]
El diseño de ácidos nucleicos tiene objetivos similares a los del diseño de proteínas . En ambos, la secuencia de monómeros está diseñada para favorecer la estructura objetivo deseada y desfavorecer otras estructuras. El diseño de ácidos nucleicos tiene la ventaja de ser mucho más fácil desde el punto de vista computacional que el diseño de proteínas, porque las reglas simples de emparejamiento de bases son suficientes para predecir la favorabilidad energética de una estructura y no se requiere información detallada sobre el plegamiento tridimensional general de la estructura. Esto permite el uso de métodos heurísticos simples que producen diseños experimentalmente robustos. Las estructuras de los ácidos nucleicos son menos versátiles que las proteínas en su función debido a la mayor capacidad de las proteínas para plegarse en estructuras complejas y a la diversidad química limitada de los cuatro nucleótidos en comparación con los veinte aminoácidos proteinogénicos . [93]
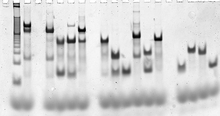
Las secuencias de las cadenas de ADN que forman una estructura objetivo se diseñan computacionalmente, utilizando software de modelado molecular y termodinámico . [91] [93] Los propios ácidos nucleicos luego se sintetizan utilizando métodos estándar de síntesis de oligonucleótidos , generalmente automatizados en un sintetizador de oligonucleótidos , y hay cadenas de secuencias personalizadas disponibles comercialmente. [94] Las hebras se pueden purificar mediante electroforesis en gel desnaturalizante si es necesario, [95] y se pueden determinar concentraciones precisas mediante cualquiera de varios métodos de cuantificación de ácidos nucleicos utilizando espectroscopia de absorbancia ultravioleta . [96]
Las estructuras diana completamente formadas se pueden verificar mediante electroforesis en gel nativo , que proporciona información sobre el tamaño y la forma de los complejos de ácidos nucleicos. Un ensayo de cambio de movilidad electroforética puede evaluar si una estructura incorpora todas las hebras deseadas. [97] El marcaje fluorescente y la transferencia de energía por resonancia de Förster (FRET) se utilizan a veces para caracterizar la estructura de los complejos. [98]
Las estructuras de ácidos nucleicos se pueden obtener imágenes directamente mediante microscopía de fuerza atómica , que es muy adecuada para estructuras bidimensionales extendidas, pero menos útil para estructuras tridimensionales discretas debido a la interacción de la punta del microscopio con la frágil estructura de ácido nucleico; En este caso se utilizan a menudo la microscopía electrónica de transmisión y la microscopía crioelectrónica . Las redes tridimensionales extendidas se analizan mediante cristalografía de rayos X. [99] [100]
General:
Subcampos específicos: