Los receptores acoplados a proteína G ( GPCR ), también conocidos como receptores de siete dominios transmembrana (de paso) , receptores 7TM , receptores heptahelicales , receptores serpentinos y receptores ligados a proteína G ( GPLR ), forman un gran grupo de proteínas relacionadas evolutivamente que son receptores de superficie celular que detectan moléculas fuera de la célula y activan respuestas celulares. Están acoplados a proteínas G. Pasan a través de la membrana celular siete veces en forma de seis bucles [2] (tres bucles extracelulares que interactúan con moléculas de ligando , tres bucles intracelulares que interactúan con proteínas G, una región extracelular N-terminal y una región intracelular C-terminal [2] ) de residuos de aminoácidos , por lo que a veces se los denomina receptores de siete dominios transmembrana. [3] Los ligandos pueden unirse al extremo N y a los bucles extracelulares (por ejemplo, los receptores de glutamato) o al sitio de unión dentro de las hélices transmembrana ( familia similar a la rodopsina ). Todos ellos son activados por agonistas , aunque también se ha observado una autoactivación espontánea de un receptor vacío. [3]
Los receptores acoplados a proteína G se encuentran solo en eucariotas , incluidas las levaduras y los coanoflagelados . [4] Los ligandos que se unen y activan estos receptores incluyen compuestos sensibles a la luz, olores , feromonas , hormonas y neurotransmisores , y varían en tamaño desde pequeñas moléculas hasta péptidos y proteínas grandes . Los receptores acoplados a proteína G están involucrados en muchas enfermedades.
Hay dos vías principales de transducción de señales que involucran a los receptores acoplados a la proteína G:
Cuando un ligando se une al GPCR, provoca un cambio conformacional en el GPCR, lo que le permite actuar como un factor de intercambio de nucleótidos de guanina (GEF). El GPCR puede entonces activar una proteína G asociada intercambiando el GDP unido a la proteína G por un GTP . La subunidad α de la proteína G, junto con el GTP unido, puede entonces disociarse de las subunidades β y γ para afectar aún más a las proteínas de señalización intracelular o dirigirse directamente a las proteínas funcionales dependiendo del tipo de subunidad α ( G αs , G αi/o , G αq/11 , G α12/13 ). [6] : 1160
Los GPCR son un objetivo importante de los fármacos y aproximadamente el 34% [7] de todos los fármacos aprobados por la Administración de Alimentos y Medicamentos (FDA) se dirigen a 108 miembros de esta familia. El volumen de ventas global de estos fármacos se estima en 180 mil millones de dólares estadounidenses a partir de 2018. [actualizar][ 7] Se estima que los GPCR son objetivos para aproximadamente el 50% de los fármacos actualmente en el mercado, principalmente debido a su participación en las vías de señalización relacionadas con muchas enfermedades, es decir, mentales, metabólicas, incluidos los trastornos endocrinológicos, inmunológicas, incluidas las infecciones virales, cardiovasculares, inflamatorias, trastornos de los sentidos y cáncer. La asociación descubierta hace mucho tiempo entre los GPCR y muchas sustancias endógenas y exógenas, que da como resultado, por ejemplo, analgesia, es otro campo de investigación farmacéutica en desarrollo dinámico. [3]
Con la determinación de la primera estructura del complejo entre un receptor acoplado a proteína G (GPCR) y un trímero de proteína G (Gαβγ) en 2011 se abrió un nuevo capítulo en la investigación de GPCR para las investigaciones estructurales de interruptores globales con más de una proteína en estudio. Los avances anteriores incluyeron la determinación de la estructura cristalina del primer GPCR, la rodopsina, en 2000 y la estructura cristalina del primer GPCR con un ligando difusible (β 2 AR) en 2007. La forma en que las siete hélices transmembrana de un GPCR se organizan en un haz se sospechó basándose en el modelo de baja resolución de la rodopsina de rana a partir de estudios de microscopía electrónica criogénica de los cristales bidimensionales. La estructura cristalina de la rodopsina, que apareció tres años después, no fue una sorpresa, aparte de la presencia de una hélice citoplasmática adicional H8 y una ubicación precisa de un bucle que cubre el sitio de unión de la retina. Sin embargo, proporcionó una base que se esperaba que fuera una plantilla universal para el modelado de homología y el diseño de fármacos para otros GPCR, una noción que resultó ser demasiado optimista.
Siete años después, la cristalización del receptor β2-adrenérgico (β2AR ) con un ligando difusible arrojó resultados sorprendentes porque reveló una forma bastante diferente del lado extracelular del receptor que la de la rodopsina. Esta área es importante porque es responsable de la unión del ligando y es el objetivo de muchos fármacos. Además, el sitio de unión del ligando era mucho más espacioso que en la estructura de la rodopsina y estaba abierto al exterior. En los otros receptores cristalizados poco después, el lado de unión era incluso más fácilmente accesible al ligando. Las nuevas estructuras complementadas con investigaciones bioquímicas descubrieron mecanismos de acción de interruptores moleculares que modulan la estructura del receptor, lo que conduce a estados de activación para los agonistas o a estados de inactivación total o parcial para los agonistas inversos. [3]
El Premio Nobel de Química de 2012 fue otorgado a Brian Kobilka y Robert Lefkowitz por su trabajo, que fue "crucial para comprender cómo funcionan los receptores acoplados a la proteína G". [8] Se han otorgado al menos otros siete Premios Nobel por algún aspecto de la señalización mediada por la proteína G. En 2012, dos de los diez medicamentos más vendidos a nivel mundial ( Advair Diskus y Abilify ) actúan dirigiéndose a los receptores acoplados a la proteína G. [9]

Se desconoce el tamaño exacto de la superfamilia GPCR, pero se ha predicho que al menos 831 genes humanos diferentes (o aproximadamente el 4% de todo el genoma codificador de proteínas ) los codifican a partir del análisis de la secuencia del genoma . [10] [11] Aunque se han propuesto numerosos esquemas de clasificación, la superfamilia se dividió clásicamente en tres clases principales (A, B y C) sin homología de secuencia compartida detectable entre clases.
La clase más grande con diferencia es la clase A, que representa casi el 85% de los genes GPCR. De los GPCR de clase A, se predice que más de la mitad de ellos codifican receptores olfativos , mientras que los receptores restantes están ligados por compuestos endógenos conocidos o se clasifican como receptores huérfanos . A pesar de la falta de homología de secuencia entre las clases, todos los GPCR tienen una estructura y un mecanismo de transducción de señales comunes . El grupo muy grande de la rodopsina A se ha subdividido en 19 subgrupos ( A1-A19 ). [12]
Según el sistema AF clásico, los GPCR se pueden agrupar en seis clases según la homología de secuencia y la similitud funcional: [13] [14] [15] [16]
Más recientemente, se ha propuesto un sistema de clasificación alternativo llamado GRAFS ( Glutamato , Rodopsina , Adhesión , Frizzled / Taste2 , Secretina ) para los GPCR de vertebrados. [10] Corresponden a las clases clásicas C, A, B2, F y B. [17]
Un estudio preliminar basado en la secuencia de ADN disponible sugirió que el genoma humano codifica aproximadamente 750 receptores acoplados a la proteína G, [18] de los cuales aproximadamente 350 detectan hormonas, factores de crecimiento y otros ligandos endógenos. Aproximadamente 150 de los GPCR que se encuentran en el genoma humano tienen funciones desconocidas.
Se han utilizado algunos servidores web [19] y métodos de predicción bioinformática [20] [21] para predecir la clasificación de GPCR según su secuencia de aminoácidos únicamente, mediante el enfoque de composición de pseudoaminoácidos .
Los GPCR intervienen en una amplia variedad de procesos fisiológicos. Algunos ejemplos de sus funciones fisiológicas son:
Los GPCR son proteínas integrales de membrana que poseen siete dominios que abarcan la membrana o hélices transmembrana . [26] [27] Las partes extracelulares del receptor pueden estar glicosiladas . Estos bucles extracelulares también contienen dos residuos de cisteína altamente conservados que forman enlaces disulfuro para estabilizar la estructura del receptor. Algunas proteínas de siete hélices transmembrana ( canalrodopsina ) que se parecen a los GPCR pueden contener canales iónicos, dentro de su proteína.
En 2000, se resolvió la primera estructura cristalina de un GPCR de mamífero, la de la rodopsina bovina ( 1F88 ). [28] En 2007, se resolvió la primera estructura de un GPCR humano [29] [1] [30] Esta estructura del GPCR del receptor β2 - adrenérgico humano demostró ser muy similar a la rodopsina bovina. También se han determinado las estructuras de los GPCR activados o unidos a agonistas. [31] [32] [33] [34] Estas estructuras indican cómo la unión del ligando en el lado extracelular de un receptor conduce a cambios conformacionales en el lado citoplasmático del receptor. El cambio más grande es un movimiento hacia afuera de la parte citoplasmática de la quinta y sexta hélice transmembrana (TM5 y TM6). La estructura del receptor beta-2-adrenérgico activado en complejo con G s confirmó que el Gα se une a una cavidad creada por este movimiento. [35]
Los GPCR presentan una estructura similar a la de otras proteínas con siete dominios transmembrana , como las rodopsinas microbianas y los receptores de adiponectina 1 y 2 ( ADIPOR1 y ADIPOR2 ). Sin embargo, estos receptores y canales 7TMH (7 hélices transmembrana) no se asocian con proteínas G. Además, ADIPOR1 y ADIPOR2 están orientados de manera opuesta a los GPCR en la membrana (es decir, los GPCR generalmente tienen un extremo N extracelular y un extremo C citoplasmático , mientras que los ADIPOR están invertidos). [36]

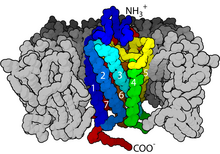
En términos de estructura, los GPCR se caracterizan por un extremo N extracelular , seguido de siete hélices α transmembrana (7-TM) (TM-1 a TM-7) conectadas por tres bucles intracelulares (IL-1 a IL-3) y tres extracelulares (EL-1 a EL-3), y finalmente un extremo C intracelular . El GPCR se organiza en una estructura terciaria que se asemeja a un barril, con las siete hélices transmembrana formando una cavidad dentro de la membrana plasmática que sirve como dominio de unión al ligando que a menudo está cubierto por EL-2. Sin embargo, los ligandos también pueden unirse a otros lugares, como es el caso de los ligandos más voluminosos (p. ej., proteínas o péptidos grandes ), que en cambio interactúan con los bucles extracelulares o, como lo ilustran los receptores de glutamato metabotrópicos de clase C (mGluR), la cola N-terminal. Los GPCR de clase C se distinguen por su gran cola N-terminal, que también contiene un dominio de unión al ligando. Al unirse el glutamato a un mGluR, la cola N-terminal sufre un cambio conformacional que conduce a su interacción con los residuos de los bucles extracelulares y los dominios TM. El efecto final de los tres tipos de activación inducida por agonistas es un cambio en las orientaciones relativas de las hélices TM (similar a un movimiento de torsión) que conduce a una superficie intracelular más amplia y a la "revelación" de residuos de las hélices intracelulares y los dominios TM cruciales para la función de transducción de señales (es decir, acoplamiento de proteína G). Los agonistas y antagonistas inversos también pueden unirse a varios sitios diferentes, pero el efecto final debe ser la prevención de esta reorientación de la hélice TM. [3]
La estructura de las colas N- y C-terminales de los GPCR también puede cumplir funciones importantes más allá de la unión del ligando. Por ejemplo, el extremo C de los receptores muscarínicos M 3 es suficiente, y el dominio polibásico de seis aminoácidos (KKKRRK) en el extremo C es necesario para su preensamblaje con proteínas G q . [37] En particular, el extremo C a menudo contiene residuos de serina (Ser) o treonina (Thr) que, cuando se fosforilan , aumentan la afinidad de la superficie intracelular para la unión de proteínas de andamiaje llamadas β- arrestinas (β-arr). [38] Una vez unidas, las β-arrestinas previenen estéricamente el acoplamiento de proteínas G y pueden reclutar otras proteínas, lo que lleva a la creación de complejos de señalización involucrados en la activación de la vía de la quinasa regulada por señales extracelulares ( ERK ) o la endocitosis del receptor (internalización). Como la fosforilación de estos residuos de Ser y Thr a menudo ocurre como resultado de la activación de GPCR, el desacoplamiento de la proteína G mediada por β-arr y la internalización de GPCR son mecanismos importantes de desensibilización . [39] Además, existen "megacomplejos" internalizados que consisten en un solo GPCR, β-arr (en la conformación de cola), [40] [41] y proteína G heterotrimérica y pueden explicar la señalización de proteínas de los endosomas. [42] [43]
Un último tema estructural común entre los GPCR es la palmitoilación de uno o más sitios de la cola C-terminal o de los bucles intracelulares. La palmitoilación es la modificación covalente de los residuos de cisteína (Cys) mediante la adición de grupos acilo hidrofóbicos , y tiene el efecto de dirigir el receptor a microdominios ricos en colesterol y esfingolípidos de la membrana plasmática llamados balsas lipídicas . Como muchas de las moléculas transductoras y efectoras posteriores de los GPCR (incluidas las involucradas en las vías de retroalimentación negativa ) también se dirigen a las balsas lipídicas, esto tiene el efecto de facilitar la señalización rápida del receptor.
Los GPCR responden a señales extracelulares mediadas por una enorme diversidad de agonistas, que van desde proteínas hasta aminas biógenas y protones , pero todos transducen esta señal a través de un mecanismo de acoplamiento de proteína G. Esto es posible gracias a un dominio de factor de intercambio de nucleótidos de guanina ( GEF ) formado principalmente por una combinación de IL-2 e IL-3 junto con residuos adyacentes de las hélices TM asociadas.

El receptor acoplado a la proteína G se activa mediante una señal externa en forma de ligando u otro mediador de señales. Esto crea un cambio conformacional en el receptor, lo que provoca la activación de una proteína G. El efecto adicional depende del tipo de proteína G. Las proteínas G son posteriormente inactivadas por proteínas activadoras de GTPasa, conocidas como proteínas RGS .
Los GPCR incluyen uno o más receptores para los siguientes ligandos: mediadores de señales sensoriales (p. ej., moléculas estimuladoras de luz y olfato ); adenosina , bombesina , bradicinina , endotelina , ácido γ-aminobutírico ( GABA ), factor de crecimiento de hepatocitos ( HGF ), melanocortinas , neuropéptido Y , péptidos opioides , opsinas , somatostatina , GH , taquiquininas , miembros de la familia de péptidos intestinales vasoactivos y vasopresina ; aminas biógenas (p. ej., dopamina , epinefrina , norepinefrina , histamina , serotonina y melatonina ); glutamato ( efecto metabotrópico ); glucagón ; acetilcolina ( efecto muscarínico ); quimiocinas ; mediadores lipídicos de la inflamación (p. ej., prostaglandinas , prostanoides , factor activador de plaquetas y leucotrienos ); hormonas peptídicas (p. ej., calcitonina , anafilatoxina C5a , hormona folículo estimulante [FSH], hormona liberadora de gonadotropina [GnRH], neuroquinina , hormona liberadora de tirotropina [TRH] y oxitocina ); y endocannabinoides .
Los GPCR que actúan como receptores de estímulos que aún no han sido identificados se conocen como receptores huérfanos .
Sin embargo, a diferencia de otros tipos de receptores que se han estudiado, en los que los ligandos se unen externamente a la membrana, los ligandos de los GPCR normalmente se unen dentro del dominio transmembrana. Sin embargo, los receptores activados por proteasas se activan mediante la escisión de parte de su dominio extracelular. [45]

La transducción de la señal a través de la membrana por el receptor no se entiende completamente. Se sabe que en el estado inactivo, el GPCR está unido a un complejo de proteína G heterotrimérica . La unión de un agonista al GPCR da como resultado un cambio conformacional en el receptor que se transmite a la subunidad G α unida de la proteína G heterotrimérica a través de la dinámica del dominio proteico . La subunidad G α activada intercambia GTP en lugar de GDP , lo que a su vez desencadena la disociación de la subunidad G α del dímero G βγ y del receptor. Las subunidades G α y G βγ disociadas interactúan con otras proteínas intracelulares para continuar la cascada de transducción de señales mientras que el GPCR liberado puede volver a unirse a otra proteína G heterotrimérica para formar un nuevo complejo que está listo para iniciar otra ronda de transducción de señales. [46]
Se cree que una molécula receptora existe en un equilibrio conformacional entre estados biofísicos activos e inactivos. [47] La unión de ligandos al receptor puede cambiar el equilibrio hacia los estados activos del receptor. Existen tres tipos de ligandos: los agonistas son ligandos que cambian el equilibrio a favor de los estados activos; los agonistas inversos son ligandos que cambian el equilibrio a favor de los estados inactivos; y los antagonistas neutrales son ligandos que no afectan el equilibrio. Todavía no se sabe exactamente en qué se diferencian entre sí los estados activo e inactivo.

Cuando el receptor está inactivo, el dominio GEF puede estar unido a una subunidad α también inactiva de una proteína G heterotrimérica . Estas "proteínas G" son un trímero de subunidades α, β y γ (conocidas como Gα, Gβ y Gγ, respectivamente) que se vuelve inactiva cuando se une reversiblemente al difosfato de guanosina (GDP) (o, alternativamente, no hay nucleótido de guanina) pero se activa cuando se une al trifosfato de guanosina (GTP). Tras la activación del receptor, el dominio GEF, a su vez, activa alostéricamente la proteína G al facilitar el intercambio de una molécula de GDP por GTP en la subunidad α de la proteína G. La célula mantiene una proporción de 10:1 de GTP:GDP citosólico, por lo que se asegura el intercambio por GTP. En este punto, las subunidades de la proteína G se disocian del receptor, así como entre sí, para producir un monómero Gα-GTP y un dímero Gβγ de interacción estrecha , que ahora son libres de modular la actividad de otras proteínas intracelulares. Sin embargo, el grado en que pueden difundirse es limitado debido a la palmitoilación de Gα y a la presencia de una fracción isoprenoide que se ha añadido covalentemente a los extremos C de Gγ.
Debido a que Gα también tiene una capacidad lenta de hidrólisis de GTP→GDP , la forma inactiva de la subunidad α (Gα-GDP) finalmente se regenera, lo que permite la reasociación con un dímero Gβγ para formar la proteína G "en reposo", que puede unirse nuevamente a un GPCR y esperar la activación. La tasa de hidrólisis de GTP a menudo se acelera debido a las acciones de otra familia de proteínas moduladoras alostéricas llamadas reguladores de la señalización de la proteína G o proteínas RGS, que son un tipo de proteína activadora de GTPasa o GAP. De hecho, muchas de las proteínas efectoras primarias (por ejemplo, adenilato ciclasas ) que se activan/inactivan tras la interacción con Gα-GTP también tienen actividad GAP. Por lo tanto, incluso en esta etapa temprana del proceso, la señalización iniciada por GPCR tiene la capacidad de autoterminarse.

Se ha demostrado que las señales descendentes de GPCR posiblemente interactúan con señales de integrina , como FAK . [48] La señalización de integrina fosforilará FAK, lo que luego puede disminuir la actividad de GPCR G αs .

Si un receptor en estado activo encuentra una proteína G , puede activarla. Algunas evidencias sugieren que los receptores y las proteínas G están en realidad preacoplados. [37] Por ejemplo, la unión de las proteínas G a los receptores afecta la afinidad del receptor por los ligandos. Las proteínas G activadas están unidas a GTP .
La transducción de señales adicional depende del tipo de proteína G. La enzima adenilato ciclasa es un ejemplo de una proteína celular que puede ser regulada por una proteína G, en este caso la proteína G G s . La actividad de la adenilato ciclasa se activa cuando se une a una subunidad de la proteína G activada. La activación de la adenilato ciclasa termina cuando la proteína G regresa al estado unido al GDP .
Las adenilato ciclasas (de las cuales se conocen en los seres humanos 9 formas unidas a la membrana y una citosólica) también pueden activarse o inhibirse de otras maneras (por ejemplo, unión de Ca2+/ calmodulina ), lo que puede modificar la actividad de estas enzimas de manera aditiva o sinérgica junto con las proteínas G.
Las vías de señalización activadas a través de un GPCR están limitadas por la secuencia primaria y la estructura terciaria del propio GPCR, pero en última instancia están determinadas por la conformación particular estabilizada por un ligando particular , así como por la disponibilidad de moléculas transductoras . Actualmente, se considera que los GPCR utilizan dos tipos principales de transductores: proteínas G y β-arrestinas . Debido a que las β-arr tienen una alta afinidad solo por la forma fosforilada de la mayoría de los GPCR (ver arriba o abajo), la mayor parte de la señalización depende en última instancia de la activación de la proteína G. Sin embargo, la posibilidad de interacción permite que se produzca una señalización independiente de la proteína G.
Existen tres vías principales de señalización mediadas por la proteína G, mediadas por cuatro subclases de proteínas G que se distinguen entre sí por homología de secuencia ( G αs , G αi/o , G αq/11 y G α12/13 ). Cada subclase de proteína G consta de múltiples proteínas, cada una producto de múltiples genes o variaciones de empalme que pueden imbuirlas de diferencias que van desde sutiles a distintas con respecto a las propiedades de señalización, pero en general parecen agruparse razonablemente en cuatro clases. Debido a que las propiedades de transducción de señales de las diversas combinaciones βγ posibles no parecen diferir radicalmente entre sí, estas clases se definen de acuerdo con la isoforma de su subunidad α. [6] : 1163
Aunque la mayoría de los GPCR son capaces de activar más de un subtipo de Gα, también muestran una preferencia por un subtipo sobre otro. Cuando el subtipo activado depende del ligando que está unido al GPCR, esto se llama selectividad funcional (también conocida como tráfico dirigido por agonista o agonismo específico de conformación). Sin embargo, la unión de cualquier agonista en particular también puede iniciar la activación de múltiples proteínas G diferentes, ya que puede ser capaz de estabilizar más de una conformación del dominio GEF del GPCR , incluso en el transcurso de una sola interacción. Además, una conformación que activa preferiblemente una isoforma de Gα puede activar otra si la preferida está menos disponible. Además, las vías de retroalimentación pueden dar lugar a modificaciones del receptor (p. ej., fosforilación) que alteran la preferencia de la proteína G. Independientemente de estos diversos matices, el compañero de acoplamiento preferido del GPCR suele definirse de acuerdo con la proteína G activada de forma más obvia por el ligando endógeno en la mayoría de las condiciones fisiológicas o experimentales .
Las descripciones anteriores ignoran los efectos de la señalización Gβγ , que también puede ser importante, en particular en el caso de GPCR acoplados a G αi/o activados . Los efectores primarios de Gβγ son varios canales iónicos, como los canales de K + rectificadores internos regulados por proteína G (GIRK), los canales de Ca2 + dependientes del voltaje de tipo P / Q y N , así como algunas isoformas de AC y PLC, junto con algunas isoformas de fosfoinosítido-3-quinasa (PI3K).
Aunque clásicamente se piensa que trabajan solo juntos, los GPCR pueden señalizar a través de mecanismos independientes de la proteína G, y las proteínas G heterotriméricas pueden desempeñar papeles funcionales independientes de los GPCR. Los GPCR pueden señalizar independientemente a través de muchas proteínas ya mencionadas por sus papeles en la señalización dependiente de la proteína G, como β-arrs , GRKs y Srcs . Se ha demostrado que dicha señalización es fisiológicamente relevante, por ejemplo, la señalización de β-arrestina mediada por el receptor de quimiocinas CXCR3 fue necesaria para la quimiotaxis de eficacia completa de las células T activadas. [49] Además, otras proteínas de andamiaje involucradas en la localización subcelular de los GPCR (por ejemplo, proteínas que contienen el dominio PDZ ) también pueden actuar como transductores de señales. La mayoría de las veces, el efector es un miembro de la familia MAPK .
A fines de la década de 1990, se empezó a acumular evidencia que sugería que algunos GPCR pueden enviar señales sin proteínas G. Se ha demostrado que la proteína quinasa activada por mitógeno ERK2 , un mediador clave de la transducción de señales aguas abajo de la activación del receptor en muchas vías, se activa en respuesta a la activación del receptor mediada por AMPc en el moho mucilaginoso D. discoideum a pesar de la ausencia de las subunidades α y β de la proteína G asociadas. [50]
En las células de mamíferos, se ha demostrado que el muy estudiado receptor β 2 -adrenoceptor activa la vía ERK2 después de la disociación mediada por arrestina de la señalización mediada por proteína G. Por lo tanto, parece probable que algunos mecanismos que antes se creían relacionados puramente con la desensibilización del receptor sean en realidad ejemplos de receptores que cambian su vía de señalización, en lugar de simplemente desactivarse.
En las células renales, se ha demostrado que el receptor B2 de bradicinina interactúa directamente con una fosfatasa de tirosina proteica. La presencia de una secuencia ITIM (motivo inhibidor basado en tirosina del inmunorreceptor) fosforilada en tirosina en el receptor B2 es necesaria para mediar esta interacción y, posteriormente, el efecto antiproliferativo de la bradicinina. [51]
Aunque se trata de un área de investigación relativamente inmadura, parece que las proteínas G heterotriméricas también pueden participar en la señalización no GPCR. Hay evidencia de funciones como transductores de señales en casi todos los demás tipos de señalización mediada por receptores, incluidas las integrinas , las tirosina quinasas receptoras (RTK), los receptores de citocinas ( JAK/STAT ), así como la modulación de varias otras proteínas "accesorias" como los GEF , los inhibidores de la disociación de nucleótidos de guanina (GDI) y las fosfatasas proteicas . Incluso puede haber proteínas específicas de estas clases cuya función principal sea como parte de las vías independientes de GPCR, denominadas activadores de la señalización de la proteína G (AGS). Tanto la ubicuidad de estas interacciones como la importancia de las subunidades Gα frente a Gβγ para estos procesos aún no están claras.



Hay dos vías principales de transducción de señales que involucran a los receptores vinculados a la proteína G : la vía de señal de AMPc y la vía de señal de fosfatidilinositol . [5]
La transducción de señales de AMPc contiene cinco caracteres principales: receptor de hormona estimulante (Rs) o receptor de hormona inhibidora (Ri); proteína G reguladora estimulante (Gs) o proteína G reguladora inhibidora (Gi); adenilil ciclasa ; proteína quinasa A (PKA); y fosfodiesterasa de AMPc .
El receptor de hormona estimulante (Rs) es un receptor que puede unirse con moléculas de señal estimulante, mientras que el receptor de hormona inhibidora (Ri) es un receptor que puede unirse con moléculas de señal inhibidora.
La proteína G reguladora estimulante es una proteína G unida al receptor de hormonas estimulantes (Rs), y su subunidad α, al activarse, podría estimular la actividad de una enzima u otro metabolismo intracelular. Por el contrario, la proteína G reguladora inhibidora está unida a un receptor de hormonas inhibidoras, y su subunidad α, al activarse, podría inhibir la actividad de una enzima u otro metabolismo intracelular.
La adenilil ciclasa es una glicoproteína transmembrana 12 veces mayor que cataliza la conversión de ATP en AMPc con la ayuda del cofactor Mg 2+ o Mn 2+ . El AMPc producido es un segundo mensajero en el metabolismo celular y es un activador alostérico de la proteína quinasa A.
La proteína quinasa A es una enzima importante en el metabolismo celular debido a su capacidad para regular el metabolismo celular mediante la fosforilación de enzimas específicas comprometidas en la vía metabólica. También puede regular la expresión de genes específicos, la secreción celular y la permeabilidad de la membrana. La enzima proteica contiene dos subunidades catalíticas y dos subunidades reguladoras. Cuando no hay AMPc, el complejo está inactivo. Cuando el AMPc se une a las subunidades reguladoras, su conformación se altera, lo que provoca la disociación de las subunidades reguladoras, lo que activa la proteína quinasa A y permite otros efectos biológicos.
Estas señales pueden luego ser terminadas por la fosfodiesterasa de AMPc, que es una enzima que degrada el AMPc a 5'-AMP e inactiva la proteína quinasa A.
En la vía de señalización del fosfatidilinositol , la molécula de señalización extracelular se une al receptor de proteína G (G q ) en la superficie celular y activa la fosfolipasa C , que se encuentra en la membrana plasmática . La lipasa hidroliza el fosfatidilinositol 4,5-bisfosfato (PIP2) en dos segundos mensajeros: inositol 1,4,5-trisfosfato (IP3) y diacilglicerol (DAG). El IP3 se une al receptor de IP3 en la membrana del retículo endoplasmático liso y las mitocondrias para abrir los canales de Ca 2+ . El DAG ayuda a activar la proteína quinasa C (PKC), que fosforila muchas otras proteínas, modificando sus actividades catalíticas y dando lugar a respuestas celulares.
Los efectos del Ca 2+ también son notables: coopera con DAG en la activación de PKC y puede activar la vía de la quinasa CaM , en la que la proteína calmodulina (CaM) modulada por calcio se une al Ca 2+ , sufre un cambio de conformación y activa la quinasa CaM II, que tiene la capacidad única de aumentar su afinidad de unión a la CaM por autofosforilación, haciendo que la CaM no esté disponible para la activación de otras enzimas. La quinasa luego fosforila las enzimas objetivo, regulando sus actividades. Las dos vías de señalización están conectadas entre sí por Ca 2+ -CaM, que también es una subunidad reguladora de la adenilil ciclasa y la fosfodiesterasa en la vía de señalización del AMPc.
Los GPCR se desensibilizan cuando se exponen a su ligando durante un largo período de tiempo. Existen dos formas reconocidas de desensibilización: 1) desensibilización homóloga , en la que el GPCR activado se regula a la baja; y 2) desensibilización heteróloga , en la que el GPCR activado provoca la regulación a la baja de un GPCR diferente. La reacción clave de esta regulación a la baja es la fosforilación del dominio del receptor intracelular (o citoplasmático ) por las proteínas quinasas .
Las quinasas de proteína dependientes de AMP cíclico ( quinasa de proteína A ) son activadas por la cadena de señal que viene de la proteína G (que fue activada por el receptor) a través de la adenilato ciclasa y el AMP cíclico (AMPc). En un mecanismo de retroalimentación , estas quinasas activadas fosforilan el receptor. Cuanto más tiempo permanece activo el receptor, más quinasas se activan y más receptores se fosforilan. En los β 2 -adrenoceptores , esta fosforilación da como resultado el cambio del acoplamiento de la clase G s de proteína G a la clase G i . [52] La fosforilación mediada por PKA dependiente de AMPc puede causar desensibilización heteróloga en receptores distintos de los activados. [53]
Las quinasas del receptor acoplado a proteína G (GRK) son proteínas quinasas que fosforilan solo GPCR activos. [54] Las quinasas del receptor acoplado a proteína G (GRK) son moduladores clave de la señalización del receptor acoplado a proteína G (GPCR). Constituyen una familia de siete proteínas quinasas de serina-treonina de mamíferos que fosforilan el receptor unido al agonista. La fosforilación del receptor mediada por GRK inicia rápidamente un deterioro profundo de la señalización del receptor y la desensibilización. La actividad de las GRK y la focalización subcelular están estrechamente reguladas por la interacción con los dominios del receptor, las subunidades de la proteína G, los lípidos, las proteínas de anclaje y las proteínas sensibles al calcio. [55]
La fosforilación del receptor puede tener dos consecuencias:
Como se mencionó anteriormente, las proteínas G pueden terminar su propia activación debido a su capacidad intrínseca de hidrólisis de GTP→GDP . Sin embargo, esta reacción se produce a una velocidad lenta (≈0,02 veces/seg) y, por lo tanto, cualquier proteína G tardaría unos 50 segundos en desactivarse si no entraran en juego otros factores. De hecho, hay alrededor de 30 isoformas de proteínas RGS que, cuando se unen a Gα a través de su dominio GAP , aceleran la velocidad de hidrólisis a ≈30 veces/seg. Este aumento de 1500 veces en la velocidad permite que la célula responda a señales externas con alta velocidad, así como resolución espacial debido a la cantidad limitada de segundo mensajero que se puede generar y la distancia limitada que una proteína G puede difundir en 0,03 segundos. En su mayor parte, las proteínas RGS son promiscuas en su capacidad para desactivar proteínas G, mientras que el RGS que participa en una vía de señalización dada parece estar más determinado por el tejido y el GPCR involucrados que por cualquier otra cosa. Además, las proteínas RGS tienen la función adicional de aumentar la tasa de intercambio de GTP-GDP en los GPCR (es decir, como una especie de co-GEF), contribuyendo aún más a la resolución temporal de la señalización de GPCR.
Además, el propio GPCR puede desensibilizarse . Esto puede ocurrir de las siguientes maneras:
Una vez que la β-arrestina se une a un GPCR, sufre un cambio conformacional que le permite servir como proteína de andamiaje para un complejo adaptador denominado AP-2 , que a su vez recluta otra proteína llamada clatrina . Si suficientes receptores en el área local reclutan clatrina de esta manera, se agregan y la membrana se desprende hacia adentro como resultado de las interacciones entre las moléculas de clatrina, en un proceso llamado opsonización . Una vez que la cavidad se ha separado de la membrana plasmática debido a las acciones de otras dos proteínas llamadas anfifisina y dinamina , ahora es una vesícula endocítica . En este punto, las moléculas adaptadoras y la clatrina se han disociado , y el receptor se transporta de regreso a la membrana plasmática o se dirige a los lisosomas para su degradación .
En cualquier punto de este proceso, las β-arrestinas también pueden reclutar otras proteínas, como la tirosina quinasa no receptora (nRTK), c-SRC , que puede activar ERK1/2 u otra señalización de proteína quinasa activada por mitógeno (MAPK) a través, por ejemplo, de la fosforilación de la pequeña GTPasa , Ras , o reclutar las proteínas de la cascada ERK directamente (es decir, Raf-1 , MEK , ERK-1/2) en cuyo punto se inicia la señalización debido a su proximidad entre sí. Otro objetivo de c-SRC son las moléculas de dinamina involucradas en la endocitosis. Las dinaminas se polimerizan alrededor del cuello de una vesícula entrante, y su fosforilación por c-SRC proporciona la energía necesaria para el cambio conformacional que permite el "desprendimiento" final de la membrana.
La desensibilización del receptor está mediada por una combinación de fosforilación, unión de β-arr y endocitosis, como se describió anteriormente. La regulación negativa ocurre cuando el receptor endocitado se incrusta en un endosoma que se dirige a fusionarse con un orgánulo llamado lisosoma. Debido a que las membranas lisosomales son ricas en bombas de protones, sus interiores tienen un pH bajo (≈4,8 frente al pH≈7,2 del citosol), lo que actúa para desnaturalizar los GPCR. Además, los lisosomas contienen muchas enzimas degradativas , incluidas las proteasas, que pueden funcionar solo a un pH tan bajo, por lo que los enlaces peptídicos que unen los residuos del GPCR pueden escindirse. El hecho de que un receptor determinado se dirija a un lisosoma, se detenga en los endosomas o se dirija de nuevo a la membrana plasmática depende de una variedad de factores, incluido el tipo de receptor y la magnitud de la señal. La regulación de GPCR también está mediada por factores de transcripción genética. Estos factores pueden aumentar o disminuir la transcripción genética y, por lo tanto, aumentar o disminuir la generación de nuevos receptores (regulación ascendente o descendente) que viajan a la membrana celular.
La oligomerización del receptor acoplado a proteína G es un fenómeno muy extendido. Uno de los ejemplos mejor estudiados es el receptor metabotrópico GABA B . Este llamado receptor constitutivo se forma por heterodimerización de las subunidades GABA B R1 y GABA B R2 . La expresión de GABA B R1 sin GABA B R2 en sistemas heterólogos conduce a la retención de la subunidad en el retículo endoplásmico . Mientras tanto, la expresión de la subunidad GABA B R2 sola conduce a la expresión superficial de la subunidad, aunque sin actividad funcional (es decir, el receptor no se une al agonista y no puede iniciar una respuesta después de la exposición al agonista). La expresión de las dos subunidades juntas conduce a la expresión de la membrana plasmática del receptor funcional. Se ha demostrado que la unión de GABA B R2 a GABA B R1 causa el enmascaramiento de una señal de retención [60] de receptores funcionales. [61]
La transducción de señales mediada por la superfamilia de GPCR se remonta al origen de la multicelularidad . Los GPCR similares a los de los mamíferos se encuentran en los hongos y se han clasificado de acuerdo con el sistema de clasificación GRAFS basado en las huellas dactilares de GPCR. [17] La identificación de los miembros de la superfamilia en el dominio eucariota y la comparación de los motivos específicos de la familia han demostrado que la superfamilia de GPCR tiene un origen común. [62] Los motivos característicos indican que tres de las cinco familias GRAFS, Rhodopsin , Adhesion y Frizzled , evolucionaron a partir de los receptores de AMPc de Dictyostelium discoideum antes de la división de los opistocontos . Más tarde, la familia Secretin evolucionó a partir de la familia de receptores GPCR Adhesion antes de la división de los nematodos . [17] Los GPCR de insectos parecen estar en su propio grupo y se identifica a Taste2 como descendiente de Rhodopsin . [62] Tenga en cuenta que la división de secretina / adhesión se basa en la función presunta en lugar de la firma, ya que la clase B clásica (7tm_2, Pfam PF00002) se utiliza para identificar ambas en los estudios.
Referencia para modelos moleculares y matemáticos de la respuesta inicial del receptor
Datos, diagramas y herramientas web sobre receptores acoplados a proteína G (GPCR).; Munk C, Isberg V, Mordalski S, Harpsøe K, Rataj K, Hauser AS, et al. (Julio de 2016). "GPCRdb: la base de datos de receptores acoplados a proteína G: una introducción". Revista británica de farmacología . 173 (14): 2195–207. doi :10.1111/bph.13509. PMC 4919580 . PMID 27155948.
Clasificación de GPCR
Iniciativa de estructura de proteínas: Centro de red de biología cuyo objetivo es determinar las estructuras 3D de las proteínas representativas de la familia GPCR