Las acidemias metilmalónicas , también llamadas acidurias metilmalónicas , [nota 1] son un grupo de trastornos metabólicos hereditarios que impiden que el cuerpo descomponga adecuadamente las proteínas y las grasas . [1] Esto conduce a una acumulación de un nivel tóxico de ácido metilmalónico en los líquidos y tejidos corporales. Debido al metabolismo alterado de los aminoácidos de cadena ramificada (BCAA), se encuentran entre las acidemias orgánicas clásicas . [2]
Las acidemias metilmalónicas tienen diferentes diagnósticos, requisitos de tratamiento y pronósticos, que están determinados por la mutación genética específica que causa la forma hereditaria del trastorno. [3]
Los primeros síntomas pueden comenzar desde el primer día de vida o hasta la edad adulta. [4] Los síntomas pueden variar desde leves hasta potencialmente mortales. [1] Algunas formas pueden provocar la muerte si no se diagnostican o no se tratan.
Las acidemias metilmalónicas se encuentran con igual frecuencia en todas las fronteras étnicas. [5]
Dependiendo de los genes afectados y la mutación, los síntomas actuales pueden variar desde leves hasta potencialmente mortales.
Como regla general, las acidemias metilmalónicas no son evidentes al nacer, ya que los síntomas no se presentan hasta que se agregan proteínas a la dieta del bebé. [10] Debido a esto, los síntomas generalmente se manifiestan en cualquier momento dentro del primer año de vida. [12] Sin embargo, también hay formas que solo desarrollan síntomas en la edad adulta. [4]
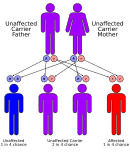
Las acidemias metilmalónicas tienen un patrón de herencia autosómico recesivo, lo que significa que el gen defectuoso está ubicado en un autosoma y se deben heredar dos copias del gen, una de cada padre, para verse afectado por el trastorno. Los padres de un niño con un trastorno autosómico recesivo son portadores de una copia del gen defectuoso, pero normalmente no se ven afectados por el trastorno. [ cita necesaria ] La excepción es la acidemia metilmalónica y la homocistinuria, tipo cblX debido a variantes en el gen HCFC1 , que se hereda de forma recesiva ligada al cromosoma X. [13]
Los siguientes son los genotipos conocidos responsables de acidemias metilmalónicas aisladas : [13]
El tipo mut se puede dividir además en subtipos mut0 y mut-, donde mut0 se caracteriza por una falta total de metilmalonil-CoA mutasa y síntomas más graves y mut- se caracteriza por una disminución de la actividad mutasa. [5]
Además, los siguientes genes también son responsables de las acidemias metilmalónicas: [13] [19]
Aunque no siempre se agrupa con las versiones hereditarias, una deficiencia nutricional grave de vitamina B 12 también puede provocar un síndrome con síntomas y tratamientos idénticos a las acidemias metilmalónicas genéticas. [37] La metilmalonil-CoA requiere vitamina B 12 para formar succinil-CoA. Cuando la cantidad de B 12 es insuficiente para la conversión del cofactor metilmalonil-CoA en succinil-CoA, la acumulación de metilmalonil-CoA no utilizada eventualmente conduce a acidemia metilmalónica. Este diagnóstico se utiliza a menudo como indicador de deficiencia de vitamina B 12 en suero . [38]

En las acidemias metilmalónicas, el organismo no puede descomponer adecuadamente:
Como resultado, el ácido metilmalónico se acumula en líquidos y tejidos. Quienes padecen este trastorno carecen de copias funcionales o niveles adecuados de una o más de las siguientes enzimas: [6] [11] [9]
Estos se presentan brevemente a continuación:
Se estima que hasta el 60% de los casos aislados de acidemia metilmalónica son el resultado de una mutación en el gen MMUT que codifica la proteína metilmalonil-CoA mutasa. Esta enzima es responsable de la digestión de derivados potencialmente tóxicos de la descomposición de los aminoácidos y grasas antes mencionados, principalmente el colesterol , [11] en particular, esta enzima convierte la metilmalonil-CoA en succinil-CoA. [40] Sin esta enzima, el cuerpo no tiene medios para neutralizar o eliminar el ácido metilmalónico y compuestos relacionados. La acción de esta enzima también puede verse afectada por mutaciones en los genes MMAA , MMAB y MMADHC , cada uno de los cuales codifica una proteína necesaria para el funcionamiento normal de la metilmalonil-CoA mutasa. [11]
CMAMMA es probablemente la forma más común de acidemia metilmalónica, pero rara vez se diagnostica debido al desvío en las pruebas de detección de rutina en recién nacidos , la amplia variedad de síntomas y, en algunos casos, los síntomas solo aparecen en la edad adulta. [9] [41] Las mutaciones del gen ACSF3 conducen a una deficiencia de la enzima mitocondrial acil-CoA sintetasa, miembro 3 de la familia, lo que resulta en niveles elevados de ácido metilmalónico y ácido malónico . [9] Dado que la tarea de la enzima es tanto la conversión del ácido metilmalónico en metilmalonil-CoA, para que pueda ser introducido en el ciclo del ácido cítrico , como la conversión del ácido malónico en malonil-CoA , que es el primer paso en la grasa mitocondrial. síntesis de ácido (mtFASII). [42] [43] Por lo tanto, CMAMMA puede definirse no sólo como una acidemia orgánica sino también como un defecto de la síntesis de ácidos grasos mitocondriales. [43]
Las mutaciones en el gen MCEE , que codifica la proteína metilmalonil-CoA epimerasa, también conocida como metilmalonil racemasa, causarán una forma mucho más leve del trastorno que la variante relacionada de la metilmalonil-CoA mutasa. Al igual que la mutasa, la epimerasa también actúa descomponiendo las mismas sustancias, pero en un grado significativamente menor que la mutasa. [11] Las diferencias fenotípicas causadas por una deficiencia de la epimerasa en comparación con la mutasa son tan leves que existe un debate dentro de la comunidad médica sobre si esta deficiencia genética puede considerarse o no un trastorno o síndrome clínico. [44]
También conocida como vitamina B 12, esta forma de cobalamina es un cofactor necesario de la metilmalonil-CoA mutasa. Incluso con una versión funcional de la enzima en niveles fisiológicamente normales, si la B 12 no se puede convertir a esta forma activa, la mutasa no podrá funcionar. [11]
Debido a la gravedad y rapidez con la que este trastorno puede causar complicaciones si no se diagnostica, la detección de acidemia metilmalónica a menudo se incluye en el examen de detección del recién nacido . [10] [45] Para ello, se realiza una prueba de sangre seca para el parámetro propionilcarnitina (C3) a las 24-48 horas de edad para detectar acidemias metilmalónicas aisladas. [13] [46]
Debido a los niveles normales de propionilcarnitina y los síntomas asintomáticos en el momento de la prueba, la forma probablemente más común de acidemias metilmalónicas, CMAMMA, pasa desapercibida en la evaluación neonatal. [9] [13] El trastorno del desarrollo intelectual autosómico recesivo 69 también tiene niveles normales de propionilcarnitina. [13] La acidemia metilmalónica y la homocistinuria, tipo cblC, si son leves y de aparición tardía, también pueden pasar desapercibidas. [47]
Normalmente, el parámetro ácido metilmalónico sólo se analiza si la propionilcarnitina estaba previamente elevada. [48]
Debido a la incapacidad de descomponer completamente los aminoácidos, el subproducto de la digestión de proteínas, el compuesto ácido metilmalónico, se encuentra en una concentración desproporcionada en la sangre y la orina de los afectados. Estos niveles anormales se utilizan como principal criterio de diagnóstico para diagnosticar el trastorno. Este trastorno generalmente se determina mediante el uso de un análisis de orina o un panel de sangre . [12] También pueden estar presentes niveles elevados de amoníaco , glicina y cuerpos cetónicos en la sangre y la orina. [6]
Con la inclusión del parámetro ácido malónico , CMAMMA se puede diferenciar rápidamente de la acidemia metilmalónica clásica calculando la proporción de ácido malónico a ácido metilmalónico, pero solo con valores del plasma sanguíneo y no de la orina. [49] La proporción también se puede utilizar para determinar si se trata de CMAMMA (MA<MMA) o aciduria malónica (MA>MMA). [49] [7] [50]
La prueba se utiliza para un diagnóstico diferencial adicional y para comprobar la eficacia del tratamiento con vitamina B 12 , esta última puede prevenir inyecciones innecesarias (de vitamina B 12 ) en los niños. [51] Para una mejor comparabilidad e interpretación de los informes de los pacientes, Fowler et al han desarrollado un protocolo para una prueba estandarizada de capacidad de respuesta a la vitamina B 12 ( in vivo ): [51]
Además, la capacidad de respuesta a la vitamina B 12 también se puede probar in vitro . [13] [51] Puede proporcionar algunas ideas, pero no siempre puede predecir correctamente la capacidad de respuesta de la vitamina B 12 in vivo . [13]
El diagnóstico final se confirma mediante pruebas genéticas moleculares si se encuentran variantes patogénicas bialélicas en los genes afectados. Debido a su alta sensibilidad, fácil accesibilidad y no invasividad, las pruebas genéticas moleculares reemplazan a los ensayos enzimáticos en la mayoría de los casos. [13] Existen paneles multigénicos específicos para la acidemia metilmalónica, pero los genes particulares analizados pueden variar de un laboratorio a otro y el médico puede personalizarlos según el fenotipo individual. [13] [19] Los métodos genéticos moleculares utilizados en estos paneles van desde análisis de secuencia , análisis de eliminación/duplicación y otras pruebas no basadas en secuenciación, pero en la gran mayoría de los casos el diagnóstico se realiza mediante análisis de secuencia. [13]
Además, las pruebas genéticas moleculares son necesarias para comprobar los diagnósticos sospechosos y corregir los diagnósticos erróneos que pueden haber sido causados por síntomas y resultados engañosos de la prueba de capacidad de respuesta a la vitamina B 12 . [52]
La presencia de acidemia metilmalónica también se puede sospechar mediante el uso de una tomografía computarizada o una resonancia magnética ; sin embargo, estas pruebas no son de ninguna manera específicas y requieren una correlación clínica y metabólica. [10]
El tratamiento para todas las formas de esta afección se basa principalmente en una dieta baja en proteínas y, según la variante del trastorno que padezca el individuo, en diversos suplementos dietéticos. Todas las variantes responden al isómero levo de la carnitina, ya que la descomposición inadecuada de las sustancias afectadas hace que los pacientes desarrollen una deficiencia de carnitina. La carnitina también ayuda a eliminar la acil-CoA, cuya acumulación es común en dietas bajas en proteínas, convirtiéndola en acil-carnitina que puede excretarse en la orina. Algunas formas de acidemia por metilmalonilo responden a la cobalamina, aunque los suplementos de cianocobalamina podrían resultar perjudiciales para algunas formas. [53] Si el individuo demuestra responder a los suplementos de cobalamina y carnitina, entonces es posible que ingiera sustancias que incluyan pequeñas cantidades de los aminoácidos problemáticos isoleucina, treonina, metionina y valina sin causar un ataque. [10] Se ha descubierto que las versiones CblA y cblB de la acidemia metilmalónica responden a la cobalamina.
Un tratamiento más extremo incluye el trasplante de riñón o hígado de un donante sin la afección. Los órganos extraños producirán una versión funcional de las enzimas defectuosas y digerirán el ácido metilmalónico; sin embargo, todas las desventajas del trasplante de órganos, por supuesto, son aplicables en esta situación. [10] Hay evidencia que sugiere que el sistema nervioso central puede metabolizar la metilmalonil-CoA en un sistema aislado del resto del cuerpo. Si este es el caso, es posible que el trasplante no revierta los efectos neurológicos del ácido metilmalónico previos al trasplante ni evite daños mayores al cerebro debido a su acumulación continua. [54] [40]
Los estudios preclínicos de prueba de concepto en modelos animales han demostrado que la terapia con ARNm también es adecuada para enfermedades metabólicas raras, incluida la acidemia metilmalónica aislada. [55] [56] En este contexto, vale la pena mencionar el candidato a terapia de acidemia mut metilmalónica mRNA-3705 de la empresa de biotecnología Moderna , que se encuentra actualmente en la fase 1/2. [57]
Cabe mencionar aquí el terapéutico de pequeño peso molecular en investigación HST5040 de HemoShear Therapeutics para la aciduria metilmalónica y la aciduria propiónica, que actualmente se encuentra en la fase 2. [58] [59] Tomado diariamente por vía oral o por sonda gástrica, está diseñado para prevenir la acumulación tóxica de propionil-CoA y metilmalonil-CoA o sus derivados al desviar la CoA de la vía del propionil-CoA, lo que conduce a una normal o casi normal niveles de estos metabolitos y potencialmente mejorar el estado metabólico y las vías de producción de energía. [60] [59]
Otra pequeña molécula terapéutica en desarrollo es BBP-671 de BridgeBio Pharma para la neurodegeneración asociada a pantotenato quinasa (PKAN), acidemia propiónica y metilmalónica, que se encuentra actualmente en la fase 1. [61] Al activar alostéricamente las pantotenato quinasas , se espera que BBP-671 aumentar la producción de CoA a partir de vitamina B 5 y así normalizar los procesos metabólicos. [62]
Aunque no existen distintas etapas de la enfermedad, la acidemia metilmalónica es una afección progresiva; Los síntomas de este trastorno se agravan a medida que aumenta la concentración de ácido metilmalónico. Si las proteínas y grasas desencadenantes no se eliminan de la dieta, esta acumulación puede provocar daños irreparables en los riñones o el hígado y, finalmente, la muerte. [10]
El pronóstico variará según la gravedad de la afección y la respuesta del individuo al tratamiento. El pronóstico suele ser mejor para quienes tienen variantes que responden a la cobalamina y no es prometedor para quienes padecen variantes que no responden a la cobalamina. [40] Las variantes más leves tienen una mayor frecuencia de aparición en la población que las más graves. [12] Incluso con modificaciones en la dieta y atención médica continua, puede que no sea posible prevenir el daño neurológico en personas con acidemia que no responde. [40] Sin el tratamiento o diagnóstico adecuado, no es raro que el primer ataque acidémico sea fatal. [10]
A pesar de estos desafíos, desde que se identificó por primera vez en 1967, el tratamiento y la comprensión de la afección han mejorado hasta el punto de que no es extraño que incluso aquellas personas con formas que no responden a la acidemia metilmalónica puedan llegar a la edad adulta e incluso tener y dar a luz. sin peligro. [54]
La primera acidemia metilmalónica fue caracterizada por Oberholzer et al. en 1967. [63] [54]
Hace tiempo que se informa que el ácido metilmalónico puede tener efectos desastrosos en el sistema nervioso; sin embargo, nunca se ha determinado el mecanismo por el cual esto ocurre. Publicada en 2015, una investigación realizada sobre los efectos del ácido metilmalónico en neuronas aisladas de fetos de ratas en un entorno in vitro utilizando un grupo de control de neuronas tratadas con un ácido alternativo de pH similar . [64] Estas pruebas han sugerido que el ácido metilmalónico provoca disminuciones en el tamaño celular y un aumento en la tasa de apoptosis celular de una manera dependiente de la concentración, observándose efectos más extremos en concentraciones más altas. [64] Además, el análisis de micromatrices de estas neuronas tratadas también ha sugerido que, a nivel epigenético , el ácido metilmalónico altera la tasa de transcripción de 564 genes, incluidos los implicados en las vías de señalización de apoptosis, p53 y MAPK . [64]
Como la conversión de metilmalonil-CoA en succinil-CoA tiene lugar dentro de las mitocondrias , durante mucho tiempo se ha sospechado que la disfunción mitocondrial como resultado de la función disminuida de la cadena de transporte de electrones es una característica de las acidemias metilmalónicas. Reciente [ ¿cuándo? ] La investigación ha descubierto que en modelos de ratas, las mitocondrias de ratas afectadas por el trastorno crecen hasta alcanzar un tamaño inusual, denominado megamitocondria . Estas megamitocondrias también parecen tener estructuras internas deformadas y una pérdida de riqueza de electrones en su matriz . Estas megamitocondrias también mostraron signos de disminución de la función de la cadena respiratoria, particularmente en el complejo respiratorio IV, que solo funcionó con aproximadamente un 50% de eficiencia. Se identificaron cambios similares en las mitocondrias de una muestra de hígado extraída durante un trasplante de un niño de 5 años que padecía acidemia metilmalónica de tipo mut. [sesenta y cinco]
Los estudios de casos en varios pacientes que presentan acidemia metilmalónica mut0 que no responde con una mutación específica denominada p.P86L han sugerido la posibilidad de que exista una mayor subdivisión en la acidemia metilmalónica de tipo mut. [66] Aunque actualmente no está claro si esto se debe a la mutación específica o a la detección y el tratamiento tempranos, a pesar de la falta total de respuesta a los suplementos de cobalamina, estos individuos parecieron desarrollar una versión en gran medida benigna y casi completamente asintomática de la acidemia metilmalónica. [66] A pesar de mostrar constantemente niveles elevados de ácido metilmalónico en la sangre y la orina, estos individuos parecían en su mayor parte desde el punto de vista del desarrollo normal. [66]