La iminoglicinuria es un trastorno autosómico recesivo [4] del transporte tubular renal que afecta la reabsorción del aminoácido glicina y los iminoácidos prolina e hidroxiprolina . [4] [5] Esto da como resultado una excreción urinaria excesiva de los tres ácidos ( -uria denota "en la orina"). [6]
La iminoglicinuria es un trastorno raro y complejo, asociado con una serie de mutaciones genéticas que causan defectos en los sistemas de transporte renal e intestinal de glicina e iminoácidos. [4] [7] [8] [9]
Los iminoácidos suelen contener un grupo funcional imina , en lugar del grupo amino que se encuentra en los aminoácidos. La prolina se considera y suele denominarse aminoácido, [10] [11] pero, a diferencia de otros, tiene una amina secundaria. Esta característica, exclusiva de la prolina, la identifica también como un iminoácido. [12] [13] La hidroxiprolina es otro iminoácido, elaborado a partir de la hidroxilación natural de la prolina. [12]
La característica principal de la iminoglicinuria es la presencia de glicina e iminoácidos en la orina. Por lo demás, se cree que es un trastorno relativamente benigno, [6] [14] aunque los síntomas asociados a alteraciones del metabolismo de la prolina y la glicina causados por malabsorción pueden estar presentes con la iminoglicinuria. [4] [15] Estos incluyen encefalopatía , retraso mental , [2] sordera , [3] ceguera , [16] cálculos renales , [17] hipertensión [18] y atrofia girada . [19]
La atrofia girada es un trastorno degenerativo hereditario de la retina y la coroides , [20] que a veces acompaña a la condición metabólica hiperornitinemia . [19] [21] La presencia de atrofia girada con iminoglicinuria se debe a una deficiencia de prolina en los tejidos coriorretinianos , mientras que los procesos detrás de la hiperornitinemia interrumpen la vía metabólica de la ornitina a la prolina, lo que altera el catabolismo de la ornitina y también da como resultado niveles reducidos de prolina. Por lo tanto, la atrofia girada se puede encontrar con cualquiera de los trastornos, con la deficiencia de prolina como característica subyacente. [19] [22]
La hiperglicinuria es otro trastorno que afecta la reabsorción de glicina e iminosácidos, similar a la iminoglicinuria y considerada una forma heterocigótica . [3] [4] Cuando se acompaña de un tipo específico de cálculo renal (nefrolitiasis), a veces se la denomina "iminoglicinuria, tipo II". [15] [23] [24]

Se cree que la iminoglicinuria se hereda de manera autosómica recesiva. [4] Esto significa que un gen defectuoso responsable del trastorno se encuentra en un autosoma y la herencia requiere dos copias del gen defectuoso, una de cada progenitor. Los padres de una persona con un trastorno autosómico recesivo son portadores de una copia del gen defectuoso, pero por lo general no experimentan ningún signo o síntoma del trastorno. [ cita requerida ]
Una causa no hereditaria de excreción urinaria excesiva de prolina y glicina, similar a la encontrada en la iminoglicinuria, es bastante común en los recién nacidos menores de seis meses. A veces denominada iminoglicinuria neonatal, se debe al subdesarrollo de mecanismos de transporte de alta afinidad dentro del circuito renal, específicamente PAT2, SIT1 y SLC6A18. La afección se corrige por sí sola con la edad. [4] [25] Sin embargo, en los casos en que esto persiste más allá de la infancia, puede sospecharse hiperglicinuria hereditaria o iminoglicinuria. [4]
La glicina, la prolina y la hidroxiprolina comparten mecanismos comunes de reabsorción tubular renal , [7] una función específica del túbulo proximal . [4] [5] Tanto la reabsorción como la absorción de glicina e iminoácidos tienen lugar respectivamente en el túbulo proximal o en el epitelio del borde en cepillo intestinal . El transporte más selectivo de prolina y otros iminoácidos es impulsado a nivel molecular por un mecanismo de transporte celular de mamíferos acertadamente conocido como sistema IMINO. [5] [26] [27]
Si bien no se ha establecido ninguna mutación genética como causa de la iminoglicinuria, se sabe que varias mutaciones que afectan los mecanismos de transporte compartidos por la glicina, la prolina y la hidroxiprolina, así como los que transportan selectivamente glicina o iminosácidos, incluido el sistema IMINO, están asociadas con el trastorno. [4] Cuando se combinan, estos factores darán como resultado un fenotipo variable para la iminoglicinuria según las mutaciones presentes. [4] Sin embargo, a pesar del papel que puede desempeñar la malabsorción intestinal de glicina e iminosácidos en la iminoglicinuria, el defecto primario altera su transporte y reabsorción renal. [4] [14] Esto es evidente, ya que la iminoglicinuria hereditaria puede estar clínicamente presente sin afectación intestinal. [16]
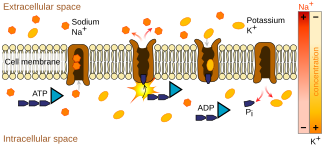
En los mamíferos, incluidos los humanos , el transporte de aminoácidos e iminoácidos desde el lumen (interior) del intestino o el túbulo proximal renal hacia las células ocurre en la membrana del borde en cepillo del epitelio (revestimiento celular húmedo y compacto de muchos tejidos y órganos del cuerpo). Aquí, los cotransportadores como el sodio o el cloruro (parte del sistema de cotransportadores Na-K-Cl ) se acoplan con los aminoácidos o iminoácidos a nivel molecular y los transportan a través de proteínas integrales de membrana específicas que forman canales iónicos , que se encuentran dentro de la membrana celular . [27] [28] Desde las células, los aminoácidos e iminoácidos absorbidos o reabsorbidos finalmente llegan a la sangre. La absorción se refiere al proceso general que ocurre en el intestino en lugar de la descomposición digestiva normal de las proteínas, mientras que la reabsorción se refiere al proceso que ocurre en el túbulo proximal renal para recuperar los aminoácidos e iminoácidos que se han filtrado de la sangre a través del glomérulo . [ cita requerida ]
Estas formas de transporte requieren energía, ya que los productos transportados suelen moverse en contra de un gradiente de concentración más alto . Este proceso, llamado transporte activo , obtiene su energía del ATP y otros sistemas de cotransporte relacionados con el ATP que producen energía, como la bomba de sodio-potasio . [ cita requerida ]
El defecto primario asociado con la iminoglicinuria es una mutación homocigótica (recesiva) del gen SLC36A2 (PAT2). [4] PAT2, una de las diversas proteínas de transporte de membrana de la familia de transportadores de aminoácidos, es el transportador renal de alta afinidad de glicina, prolina e hidroxiprolina que se ha encontrado defectuoso en ambos alelos cuando hay iminoglicinuria en un individuo. Esto contrasta con el hecho de que cuando solo un alelo PAT2 es defectuoso, habrá hiperglicinuria en lugar de iminoglicinuria. Estos hallazgos delinean a la iminoglicinuria como la forma homocigótica de hiperglicinuria, donde la primera tiene un mayor grado de excreción urinaria de glicina e iminoácidos que se correlaciona con mutaciones en ambos alelos. [4] [7]
Otra mutación que se sospecha que transmite el fenotipo de iminoglicinuria se puede encontrar en el gen SLC36A1 (PAT1). [29] [30] Identificado como el transportador intestinal de baja afinidad de glicina e iminoácidos, PAT1 trabaja en cooperación con el intercambiador renal de sodio-hidrógeno NHE3 ( SLC9A3 ). [30] Como la absorción y reabsorción de glicina, prolina e hidroxiprolina también se produce a través de PAT1, se cree que desempeña otro papel en la expresión del fenotipo de iminoglicinuria malabsortiva. Sin embargo, informes recientes sugieren un papel más reducido de PAT1 en algunos casos del trastorno. [4] [5] [30] [31]
Aunque se ha señalado firmemente que PAT2 es el principal mutágeno responsable de la iminoglicinuria, se ha descubierto que la variabilidad del fenotipo está determinada por tres mutaciones genéticas modificadoras, de las cuales se cree que la principal es el sistema IMINO. [4]
Definido como el transportador de prolina dependiente de sodio no inhibido por alanina , el sistema IMINO, que se cree que está formado por el gen SLC6A20 (SIT1), es un mecanismo de transporte crucial en los mamíferos responsable tanto de la reabsorción renal como de la absorción intestinal de prolina y otros iminoácidos, como la hidroxiprolina y el pipecolato. [26] [27] La secuencia de ARNm para SIT1 se expresa en gran parte del tracto gastrointestinal , incluido el estómago , el duodeno , el yeyuno , el íleon , el ciego y el colon . También se encuentra en el riñón , la coroides óptica y partes del sistema nervioso central como el cerebro y las células microgliales . [26]
La penetrancia reducida es un fenómeno en el que un rasgo genético totalmente heredado, como una enfermedad o trastorno, no exhibe el fenotipo esperado. Esto se ha informado en algunos casos de iminoglicinuria. [4] En este caso, se cree que el sistema IMINO desempeña un papel en la penetrancia reducida de la iminoglicinuria al compensar la malabsorción de iminoácidos relacionada específicamente con mutaciones de PAT2. [4] Por el contrario, se cree que las mutaciones de SIT1 dan lugar a la expresión completa de iminoglicinuria en algunos casos en los que las mutaciones heterocigotas de PAT2 solo habrían sido suficientes para causar hiperglicinuria. [4]
Se cree que otros dos sistemas de transporte desempeñan funciones posteriores en la iminoglicinuria, cuando hay mutaciones en ellos. El transportador de aminoácidos neutros SLC6A19 (que afecta a la glicina , la prolina y otros aminoácidos neutros como la cisteína y el triptófano ), asociado con la enfermedad de Hartnup , desempeña una función en la iminoglicinuria como modificador de las mutaciones de PAT2 y también se ve afectado directamente por las acciones de SIT1. [4] [32] El transportador específico de glicina, SLC6A18 , también tiene un efecto en el fenotipo de la iminoglicinuria, ya sea combinando o compensando las fallas del transporte de glicina. [4]
En resumen, la iminoglicinuria se expresa principalmente por mutaciones homocigotas del transportador renal PAT2, mientras que el fenotipo general de la iminoglicinuria puede modificarse por la actividad normal o defectuosa de SIT1 (IMINO), SLC6A19 y SLC6A18 . [4]