Henry Cavendish FRS ( / ˈkævəndɪʃ / KAV -ən-dish ; 10 de octubre de 1731 - 24 de febrero de 1810) fue un filósofo natural y científico inglés, un importante químico y físico experimental y teórico . Es conocido por su descubrimiento del hidrógeno , al que denominó «aire inflamable». [1] Describió la densidad del aire inflamable, que formaba agua en la combustión, en un artículo de 1766, On Factitious Airs . Antoine Lavoisier más tarde reprodujo el experimento de Cavendish y le dio al elemento su nombre.
Cavendish, un hombre tímido, se distinguió por su gran exactitud y precisión en sus investigaciones sobre la composición del aire atmosférico , las propiedades de los diferentes gases, la síntesis del agua, la ley que rige la atracción y repulsión eléctricas , una teoría mecánica del calor y los cálculos de la densidad (y, por lo tanto, la masa ) de la Tierra . Su experimento para medir la densidad de la Tierra (que, a su vez, permite calcular la constante gravitacional ) ha llegado a conocerse como el experimento de Cavendish .
Henry Cavendish nació el 10 de octubre de 1731 en Niza , donde su familia vivía en ese momento. [2] Su madre era Lady Anne de Grey, cuarta hija de Henry Grey, primer duque de Kent , y su padre era Lord Charles Cavendish , el tercer hijo de William Cavendish, segundo duque de Devonshire . [2] La familia trazó su linaje a lo largo de ocho siglos hasta la época normanda , y estaba estrechamente relacionada con muchas familias aristocráticas de Gran Bretaña. La madre de Henry murió en 1733, tres meses después del nacimiento de su segundo hijo, Frederick, y poco antes del segundo cumpleaños de Henry, dejando a Lord Charles Cavendish para criar a sus dos hijos. Henry Cavendish fue llamado como "El Honorable Henry Cavendish". [3]
Desde los 11 años, Henry asistió a la Newcome's School , una escuela privada cerca de Londres. A los 18 años (el 24 de noviembre de 1748) ingresó en la Universidad de Cambridge en St Peter's College, ahora conocida como Peterhouse , pero abandonó la institución tres años después, el 23 de febrero de 1751, sin obtener un título (en ese momento, una práctica común). [4] [5] Luego vivió con su padre en Londres, donde pronto tuvo su propio laboratorio con cuarto para perros.
Lord Charles Cavendish dedicó su vida primero a la política y luego, cada vez más, a la ciencia, especialmente en la Royal Society de Londres. En 1758, llevó a Henry a las reuniones de la Royal Society y también a las cenas del Royal Society Club. En 1760, Henry Cavendish fue elegido miembro de ambos grupos, y a partir de entonces fue asiduo en su asistencia. [2] Prácticamente no participó en la política, pero siguió a su padre en la ciencia, a través de sus investigaciones y su participación en organizaciones científicas. Fue activo en el Consejo de la Royal Society de Londres (al que fue elegido en 1765).
Su interés y experiencia en el uso de instrumentos científicos lo llevaron a encabezar un comité para revisar los instrumentos meteorológicos de la Royal Society y ayudar a evaluar los instrumentos del Royal Greenwich Observatory . Su primer artículo, Factitious Airs , apareció en 1766. Otros comités en los que sirvió incluyeron el comité de artículos, que eligió los artículos para su publicación en Philosophical Transactions of the Royal Society , y los comités para el tránsito de Venus (1769), para la atracción gravitatoria de las montañas (1774), y para las instrucciones científicas para la expedición de Constantine Phipps (1773) en busca del Polo Norte y el Paso del Noroeste . En 1773, Henry se unió a su padre como fideicomisario electo del Museo Británico , al que dedicó una gran cantidad de tiempo y esfuerzo. Poco después de que se estableciera la Royal Institution of Great Britain, Cavendish se convirtió en gerente (1800) y mostró un interés activo, especialmente en el laboratorio, donde observó y ayudó en los experimentos químicos de Humphry Davy .
En la época de la muerte de su padre, Cavendish comenzó a trabajar estrechamente con Charles Blagden , una asociación que ayudó a Blagden a entrar de lleno en la sociedad científica de Londres. A cambio, Blagden ayudó a mantener al mundo a distancia de Cavendish. Cavendish no publicó libros y pocos artículos, pero logró mucho. Varias áreas de investigación, incluyendo la mecánica , la óptica y el magnetismo , aparecen ampliamente en sus manuscritos, pero apenas aparecen en su obra publicada. Cavendish es considerado uno de los llamados químicos neumáticos de los siglos XVIII y XIX, junto con, por ejemplo, Joseph Priestley , Joseph Black y Daniel Rutherford . Cavendish descubrió que un gas definido, peculiar y altamente inflamable, al que se refirió como "aire inflamable", se producía por la acción de ciertos ácidos sobre ciertos metales . Este gas era hidrógeno , que Cavendish adivinó correctamente que estaba proporcionado dos a uno en agua. [6]
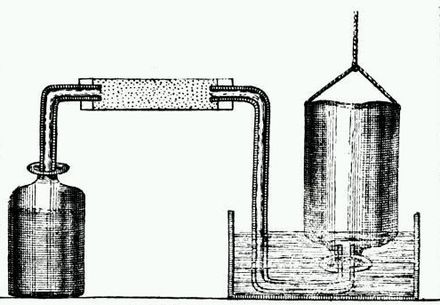
Aunque otros, como Robert Boyle , habían preparado gas hidrógeno antes, a Cavendish se le suele dar el crédito por reconocer su naturaleza elemental. En 1777, Cavendish descubrió que el aire exhalado por los mamíferos se convierte en "aire fijo" ( dióxido de carbono ), no en "aire flogístico" como predijo Joseph Priestley. [7] Además, al disolver álcalis en ácidos, Cavendish produjo dióxido de carbono, que recogió, junto con otros gases, en botellas invertidas sobre agua o mercurio . Luego midió su solubilidad en agua y su gravedad específica , y anotó su combustibilidad . Concluyó en su artículo de 1778 "Consideraciones generales sobre los ácidos" que el aire respirable constituye acidez. [7] Cavendish recibió la Medalla Copley de la Royal Society por este artículo. La química de los gases adquirió creciente importancia en la segunda mitad del siglo XVIII y resultó crucial para la reforma de la química del francés Antoine-Laurent Lavoisier , conocida generalmente como la revolución química .
En 1783, Cavendish publicó un artículo sobre eudiometría (la medición de la bondad de los gases para la respiración). Describió un nuevo eudiómetro de su invención, con el que logró los mejores resultados hasta la fecha, utilizando lo que en otras manos había sido el método inexacto de medir los gases pesándolos. Luego, después de una repetición de un experimento de 1781 realizado por Priestley, Cavendish publicó un artículo sobre la producción de agua pura quemando hidrógeno en " aire desflogistizado " (aire en proceso de combustión, ahora conocido como oxígeno ). [7] [8] [9] Cavendish concluyó que, en lugar de sintetizarse, la quema de hidrógeno hacía que el agua se condensara del aire. Algunos físicos interpretaron el hidrógeno como flogisto puro . Cavendish informó de sus hallazgos a Priestley a más tardar en marzo de 1783, pero no los publicó hasta el año siguiente. El inventor escocés James Watt publicó un artículo sobre la composición del agua en 1783; se produjo una controversia sobre quién hizo el descubrimiento primero. [7]
En 1785, Cavendish investigó la composición del aire común (es decir, atmosférico) y obtuvo resultados impresionantemente precisos. Realizó experimentos en los que combinó hidrógeno y aire ordinario en proporciones conocidas y luego los hizo explotar con una chispa de electricidad. Además, también describió un experimento en el que pudo eliminar, en terminología moderna, tanto los gases de oxígeno como de nitrógeno de una muestra de aire atmosférico hasta que solo quedó una pequeña burbuja de gas sin reaccionar en la muestra original. Utilizando sus observaciones, Cavendish observó que, cuando había determinado las cantidades de aire flogístico ( nitrógeno ) y aire desflogistizado (oxígeno), quedaba un volumen de gas equivalente a 1/120 del volumen original de nitrógeno. [10] [11] Mediante mediciones cuidadosas, llegó a la conclusión de que "el aire común consta de una parte de aire desflogistizado [oxígeno], mezclado con cuatro de [nitrógeno] flogístico". [12] [13]
En la década de 1890 (unos 100 años después), dos físicos británicos, William Ramsay y Lord Rayleigh , se dieron cuenta de que el gas inerte que habían descubierto recientemente , el argón , era el responsable del residuo problemático de Cavendish; no había cometido ningún error. Lo que había hecho era realizar experimentos cuantitativos rigurosos, utilizando instrumentos y métodos estandarizados, destinados a obtener resultados reproducibles; tomó la media del resultado de varios experimentos; e identificó y tuvo en cuenta las fuentes de error. La balanza que utilizó, fabricada por un artesano llamado Harrison, fue la primera de las balanzas de precisión del siglo XVIII, y tan precisa como la de Lavoisier (que se ha estimado que mide una parte en 400.000). Cavendish trabajó con sus fabricantes de instrumentos, generalmente mejorando los instrumentos existentes en lugar de inventar otros completamente nuevos.
Como se indicó anteriormente, Cavendish utilizó el lenguaje de la antigua teoría del flogisto en química. En 1787, se convirtió en uno de los primeros fuera de Francia en adoptar la nueva teoría antiflogista de Lavoisier, aunque se mantuvo escéptico sobre la nomenclatura de la nueva teoría. [ cita requerida ] También se opuso a la identificación de Lavoisier del calor como algo que tenía una base material o elemental. Trabajando dentro del marco del mecanismo newtoniano, Cavendish había abordado el problema de la naturaleza del calor en la década de 1760, explicando el calor como el resultado del movimiento de la materia.
En 1783 publicó un artículo sobre la temperatura a la que se congela el mercurio y en ese artículo hizo uso de la idea del calor latente , aunque no utilizó el término porque creía que implicaba la aceptación de una teoría material del calor. Hizo explícitas sus objeciones en su artículo de 1784 sobre el aire. Luego desarrolló una teoría general del calor, y el manuscrito de esa teoría ha sido fechado de manera convincente a fines de la década de 1780. Su teoría era a la vez matemática y mecánica: contenía el principio de conservación del calor (más tarde entendido como un ejemplo de conservación de la energía ) e incluso incluía el concepto (aunque no la etiqueta) del equivalente mecánico del calor .
Tras la muerte de su padre, Henry compró otra casa en la ciudad y también una casa en Clapham Common (construida por Thomas Cubitt ), en ese momento al suroeste de Londres. [14] La casa de Londres contenía la mayor parte de su biblioteca, mientras que guardaba la mayoría de sus instrumentos en Clapham Common, donde llevó a cabo la mayoría de sus experimentos. El más famoso de esos experimentos, publicado en 1798, fue para determinar la densidad de la Tierra y se conoció como el experimento de Cavendish . El aparato que Cavendish utilizó para pesar la Tierra era una modificación de la balanza de torsión construida por el geólogo John Michell , quien murió antes de poder comenzar el experimento. El aparato fue enviado en cajas a Cavendish, quien completó el experimento en 1797-1798 [15] y publicó los resultados. [16]
El aparato experimental consistía en una balanza de torsión con un par de esferas de plomo de 2 pulgadas y 1,61 libras suspendidas del brazo de una balanza de torsión y dos bolas de plomo estacionarias mucho más grandes (350 libras). Cavendish pretendía medir la fuerza de atracción gravitatoria entre las dos. [15] Se dio cuenta de que el aparato de Michell sería sensible a las diferencias de temperatura y a las corrientes de aire inducidas, por lo que realizó modificaciones aislando el aparato en una habitación separada con controles externos y telescopios para realizar observaciones. [17]
Utilizando este equipo, Cavendish calculó la atracción entre las bolas a partir del período de oscilación de la balanza de torsión, y luego utilizó este valor para calcular la densidad de la Tierra. Cavendish descubrió que la densidad media de la Tierra es 5,48 veces mayor que la del agua. John Henry Poynting señaló más tarde que los datos deberían haber llevado a un valor de 5,448, [18] y, de hecho, ese es el valor medio de las veintinueve determinaciones que Cavendish incluyó en su artículo. [19] El error en el número publicado se debió a un simple error aritmético de su parte. [20] Lo extraordinario del experimento de Cavendish fue la eliminación de toda fuente de error y de todo factor que pudiera perturbar el experimento, y su precisión al medir una atracción sorprendentemente pequeña, un mero 1/50.000.000 del peso de las bolas de plomo. El resultado que Cavendish obtuvo para la densidad de la Tierra está dentro del 1 por ciento de la cifra actualmente aceptada.
El trabajo de Cavendish llevó a otros a obtener valores precisos para la constante gravitacional ( G ) y la masa de la Tierra. Con base en sus resultados, se puede calcular un valor para G de 6,754 × 10 −11 N-m 2 /kg 2 , [21] que se compara favorablemente con el valor moderno de 6,67428 × 10 −11 N-m 2 /kg 2 . [22]
Los libros suelen describir el trabajo de Cavendish como una medida de G o de la masa de la Tierra. Dado que estas están relacionadas con la densidad de la Tierra mediante una red trivial de relaciones algebraicas, ninguna de estas fuentes es errónea, pero no coinciden con la elección exacta de palabras de Cavendish, [23] [24] y este error ha sido señalado por varios autores. [25] [26] El objetivo declarado de Cavendish era medir la densidad de la Tierra.
La primera vez que la constante recibió este nombre fue en 1873, casi 100 años después del experimento de Cavendish. [27] Los resultados de Cavendish también dan la masa de la Tierra .
Los experimentos eléctricos y químicos de Cavendish, como los relacionados con el calor, habían comenzado mientras vivía con su padre en un laboratorio en su casa de Londres. Lord Charles Cavendish murió en 1783, dejando casi todo su sustancioso patrimonio a Henry. Al igual que su teoría del calor, la teoría integral de Cavendish sobre la electricidad tenía una forma matemática y se basaba en experimentos cuantitativos precisos. Trabajando con su colega, Timothy Lane , creó un pez torpedo artificial que podía dispensar descargas eléctricas para demostrar que la fuente de descarga de estos peces era la electricidad. [28] Publicó una versión temprana de su teoría de la electricidad en 1771, basada en un fluido eléctrico expansivo que ejercía presión. Demostró que si la intensidad de la fuerza eléctrica fuera inversamente proporcional a la distancia, entonces el fluido eléctrico más del necesario para la neutralidad eléctrica se encontraría en la superficie exterior de una esfera electrificada; luego lo confirmó experimentalmente. Cavendish continuó trabajando en electricidad después de este artículo inicial, pero no publicó más sobre el tema.
Cavendish escribió artículos sobre temas eléctricos para la Royal Society [29] [30] pero la mayor parte de sus experimentos eléctricos no se dieron a conocer hasta que fueron recopilados y publicados por James Clerk Maxwell un siglo después, en 1879, mucho después de que otros científicos hubieran obtenido el crédito por los mismos resultados. Los artículos eléctricos de Cavendish de las Philosophical Transactions of the Royal Society of London han sido reimpresos, junto con la mayoría de sus manuscritos eléctricos, en The Scientific Papers of the Honourable Henry Cavendish, FRS (1921). Según la edición de 1911 de la Encyclopædia Britannica , entre los descubrimientos de Cavendish estaban el concepto de potencial eléctrico (al que llamó el "grado de electrificación"), una unidad temprana de capacitancia (la de una esfera de una pulgada de diámetro), la fórmula para la capacitancia de un capacitor de placas , [31] el concepto de la constante dieléctrica de un material, la relación entre el potencial eléctrico y la corriente (ahora llamada ley de Ohm ) (1781), leyes para la división de la corriente en circuitos paralelos (ahora atribuidas a Charles Wheatstone ), y la ley del cuadrado inverso de la variación de la fuerza eléctrica con la distancia, ahora llamada ley de Coulomb . [32]
Cavendish murió en Clapham el 24 de febrero de 1810 [2] (como uno de los hombres más ricos de Gran Bretaña) y fue enterrado, junto con muchos de sus antepasados, en la iglesia que ahora es la catedral de Derby . La calle en la que solía vivir en Derby lleva su nombre, al igual que una calle cerca de su casa en Clapham, cuya parte norte es parte de la South Circular Road . El Laboratorio Cavendish de la Universidad de Cambridge fue financiado por uno de los parientes posteriores de Cavendish, William Cavendish, séptimo duque de Devonshire (canciller de la universidad de 1861 a 1891).
Cavendish heredó dos fortunas tan grandes que Jean Baptiste Biot lo llamó "el más rico de todos los sabios y el más erudito de los ricos". A su muerte, Cavendish era el mayor depositante del Banco de Inglaterra . Era un hombre tímido que se sentía incómodo en sociedad y la evitaba cuando podía. Podía hablar con una sola persona a la vez, y solo si la persona era conocida por él y era hombre. [33] Conversaba poco, siempre vestía un traje anticuado y no desarrolló vínculos personales profundos conocidos fuera de su familia. Cavendish era taciturno y solitario y muchos lo consideraban excéntrico. Se comunicaba con sus sirvientas solo por notas. Según un relato, Cavendish hizo agregar una escalera trasera a su casa para evitar encontrarse con su ama de llaves, porque era especialmente tímido con las mujeres. Los relatos contemporáneos de su personalidad han llevado a algunos comentaristas modernos, como Oliver Sacks , a especular que era autista . [34]
Su único medio de comunicación social era el Royal Society Club, cuyos miembros cenaban juntos antes de las reuniones semanales. Cavendish rara vez faltaba a estas reuniones y era profundamente respetado por sus contemporáneos. Sin embargo, su timidez dificultaba la conversación; se aconsejaba a los invitados que se acercaran a él y luego hablaran como si "se tratara de algo que no tenía sentido. Si sus comentarios eran científicamente valiosos, podrían recibir una respuesta murmurada". Cavendish era más propenso a no responder en absoluto. [15] Las opiniones religiosas de Cavendish también se consideraban excéntricas para su época. Se le consideraba agnóstico . Como comenta su biógrafo, George Wilson, "en cuanto a la religión de Cavendish, no era nada en absoluto". [35] [36]
La disposición de su residencia reservaba sólo una fracción del espacio para la comodidad personal, ya que su biblioteca estaba separada, las habitaciones superiores y el césped eran para la observación astronómica y su salón era un laboratorio con una forja en una habitación contigua. [37] También disfrutaba coleccionando muebles finos, ejemplificado por su compra de un juego de "diez sillas de madera satinada con incrustaciones con un sofá con patas cabriolé a juego ". [38]
Debido a su comportamiento asocial y reservado, Cavendish a menudo evitaba publicar su trabajo, y muchos de sus hallazgos no fueron comunicados ni siquiera a sus colegas científicos. A fines del siglo XIX, mucho después de su muerte, James Clerk Maxwell revisó los documentos de Cavendish y encontró observaciones y resultados por los cuales otros habían recibido crédito. Ejemplos de lo que se incluyó en los descubrimientos o anticipaciones de Cavendish fueron la ley de proporciones recíprocas de Richter , la ley de Ohm , la ley de presiones parciales de Dalton , los principios de conductividad eléctrica (incluida la ley de Coulomb ) y la ley de Charles de los gases. Un manuscrito "Heat", fechado tentativamente entre 1783 y 1790, describe una "teoría mecánica del calor". Hasta ahora desconocido, el manuscrito fue analizado a principios del siglo XXI. El historiador de la ciencia Russell McCormmach propuso que "Heat" es la única obra del siglo XVIII que prefigura la termodinámica . El físico teórico Dietrich Belitz concluyó que en este trabajo Cavendish "captó de forma esencialmente correcta la naturaleza del calor". [39]
Mientras Cavendish realizaba su famoso experimento sobre la densidad de la Tierra en un edificio anexo en el jardín de su finca de Clapham Common, sus vecinos señalaban el edificio y les decían a sus hijos que era allí donde se pesaba la tierra. [38] En honor a los logros de Henry Cavendish y debido a una donación otorgada por el pariente de Henry, William Cavendish, séptimo duque de Devonshire, el laboratorio de física de la Universidad de Cambridge fue nombrado Laboratorio Cavendish por Maxwell, el primer profesor de Física Cavendish y admirador del trabajo de Cavendish.
La cifra que da para la gravedad específica de la Tierra es 5,48, siendo el agua 1, pero de hecho la media de los 29 resultados que registra es 5,448
No asistía a la iglesia y se lo consideraba agnóstico. "En cuanto a la religión de Cavendish, no era nada en absoluto", escribe su biógrafo, el Dr. G. Wilson.
Un miembro de la Royal Society, que tenía buenos medios para juzgar, afirma que "en cuanto a la religión de Cavendish, no era nada en absoluto. Los únicos temas en los que parecía interesarse eran los científicos...". ...De lo que se ha dicho, parecerá que sería vano afirmar que sabemos con alguna certeza qué doctrina sostenía Cavendish sobre las cosas espirituales; pero podemos afirmar con cierta confianza que el Mundo Venidero no absorbió sus pensamientos; que no dio ninguna demostración externa de interés en la religión y no se unió a sus semejantes en la adoración a Dios. ...Murió y no dio señales, rechazando la compasión humana y sin dejarnos medios para determinar si esperaba la aniquilación o esperaba una vida eterna. ... No amó, no odió, no tuvo esperanza, no temió, no adoró como lo hacen los demás. Se separó de sus semejantes y, aparentemente, de Dios.