Xilosa isomerasa
En enzimología, se denomina xilosa isomerasa a una enzima que cataliza la interconversión de D-xilosa y D-xilulosa.
Esta enzima pertenece a la familia de las isomerasas, específicamente las oxidoreductasas intramoleculares que toman parte en la transformación entre aldosas y cetosas.
[9] Marshall obtuvo una patente para la conversión de glucosa a fructosa por la xilosa isomerasa, pero fue invalidada y al final abandonó este campo de investigación por no poder desarrollar un proceso comercialmente viable adecuado a escalas industriales.
Los organismos que no poseen esta enzima, como las levaduras, precisan de dos reacciones distintas para realizar la misma conversión, catalizadas por la xilosa reductasa y xilitol dehidrogenasa respectivamente.
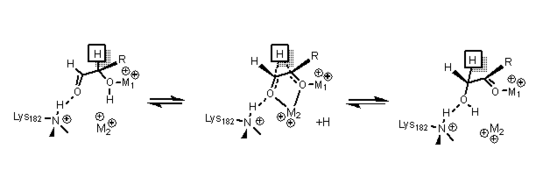
[17] La xilosa isomerasa precisa de un catión divalente para su funcionamiento, generalmente magnesio, manganeso o cobalto, según la especie.
[18][19] Presenta una gran estabilidad térmica y la temperatura óptima abarca un rango amplio, desde los 45 °C en Lactobacillus brevis hasta los 90 °C en Actinoplanes missouriensis.
[25] A pesar de las diferencias entre las enzimas de especies diferentes, los aminoácidos que forman enlaces con el sustrato y conforman el centro activo son similares en todas ellas, con la secuencia fenilalanina-histidina-ácido aspártico-X-ácido aspártico-X-X-prolina-X-glicina en común.
[5][26] La estructura de la xilosa isomerasa se basa en el motivo conocido como barril TIM en el que ocho hélices alfa y ocho láminas beta se entrelazan alrededor de una cavidad central.
En el exterior del barril se extiende un bucle secundario que rodea y enlaza una molécula vecina, formando un dímero.
[4] A un lado de la cavidad formada por el barril se disponen los dos metales covalentes en una geometría octaédrica.
La xilosa isomerasa se inmoviliza mediante adsorción a un gel o material similares para poder reutilizarla.