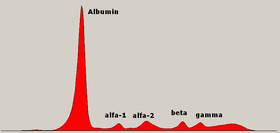
Electroforesis proteica
Cuanto mayor es la fuerza iónica, más estrechas son las bandas de separación.
A mayor carga y menor tamaño, más velocidad de migración.
Cada proteína migrará hasta alcanzar su pI, punto en el cual precipitará al acumularse (de ahí el nombre, isoelectroenfoque).
También se suelen utilizar acoplados a zimogramas si deseamos determinar el pI de una enzima o en electroforesis bidimensional como primera dimensión.
Hay diferentes protocolos en función de lo que se quiere estudiar: fijación por calor o química y tinción en caso de estudios no específicos (proteinograma y electroforesis Hb, por ejemplo) o fijación mediante anticuerpos previa a la tinción en caso de estudiar proteínas específicas (inmunofijación).
Este tipo de análisis electroforético tiene aplicaciones en investigación y en clínica, tanto humana como animal.
En el proteinograma realizado por electroforesis capilar se definen las siguientes bandas: Es una banda difusa, por delante de la albúmina,[2] poco visible y que está constituida por dos proteínas con un gran interés para la valoración nutricional como son la prealbúmina y la proteína fijadora del retinol.
[4] Su interés se centra en las hepatopatías (cirrosis) y nefropatías (síndrome nefrótico), donde está disminuida.
En esta banda pueden aparecer otras extras correspondientes a la hemoglobina de los sueros hemolizados, el fibrinógeno[12] (cuando el proteinograma se realiza con plasma) y las gammapatías monoclonales, sobre todo IgA.
Su elevación puede ser policlonal, donde todas las inmunoglobulinas se elevan dando lugar a una curva simétrica, o bien monoclonal donde aparece un pico correspondiente a la síntesis de una sola cadena de inmunoglobulinas.
La elevación policlonal de la IgA[15] da lugar a lo que se llama puente βδ-globulina.