Principio isolobal
Hoffmann presentó su trabajo respecto a la analogía isolobal, cuando se le otorgó el premio Nobel en Química en 1981, el cual compartiría con Kenichi Fukui.
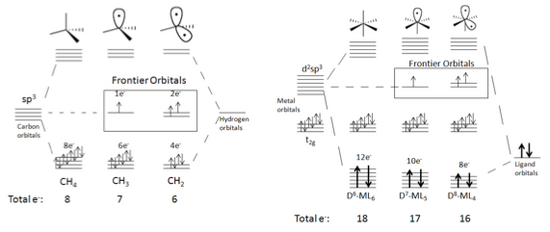
Para empezar a generar un fragmento isolobal, la molécula necesita seguir ciertos criterios.
Este proceso puede ser repetido hasta que solo quede un enlace al átomo central de la molécula.
Para satisfacer los criterios de carga cero, el centro del metal tiene que ser cambiado.
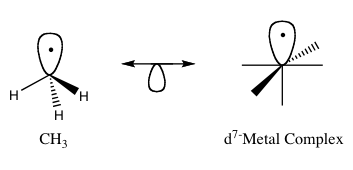
Sacando un ligando para formar el primer orbital frontera resultaría en un complejo MoL5− porque el Mo ha ganado un electrón adicional que lo vuelve d7.
Para remediar esto, Mo puede ser intercambiado por Mn, el cual formaría un complejo neutral d7 en este caso, como se muestra en la Figura 3.
Esta tendencia puede continuar hasta que solo quede un ligando coordinado al centro del metal.
Por ejemplo, considere la Figura 5, el cual muestra la producción de orbitales frontera en moléculas tetraédricas y octaédricas.
Puede ser utilizado con una variedad de ligandos, especies cargadas y complejos no octaédricos.
La analogía isolobal también puede ser utilizada con fragmentos isoelectrónicos con el mismo número de coordinación, el cual permite que la especie cargada sea considerada.
La analogía aplica a otras formas además de las geometrías tetraédricas y octaédricas.
La excepción es la geometría cuadrada plana ya que los complejos cuadrado-planos se rigen típicamente con la regla de 16 electrones.
Más adelante estos fragmentos orgánicos e inorgánicos pueden combinarse para conseguir un complejo H3C-Mn(CO)5. como se muestra en la figura 8.2[7] Suponiendo que los ligandos actúan como donadores de dos electrones el centro metálico en las moléculas cuadradas planas es d8.
Para relacionar un fragmento octaédrico, MLn, donde M tiene una configuración electrónica dx a un fragmento cuadrado-plano análogo, la fórmula MLn−2 dónde M tiene una configuración electrónica dx+2 tendría que ser la siguiente.
De la simple visualización de dos radicales CH3 reaccionando para formar etano, uno puede basarse en el principio isolobal para predecir enlaces M-C o M-M como lo son (CH3)M(CO)5 y M2(CO)10, donde M es un d7.
No hay límites en el potencial de comparaciones que pueden haber entre complejos orgánicos e inorgánicos.