
Un virus es un agente infeccioso diminuto que se reproduce dentro de las células de huéspedes vivos . Cuando se infecta, la célula huésped se ve obligada a producir rápidamente miles de copias idénticas del virus original. A diferencia de la mayoría de los seres vivos , los virus no tienen células que se dividan; los nuevos virus se ensamblan en la célula huésped infectada. Pero a diferencia de los agentes infecciosos más simples como los priones , contienen genes , que les permiten mutar y evolucionar. Se han descrito en detalle más de 4.800 especies de virus [1] de los millones que hay en el medio ambiente. Su origen no está claro: algunos pueden haber evolucionado a partir de plásmidos (fragmentos de ADN que pueden moverse entre células), mientras que otros pueden haber evolucionado a partir de bacterias .
Los virus están formados por dos o tres partes. Todas incluyen genes . Estos genes contienen la información biológica codificada del virus y están formados por ADN o ARN . Todos los virus también están cubiertos por una capa de proteína para proteger los genes. Algunos virus también pueden tener una envoltura de una sustancia similar a la grasa que cubre la capa de proteína y los hace vulnerables al jabón. Un virus con esta "envoltura viral" la utiliza, junto con receptores específicos , para entrar en una nueva célula huésped. Los virus varían en forma desde la simple helicoidal e icosaédrica hasta estructuras más complejas . Los virus varían en tamaño de 20 a 300 nanómetros ; se necesitarían entre 33.000 y 500.000 de ellos, uno al lado del otro, para estirarse hasta 1 centímetro (0,4 pulgadas).
Los virus se propagan de muchas maneras. Aunque muchos son muy específicos en cuanto a la especie huésped o tejido que atacan, cada especie de virus depende de un método particular para copiarse a sí misma. Los virus de las plantas a menudo se propagan de una planta a otra por medio de insectos y otros organismos , conocidos como vectores . Algunos virus de los seres humanos y otros animales se propagan por exposición a fluidos corporales infectados. Los virus como el de la gripe se propagan por el aire a través de gotitas de humedad cuando las personas tosen o estornudan. Los virus como el norovirus se transmiten por vía fecal-oral , que implica la contaminación de las manos, los alimentos y el agua. El rotavirus a menudo se propaga por contacto directo con niños infectados. El virus de la inmunodeficiencia humana, VIH , se transmite por fluidos corporales transferidos durante las relaciones sexuales. Otros, como el virus del dengue , se propagan por insectos hematófagos .
Los virus, especialmente los compuestos de ARN, pueden mutar rápidamente para dar lugar a nuevos tipos. Los huéspedes pueden tener poca protección contra estas nuevas formas. El virus de la gripe, por ejemplo, cambia a menudo, por lo que se necesita una nueva vacuna cada año. Los cambios importantes pueden causar pandemias , como la gripe porcina de 2009 que se propagó a la mayoría de los países. A menudo, estas mutaciones tienen lugar cuando el virus ha infectado por primera vez a otros huéspedes animales. Algunos ejemplos de estas enfermedades "zoonóticas" incluyen el coronavirus en murciélagos y la gripe en cerdos y aves, antes de que esos virus se transfirieran a los humanos .
Las infecciones virales pueden causar enfermedades en humanos, animales y plantas. En humanos y animales sanos, las infecciones son generalmente eliminadas por el sistema inmunológico , que puede proporcionar inmunidad de por vida al huésped contra ese virus. Los antibióticos , que actúan contra las bacterias, no tienen ningún efecto, pero los medicamentos antivirales pueden tratar infecciones potencialmente mortales. Las vacunas que producen inmunidad de por vida pueden prevenir algunas infecciones.

En 1884, el microbiólogo francés Charles Chamberland inventó el filtro Chamberland (o filtro Chamberland-Pasteur), que contiene poros más pequeños que las bacterias . A continuación, podía pasar una solución que contenía bacterias a través del filtro y eliminarlas por completo. A principios de la década de 1890, el biólogo ruso Dmitri Ivanovsky utilizó este método para estudiar lo que se conocería como el virus del mosaico del tabaco . Sus experimentos demostraron que los extractos de las hojas trituradas de plantas de tabaco infectadas siguen siendo infecciosos después de la filtración. [2]
Al mismo tiempo, varios otros científicos demostraron que, aunque estos agentes (posteriormente llamados virus) eran diferentes de las bacterias y unas cien veces más pequeños, aún podían causar enfermedades. En 1899, el microbiólogo holandés Martinus Beijerinck observó que el agente solo se multiplicaba cuando se encontraba en células en división . Lo llamó un "fluido vivo contagioso" ( latín : contagium vivum fluidum ) o un "germen vivo soluble" porque no pudo encontrar ninguna partícula similar a un germen. [3] A principios del siglo XX, el bacteriólogo inglés Frederick Twort descubrió virus que infectan bacterias, [4] y el microbiólogo francocanadiense Félix d'Herelle describió virus que, cuando se agregaban a bacterias que crecían en agar , darían lugar a la formación de áreas enteras de bacterias muertas. Contar estas áreas muertas le permitió calcular la cantidad de virus en la suspensión. [5]
La invención del microscopio electrónico en 1931 trajo consigo las primeras imágenes de virus. [6] En 1935, el bioquímico y virólogo estadounidense Wendell Meredith Stanley examinó el virus del mosaico del tabaco (TMV) y descubrió que estaba compuesto principalmente de proteínas . [7] Poco tiempo después, se demostró que este virus estaba compuesto de proteínas y ARN . [8] Rosalind Franklin desarrolló imágenes cristalográficas de rayos X y determinó la estructura completa del TMV en 1955. [9] Franklin confirmó que las proteínas virales formaban un tubo hueco en espiral, envuelto por ARN, y también demostró que el ARN viral era una sola hebra, no una doble hélice como el ADN. [10]
Un problema para los primeros científicos era que no sabían cómo cultivar virus sin utilizar animales vivos. El gran avance se produjo en 1931, cuando los patólogos estadounidenses Ernest William Goodpasture y Alice Miles Woodruff cultivaron el virus de la gripe y otros virus en huevos de gallina fertilizados. [11] Algunos virus no podían cultivarse en huevos de gallina. Este problema se resolvió en 1949, cuando John Franklin Enders , Thomas Huckle Weller y Frederick Chapman Robbins cultivaron el virus de la polio en cultivos de células animales vivas. [12] Se han descrito en detalle más de 4.800 especies de virus . [1]
Los virus coexisten con la vida dondequiera que se produzca. Probablemente han existido desde que las células vivas evolucionaron por primera vez. Su origen sigue siendo incierto porque no se fosilizan , por lo que las técnicas moleculares han sido la mejor manera de formular hipótesis sobre cómo surgieron. Estas técnicas se basan en la disponibilidad de ADN o ARN viral antiguo, pero la mayoría de los virus que se han conservado y almacenado en laboratorios tienen menos de 90 años. [13] [14] Los métodos moleculares solo han tenido éxito en el rastreo de la ascendencia de los virus que evolucionaron en el siglo XX. [15] Es posible que hayan surgido nuevos grupos de virus repetidamente en todas las etapas de la evolución de la vida. [16] Hay tres teorías principales sobre los orígenes de los virus: [16] [17]
Todas estas teorías tienen problemas. La hipótesis regresiva no explica por qué ni siquiera los parásitos celulares más pequeños se parecen en nada a los virus. La hipótesis del escape o del origen celular no explica la presencia de estructuras únicas en los virus que no aparecen en las células. La hipótesis de la coevolución, o de "primero el virus", entra en conflicto con la definición de virus, porque los virus dependen de las células huésped. [20] [21] Además, se reconoce que los virus son antiguos y que tienen orígenes anteriores a la divergencia de la vida en los tres dominios . [22] Este descubrimiento ha llevado a los virólogos modernos a reconsiderar y reevaluar estas tres hipótesis clásicas. [16] [22]

Una partícula viral, también llamada virión , consiste en genes hechos de ADN o ARN que están rodeados por una capa protectora de proteína llamada cápside . [23] La cápside está hecha de muchas moléculas de proteína idénticas más pequeñas llamadas capsómeros . La disposición de los capsómeros puede ser icosaédrica (de 20 lados), helicoidal o más compleja. Hay una capa interna alrededor del ADN o ARN llamada nucleocápside , hecha de proteínas. Algunos virus están rodeados por una burbuja de lípidos (grasa) llamada envoltura , que los hace vulnerables al jabón y al alcohol. [24]

Los virus se encuentran entre los agentes infecciosos más pequeños y son demasiado pequeños para ser vistos por microscopio óptico ; la mayoría de ellos solo pueden verse por microscopio electrónico . Sus tamaños varían de 20 a 300 nanómetros ; se necesitarían entre 30.000 y 500.000 de ellos, uno al lado del otro, para estirarse hasta un centímetro (0,4 pulgadas). [23] En comparación, las bacterias suelen tener alrededor de 1000 nanómetros (1 micrómetro) de diámetro, y las células huésped de organismos superiores suelen tener unas pocas decenas de micrómetros . Algunos virus, como los megavirus y los pandoravirus, son virus relativamente grandes. Con alrededor de 1000 nanómetros, estos virus, que infectan a las amebas , fueron descubiertos en 2003 y 2013. [25] [26] Son alrededor de diez veces más anchos (y por lo tanto mil veces más grandes en volumen) que los virus de la gripe , y el descubrimiento de estos virus "gigantes" asombró a los científicos. [27]
Los genes de los virus están compuestos de ADN (ácido desoxirribonucleico) y, en muchos virus, de ARN (ácido ribonucleico). La información biológica contenida en un organismo está codificada en su ADN o ARN. La mayoría de los organismos utilizan ADN, pero muchos virus tienen ARN como material genético. El ADN o ARN de los virus consta de una sola hebra o de una doble hélice. [28]
Los virus pueden reproducirse rápidamente porque tienen relativamente pocos genes. Por ejemplo, el virus de la gripe tiene solo ocho genes y el rotavirus tiene once. En comparación, los humanos tenemos entre 20.000 y 25.000. Algunos genes virales contienen el código para fabricar las proteínas estructurales que forman la partícula viral. Otros genes producen proteínas no estructurales que se encuentran solo en las células que el virus infecta. [29] [30]
Todas las células, y muchos virus, producen proteínas que son enzimas que impulsan las reacciones químicas. Algunas de estas enzimas, llamadas ADN polimerasa y ARN polimerasa , crean nuevas copias de ADN y ARN. Las enzimas polimerasas de un virus suelen ser mucho más eficientes en la fabricación de ADN y ARN que las enzimas equivalentes de las células huésped, [31] pero las enzimas ARN polimerasas virales son propensas a errores, lo que hace que los virus ARN muten y formen nuevas cepas. [32]
En algunas especies de virus ARN, los genes no se encuentran en una molécula continua de ARN, sino que están separados. El virus de la gripe, por ejemplo, tiene ocho genes separados hechos de ARN. Cuando dos cepas diferentes del virus de la gripe infectan la misma célula, estos genes pueden mezclarse y producir nuevas cepas del virus en un proceso llamado reordenamiento . [33]

Las proteínas son esenciales para la vida. Las células producen nuevas moléculas de proteínas a partir de los bloques de construcción de aminoácidos en función de la información codificada en el ADN. Cada tipo de proteína es un especialista que, por lo general, solo realiza una función, por lo que si una célula necesita hacer algo nuevo, debe fabricar una nueva proteína. Los virus obligan a la célula a fabricar nuevas proteínas que la célula no necesita, pero que son necesarias para que el virus se reproduzca. La síntesis de proteínas consta de dos pasos principales: transcripción y traducción . [34]
La transcripción es el proceso mediante el cual la información contenida en el ADN, llamada código genético , se utiliza para producir copias de ARN llamadas ARN mensajero (ARNm). Estas copias migran a través de la célula y llevan el código a los ribosomas , donde se utiliza para fabricar proteínas. Esto se denomina traducción porque la estructura de aminoácidos de la proteína está determinada por el código del ARNm. Por lo tanto, la información se traduce del lenguaje de los ácidos nucleicos al lenguaje de los aminoácidos. [34]
Algunos ácidos nucleicos de los virus ARN funcionan directamente como ARNm sin modificación adicional. Por esta razón, estos virus se denominan virus ARN de sentido positivo. [35] En otros virus ARN, el ARN es una copia complementaria del ARNm y estos virus dependen de la enzima de la célula o de su propia enzima para fabricar ARNm. Estos se denominan virus ARN de sentido negativo . En los virus hechos de ADN, el método de producción de ARNm es similar al de la célula. Las especies de virus llamadas retrovirus se comportan de manera completamente diferente: tienen ARN, pero dentro de la célula huésped se fabrica una copia de ADN de su ARN con la ayuda de la enzima transcriptasa inversa . Este ADN luego se incorpora al ADN del propio huésped y se copia en ARNm por las vías normales de la célula. [36]

Cuando un virus infecta una célula, la obliga a crear miles de virus más. Para ello, hace que la célula copie el ADN o el ARN del virus, lo que produce proteínas virales que, a su vez, se ensamblan para formar nuevas partículas virales. [37]
Hay seis etapas básicas superpuestas en el ciclo de vida de los virus en las células vivas: [38]
Los virus tienen una amplia gama de efectos estructurales y bioquímicos en la célula huésped. [39] Estos se denominan efectos citopáticos . [40] La mayoría de las infecciones virales finalmente resultan en la muerte de la célula huésped. Las causas de muerte incluyen lisis celular (estallido), alteraciones en la membrana superficial de la célula y apoptosis ("suicidio" celular). [41] A menudo, la muerte celular es causada por el cese de su actividad normal debido a las proteínas producidas por el virus, no todas las cuales son componentes de la partícula viral. [42]
Algunos virus no provocan cambios aparentes en la célula infectada. Las células en las que el virus está latente (inactivo) muestran pocos signos de infección y suelen funcionar con normalidad. [43] Esto provoca infecciones persistentes y el virus suele permanecer inactivo durante muchos meses o años. Este suele ser el caso de los virus del herpes . [44] [45]
Algunos virus, como el virus de Epstein-Barr , a menudo hacen que las células proliferen sin causar malignidad ; [46] pero otros virus, como el virus del papiloma , son una causa establecida de cáncer. [47] Cuando el ADN de una célula es dañado por un virus de tal manera que la célula no puede repararse a sí misma, esto a menudo desencadena la apoptosis. Uno de los resultados de la apoptosis es la destrucción del ADN dañado por la propia célula. Algunos virus tienen mecanismos para limitar la apoptosis de modo que la célula huésped no muera antes de que se hayan producido los virus de la progenie; el VIH , por ejemplo, hace esto. [48]
Hay muchas formas en las que los virus se propagan de un huésped a otro, pero cada especie de virus utiliza solo una o dos. Muchos virus que infectan a las plantas son transportados por organismos ; dichos organismos se denominan vectores . Algunos virus que infectan a los animales, incluidos los humanos, también se propagan por vectores, generalmente insectos chupadores de sangre, pero la transmisión directa es más común. Algunas infecciones virales, como el norovirus y el rotavirus , se propagan a través de alimentos y agua contaminados, por las manos y objetos comunes y por contacto íntimo con otra persona infectada, mientras que otras, como el SARS-CoV-2 y los virus de la gripe, se transmiten por el aire. Virus como el VIH, la hepatitis B y la hepatitis C a menudo se transmiten por relaciones sexuales sin protección o agujas hipodérmicas contaminadas . Para prevenir infecciones y epidemias, es importante saber cómo se propaga cada tipo diferente de virus. [49]
Las enfermedades humanas más comunes causadas por virus incluyen el resfriado común , la gripe , la varicela y el herpes labial . Enfermedades graves como el ébola y el sida también son causadas por virus. [50] Muchos virus causan poca o ninguna enfermedad y se dice que son "benignos". Los virus más dañinos se describen como virulentos . [51] Los virus causan diferentes enfermedades según los tipos de células que infectan. Algunos virus pueden causar infecciones crónicas o de por vida en las que los virus continúan reproduciéndose en el cuerpo a pesar de los mecanismos de defensa del huésped. [52] Esto es común en las infecciones por el virus de la hepatitis B y el virus de la hepatitis C. Las personas infectadas crónicamente con un virus se conocen como portadores. Sirven como reservorios importantes del virus. [53] [54]
Si la proporción de portadores en una población dada alcanza un umbral dado, se dice que una enfermedad es endémica . [55] Antes de la llegada de la vacunación, las infecciones con virus eran comunes y los brotes ocurrían regularmente. En países con un clima templado, las enfermedades virales suelen ser estacionales. La poliomielitis , causada por el poliovirus , a menudo se producía en los meses de verano. [56] Por el contrario, los resfriados, la gripe y las infecciones por rotavirus suelen ser un problema durante los meses de invierno. [57] [58] Otros virus, como el virus del sarampión , causaban brotes regularmente cada tres años. [59] En los países en desarrollo, los virus que causan infecciones respiratorias y entéricas son comunes durante todo el año. Los virus transportados por insectos son una causa común de enfermedades en estos entornos. Los virus del Zika y del dengue , por ejemplo, son transmitidos por los mosquitos Aedes hembra, que pican a los humanos especialmente durante la temporada de reproducción de los mosquitos. [60]


Aunque las pandemias virales son eventos raros, el VIH, que evolucionó a partir de virus encontrados en monos y chimpancés, ha sido una pandemia desde al menos la década de 1980. [62] Durante el siglo XX hubo cuatro pandemias causadas por el virus de la influenza y las que ocurrieron en 1918, 1957 y 1968 fueron graves. [63] Antes de su erradicación, la viruela fue causa de pandemias durante más de 3000 años. [64] A lo largo de la historia, la migración humana ha ayudado a la propagación de infecciones pandémicas; primero por mar y en los tiempos modernos también por aire. [65]
Con excepción de la viruela, la mayoría de las pandemias son causadas por virus de reciente evolución. Estos virus "emergentes" suelen ser mutantes de virus menos dañinos que han circulado previamente en humanos o en otros animales. [66]
El síndrome respiratorio agudo severo (SARS) y el síndrome respiratorio de Oriente Medio (MERS) son causados por nuevos tipos de coronavirus . Se sabe que otros coronavirus causan infecciones leves en humanos, [67] por lo que la virulencia y la rápida propagación de las infecciones por SARS (que en julio de 2003 habían causado alrededor de 8.000 casos y 800 muertes) fue inesperada y la mayoría de los países no estaban preparados. [68]
En noviembre de 2019 surgió en Wuhan (China) un coronavirus relacionado que se propagó rápidamente por todo el mundo. Se cree que se originó en murciélagos y, posteriormente, se lo denominó coronavirus 2 del síndrome respiratorio agudo severo . Las infecciones por el virus causan una enfermedad llamada COVID-19 , que varía en gravedad de leve a mortal, [69] y condujo a una pandemia en 2020. [61] [70] [71] Se impusieron restricciones sin precedentes en tiempos de paz a los viajes internacionales, [72] y se impusieron toques de queda en varias ciudades importantes del mundo. [73]

Existen muchos tipos de virus de plantas , pero a menudo sólo causan una disminución en el rendimiento , y no es económicamente viable tratar de controlarlos. Los virus de plantas se propagan con frecuencia de una planta a otra por organismos llamados " vectores ". Estos normalmente son insectos, pero algunos hongos , gusanos nematodos y organismos unicelulares también han demostrado ser vectores. Cuando el control de las infecciones por virus de plantas se considera económico (frutos perennes, por ejemplo), los esfuerzos se concentran en matar a los vectores y eliminar huéspedes alternativos como las malas hierbas. [74] Los virus de plantas son inofensivos para los humanos y otros animales porque sólo pueden reproducirse en células vegetales vivas. [75]

Los bacteriófagos son virus que infectan bacterias y arqueas . [76] Son importantes en la ecología marina : a medida que las bacterias infectadas estallan, los compuestos de carbono se liberan de nuevo al medio ambiente, lo que estimula el crecimiento orgánico fresco. Los bacteriófagos son útiles en la investigación científica porque son inofensivos para los humanos y se pueden estudiar fácilmente. Estos virus pueden ser un problema en las industrias que producen alimentos y medicamentos por fermentación y dependen de bacterias saludables. Algunas infecciones bacterianas se están volviendo difíciles de controlar con antibióticos, por lo que existe un creciente interés en el uso de bacteriófagos para tratar infecciones en humanos. [77]
Los animales, incluidos los humanos, tienen muchas defensas naturales contra los virus. Algunas no son específicas y protegen contra muchos virus independientemente del tipo. Esta inmunidad innata no mejora con la exposición repetida a los virus y no conserva una "memoria" de la infección. La piel de los animales, en particular su superficie, que está hecha de células muertas, evita que muchos tipos de virus infecten al huésped. La acidez del contenido del estómago destruye muchos virus que han sido ingeridos. Cuando un virus supera estas barreras y entra en el huésped, otras defensas innatas impiden la propagación de la infección en el cuerpo. El cuerpo produce una hormona especial llamada interferón cuando hay virus, que impide que los virus se reproduzcan matando a las células infectadas y a sus vecinas cercanas. Dentro de las células, hay enzimas que destruyen el ARN de los virus. Esto se llama interferencia de ARN . Algunas células sanguíneas engullen y destruyen otras células infectadas por virus. [78]

La inmunidad específica a los virus se desarrolla con el tiempo y los glóbulos blancos llamados linfocitos desempeñan un papel central. Los linfocitos conservan una "memoria" de las infecciones virales y producen muchas moléculas especiales llamadas anticuerpos . Estos anticuerpos se adhieren a los virus e impiden que el virus infecte las células. Los anticuerpos son altamente selectivos y atacan solo a un tipo de virus. El cuerpo produce muchos anticuerpos diferentes, especialmente durante la infección inicial. Después de que la infección remite, algunos anticuerpos permanecen y continúan produciéndose, lo que generalmente le da al huésped inmunidad de por vida al virus. [79]
Las plantas tienen mecanismos de defensa elaborados y eficaces contra los virus. Uno de los más eficaces es la presencia de los denominados genes de resistencia (R) . Cada gen R confiere resistencia a un virus concreto al desencadenar zonas localizadas de muerte celular alrededor de la célula infectada, que a menudo se pueden ver a simple vista como manchas grandes. Esto impide que la infección se propague. [80] La interferencia del ARN también es una defensa eficaz en las plantas. [81] Cuando se infectan, las plantas suelen producir desinfectantes naturales que destruyen los virus, como el ácido salicílico , el óxido nítrico y las moléculas reactivas de oxígeno . [82]
La principal forma en que las bacterias se defienden de los bacteriófagos es mediante la producción de enzimas que destruyen el ADN extraño. Estas enzimas, llamadas endonucleasas de restricción , cortan el ADN viral que los bacteriófagos inyectan en las células bacterianas. [83]

Las vacunas simulan una infección natural y su respuesta inmune asociada, pero no causan la enfermedad. Su uso ha resultado en la erradicación de la viruela y una disminución dramática en la enfermedad y muerte causadas por infecciones como la polio , el sarampión , las paperas y la rubéola . [84] Hay vacunas disponibles para prevenir más de catorce infecciones virales de humanos [85] y se usan más para prevenir infecciones virales de animales. [86] Las vacunas pueden consistir en virus vivos o muertos. [87] Las vacunas vivas contienen formas debilitadas del virus, pero estas vacunas pueden ser peligrosas cuando se administran a personas con inmunidad débil . En estas personas, el virus debilitado puede causar la enfermedad original. [88] Las técnicas de biotecnología e ingeniería genética se utilizan para producir vacunas "de diseño" que solo tienen las proteínas de la cápside del virus. La vacuna contra la hepatitis B es un ejemplo de este tipo de vacuna. [89] Estas vacunas son más seguras porque nunca pueden causar la enfermedad. [87]
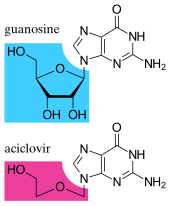
Desde mediados de la década de 1980, el desarrollo de medicamentos antivirales ha aumentado rápidamente, impulsado principalmente por la pandemia del SIDA. Los medicamentos antivirales a menudo son análogos de nucleósidos , que se hacen pasar por bloques de construcción de ADN ( nucleósidos ). Cuando comienza la replicación del ADN del virus, se utilizan algunos de los bloques de construcción falsos. Esto impide la replicación del ADN porque los medicamentos carecen de las características esenciales que permiten la formación de una cadena de ADN. Cuando la producción de ADN se detiene, el virus ya no puede reproducirse. [90] Ejemplos de análogos de nucleósidos son el aciclovir para las infecciones por el virus del herpes y la lamivudina para las infecciones por el VIH y el virus de la hepatitis B. El aciclovir es uno de los medicamentos antivirales más antiguos y más recetados. [91]
Otros fármacos antivirales actúan sobre distintas etapas del ciclo de vida del virus. El VIH depende de una enzima llamada proteasa del VIH-1 para que el virus se vuelva infeccioso. Existe una clase de fármacos llamados inhibidores de la proteasa , que se unen a esta enzima y detienen su funcionamiento. [92]
La hepatitis C es causada por un virus ARN. En el 80% de los infectados, la enfermedad se vuelve crónica y siguen siendo contagiosos durante el resto de sus vidas a menos que reciban tratamiento. Existen tratamientos eficaces que utilizan antivirales de acción directa . [93] Se han desarrollado tratamientos para portadores crónicos del virus de la hepatitis B mediante una estrategia similar, utilizando lamivudina y otros fármacos antivirales. En ambas enfermedades, los fármacos impiden que el virus se reproduzca y el interferón mata cualquier célula infectada restante. [94]
Las infecciones por VIH suelen tratarse con una combinación de medicamentos antivirales, cada uno de los cuales actúa sobre una fase diferente del ciclo de vida del virus. Hay medicamentos que impiden que el virus se adhiera a las células, otros son análogos de nucleósidos y algunos envenenan las enzimas del virus que necesita para reproducirse. El éxito de estos medicamentos es una prueba de la importancia de saber cómo se reproducen los virus. [92]
Los virus son la entidad biológica más abundante en los ambientes acuáticos; [95] una cucharadita de agua de mar contiene alrededor de diez millones de virus, [96] y son esenciales para la regulación de los ecosistemas de agua salada y dulce. [97] La mayoría son bacteriófagos, [98] que son inofensivos para las plantas y los animales. Infectan y destruyen las bacterias en las comunidades microbianas acuáticas y este es el mecanismo más importante de reciclaje de carbono en el medio marino. Las moléculas orgánicas liberadas de las células bacterianas por los virus estimulan el crecimiento de nuevas bacterias y algas. [99]
Los microorganismos constituyen más del 90% de la biomasa del mar. Se estima que los virus matan aproximadamente el 20% de esta biomasa cada día y que hay quince veces más virus en los océanos que bacterias y arqueas. Son los principales responsables de la rápida destrucción de las floraciones de algas nocivas [100] , que a menudo matan a otras formas de vida marina [101] . El número de virus en los océanos disminuye a medida que se adentran más en la costa y más profundamente en el agua, donde hay menos organismos hospedadores [102] .
Sus efectos son de largo alcance: al aumentar la cantidad de respiración en los océanos, los virus son indirectamente responsables de reducir la cantidad de dióxido de carbono en la atmósfera en aproximadamente 3 gigatoneladas de carbono por año. [102]
Los mamíferos marinos también son susceptibles a las infecciones virales. En 1988 y 2002, miles de focas comunes murieron en Europa a causa del virus del moquillo focino . [103] Muchos otros virus, incluidos los calicivirus, los herpesvirus, los adenovirus y los parvovirus, circulan en las poblaciones de mamíferos marinos. [102]
Los virus también pueden servir como fuente de alimento alternativa para los microorganismos que participan en la virovioría , suministrando ácidos nucleicos, nitrógeno y fósforo a través de su consumo. [104] [105]