.pdf/page1-440px-How_viral_vector_COVID-19_Vaccines_Work_(English).pdf.jpg)
Los vectores virales son virus modificados diseñados para introducir material genético en las células . Este proceso puede realizarse dentro de un organismo o en un cultivo celular . Los vectores virales tienen aplicaciones generalizadas en la investigación básica, la agricultura y la medicina.
Los virus han desarrollado mecanismos moleculares especializados para transportar sus genomas a huéspedes infectados, un proceso denominado transducción . Esta capacidad se ha aprovechado para su uso como vectores virales, que pueden integrar su carga genética (el transgén ) en el genoma del huésped, aunque también se utilizan habitualmente vectores no integrativos. Además de en la agricultura y la investigación de laboratorio, los vectores virales se aplican ampliamente en la terapia génica : a partir de 2022, todas las terapias génicas aprobadas se basaban en vectores virales. Además, en comparación con las vacunas tradicionales , la expresión intracelular de antígenos que permiten las vacunas de vectores virales ofrece una activación inmunitaria más robusta.
Se han desarrollado muchos tipos de virus en plataformas de vectores virales, que van desde los retrovirus hasta los citomegalovirus . Las diferentes clases de vectores virales varían ampliamente en cuanto a fortalezas y limitaciones, y algunas se adaptan a aplicaciones específicas. Por ejemplo, los vectores relativamente no inmunogénicos e integrativos como los vectores lentivirales se emplean comúnmente para la terapia génica. También se han desarrollado vectores virales quiméricos, como vectores híbridos con cualidades tanto de bacteriófagos como de virus eucariotas.
Los vectores virales fueron creados por primera vez en 1972 por Paul Berg . El desarrollo posterior se detuvo temporalmente por una moratoria de la investigación del ADN recombinante después de la Conferencia de Asilomar y las estrictas regulaciones de los Institutos Nacionales de Salud . Una vez levantada, la década de 1980 vio la primera terapia génica con vector viral recombinante y la primera vacuna de vector viral. Aunque la década de 1990 vio avances significativos en los vectores virales, los ensayos clínicos tuvieron una serie de reveses, que culminaron con la muerte de Jesse Gelsinger . Sin embargo, en el siglo XXI, los vectores virales experimentaron un resurgimiento y han sido aprobados globalmente para el tratamiento de varias enfermedades. Se han administrado a miles de millones de pacientes, en particular durante la pandemia de COVID-19 .

Los virus , agentes infecciosos compuestos por una capa proteica que encierra un genoma , son las entidades biológicas más numerosas de la Tierra. [1] [2] Como no pueden replicarse de forma independiente, deben infectar células y secuestrar la maquinaria de replicación del huésped para producir copias de sí mismos . [2] Los virus hacen esto insertando su genoma, que puede ser ADN o ARN , ya sea monocatenario o bicatenario , en el huésped. [3] Algunos virus pueden integrar su genoma directamente en el del huésped en forma de provirus . [4]
Los ingenieros genéticos han aprovechado esta capacidad de transferir material genético extraño para crear vectores virales que pueden transducir el transgén deseado en una célula objetivo. [2] Los vectores virales constan de tres componentes: [5] [6]

Los vectores virales se utilizan rutinariamente en un entorno de investigación básica y pueden introducir genes que codifican, por ejemplo, ADN complementario , ARN de horquilla corta o sistemas CRISPR/Cas9 para la edición genética. [8] Los vectores virales se emplean para la reprogramación celular, como la inducción de células madre pluripotentes o la diferenciación de células somáticas adultas en diferentes tipos de células. [9] Los investigadores también utilizan vectores virales para crear ratones y ratas transgénicos para experimentos. [10] Los vectores virales se pueden utilizar para la obtención de imágenes in vivo mediante la introducción de un gen reportero . Además, la transducción de células madre puede permitir el rastreo del linaje celular durante el desarrollo . [9]

La terapia génica busca modular o afectar de alguna otra manera la expresión génica mediante la introducción de un transgén terapéutico. La terapia génica con vectores virales se puede realizar mediante administración in vivo , administrando directamente el vector al paciente, o ex vivo, extrayendo células del paciente, transduciéndolas y luego reintroduciendo las células modificadas en el paciente. [11] Las terapias génicas con vectores virales también se pueden utilizar para plantas, mejorando tentativamente el rendimiento de los cultivos o promoviendo la producción sostenible. [12]
Existen cuatro grandes categorías de terapia génica: reemplazo de genes, silenciamiento de genes , adición de genes o edición de genes. [11] [13] En comparación con otros enfoques de terapia génica no integrativa, los transgenes introducidos por vectores virales ofrecen una expresión de varios años de duración. [14]
_(51611494786).jpg/440px-201021_Llegada_de_la_vacuna_conytra_COVID_-19_S-putnik_V_(12)_(51611494786).jpg)
Para su uso como plataformas de vacunas , los vectores virales pueden diseñarse para transportar un antígeno específico asociado con una enfermedad infecciosa o un antígeno tumoral . [15] [16] Las vacunas convencionales no son adecuadas para la protección contra algunos patógenos debido a estrategias únicas de evasión inmunológica y diferencias en la patogénesis. [17] Las vacunas basadas en vectores virales, por ejemplo, podrían eventualmente ofrecer inmunidad contra el VIH-1 y la malaria . [18]
Mientras que las vacunas de subunidades tradicionales provocan una respuesta humoral, [19] los vectores virales permiten la expresión intracelular de antígenos que activan las vías del CMH a través de vías directas y de presentación cruzada. Esto induce una respuesta inmunitaria adaptativa robusta. [20] [21] Las vacunas de vectores virales también tienen propiedades adyuvantes intrínsecas a través de la activación del sistema inmunitario innato y la expresión de patrones moleculares asociados a patógenos , lo que elimina la necesidad de cualquier adyuvante adicional. [22] [15] Además de una respuesta inmunitaria más robusta en comparación con otros tipos de vacunas, los vectores virales ofrecen una transducción genética eficiente y pueden dirigirse a tipos de células específicos. [19] Sin embargo, la inmunidad preexistente al virus utilizado como vector puede ser un problema importante. [18]
Antes de 2020, las vacunas de vectores virales se administraban ampliamente, pero se limitaban a la medicina veterinaria. [22] En la respuesta mundial a la pandemia de COVID-19 , las vacunas de vectores virales desempeñaron un papel fundamental y se administraron a miles de millones de personas, particularmente en países de ingresos bajos y medios. [23]
Los retrovirus (virus de ARN envuelto) son plataformas de vectores virales populares debido a su capacidad de integrar material genético en el genoma del huésped. [2] Los vectores retrovirales comprenden dos clases generales: vectores retrovirales gamma y vectores lentivirales. La diferencia fundamental entre los dos es que los vectores retrovirales gamma solo pueden infectar células en división, mientras que los vectores lentivirales pueden infectar tanto células en división como en reposo. [24] En particular, los genomas retrovirales están compuestos de ARN monocatenario y deben convertirse en ADN bicatenario proviral, un proceso conocido como transcripción inversa , antes de que se integre en el genoma del huésped a través de proteínas virales como la integrasa . [25]
El vector gammaretroviral más utilizado es un virus de la leucemia murina de Moloney modificado (MMLV), capaz de transducir varios tipos de células de mamíferos. Los vectores MMLV se han asociado con algunos casos de carcinogénesis. [26] Los vectores gammaretrovirales se han aplicado con éxito a células madre hematopoyéticas ex vivo para tratar múltiples enfermedades genéticas. [27]
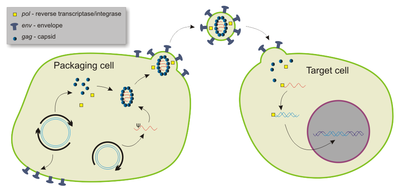
La mayoría de los vectores lentivirales se derivan del virus de inmunodeficiencia humana tipo 1 (VIH-1), aunque también se han utilizado el virus de inmunodeficiencia simia modificado (VIS), el virus de inmunodeficiencia felina (VIF) y el virus de anemia infecciosa equina (VAIE). [24] Como todos los genes funcionales se eliminan o mutan de otro modo, los vectores no son citopáticos y se pueden diseñar para que no sean integrativos. [28]
Los vectores lentivirales pueden transportar hasta 10 kb de material genético extraño, aunque se informó que 3-4 kb eran óptimos a partir de 2023. [24] [28] En relación con otros vectores virales, los vectores lentivirales poseen la mayor capacidad de transducción, debido a la formación de un "colgajo de ADN" de tres cadenas durante la retrotranscripción del ARN lentiviral de una sola cadena a ADN dentro del huésped. [28]
Aunque en gran medida no son inflamatorios, [29] los vectores lentivirales pueden inducir respuestas inmunes adaptativas robustas por parte de las células T citotóxicas de tipo memoria y las células T auxiliares . [30] Esto se debe en gran medida al alto tropismo de los vectores lentivirales por las células dendríticas , que activan las células T. [30] Sin embargo, pueden infectar todos los tipos de células presentadoras de antígenos. [31] Además, como son los únicos vectores retrovirales capaces de transducir eficientemente tanto células en división como células que no se dividen, los convierten en las plataformas de vacunas más prometedoras. [31] También se han probado como vacunas contra el cáncer. [32]
Los vectores lentivirales se han utilizado como terapias in vivo , como el tratamiento directo de enfermedades genéticas como la hemofilia B y para tratamientos ex vivo como la modificación de células inmunes en la terapia de células CAR T. [24] En 2017, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó tisagenlecleucel , un vector lentiviral, para la leucemia linfoblástica aguda . [33]

Los adenovirus son virus de ADN bicatenario que pertenecen a la familia Adenoviridae . [34] [35] Sus genomas relativamente grandes, de aproximadamente 30-45 kb, los convierten en candidatos ideales para la administración genética; [34] Los vectores adenovirales más nuevos pueden transportar hasta 37 kb de material genético extraño. [36] Los vectores adenovirales muestran una alta eficiencia de transducción y expresión de transgenes, y pueden infectar tanto células en división como células que no se dividen. [37]
La cápside adenoviral, un icosaedro , presenta una "perilla" de fibra en cada uno de sus 12 vértices. Estas proteínas de fibra median la entrada celular, lo que afecta en gran medida la eficacia y contribuye a su amplio tropismo, en particular a través de los receptores de adenovirus coxsackie (CAR). [34] [37] Los vectores adenovirales pueden inducir respuestas inmunes innatas y adaptativas robustas. [38] Su fuerte inmunogenicidad se debe particularmente a la transducción de células dendríticas (DC), que regula positivamente la expresión de moléculas MHC I y II y activa las DC. [39] Tienen un fuerte efecto adyuvante, ya que muestran varios patrones moleculares asociados a patógenos . [38] Una desventaja es que es común la inmunidad preexistente a los serotipos de adenovirus, lo que reduce la eficacia. [37] [40] El uso de adenovirus de chimpancé puede evitar este problema. [41]
Si bien la activación de las respuestas inmunes tanto innatas como adaptativas es un obstáculo para muchas aplicaciones terapéuticas, hace que los vectores adenovirales sean una plataforma de vacuna ideal. [35] La respuesta global a la pandemia de COVID-19 vio el desarrollo y uso de múltiples vacunas de vectores adenovirales, incluidas Sputnik V , la vacuna Oxford-AstraZeneca y la vacuna Janssen . [42]

Los virus adenoasociados (AAV) son virus de ADN monocatenario relativamente pequeños que pertenecen a Parvoviridae y, al igual que los vectores lentivirales, los AAV pueden infectar tanto células en división como células que no se dividen. [43] Sin embargo, los AAV requieren la presencia de un "virus auxiliar" como un adenovirus o un virus del herpes simple para replicarse dentro del huésped, aunque pueden hacerlo de forma independiente si se induce estrés celular o los genes del virus auxiliar son transportados por el vector. [44]
Los AAV se insertan en un sitio específico del genoma del huésped, en particular en el AAVS1 del cromosoma 19 en los humanos. Sin embargo, se han diseñado AAV recombinantes que no se integran, sino que se almacenan como episomas que, en células que no se dividen, pueden durar años. [45] Una desventaja es que no pueden transportar grandes cantidades de material genético extraño. Además, la necesidad de expresar la cadena complementaria para su genoma monocatenario puede retrasar la expresión del transgén. [45]
En 2020, se habían identificado 11 serotipos diferentes de AAV, que se diferenciaban por la estructura de la cápside y, en consecuencia, por el tropismo. [43] El tropismo de los vectores virales adenoasociados se puede adaptar creando versiones recombinantes a partir de múltiples serotipos, lo que se denomina pseudotipificación. [43] Debido a su capacidad para infectar e inducir efectos duraderos dentro de células que no se dividen, los AAV se utilizan comúnmente en la investigación básica en neurociencia. [46] Tras la aprobación del AAV Alipogene tiparvovec en Europa en 2012, [47] en 2017, la FDA aprobó la primera terapia génica in vivo basada en AAV, voretigene neparvovec , que trataba la amaurosis congénita de Leber asociada a RPE65 . [33] En 2020, se estaban realizando o se habían completado 230 ensayos clínicos que utilizaban tratamientos basados en AAV. [47]

El virus vaccinia , un poxvirus , es otro candidato prometedor para el desarrollo de vectores virales. [48] Su uso como vacuna contra la viruela (informado por primera vez por Edward Jenner en 1798) condujo a la erradicación de la viruela y demostró que la vacuna era segura y eficaz en humanos. [49] [48] Además, los procedimientos de fabricación desarrollados para producir en masa reservas de vacunas contra la viruela pueden acelerar la producción de vectores virales de la vacuna. [50]
La vacuna posee un genoma de ADN grande y, en consecuencia, puede transportar hasta 40 kb de ADN extraño. [49] [51] [52] [51] Además, es poco probable que la vacuna se integre en el genoma del huésped, lo que reduce la posibilidad de carcinogénesis. [51] Se han desarrollado cepas atenuadas (replicantes y no replicantes). [49] Aunque se ha caracterizado ampliamente debido a su uso contra la viruela, en 2019 se desconocía la función del 50 por ciento del genoma de la vacuna. Esto puede provocar efectos impredecibles. [52]
Como plataforma de vacuna, los vectores vaccinia muestran una expresión transgénica altamente efectiva y crean una respuesta inmune robusta. [50] El virus actúa rápidamente: su ciclo de vida produce progenie vaccinia madura en 6 horas y tiene tres mecanismos de propagación viral. [52] La vaccinia también tiene un efecto adyuvante , activando una fuerte respuesta innata a través de receptores tipo toll . [50] Sin embargo, una desventaja significativa que puede reducir su eficacia es la inmunidad preexistente contra la vaccinia en aquellos que recibieron la vacuna contra la viruela. [50]

De los nueve virus del herpes que infectan a los seres humanos, el virus del herpes simple 1 (HSV-1) es el mejor caracterizado y el más utilizado como vector viral. [53] El HSV-1 ofrece varias ventajas: tiene un amplio tropismo y puede administrar terapias a través de sistemas de expresión especializados. [54] Además, el HSV-1 puede atravesar la barrera hematoencefálica si se altera médicamente, lo que le permite atacar enfermedades neurológicas. Además, el HSV-1 no se integra en el genoma del huésped y puede transportar grandes cantidades de ADN extraño. La primera característica evita la mutagénesis dañina, como puede ocurrir con los vectores retrovirales y adenoasociados. Se han desarrollado cepas deficientes en la replicación. [55]
En 2015, la FDA aprobó el talimogén laherparepvec , un vector HSV-1 que desencadena una respuesta inmunitaria antitumoral, para tratar el melanoma . [56] A partir de 2020, los vectores HSV-1 se han aplicado experimentalmente contra sarcomas y cánceres de cerebro, colon, próstata y piel. [57]
El citomegalovirus (CMV), un herpesvirus, también se ha desarrollado para su uso como vector viral. [58] El CMV puede infectar a la mayoría de los tipos de células y, por lo tanto, puede proliferar en todo el cuerpo. Aunque una vacuna basada en CMV proporcionó una inmunidad significativa contra el VIS (estrechamente relacionado con el VIH) en macacos, se informó que el desarrollo del CMV como vector confiable todavía estaba en etapas iniciales en 2020. [59] [60]
Los virus de plantas también son vectores virales diseñados para su uso en agricultura, horticultura y producción biológica . [61] Estos vectores se han empleado para una variedad de aplicaciones, desde aumentar la calidad estética de las plantas ornamentales hasta el biocontrol de plagas , la expresión rápida de proteínas y péptidos recombinantes y para acelerar el mejoramiento de cultivos. [62] Se ha propuesto el uso de virus de plantas diseñados para mejorar el rendimiento de los cultivos y promover la producción sostenible. [12]
Los vectores basados en virus replicantes se utilizan típicamente. [63] Los virus de ARN utilizados para monocotiledóneas incluyen el virus del mosaico estriado del trigo y el virus del mosaico estriado de la cebada y, para dicotiledóneas, el virus del cascabel del tabaco . También se han utilizado virus de ADN monocatenario como los geminivirus . [63] Los vectores virales se pueden administrar a las plantas a través de varias vías denominadas "agroinoculación", que incluyen frotamiento, un sistema de administración biolística , agrospray, agroinyección e incluso a través de vectores de insectos . [64] [62] Sin embargo, la administración de vectores virales mediada por Agrobacterium , en la que las bacterias se transforman con ADN plasmídico que codifica la construcción del vector viral, es el enfoque más común. [65]
Se han desarrollado vectores quiméricos que combinan bacteriófagos y virus eucariotas y son capaces de infectar células eucariotas. [66] [67] A diferencia de los vectores basados en virus eucariotas, estos vectores bacteriófagos no tienen un tropismo innato por las células eucariotas, lo que permite diseñarlos para que sean altamente específicos para las células cancerosas. [68]
Los vectores bacteriófagos también se utilizan comúnmente en biología molecular. [69] Por ejemplo, los vectores bacteriófagos se utilizan en la evolución continua asistida por fagos , promoviendo la mutagénesis rápida de bacterias. [70] Aunque se limitan a los micobacteriófagos y algunos fagos de bacterias gramnegativas , los bacteriófagos se pueden utilizar para la clonación directa. [71]
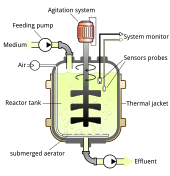
Los métodos de fabricación de vectores virales suelen variar según el vector, aunque la mayoría utiliza un sistema adherente o basado en suspensión con células de mamíferos. [72] Para la producción de vectores virales en un entorno de laboratorio más pequeño, se suelen utilizar sistemas de cultivo celular estático como placas de Petri. [73]
Las técnicas que se utilizan en el laboratorio son difíciles de escalar y requieren enfoques diferentes a escala industrial. [72] Los fabricantes suelen utilizar grandes sistemas de cultivo desechables de un solo uso y biorreactores . [72] Se utilizan recipientes como los que tienen superficies permeables a los gases para maximizar la densidad del cultivo celular y las unidades de transducción de soluciones. [72] Dependiendo del recipiente, los virus se pueden aislar directamente del sobrenadante o aislarse mediante lisis química de las células cultivadas o microfluidización. [74] En 2017, The New York Times informó sobre una acumulación de fabricación de virus inactivados, lo que retrasó algunos ensayos de terapia génica durante años. [75]
En 1972, el bioquímico de la Universidad de Stanford Paul Berg desarrolló el primer vector viral, incorporando ADN del fago lambda al poliomavirus SV40 para infectar células renales mantenidas en cultivo. [76] [77] [78] Las implicaciones de este logro preocuparon a científicos como Robert Pollack , quien convenció a Berg de no transducir ADN de SV40 en E. coli a través de un vector bacteriófago. Temían que la introducción de los genes supuestamente cancerígenos de SV40 crearía cepas bacterianas cancerígenas. [79] [80] Estas preocupaciones y otras en el campo emergente del ADN recombinante llevaron a la Conferencia de Asilomar de 1975, donde los asistentes acordaron una moratoria voluntaria sobre la clonación de ADN . [81]
En 1977, los Institutos Nacionales de Salud (NIH) emitieron directrices formales que limitaban la clonación de ADN viral a condiciones BSL-4 rígidas, impidiendo prácticamente este tipo de investigación. Sin embargo, el NIH flexibilizó estas reglas en 1979, lo que permitió a Bernard Moss desarrollar un vector viral utilizando vaccinia . [81] En 1982, Moss informó sobre el primer uso de un vector viral para la expresión génica transitoria. [18] El año siguiente, Moss utilizó el vector vaccinia para expresar un antígeno de la hepatitis B , creando la primera vacuna de vector viral. [22]
Cada campo de la medicina tiene su momento decisivo, a menudo con un rostro humano. La polio tuvo a Jonas Salk . La fertilización in vitro tuvo a Louise Brown , la primera bebé probeta del mundo. La cirugía de trasplante tuvo a Barney Clark , el dentista de Seattle con el corazón artificial. El SIDA tuvo a Magic Johnson . Ahora, la terapia genética tiene a Jesse Gelsinger .
Aunque ya en 1972 se había realizado un intento fallido de terapia génica utilizando el virus del papiloma de Shope de tipo salvaje , Martin Cline intentó la primera terapia génica utilizando ADN recombinante en 1980. Resultó infructuosa. [83] [11] En la década de 1990, a medida que se caracterizaban más las enfermedades genéticas y mejoraba la tecnología de vectores virales, hubo un optimismo excesivo sobre las capacidades de la tecnología. Muchos ensayos clínicos resultaron ser fracasos. [84] Hubo algunos éxitos, como la primera terapia génica eficaz para la inmunodeficiencia combinada grave (SCID); empleó un vector retroviral. [11]
Sin embargo, durante un ensayo clínico de 1999 en la Universidad de Pensilvania , Jesse Gelsinger murió por una reacción fatal a una terapia génica basada en un vector adenoviral. [82] [84] Fue la primera muerte relacionada con cualquier forma de terapia génica. [85] En consecuencia, la FDA suspendió todos los ensayos de terapia génica en la Universidad de Pensilvania e investigó otros 60 en todo Estados Unidos. [85] Un editorial anónimo en Nature Medicine señaló que representaba una "pérdida de la inocencia" para los vectores virales. [84] Poco después, la reputación del campo se dañó aún más cuando 5 niños tratados con una terapia génica SCID desarrollaron leucemia debido a un problema con el vector retroviral. [84] [nota 1]
Los vectores virales experimentaron un resurgimiento cuando se emplearon con éxito para la administración de genes hematopoyéticos ex vivo en entornos clínicos. [86] En 2003, China aprobó la primera terapia génica para uso clínico: Gendicine , un vector adenoviral que codifica p53 . [87] [88] En 2012, la Unión Europea emitió su primera aprobación de una terapia génica, un vector viral adenoasociado. [89] Durante la pandemia de COVID-19 , las vacunas de vectores virales se utilizaron en una medida sin precedentes: se administraron a miles de millones de personas. [90] [22] A partir de 2022, todas las terapias génicas aprobadas se basaban en vectores virales y se estaban realizando más de 1000 ensayos clínicos de vectores virales dirigidos al cáncer. [86]

En el cine, los vectores virales suelen ser retratados como causantes involuntarios de una pandemia y una catástrofe civilizatoria. [91] La película de 2007 Soy leyenda muestra un vector viral que ataca al cáncer desencadenando un apocalipsis zombi . [92] [93] De manera similar, una terapia de vector viral para la enfermedad de Alzheimer en El origen del planeta de los simios (2011) se convierte en un patógeno mortal y causa un levantamiento de simios . Otras películas que presentan vectores virales incluyen El legado de Bourne (2012) y Resident Evil: El capítulo final (2016). [94]