

En química , la solubilidad es la capacidad de una sustancia , el soluto , de formar una solución con otra sustancia, el disolvente . La insolubilidad es la propiedad opuesta, la incapacidad del soluto de formar dicha solución.
El grado de solubilidad de una sustancia en un disolvente específico se mide generalmente como la concentración del soluto en una solución saturada, en la que ya no se puede disolver más soluto. [1] En este punto, se dice que las dos sustancias están en el equilibrio de solubilidad . Para algunos solutos y disolventes, puede que no exista tal límite, en cuyo caso se dice que las dos sustancias son " miscibles en todas las proporciones" (o simplemente "miscibles"). [2]
El soluto puede ser un sólido , un líquido o un gas , mientras que el disolvente suele ser sólido o líquido. Ambos pueden ser sustancias puras o ser soluciones. Los gases son siempre miscibles en todas las proporciones, excepto en situaciones muy extremas, [3] y un sólido o un líquido pueden "disolverse" en un gas solo si pasan primero al estado gaseoso.
La solubilidad depende principalmente de la composición del soluto y del disolvente (incluido su pH y la presencia de otras sustancias disueltas), así como de la temperatura y la presión. La dependencia a menudo se puede explicar en términos de interacciones entre las partículas ( átomos , moléculas o iones ) de las dos sustancias y de conceptos termodinámicos como la entalpía y la entropía .
En determinadas condiciones, la concentración del soluto puede superar su límite de solubilidad habitual. El resultado es una solución sobresaturada , que es metaestable y excluirá rápidamente el exceso de soluto si aparece un sitio de nucleación adecuado . [4]
El concepto de solubilidad no se aplica cuando se produce una reacción química irreversible entre dos sustancias, como la reacción del hidróxido de calcio con el ácido clorhídrico ; aunque se podría decir, informalmente, que una "disuelve" a la otra. La solubilidad tampoco es lo mismo que la velocidad de disolución , que es la rapidez con la que un soluto sólido se disuelve en un disolvente líquido. Esta propiedad depende de muchas otras variables, como la forma física de las dos sustancias y la manera e intensidad de la mezcla.
El concepto y la medida de la solubilidad son extremadamente importantes en muchas ciencias además de la química, como la geología , la biología , la física y la oceanografía , así como en la ingeniería , la medicina , la agricultura e incluso en actividades no técnicas como pintar , limpiar , cocinar y elaborar cerveza . La mayoría de las reacciones químicas de interés científico, industrial o práctico solo ocurren después de que los reactivos se hayan disuelto en un disolvente adecuado. El agua es, con mucho, el disolvente más común.
El término "soluble" se utiliza a veces para materiales que pueden formar suspensiones coloidales de partículas sólidas muy finas en un líquido. [5] Sin embargo, la solubilidad cuantitativa de dichas sustancias generalmente no está bien definida.
La solubilidad de un soluto específico en un solvente específico generalmente se expresa como la concentración de una solución saturada de los dos. [1] Se puede utilizar cualquiera de las diversas formas de expresar la concentración de soluciones, como la masa , el volumen o la cantidad en moles del soluto para una masa, un volumen o una cantidad molar específicos del solvente o de la solución.
En particular, los manuales de química a menudo expresan la solubilidad como gramos de soluto por 100 mililitros de disolvente (g/(100 mL), a menudo escrito como g/100 ml), o como gramos de soluto por decilitro de disolvente (g/dL); o, con menos frecuencia, como gramos de soluto por litro de disolvente (g/L). La cantidad de disolvente puede expresarse en masa, como gramos de soluto por 100 gramos de disolvente (g/(100 g), a menudo escrito como g/100 g), o como gramos de soluto por kilogramo de disolvente (g/kg). El número puede expresarse como un porcentaje en este caso, y la abreviatura "w/w" puede usarse para indicar "peso por peso". [6] (Los valores en g/L y g/kg son similares para el agua, pero ese puede no ser el caso para otros disolventes).
Alternativamente, la solubilidad de un soluto se puede expresar en moles en lugar de masa. Por ejemplo, si la cantidad de disolvente se expresa en kilogramos , el valor es la molalidad de la solución (mol/kg).
La solubilidad de una sustancia en un líquido también puede expresarse como la cantidad de soluto por cantidad de solución , en lugar de la cantidad de disolvente. Por ejemplo, siguiendo la práctica común en titulación , puede expresarse como moles de soluto por litro de solución (mol/L), siendo la molaridad de este último.
En contextos más especializados, la solubilidad puede expresarse mediante la fracción molar (moles de soluto por moles totales de soluto más disolvente) o mediante la fracción de masa en equilibrio (masa de soluto por masa de soluto más disolvente). Ambos son números adimensionales entre 0 y 1 que pueden expresarse como porcentajes (%).
En el caso de soluciones de líquidos o gases en líquidos, las cantidades de ambas sustancias pueden expresarse en volumen en lugar de en masa o moles, como por ejemplo litro de soluto por litro de disolvente o litro de soluto por litro de solución. El valor puede expresarse en porcentaje y puede utilizarse la abreviatura "v/v" para "volumen por volumen" para indicar esta elección.
La conversión entre estas diversas formas de medir la solubilidad puede no ser trivial, ya que puede requerir conocer la densidad de la solución, que a menudo no se mide y no se puede predecir. Si bien la masa total se conserva por disolución, el volumen final puede ser diferente tanto del volumen del solvente como de la suma de los dos volúmenes. [7]
Además, muchos sólidos (como los ácidos y las sales ) se disocian de maneras no triviales cuando se disuelven; a la inversa, el disolvente puede formar complejos de coordinación con las moléculas o iones del soluto. En esos casos, la suma de los moles de moléculas de soluto y disolvente no es realmente la cantidad total de moles de partículas independientes en solución. Para evitar ese problema, la solubilidad por mol de solución se calcula y se cita generalmente como si el soluto no se disociara ni formara complejos, es decir, pretendiendo que la cantidad molar de solución es la suma de las cantidades molares de las dos sustancias.
El grado de solubilidad varía ampliamente, desde infinitamente soluble (sin límite, es decir, miscible [2] ) como el etanol en agua, hasta esencialmente insoluble, como el dióxido de titanio en agua. También se utilizan otros términos descriptivos para calificar el grado de solubilidad para una aplicación determinada. Por ejemplo, la farmacopea estadounidense proporciona los siguientes términos, según la masa m sv del disolvente necesaria para disolver una unidad de masa m su de soluto: [8] (Las solubilidades de los ejemplos son aproximadas, para agua a 20–25 °C).
Los umbrales para describir algo como insoluble, o términos similares, pueden depender de la aplicación. Por ejemplo, una fuente afirma que las sustancias se describen como "insolubles" cuando su solubilidad es inferior a 0,1 g por 100 ml de disolvente. [9]
La solubilidad se produce en condiciones de equilibrio dinámico, lo que significa que la solubilidad resulta de los procesos simultáneos y opuestos de disolución y unión de fases (por ejemplo, precipitación de sólidos ). Un estado estable del equilibrio de solubilidad se produce cuando las velocidades de disolución y unión son iguales, lo que significa que las cantidades relativas de materiales disueltos y no disueltos son iguales. Si se elimina el disolvente, se recupera toda la sustancia que se había disuelto.
El término solubilidad también se utiliza en algunos campos en los que el soluto se altera por solvólisis . Por ejemplo, se dice que muchos metales y sus óxidos son "solubles en ácido clorhídrico", aunque en realidad el ácido acuoso degrada irreversiblemente el sólido para dar productos solubles. La mayoría de los sólidos iónicos se disocian cuando se disuelven en disolventes polares. En aquellos casos en los que el soluto no se recupera tras la evaporación del disolvente, el proceso se denomina solvólisis. El concepto termodinámico de solubilidad no se aplica directamente a la solvólisis.
Cuando un soluto se disuelve, puede formar varias especies en la solución. Por ejemplo, una solución acuosa de cloruro de cobalto (II) puede producir [Co(H 2 O) 6 ] 2+ , [CoCl(H 2 O) 5 ] + , CoCl 2 (H 2 O) 2 , cada uno de los cuales se interconvierte.
La solubilidad se define para fases específicas . Por ejemplo, se espera que la solubilidad de la aragonita y la calcita en agua sea diferente, aunque ambas sean polimorfos del carbonato de calcio y tengan la misma fórmula química . [ Aclaración necesaria ]
La solubilidad de una sustancia en otra está determinada por el equilibrio de fuerzas intermoleculares entre el disolvente y el soluto, y el cambio de entropía que acompaña a la solvatación. Factores como la temperatura y la presión alterarán este equilibrio, modificando así la solubilidad.
La solubilidad también puede depender en gran medida de la presencia de otras especies disueltas en el disolvente, por ejemplo, aniones formadores de complejos ( ligandos ) en líquidos. La solubilidad también dependerá del exceso o deficiencia de un ion común en la solución [ aclaración necesaria ] , un fenómeno conocido como el efecto del ion común . En menor medida, la solubilidad dependerá de la fuerza iónica de las soluciones. Los dos últimos efectos se pueden cuantificar utilizando la ecuación para el equilibrio de solubilidad .
En el caso de un sólido que se disuelve en una reacción redox, se espera que la solubilidad dependa del potencial (dentro del rango de potenciales bajo los cuales el sólido permanece como la fase termodinámicamente estable). Por ejemplo, se observa que la solubilidad del oro en agua a alta temperatura es casi un orden de magnitud mayor (es decir, aproximadamente diez veces mayor) cuando el potencial redox se controla utilizando un tampón redox Fe3O4 -Fe2O3 altamente oxidante que con un tampón Ni -NiO moderadamente oxidante . [ 10 ]
La solubilidad (metaestable, en concentraciones cercanas a la saturación) también depende del tamaño físico del cristal o gota de soluto (o, estrictamente hablando, del área superficial específica o área superficial molar del soluto). [11] Para cuantificación, véase la ecuación en el artículo sobre equilibrio de solubilidad . Para cristales altamente defectuosos, la solubilidad puede aumentar con el creciente grado de desorden. Ambos efectos ocurren debido a la dependencia de la constante de solubilidad de la energía de Gibbs del cristal. Los dos últimos efectos, aunque a menudo son difíciles de medir, son de importancia práctica. [ cita requerida ] Por ejemplo, proporcionan la fuerza impulsora para el envejecimiento del precipitado (el tamaño del cristal aumenta espontáneamente con el tiempo).
La solubilidad de un soluto dado en un disolvente dado es función de la temperatura. Dependiendo del cambio en la entalpía (Δ H ) de la reacción de disolución, es decir , del carácter endotérmico (Δ H > 0) o exotérmico (Δ H < 0) de la reacción de disolución, la solubilidad de un compuesto dado puede aumentar o disminuir con la temperatura. La ecuación de van 't Hoff relaciona el cambio de la constante de equilibrio de solubilidad ( K sp ) con el cambio de temperatura y con el cambio de entalpía de reacción . Para la mayoría de los sólidos y líquidos, su solubilidad aumenta con la temperatura porque su reacción de disolución es endotérmica (Δ H > 0). [12] En agua líquida a altas temperaturas (p. ej., la que se acerca a la temperatura crítica ), la solubilidad de los solutos iónicos tiende a disminuir debido al cambio de propiedades y estructura del agua líquida; la constante dieléctrica más baja da como resultado un disolvente menos polar y un cambio de energía de hidratación que afecta a la Δ G de la reacción de disolución.
Los solutos gaseosos presentan un comportamiento más complejo con la temperatura. A medida que aumenta la temperatura, los gases suelen volverse menos solubles en agua (reacción de disolución exotérmica relacionada con su hidratación) (hasta un mínimo, que es inferior a 120 °C para la mayoría de los gases permanentes [13] ), pero más solubles en disolventes orgánicos (reacción de disolución endotérmica relacionada con su solvatación). [12]
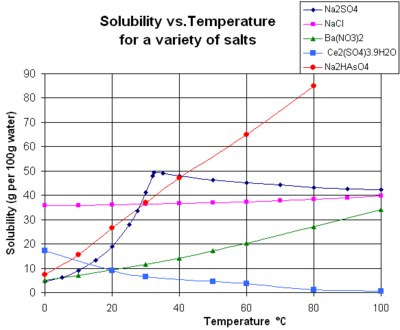
El gráfico muestra curvas de solubilidad para algunas sales inorgánicas sólidas típicas en agua líquida (la temperatura está en grados Celsius , es decir, kelvin menos 273,15). [14] Muchas sales se comportan como el nitrato de bario y el arseniato de hidrógeno disódico , y muestran un gran aumento de la solubilidad con la temperatura (Δ H > 0). Algunos solutos (por ejemplo, el cloruro de sodio en agua) exhiben una solubilidad que es bastante independiente de la temperatura (Δ H ≈ 0). Algunos, como el sulfato de calcio ( yeso ) y el sulfato de cerio (III) , se vuelven menos solubles en agua a medida que aumenta la temperatura (Δ H < 0). [15] Este también es el caso del hidróxido de calcio ( portlandita ), cuya solubilidad a 70 °C es aproximadamente la mitad de su valor a 25 °C. La disolución del hidróxido de calcio en agua también es un proceso exotérmico (Δ H < 0). Como dictan la ecuación de van 't Hoff y el principio de Le Chatelier , las temperaturas más bajas favorecen la disolución de Ca(OH) 2 . La solubilidad de la portlandita aumenta a baja temperatura. Esta dependencia de la temperatura a veces se denomina solubilidad "retrógrada" o "inversa". [ cita requerida ] Ocasionalmente, se observa un patrón más complejo, como con el sulfato de sodio , donde el cristal de decahidrato menos soluble ( mirabilita ) pierde agua de cristalización a 32 °C para formar una fase anhidra más soluble ( thenardita ) con un cambio menor en la energía libre de Gibbs (Δ G ) en la reacción de disolución. [ cita requerida ]
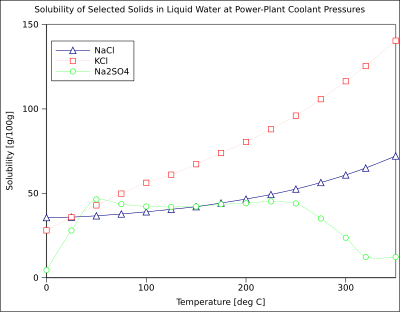
La solubilidad de los compuestos orgánicos casi siempre aumenta con la temperatura. La técnica de recristalización , utilizada para la purificación de sólidos, depende de las diferentes solubilidades de un soluto en un disolvente caliente y frío. Existen algunas excepciones, como ciertas ciclodextrinas . [16]
En el caso de las fases condensadas (sólidas y líquidas), la dependencia de la solubilidad con la presión suele ser débil y, por lo general, se descuida en la práctica. Suponiendo una solución ideal , la dependencia se puede cuantificar como:
donde el índice itera los componentes, es la fracción molar del -ésimo componente en la solución, es la presión, el índice se refiere a la temperatura constante, es el volumen molar parcial del -ésimo componente en la solución, es el volumen molar parcial del -ésimo componente en el sólido en disolución, y es la constante universal de los gases . [17]
La dependencia de la presión de la solubilidad tiene en ocasiones importancia práctica. Por ejemplo, la contaminación por precipitación de los yacimientos y pozos petrolíferos con sulfato de calcio (que disminuye su solubilidad al disminuir la presión) puede dar lugar a una disminución de la productividad con el tiempo.
La ley de Henry se utiliza para cuantificar la solubilidad de los gases en disolventes. La solubilidad de un gas en un disolvente es directamente proporcional a la presión parcial de ese gas sobre el disolvente. Esta relación es similar a la ley de Raoult y puede escribirse como:
donde es una constante dependiente de la temperatura (por ejemplo, 769,2 L · atm / mol para dioxígeno (O 2 ) en agua a 298 K), es la presión parcial (en atm), y es la concentración del gas disuelto en el líquido (en mol/L).
La solubilidad de los gases a veces también se cuantifica utilizando el coeficiente de solubilidad de Bunsen .
En presencia de pequeñas burbujas , la solubilidad del gas no depende del radio de la burbuja de ninguna otra manera que a través del efecto del radio sobre la presión (es decir, la solubilidad del gas en el líquido en contacto con pequeñas burbujas aumenta debido al aumento de presión en Δ p = 2γ/ r ; ver ecuación de Young-Laplace ). [18]
La ley de Henry es válida para los gases que no sufren cambios de especiación química al disolverse. La ley de Sievert muestra un caso en el que esta suposición no se cumple.
La solubilidad del dióxido de carbono en el agua de mar también se ve afectada por la temperatura, el pH de la solución y por el tampón de carbonato . La disminución de la solubilidad del dióxido de carbono en el agua de mar cuando aumenta la temperatura también es un factor de retroacción importante (retroalimentación positiva) que exacerba los cambios climáticos pasados y futuros, como se observa en los núcleos de hielo del sitio Vostok en la Antártida . A escala de tiempo geológico , debido a los ciclos de Milankovich , cuando los parámetros astronómicos de la órbita de la Tierra y su eje de rotación cambian progresivamente y modifican la irradiancia solar en la superficie de la Tierra, la temperatura comienza a aumentar. Cuando se inicia un período de desglaciación, el calentamiento progresivo de los océanos libera CO 2 a la atmósfera debido a su menor solubilidad en agua de mar más cálida. A su vez, los niveles más altos de CO 2 en la atmósfera aumentan el efecto invernadero y el dióxido de carbono actúa como un amplificador del calentamiento general.
Un aforismo popular utilizado para predecir la solubilidad es " lo similar disuelve a lo similar ", también expresado en el idioma latino como " Similia similibus solventur ". [19] Esta afirmación indica que un soluto se disolverá mejor en un disolvente que tenga una estructura química similar a la suya, basándose en una entropía favorable de mezcla . Esta visión es simplista, pero es una regla práctica útil. La capacidad de solvatación general de un disolvente depende principalmente de su polaridad . [a] Por ejemplo, un soluto muy polar ( hidrófilo ) como la urea es muy soluble en agua altamente polar, menos soluble en metanol bastante polar y prácticamente insoluble en disolventes no polares como el benceno . Por el contrario, un soluto no polar o lipofílico como el naftaleno es insoluble en agua, bastante soluble en metanol y altamente soluble en benceno no polar. [20]
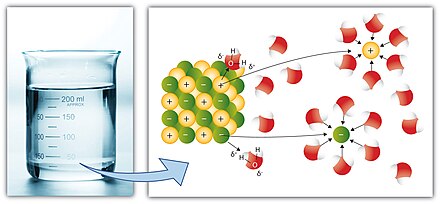
En términos aún más simples, un compuesto iónico simple (con iones positivos y negativos) como el cloruro de sodio (sal común) es fácilmente soluble en un solvente altamente polar (con cierta separación de cargas positivas (δ+) y negativas (δ-) en la molécula covalente) como el agua , por lo que el mar es salado ya que acumula sales disueltas desde épocas geológicas tempranas.
La solubilidad se ve favorecida por la entropía de mezcla (Δ S ) y depende de la entalpía de disolución (Δ H ) y del efecto hidrofóbico . La energía libre de disolución ( energía de Gibbs ) depende de la temperatura y viene dada por la relación: Δ G = Δ H – TΔ S . Cuanto menor sea Δ G, mayor será la solubilidad.
Los químicos suelen aprovechar las diferencias de solubilidad para separar y purificar compuestos de mezclas de reacción, utilizando la técnica de extracción líquido-líquido . Esto se aplica en vastas áreas de la química, desde la síntesis de fármacos hasta el reprocesamiento de combustible nuclear gastado .
La disolución no es un proceso instantáneo. La velocidad de solubilización (en kg/s) está relacionada con el producto de solubilidad y el área superficial del material. La velocidad a la que se disuelve un sólido puede depender de su cristalinidad o de la falta de ella en el caso de los sólidos amorfos y del área superficial (tamaño de los cristales) y de la presencia de polimorfismo . Muchos sistemas prácticos ilustran este efecto, por ejemplo, en el diseño de métodos para la administración controlada de fármacos . En algunos casos, los equilibrios de solubilidad pueden tardar mucho tiempo en establecerse (horas, días, meses o muchos años; dependiendo de la naturaleza del soluto y otros factores).
La velocidad de disolución se puede expresar a menudo mediante la ecuación de Noyes-Whitney o la ecuación de Nernst y Brunner [21] de la forma:
dónde:
En el caso de disolución limitada por difusión (o transferencia de masa si hay mezcla), es igual a la solubilidad de la sustancia. Cuando la velocidad de disolución de una sustancia pura se normaliza con respecto al área de superficie del sólido (que suele cambiar con el tiempo durante el proceso de disolución), se expresa en kg/m 2 s y se denomina "velocidad de disolución intrínseca". La velocidad de disolución intrínseca se define en la Farmacopea de los Estados Unidos .
Las tasas de disolución varían en órdenes de magnitud entre los distintos sistemas. Normalmente, las tasas de disolución muy bajas se corresponden con solubilidades bajas, y las sustancias con solubilidades altas presentan tasas de disolución altas, como lo sugiere la ecuación de Noyes-Whitney.
Las constantes de solubilidad se utilizan para describir soluciones saturadas de compuestos iónicos de solubilidad relativamente baja (ver equilibrio de solubilidad ). La constante de solubilidad es un caso especial de una constante de equilibrio . Dado que es un producto de las concentraciones de iones en equilibrio, también se conoce como el producto de solubilidad . Describe el equilibrio entre los iones disueltos de la sal y la sal no disuelta. La constante de solubilidad también es "aplicable" (es decir, útil) a la precipitación , la reacción inversa de la disolución. Al igual que con otras constantes de equilibrio, la temperatura puede afectar el valor numérico de la constante de solubilidad. Si bien la constante de solubilidad no es tan simple como la solubilidad, el valor de esta constante generalmente es independiente de la presencia de otras especies en el solvente.
La teoría de la solución de Flory-Huggins es un modelo teórico que describe la solubilidad de los polímeros. Los parámetros de solubilidad de Hansen y los parámetros de solubilidad de Hildebrand son métodos empíricos para la predicción de la solubilidad. También es posible predecir la solubilidad a partir de otras constantes físicas como la entalpía de fusión .
El coeficiente de partición octanol-agua , expresado habitualmente como su logaritmo (Log P), es una medida de la solubilidad diferencial de un compuesto en un disolvente hidrófobo ( 1-octanol ) y un disolvente hidrófilo (agua). El logaritmo de estos dos valores permite clasificar los compuestos en términos de hidrofilicidad (o hidrofobicidad).
El cambio de energía asociado con la disolución generalmente se expresa por mol de soluto como la entalpía de solución .
La solubilidad es de importancia fundamental en un gran número de disciplinas científicas y aplicaciones prácticas, que van desde el procesamiento de minerales y el reprocesamiento nuclear hasta el uso de medicamentos y el transporte de contaminantes.
A menudo se dice que la solubilidad es una de las "propiedades características de una sustancia", lo que significa que la solubilidad se utiliza comúnmente para describir la sustancia, para indicar la polaridad de una sustancia, para ayudar a distinguirla de otras sustancias y como guía para las aplicaciones de la sustancia. Por ejemplo, el índigo se describe como "insoluble en agua, alcohol o éter, pero soluble en cloroformo, nitrobenceno o ácido sulfúrico concentrado ". [22]
La solubilidad de una sustancia es útil para separar mezclas. Por ejemplo, una mezcla de sal ( cloruro de sodio ) y sílice se puede separar disolviendo la sal en agua y filtrando la sílice no disuelta. La síntesis de compuestos químicos, por miligramo en un laboratorio o por tonelada en la industria, utiliza las solubilidades relativas del producto deseado, así como de los materiales de partida que no han reaccionado, los subproductos y los productos secundarios para lograr la separación.
Otro ejemplo de esto es la síntesis de ácido benzoico a partir de bromuro de fenilmagnesio y hielo seco . El ácido benzoico es más soluble en un disolvente orgánico como el diclorometano o el éter dietílico , y cuando se agita con este disolvente orgánico en un embudo de decantación , se disolverá preferentemente en la capa orgánica. Los demás productos de reacción, incluido el bromuro de magnesio, permanecerán en la capa acuosa, lo que demuestra claramente que se logra la separación basada en la solubilidad. Este proceso, conocido como extracción líquido-líquido , es una técnica importante en la química sintética . El reciclado se utiliza para garantizar la máxima extracción.
En sistemas en movimiento, las diferencias de solubilidad suelen determinar el transporte de especies impulsado por la disolución-precipitación. Esto sucede cuando distintas partes del sistema experimentan condiciones diferentes. Incluso condiciones ligeramente diferentes pueden producir efectos significativos, si se da el tiempo suficiente.
Por ejemplo, se ha descubierto que los compuestos de solubilidad relativamente baja son solubles en entornos más extremos, lo que da lugar a efectos geoquímicos y geológicos de la actividad de los fluidos hidrotermales en la corteza terrestre. Estos suelen ser la fuente de depósitos minerales económicos de alta calidad y gemas preciosas o semipreciosas. De la misma manera, los compuestos con baja solubilidad se disolverán en un tiempo prolongado (tiempo geológico), lo que dará lugar a efectos importantes, como extensos sistemas de cuevas o superficies terrestres kársticas.
Algunos compuestos iónicos ( sales ) se disuelven en agua, lo que surge debido a la atracción entre cargas positivas y negativas (ver: solvatación ). Por ejemplo, los iones positivos de la sal (p. ej. Ag + ) atraen al átomo de oxígeno parcialmente negativo en H 2 O . Del mismo modo, los iones negativos de la sal (p. ej. Cl − ) atraen a los hidrógenos parcialmente positivos en H 2 O . Nota: el átomo de oxígeno es parcialmente negativo porque es más electronegativo que el hidrógeno, y viceversa (ver: polaridad química ).
Sin embargo, existe un límite a la cantidad de sal que se puede disolver en un volumen dado de agua. Esta concentración es la solubilidad y está relacionada con el producto de solubilidad , K sp . Esta constante de equilibrio depende del tipo de sal ( AgCl vs. NaCl , por ejemplo), la temperatura y el efecto del ion común.
Se puede calcular la cantidad de AgCl que se disolverá en 1 litro de agua pura de la siguiente manera:
[Ag + ] = [Cl − ], en ausencia de otras sales de plata o cloruro, por lo que
Resultado: 1 litro de agua puede disolver 1,34 × 10 −5 moles de AgCl a temperatura ambiente. En comparación con otras sales, el AgCl es poco soluble en agua. Por ejemplo, la sal de mesa ( NaCl ) tiene una K sp = 36 mucho más alta y, por lo tanto, es más soluble. La siguiente tabla ofrece una descripción general de las reglas de solubilidad para varios compuestos iónicos.
El principio descrito anteriormente en el apartado de polaridad, según el cual lo similar disuelve a lo similar , es la guía habitual para la solubilidad en sistemas orgánicos. Por ejemplo, la vaselina se disolverá en gasolina porque tanto la vaselina como la gasolina son hidrocarburos no polares. Por otro lado, no se disolverá en alcohol etílico o agua, ya que la polaridad de estos disolventes es demasiado alta. El azúcar no se disolverá en gasolina, ya que el azúcar es demasiado polar en comparación con la gasolina. Por lo tanto, una mezcla de gasolina y azúcar se puede separar por filtración o extracción con agua.
Este término se utiliza a menudo en el campo de la metalurgia para referirse al grado en que un elemento de aleación se disolverá en el metal base sin formar una fase separada . El solvus o línea (o curva) de solubilidad es la línea (o líneas) en un diagrama de fases que dan los límites de adición de soluto. Es decir, las líneas muestran la cantidad máxima de un componente que se puede agregar a otro componente y aún estar en solución sólida . En la estructura cristalina del sólido, el elemento "soluto" puede tomar el lugar de la matriz dentro de la red (una posición sustitutiva; por ejemplo, cromo en hierro) o tomar un lugar en un espacio entre los puntos de la red (una posición intersticial; por ejemplo, carbono en hierro).
En la fabricación microelectrónica, la solubilidad sólida se refiere a la concentración máxima de impurezas que se pueden colocar en el sustrato.
En los compuestos sólidos (a diferencia de los elementos), la solubilidad de un elemento soluto también puede depender de las fases que se separan en el equilibrio. Por ejemplo, la cantidad de Sn soluble en la fase ZnSb puede depender significativamente de si las fases que se separan en el equilibrio son (Zn 4 Sb 3 + Sn(L)) o (ZnSnSb 2 + Sn(L)). [24] Además de estos, el compuesto ZnSb con Sn como soluto puede separarse en otras combinaciones de fases después de que se alcanza el límite de solubilidad dependiendo de la composición química inicial durante la síntesis. Cada combinación produce una solubilidad diferente de Sn en ZnSb. Por lo tanto, los estudios de solubilidad en compuestos, concluidos en la primera instancia de observación de fases secundarias que se separan podrían subestimar la solubilidad. [25] Si bien el número máximo de fases que se separan a la vez en el equilibrio se puede determinar mediante la regla de fases de Gibbs , para los compuestos químicos no hay límite en el número de tales combinaciones de fases que se separan en sí. Por lo tanto, determinar experimentalmente la "solubilidad máxima" en compuestos sólidos puede ser difícil, ya que es necesario equilibrar muchas muestras. Si el defecto cristalográfico dominante (en su mayoría defectos intersticiales o de punto de sustitución) involucrado en la solución sólida se puede intuir químicamente de antemano, entonces el uso de algunas pautas termodinámicas simples puede reducir considerablemente el número de muestras necesarias para establecer la solubilidad máxima. [26]
Muchas sustancias se disuelven de manera congruente (es decir, la composición del sólido y del soluto disuelto coinciden estequiométricamente). Sin embargo, algunas sustancias pueden disolverse de manera incongruente , por lo que la composición del soluto en solución no coincide con la del sólido. Esta solubilización se acompaña de la alteración del "sólido primario" y posiblemente de la formación de una fase sólida secundaria. Sin embargo, en general, también permanece algo de sólido primario y se establece un equilibrio de solubilidad complejo. Por ejemplo, la disolución de albita puede dar lugar a la formación de gibbsita . [27]
En este caso, se espera que la solubilidad de la albita dependa de la relación sólido-disolvente. Este tipo de solubilidad es de gran importancia en geología, donde da lugar a la formación de rocas metamórficas .
En principio, tanto la disolución congruente como la incongruente pueden dar lugar a la formación de fases sólidas secundarias en equilibrio. Por ello, en el campo de la ciencia de los materiales , la solubilidad para ambos casos se describe de forma más general en los diagramas de fases de composición química .
La solubilidad es una propiedad de interés en muchos aspectos de la ciencia, incluyendo, pero no limitado a: predicciones ambientales, bioquímica, farmacia, diseño de fármacos, diseño agroquímico y unión de ligandos de proteínas. La solubilidad acuosa es de interés fundamental debido a las funciones biológicas y de transporte vitales que desempeña el agua. [28] [29] [30] Además de este claro interés científico en la solubilidad en agua y los efectos de los solventes, las predicciones precisas de la solubilidad son importantes industrialmente. La capacidad de predecir con precisión la solubilidad de una molécula representa un ahorro financiero potencialmente grande en muchos procesos de desarrollo de productos químicos, como los farmacéuticos. [31] En la industria farmacéutica, las predicciones de solubilidad forman parte del proceso de optimización inicial de los candidatos a fármacos. La solubilidad sigue siendo una preocupación hasta la formulación. [31] Se han aplicado varios métodos a tales predicciones, incluidas las relaciones cuantitativas estructura-actividad (QSAR), las relaciones cuantitativas estructura-propiedad (QSPR) y la minería de datos . Estos modelos proporcionan predicciones eficientes de la solubilidad y representan el estándar actual. El inconveniente de estos modelos es que pueden carecer de información física. Un método basado en la teoría física, capaz de lograr niveles similares de precisión a un coste razonable, sería una herramienta poderosa a nivel científico e industrial. [32] [33] [34] [35]
Los métodos basados en la teoría física tienden a utilizar ciclos termodinámicos, un concepto de la termodinámica clásica . Los dos ciclos termodinámicos más comunes implican el cálculo de la energía libre de sublimación (de sólido a gas sin pasar por un estado líquido) y la energía libre de solvatación de una molécula gaseosa (de gas a solución), o la energía libre de fusión (de sólido a una fase fundida) y la energía libre de mezcla (de fundido a solución). Estos dos procesos se representan en los siguientes diagramas.


Estos ciclos se han utilizado para intentar realizar predicciones de primeros principios (resolver usando las ecuaciones físicas fundamentales) usando modelos de solventes motivados físicamente [33] , para crear ecuaciones paramétricas y modelos QSPR [36] [34] y combinaciones de los dos. [34] El uso de estos ciclos permite el cálculo de la energía libre de solvatación indirectamente a través de gas (en el ciclo de sublimación) o una masa fundida (ciclo de fusión). Esto es útil ya que calcular la energía libre de solvatación directamente es extremadamente difícil. La energía libre de solvatación se puede convertir en un valor de solubilidad usando varias fórmulas, el caso más general se muestra a continuación, donde el numerador es la energía libre de solvatación, R es la constante del gas y T es la temperatura en kelvins . [33]
Las ecuaciones ajustadas más conocidas para la predicción de la solubilidad son las ecuaciones de solubilidad generales. Estas ecuaciones se derivan del trabajo de Yalkowsky et al . [37] [38] La fórmula original se presenta primero, seguida de una fórmula revisada que asume un supuesto diferente de miscibilidad completa en octanol. [38]
Estas ecuaciones se basan en los principios del ciclo de fusión.