La recombinación genética (también conocida como reorganización genética ) es el intercambio de material genético entre diferentes organismos que conduce a la producción de descendencia con combinaciones de rasgos que difieren de los encontrados en cualquiera de los padres. En los eucariotas , la recombinación genética durante la meiosis puede conducir a un nuevo conjunto de información genética que puede transmitirse de padres a hijos. La mayor parte de la recombinación ocurre naturalmente y puede clasificarse en dos tipos: (1) recombinación intercromosómica , que ocurre a través de una variedad independiente de alelos cuyos loci están en cromosomas diferentes pero homólogos (orientación aleatoria de pares de cromosomas homólogos en la meiosis I); y (2) recombinación intracromosómica , que se produce mediante entrecruzamiento. [1]
Durante la meiosis en eucariotas , la recombinación genética implica el emparejamiento de cromosomas homólogos . A esto puede seguirle una transferencia de información entre los cromosomas. La transferencia de información puede ocurrir sin intercambio físico (una sección de material genético se copia de un cromosoma a otro, sin que se cambie el cromosoma donante) (ver SDSA – Vía de recocido de hebras dependiente de la síntesis en la figura); o por la rotura y unión de cadenas de ADN , lo que forma nuevas moléculas de ADN (ver vía DHJ en la Figura).
La recombinación también puede ocurrir durante la mitosis en eucariotas, donde normalmente involucra a los dos cromosomas hermanos formados después de la replicación cromosómica. En este caso no se producen nuevas combinaciones de alelos ya que los cromosomas hermanos suelen ser idénticos. En la meiosis y la mitosis se produce la recombinación entre moléculas similares de ADN ( secuencias homólogas ). En la meiosis, los cromosomas homólogos no hermanos se emparejan entre sí de modo que la recombinación ocurre característicamente entre homólogos no hermanos. Tanto en las células meióticas como en las mitóticas, la recombinación entre cromosomas homólogos es un mecanismo común utilizado en la reparación del ADN .
Conversión genética : el proceso durante el cual las secuencias homólogas se vuelven idénticas también se incluye en la recombinación genética.
La recombinación genética y la reparación recombinante del ADN también se producen en bacterias y arqueas , que utilizan la reproducción asexual .
La recombinación puede inducirse artificialmente en entornos de laboratorio ( in vitro ), produciendo ADN recombinante para fines que incluyen el desarrollo de vacunas .
La recombinación V(D)J en organismos con un sistema inmunológico adaptativo es un tipo de recombinación genética de sitio específico que ayuda a las células inmunes a diversificarse rápidamente para reconocer y adaptarse a nuevos patógenos .
Durante la meiosis, la sinapsis (el emparejamiento de cromosomas homólogos) normalmente precede a la recombinación genética.
La recombinación genética es catalizada por muchas enzimas diferentes . Las recombinasas son enzimas clave que catalizan el paso de transferencia de cadena durante la recombinación. RecA , la principal recombinasa que se encuentra en Escherichia coli , es responsable de la reparación de las roturas de doble cadena del ADN (DSB). En la levadura y otros organismos eucariotas se necesitan dos recombinasas para reparar las DSB. La proteína RAD51 es necesaria para la recombinación mitótica y meiótica , mientras que la proteína reparadora del ADN, DMC1 , es específica de la recombinación meiótica. En las arqueas, el ortólogo de la proteína RecA bacteriana es RadA.
En las bacterias hay recombinación bacteriana regular , así como transferencia ineficaz de material genético , expresada como transferencia fallida o transferencia abortiva, que es cualquier transferencia de ADN bacteriano de la célula donante a receptores que han configurado el ADN entrante como parte del material genético de la recipiente. La transferencia abortiva se registró en la siguiente transducción y conjugación. En todos los casos, el fragmento transmitido se diluye con el crecimiento del cultivo. [2] [3] [4]

En eucariotas , la recombinación durante la meiosis se ve facilitada por el cruce cromosómico . El proceso de cruce conduce a que la descendencia tenga combinaciones de genes diferentes a las de sus padres y, ocasionalmente, pueda producir nuevos alelos quiméricos . La mezcla de genes provocada por la recombinación genética produce una mayor variación genética . También permite que los organismos que se reproducen sexualmente eviten el trinquete de Muller , en el que los genomas de una población asexual tienden a acumular con el tiempo más mutaciones deletéreas que otros tipos de mutaciones beneficiosas o inversas.
El cruce cromosómico implica la recombinación entre los cromosomas pares heredados de cada uno de los padres, y generalmente ocurre durante la meiosis . Durante la profase I (etapa de paquiteno), las cuatro cromátidas disponibles están en estrecha formación entre sí. Mientras están en esta formación, los sitios homólogos en dos cromátidas pueden emparejarse estrechamente entre sí y pueden intercambiar información genética. [5]
Debido a que la recombinación puede ocurrir con pequeña probabilidad en cualquier ubicación a lo largo del cromosoma, la frecuencia de recombinación entre dos ubicaciones depende de la distancia que las separa. Por lo tanto, para genes suficientemente distantes en el mismo cromosoma, la cantidad de cruce es lo suficientemente alta como para destruir la correlación entre los alelos .
El seguimiento del movimiento de genes resultantes de cruces ha resultado muy útil para los genetistas. Debido a que dos genes que están muy juntos tienen menos probabilidades de separarse que genes que están más separados, los genetistas pueden deducir aproximadamente qué tan separados están dos genes en un cromosoma si conocen la frecuencia de los cruces. Los genetistas también pueden utilizar este método para inferir la presencia de ciertos genes. Se dice que los genes que normalmente permanecen juntos durante la recombinación están vinculados. En ocasiones, un gen de un par vinculado puede utilizarse como marcador para deducir la presencia de otro gen. Por lo general, esto se usa para detectar la presencia de un gen que causa una enfermedad. [6]
La frecuencia de recombinación entre dos loci observados es el valor de cruce . Es la frecuencia de cruce entre dos loci genéticos vinculados ( marcadores ) y depende de la distancia mutua de los loci genéticos observados. Para cualquier conjunto fijo de condiciones genéticas y ambientales, la recombinación en una región particular de una estructura de enlace ( cromosoma ) tiende a ser constante, y lo mismo ocurre con el valor de entrecruzamiento que se utiliza en la producción de mapas genéticos . [2] [7]
En la conversión de genes, una sección de material genético se copia de un cromosoma a otro, sin que se cambie el cromosoma donante. La conversión de genes ocurre con alta frecuencia en el sitio real del evento de recombinación durante la meiosis . Es un proceso mediante el cual se copia una secuencia de ADN de una hélice de ADN (que permanece sin cambios) a otra hélice de ADN, cuya secuencia se altera. La conversión de genes se ha estudiado a menudo en cruces de hongos [8] donde se pueden observar convenientemente los 4 productos de meiosis individuales. Los eventos de conversión genética se pueden distinguir como desviaciones en una meiosis individual del patrón de segregación normal 2:2 (por ejemplo, un patrón 3:1).
La recombinación puede ocurrir entre secuencias de ADN que no contienen homología de secuencia . Esto puede provocar translocaciones cromosómicas , que en ocasiones provocan cáncer.
Las células B del sistema inmunológico realizan una recombinación genética, llamada cambio de clase de inmunoglobulina . Es un mecanismo biológico que cambia un anticuerpo de una clase a otra, por ejemplo, de un isotipo llamado IgM a un isotipo llamado IgG .
En ingeniería genética , recombinación también puede referirse a la recombinación artificial y deliberada de fragmentos dispares de ADN, a menudo de diferentes organismos, creando lo que se llama ADN recombinante . Un excelente ejemplo de tal uso de la recombinación genética es la selección de genes , que puede usarse para agregar, eliminar o cambiar los genes de un organismo. Esta técnica es importante para los investigadores biomédicos ya que les permite estudiar los efectos de genes específicos. Las técnicas basadas en la recombinación genética también se aplican en ingeniería de proteínas para desarrollar nuevas proteínas de interés biológico.
Los ejemplos incluyen la integración mediada por enzimas de restricción , el ensamblaje de Gibson y la clonación Golden Gate .
Los daños en el ADN causados por una variedad de agentes exógenos (p. ej. , luz ultravioleta , rayos X , agentes químicos de reticulación ) pueden repararse mediante reparación recombinante homóloga (HRR). [9] [10] Estos hallazgos sugieren que los daños en el ADN que surgen de procesos naturales , como la exposición a especies reactivas de oxígeno que son subproductos del metabolismo normal, también son reparados por HRR. En los seres humanos, las deficiencias en los productos genéticos necesarios para la HRR durante la meiosis probablemente causen infertilidad [11] En los seres humanos, las deficiencias en los productos genéticos necesarios para la HRR, como BRCA1 y BRCA2 , aumentan el riesgo de cáncer (ver Trastorno por deficiencia de reparación del ADN ).
En las bacterias, la transformación es un proceso de transferencia de genes que normalmente ocurre entre células individuales de la misma especie bacteriana. La transformación implica la integración del ADN del donante en el cromosoma del receptor mediante recombinación. Este proceso parece ser una adaptación para reparar los daños del ADN en el cromosoma receptor mediante HRR. [12] La transformación puede proporcionar un beneficio a las bacterias patógenas al permitir la reparación del daño del ADN, particularmente los daños que ocurren en el ambiente inflamatorio y oxidante asociado con la infección de un huésped.
Cuando dos o más virus, cada uno de los cuales contiene daños genómicos letales, infectan la misma célula huésped, los genomas del virus a menudo pueden emparejarse entre sí y someterse a HRR para producir una progenie viable. Este proceso, denominado reactivación de la multiplicidad, se ha estudiado en bacteriófagos lambda y T4 , [13] así como en varios virus patógenos. En el caso de virus patógenos, la reactivación de la multiplicidad puede ser un beneficio adaptativo para el virus, ya que permite la reparación de los daños en el ADN causados por la exposición al ambiente oxidante producido durante la infección del huésped. [12] Véase también reordenación .
En la primera figura de este artículo se describe un modelo molecular para el mecanismo de recombinación meiótica presentado por Anderson y Sekelsky [14] . Dos de las cuatro cromátidas presentes al principio de la meiosis (profase I) están emparejadas entre sí y pueden interactuar. La recombinación, en este modelo, se inicia mediante una rotura (o espacio) de doble hebra que se muestra en la molécula de ADN (cromátida) en la parte superior de la figura. Otros tipos de daño al ADN también pueden iniciar la recombinación. Por ejemplo, una reticulación entre cadenas (causada por la exposición a un agente de reticulación como la mitomicina C) puede repararse mediante HRR.
Se producen dos tipos de producto recombinante. En el lado derecho se indica un tipo "cruzado" (CO), donde se intercambian las regiones flanqueantes de los cromosomas, y en el lado izquierdo, un tipo "no cruzado" (NCO) donde las regiones flanqueantes no se intercambian. El tipo de recombinación CO implica la formación intermedia de dos "uniones Holliday" indicadas en la parte inferior derecha de la figura por dos estructuras en forma de X en cada una de las cuales hay un intercambio de hebras individuales entre las dos cromátidas participantes. Esta vía está etiquetada en la figura como vía DHJ (doble unión Holliday).
Los recombinantes NCO (ilustrados a la izquierda en la figura) se producen mediante un proceso denominado "recocido de cadenas dependiente de la síntesis" (SDSA). Los eventos de recombinación del tipo NCO/SDSA parecen ser más comunes que los del tipo CO/DHJ. [15] La vía NCO/SDSA contribuye poco a la variación genética, ya que los brazos de los cromosomas que flanquean el evento de recombinación permanecen en la configuración parental. Por tanto, las explicaciones de la función adaptativa de la meiosis que se centran exclusivamente en el entrecruzamiento son inadecuadas para explicar la mayoría de los eventos de recombinación.
La aquiasmia es el fenómeno en el que la recombinación autosómica está completamente ausente en un sexo de una especie. La segregación cromosómica aquiasmática está bien documentada en machos de Drosophila melanogaster . La heteroquiasmia ocurre cuando las tasas de recombinación difieren entre los sexos de una especie. [16] Este patrón dimórfico sexual en la tasa de recombinación se ha observado en muchas especies. En los mamíferos, las hembras suelen tener tasas más altas de recombinación. La "regla de Haldane-Huxley" establece que el aquiasmia suele presentarse en el sexo heterogamético . [dieciséis]
Numerosos virus de ARN son capaces de recombinación genética cuando al menos dos genomas virales están presentes en la misma célula huésped. [17] [18] La recombinación es en gran medida responsable de la diversidad de los virus de ARN y la evasión inmune. [19] La recombinación de ARN parece ser una fuerza impulsora importante en la determinación de la arquitectura del genoma y el curso de la evolución viral entre picornaviridae ( (+)ssRNA ) (por ejemplo, poliovirus ). [20] En los retroviridae ((+)ssRNA) (por ejemplo, VIH ), el daño en el genoma del ARN parece evitarse durante la transcripción inversa mediante el cambio de cadena, una forma de recombinación. [21] [22]
La recombinación también ocurre en reoviridae (dsRNA) (por ejemplo, reovirus), orthomyxoviridae ((-)ssRNA) (por ejemplo, virus de la influenza ) [22] y coronaviridae ((+)ssRNA) (por ejemplo, SARS ). [23] [24]
La recombinación en los virus de ARN parece ser una adaptación para hacer frente al daño del genoma. [17] El cambio entre cadenas plantilla durante la replicación del genoma, denominado recombinación por elección de copia, se propuso originalmente para explicar la correlación positiva de los eventos de recombinación en distancias cortas en organismos con un genoma de ADN (consulte la primera figura, vía SDSA ). [25]
La recombinación puede ocurrir con poca frecuencia entre virus animales de la misma especie pero de linajes divergentes. Los virus recombinantes resultantes a veces pueden causar un brote de infección en humanos. [23]
Especialmente en los coronavirus, la recombinación también puede ocurrir incluso entre grupos evolutivos (subgéneros) relacionados lejanamente, debido a su mecanismo de transcripción característico, que involucra ARNm subgenómicos que se forman mediante el cambio de plantilla. [26] [24]
Al replicar su genoma (+)ssRNA , la ARN polimerasa dependiente de ARN (RdRp) del poliovirus es capaz de llevar a cabo la recombinación. La recombinación parece ocurrir mediante un mecanismo de elección de copia en el que RdRp cambia las plantillas de ARNss (+) durante la síntesis de la cadena negativa. [27] La recombinación mediante el cambio de cadena RdRp también ocurre en los carmovirus y tombusvirus de plantas (+)ssRNA . [28]
La recombinación parece ser una fuerza impulsora importante para determinar la variabilidad genética dentro de los coronavirus, así como la capacidad de las especies de coronavirus para saltar de un huésped a otro y, con poca frecuencia, para la aparición de nuevas especies, aunque el mecanismo de recombinación no está claro. [23]
A principios de 2020, muchas secuencias genómicas de aislados australianos de SARS-CoV-2 tienen deleciones o mutaciones (29742G>A o 29742G>U; "G19A" o "G19U") en el s2m, lo que sugiere que puede haber ocurrido recombinación de ARN en este ARN. elemento. Se predijeron 29742G("G19"), 29744G("G21") y 29751G("G28") como puntos críticos de recombinación. [29] Durante los primeros meses de la pandemia de COVID-19, se sugirió que tal evento de recombinación había sido un paso crítico en la evolución de la capacidad del SARS-CoV-2 para infectar a los humanos. [30] El análisis de desequilibrio de ligamiento confirmó que la recombinación de ARN con la mutación 11083G > T también contribuyó al aumento de mutaciones entre la progenie viral. Los hallazgos indican que la mutación 11083G > T del SARS-CoV-2 se propagó durante la cuarentena a bordo del Diamond Princess y surgió a través de la recombinación de ARN de novo bajo presión de selección positiva. En tres pacientes en el crucero Diamond Princess , se localizaron dos mutaciones, 29736G > T y 29751G > T (G13 y G28) en el motivo similar al vástago II del coronavirus 3′ (s2m) del SARS-CoV-2. Aunque s2m se considera un motivo de ARN altamente conservado en la región 3' no traducida entre muchas especies de coronavirus, este resultado también sugiere que s2m del SARS-CoV-2 es un punto crítico de recombinación/mutación de ARN. [31]
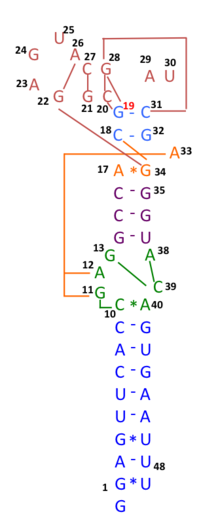
Según observaciones preliminares, todo el motivo de unión al receptor del SARS-CoV-2 parecía haberse introducido mediante recombinación de coronavirus de pangolines . [32] Sin embargo, análisis más completos refutaron posteriormente esta sugerencia y mostraron que el SARS-CoV-2 probablemente evolucionó únicamente dentro de los murciélagos y con poca o ninguna recombinación. [33] [34]
Nowak y Ohtsuki [35] señalaron que el origen de la vida ( abiogénesis ) es también el origen de la evolución biológica . Señalaron que toda la vida conocida en la Tierra se basa en biopolímeros y propusieron que cualquier teoría sobre el origen de la vida debe involucrar polímeros biológicos que actúan como portadores de información y catalizadores. Lehman [36] argumentó que la recombinación era un desarrollo evolutivo tan antiguo como los orígenes de la vida. Smail et al. [37] propusieron que en la Tierra primordial, la recombinación desempeñaba un papel clave en la expansión de los polímeros informativos inicialmente cortos (presuntamente ARN ) que fueron los precursores de la vida.
![]() Este artículo incorpora material de dominio público de Science Primer. NCBI . Archivado desde el original el 8 de diciembre de 2009.
Este artículo incorpora material de dominio público de Science Primer. NCBI . Archivado desde el original el 8 de diciembre de 2009.