
En neurociencia , la potenciación a largo plazo ( PLP ) es un fortalecimiento persistente de las sinapsis basado en patrones recientes de actividad. Se trata de patrones de actividad sináptica que producen un aumento duradero en la transmisión de señales entre dos neuronas . [2] Lo opuesto a la LTP es la depresión a largo plazo , que produce una disminución duradera de la fuerza sináptica.
Es uno de los varios fenómenos que subyacen a la plasticidad sináptica , la capacidad de las sinapsis químicas de cambiar su fuerza. Como se cree que los recuerdos se codifican mediante la modificación de la fuerza sináptica , [3] la LTP se considera ampliamente uno de los principales mecanismos celulares que subyacen al aprendizaje y la memoria . [2] [3]
La LTP fue descubierta en el hipocampo del conejo por Terje Lømo en 1966 y ha seguido siendo un tema de investigación popular desde entonces. Muchos estudios modernos sobre la LTP buscan comprender mejor su biología básica, mientras que otros apuntan a establecer un vínculo causal entre la LTP y el aprendizaje conductual. Aún así, otros intentan desarrollar métodos, farmacológicos o de otro tipo, para mejorar la LTP a fin de mejorar el aprendizaje y la memoria. La LTP también es un tema de investigación clínica , por ejemplo, en las áreas de la enfermedad de Alzheimer y la medicina de las adicciones .
_portrait_(restored).jpg/440px-Santiago_Ramón_y_Cajal_(1852-1934)_portrait_(restored).jpg)
A finales del siglo XIX, los científicos reconocieron en general que la cantidad de neuronas en el cerebro adulto (aproximadamente 100 mil millones [4] ) no aumentaba significativamente con la edad, lo que dio a los neurobiólogos buenas razones para creer que los recuerdos generalmente no eran el resultado de la producción de nuevas neuronas. [5] Con esta constatación surgió la necesidad de explicar cómo podían formarse los recuerdos en ausencia de nuevas neuronas.
El neuroanatomista español Santiago Ramón y Cajal fue uno de los primeros en sugerir un mecanismo de aprendizaje que no requería la formación de nuevas neuronas. En su Conferencia Croonian de 1894 , propuso que los recuerdos podrían formarse fortaleciendo las conexiones entre las neuronas existentes para mejorar la eficacia de su comunicación. [5] La teoría hebbiana , introducida por Donald Hebb en 1949, se hizo eco de las ideas de Ramón y Cajal, proponiendo además que las células pueden desarrollar nuevas conexiones o sufrir cambios metabólicos y sinápticos que mejoran su capacidad para comunicarse y crear una red neuronal de experiencias: [6]
Supongamos que la persistencia o repetición de una actividad reverberatoria (o "rastro") tiende a inducir cambios celulares duraderos que aumentan su estabilidad... Cuando un axón de la célula A está lo suficientemente cerca para excitar a una célula B y participa repetida o persistentemente en su activación, se produce algún proceso de crecimiento o cambio metabólico en una o ambas células, de modo que aumenta la eficiencia de A, como una de las células que activa a B. [7]
Eric Kandel (1964) y sus colaboradores fueron algunos de los primeros investigadores en descubrir la potenciación a largo plazo durante su trabajo con la babosa marina Aplysia. Intentaron aplicar el condicionamiento conductual a diferentes células de la red neuronal de la babosa. Sus resultados mostraron cambios en la fuerza sináptica y los investigadores sugirieron que esto podría deberse a una forma básica de aprendizaje que ocurre dentro de la babosa. [8] [9]
Aunque estas teorías sobre la formación de la memoria están bien establecidas hoy en día, eran visionarias para su época: los neurocientíficos y psicólogos de finales del siglo XIX y principios del XX no estaban equipados con las técnicas neurofisiológicas necesarias para dilucidar los fundamentos biológicos del aprendizaje en los animales. Estas habilidades no llegarían hasta la segunda mitad del siglo XX, aproximadamente al mismo tiempo que el descubrimiento de la potenciación a largo plazo.
La LTP fue observada por primera vez por Terje Lømo en 1966 en el laboratorio de Per Andersen en Oslo , Noruega . [10] [11] Allí, Lømo realizó una serie de experimentos neurofisiológicos en conejos anestesiados para explorar el papel del hipocampo en la memoria a corto plazo .
Los experimentos de Lømo se centraron en las conexiones, o sinapsis, de la vía perforante al giro dentado . Estos experimentos se llevaron a cabo estimulando fibras presinápticas de la vía perforante y registrando las respuestas de una colección de células postsinápticas del giro dentado. Como se esperaba, un solo pulso de estimulación eléctrica a las fibras de la vía perforante provocó potenciales postsinápticos excitatorios (PSPE) en las células del giro dentado. Lo que Lømo observó inesperadamente fue que la respuesta de las células postsinápticas a estos estímulos de un solo pulso podía mejorarse durante un largo período de tiempo si primero aplicaba un tren de estímulos de alta frecuencia a las fibras presinápticas. Cuando se aplicaba dicho tren de estímulos, los estímulos de un solo pulso posteriores provocaban PSPE más fuertes y prolongados en la población de células postsinápticas. Este fenómeno, por el cual un estímulo de alta frecuencia podía producir una mejora duradera en la respuesta de las células postsinápticas a estímulos de un solo pulso subsiguientes, se denominó inicialmente "potenciación duradera". [12] [13]
Timothy Bliss , que se unió al laboratorio de Andersen en 1968, [10] colaboró con Lømo y en 1973 ambos publicaron la primera caracterización de la potenciación duradera en el hipocampo del conejo . [12] Bliss y Tony Gardner-Medwin publicaron un informe similar de potenciación duradera en el animal despierto que apareció en el mismo número que el informe de Bliss y Lømo. [13] En 1975, Douglas y Goddard propusieron "potenciación duradera" como un nuevo nombre para el fenómeno de potenciación duradera. [14] [15] Andersen sugirió que los autores eligieron "potenciación duradera" quizás por su acrónimo de fácil pronunciación, "LTP". [16]


El mecanismo físico y biológico de la LTP aún no se entiende, pero se han desarrollado algunos modelos exitosos. [1] Los estudios de espinas dendríticas , estructuras que sobresalen de las dendritas que crecen y se retraen físicamente en el transcurso de minutos u horas, han sugerido una relación entre la resistencia eléctrica de la espina y la fuerza sináptica efectiva, debido a su relación con los transitorios de calcio intracelular. Los modelos matemáticos como la teoría BCM , que depende también del calcio intracelular en relación con las puertas de voltaje del receptor NMDA , se han desarrollado desde la década de 1980 y modifican el modelo de aprendizaje hebbiano a priori tradicional con justificación tanto biológica como experimental. Aún así, otros han propuesto reorganizar o sincronizar la relación entre la regulación del receptor, la LTP y la fuerza sináptica. [17]
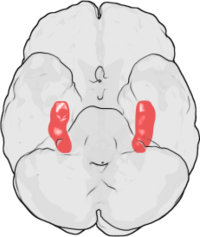
Desde su descubrimiento original en el hipocampo del conejo, la LTP se ha observado en una variedad de otras estructuras neuronales, incluida la corteza cerebral , [18] el cerebelo , [19] la amígdala , [20] y muchas otras. Robert Malenka , un destacado investigador de la LTP, ha sugerido que la LTP puede incluso ocurrir en todas las sinapsis excitatorias en el cerebro de los mamíferos. [21]
Diferentes áreas del cerebro exhiben diferentes formas de LTP. El tipo específico de LTP exhibido entre neuronas depende de una serie de factores. Uno de estos factores es la edad del organismo cuando se observa LTP. Por ejemplo, los mecanismos moleculares de LTP en el hipocampo inmaduro difieren de los mecanismos que subyacen a LTP del hipocampo adulto. [22] Las vías de señalización utilizadas por una célula particular también contribuyen al tipo específico de LTP presente. Por ejemplo, algunos tipos de LTP hipocampal dependen del receptor NMDA , otros pueden depender del receptor de glutamato metabotrópico (mGluR), mientras que otros dependen de otra molécula por completo. [21] La variedad de vías de señalización que contribuyen a LTP y la amplia distribución de estas diversas vías en el cerebro son razones por las que el tipo de LTP exhibido entre neuronas depende solo en parte de la ubicación anatómica en la que se observa LTP. Por ejemplo, la LTP en la vía colateral de Schaffer del hipocampo depende del receptor NMDA; esto se demostró mediante la aplicación de AP5 , un antagonista del receptor NMDA, que impidió la LTP en esta vía. [23] Por el contrario, la LTP en la vía de las fibras musgosas es independiente del receptor NMDA, aunque ambas vías se encuentran en el hipocampo. [24]
La actividad pre y postsináptica requerida para inducir la LTP es otro criterio por el cual se clasifica la LTP. En términos generales, esto permite la clasificación de la LTP en mecanismos hebbianos, no hebbianos y antihebbianos. Tomando prestado su nombre del postulado de Hebb , resumido por la máxima de que "las células que se activan juntas se conectan entre sí", la LTP hebbiana requiere una despolarización pre y postsináptica simultánea para su inducción. [25] La LTP no hebbiana es un tipo de LTP que no requiere dicha despolarización simultánea de las células pre y postsinápticas; un ejemplo de esto ocurre en la vía hipocampal de fibras musgosas. [26] Un caso especial de LTP no hebbiana, la LTP antihebbiana requiere explícitamente una despolarización presináptica simultánea y una hiperpolarización postsináptica relativa para su inducción. [27]
Debido a su organización predecible y a su capacidad de inducir fácilmente la PLP, el hipocampo CA1 se ha convertido en el sitio prototípico de estudio de la PLP en mamíferos. En particular, la PLP dependiente del receptor NMDA en el hipocampo CA1 adulto es el tipo de PLP más estudiado [21] y, por lo tanto, es el foco de este artículo.
La LTP dependiente del receptor NMDA exhibe varias propiedades, incluidas especificidad de entrada, asociatividad, cooperatividad y persistencia.
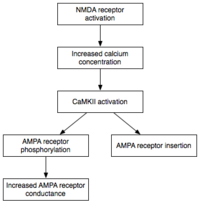

Mientras que la inducción implica la activación transitoria de CaMKII y PKC , el mantenimiento de la E-LTP (forma temprana de LTP) se caracteriza por su activación persistente . Durante esta etapa, las PKMzeta (PKMζ), que no dependen del calcio, se activan de manera autónoma. En consecuencia, pueden llevar a cabo los eventos de fosforilación que subyacen a la expresión de E-LTP. [34]
La fosforilación es una reacción química en la que se añade un pequeño grupo fosfato a otra molécula para cambiar la actividad de esa molécula. La CaMKII y la PKC, activas de forma autónoma, utilizan la fosforilación para llevar a cabo los dos mecanismos principales que subyacen a la expresión de E-LTP. En primer lugar, y lo más importante, fosforilan los receptores AMPA existentes para aumentar su actividad. [21] En segundo lugar, median o modulan la inserción de receptores AMPA adicionales en la membrana postsináptica. [21] Es importante destacar que la entrega de receptores AMPA a la sinapsis durante E-LTP es independiente de la síntesis de proteínas . Esto se logra al tener un grupo no sináptico de receptores AMPA adyacente a la membrana postsináptica. Cuando llega el estímulo inductor de LTP apropiado, los receptores AMPA no sinápticos se transportan rápidamente a la membrana postsináptica bajo la influencia de las proteínas quinasas. [35] Como se mencionó anteriormente, los receptores AMPA son los receptores de glutamato más abundantes del cerebro y median la mayor parte de su actividad excitatoria. Al aumentar la eficiencia y la cantidad de receptores AMPA en la sinapsis, los futuros estímulos excitatorios generan respuestas postsinápticas más grandes.
Si bien el modelo anterior de E-LTP describe completamente los mecanismos postsinápticos para la inducción, el mantenimiento y la expresión, puede ocurrir un componente adicional de expresión presinápticamente. [36] Una hipótesis de esta facilitación presináptica es que la actividad persistente de CaMKII en la célula postsináptica durante E-LTP puede conducir a la síntesis de un "mensajero retrógrado", que se analiza más adelante. Según esta hipótesis, el mensajero recién sintetizado viaja a través de la hendidura sináptica desde la célula postsináptica a la presináptica, lo que conduce a una cadena de eventos que facilitan la respuesta presináptica a los estímulos posteriores. Dichos eventos pueden incluir un aumento en el número de vesículas de neurotransmisores, la probabilidad de liberación de vesículas o ambos. Además del mensajero retrógrado subyacente a la expresión presináptica en la LTP temprana , el mensajero retrógrado también puede desempeñar un papel en la expresión de la LTP tardía.
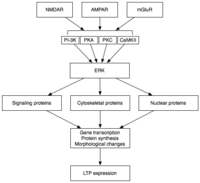
La LTP tardía (L-LTP) es la extensión natural de la E-LTP. A diferencia de la E-LTP, que es independiente de la síntesis de proteínas, la L-LTP requiere la transcripción génica [37] y la síntesis de proteínas [38] en la célula postsináptica. Existen dos fases de la L-LTP: la primera depende de la síntesis de proteínas, mientras que la segunda depende tanto de la transcripción génica como de la síntesis de proteínas. [33] Estas fases se denominan ocasionalmente LTP2 y LTP3, respectivamente, y la E-LTP se denomina LTP1 bajo esta nomenclatura.
La LTP tardía es inducida por cambios en la expresión génica y la síntesis de proteínas producidas por la activación persistente de las proteínas quinasas activadas durante la E-LTP, como MAPK. [33] [34] [39] De hecho, MAPK, específicamente la subfamilia de MAPK de las quinasas reguladas por señales extracelulares (ERK), puede ser el vínculo molecular entre la E-LTP y la L-LTP, ya que muchas cascadas de señalización involucradas en la E-LTP, incluidas CaMKII y PKC, pueden converger en ERK. [39] Investigaciones recientes han demostrado que la inducción de L-LTP puede depender de eventos moleculares coincidentes, a saber, la activación de PKA y el influjo de calcio, que convergen en CRTC1 (TORC1), un potente coactivador transcripcional para la proteína de unión al elemento de respuesta a AMPc (CREB). [40] Este requisito de una coincidencia molecular explica perfectamente la naturaleza asociativa de la LTP y, presumiblemente, la del aprendizaje.
Tras la activación, la ERK puede fosforilar una serie de moléculas citoplasmáticas y nucleares que, en última instancia, dan lugar a la síntesis de proteínas y los cambios morfológicos observados en la L-LTP. [33] Estas moléculas citoplasmáticas y nucleares pueden incluir factores de transcripción como CREB. [34] Los cambios mediados por ERK en la actividad del factor de transcripción pueden desencadenar la síntesis de proteínas que subyacen al mantenimiento de la L-LTP. Una de estas moléculas puede ser la proteína quinasa Mζ (PKMζ), una quinasa persistentemente activa cuya síntesis aumenta tras la inducción de la LTP. [41] [42] La PKMζ es una isoforma atípica de la PKC que carece de una subunidad reguladora y, por tanto, permanece constitutivamente activa. [41] A diferencia de otras quinasas que median la LTP, la PKMζ no solo está activa en los primeros 30 minutos tras la inducción de la LTP; más bien, la PKMζ se convierte en un requisito para el mantenimiento de la LTP solo durante la fase tardía de la LTP. [41] Por lo tanto, la PKMζ parece importante para la persistencia de la memoria y se esperaría que fuera importante en el mantenimiento de la memoria a largo plazo . De hecho, la administración de un inhibidor de la PKMζ en el hipocampo de la rata da como resultado amnesia retrógrada con memoria a corto plazo intacta ; la PKMζ no desempeña un papel en el establecimiento de la memoria a corto plazo. [42] Recientemente se ha demostrado que la PKMζ sustenta el mantenimiento de la L-LTP [41] [42] al dirigir el tráfico y la reorganización de las proteínas en el andamiaje sináptico que sustenta la expresión de la L-LTP. [41] Incluso más recientemente, los ratones transgénicos que carecen de PKMζ demuestran una LTP normal, lo que cuestiona la necesidad de la PKMζ. [43]
La estabilización a largo plazo de los cambios sinápticos también está determinada por un aumento paralelo de las estructuras pre y postsinápticas, como el botón axonal , la espina dendrítica y la densidad postsináptica . [44] A nivel molecular, se ha demostrado que un aumento de las proteínas de andamiaje postsinápticas PSD-95 y Homer1c se correlaciona con la estabilización del agrandamiento sináptico. [44]
Solo se conocen las identidades de unas pocas proteínas sintetizadas durante la L-LTP. Independientemente de sus identidades, se cree que contribuyen al aumento del número de espinas dendríticas , el área de superficie y la sensibilidad postsináptica a los neurotransmisores asociados con la expresión de L-LTP. [33] Esto último puede deberse en parte a la mayor síntesis de receptores AMPA durante la L-LTP. [33] La LTP tardía también se asocia con la síntesis presináptica de sinaptotagmina y un aumento del número de vesículas sinápticas , lo que sugiere que la L-LTP induce la síntesis de proteínas no solo en las células postsinápticas, sino también en las presinápticas. [33] Como se mencionó anteriormente, para que la inducción de LTP postsináptica dé como resultado la síntesis de proteínas presinápticas, debe haber comunicación de la célula postsináptica a la presináptica. Esto puede ocurrir a través de la síntesis de un mensajero retrógrado, que se analiza más adelante.
Incluso en estudios restringidos a eventos postsinápticos, los investigadores no han determinado la ubicación de la síntesis de proteínas que subyace a la L-LTP. Específicamente, no está claro si la síntesis de proteínas tiene lugar en el cuerpo celular postsináptico o en sus dendritas . [39] A pesar de haber observado ribosomas (los principales componentes de la maquinaria de síntesis de proteínas) en las dendritas ya en la década de 1960, la sabiduría prevaleciente era que el cuerpo celular era el sitio predominante de síntesis de proteínas en las neuronas. [39] Este razonamiento no fue cuestionado seriamente hasta la década de 1980, cuando los investigadores informaron haber observado síntesis de proteínas en dendritas cuya conexión con su cuerpo celular se había cortado. [39] Más recientemente, los investigadores han demostrado que este tipo de síntesis de proteínas local es necesaria para algunos tipos de LTP. [45] [46]
Una de las razones de la popularidad de la hipótesis de la síntesis proteica local es que proporciona un posible mecanismo para la especificidad asociada con la LTP. [39] En concreto, si la síntesis proteica local subyace a la L-LTP, sólo las espinas dendríticas que reciben estímulos que inducen la LTP experimentarán LTP; la potenciación no se propagará a las sinapsis adyacentes. Por el contrario, la síntesis proteica global que se produce en el cuerpo celular requiere que las proteínas se envíen a todas las áreas de la célula, incluidas las sinapsis que no han recibido estímulos que inducen la LTP. Mientras que la síntesis proteica local proporciona un mecanismo para la especificidad, la síntesis proteica global parecería comprometerla directamente. Sin embargo, como se analiza más adelante, la hipótesis del etiquetado sináptico concilia con éxito la síntesis proteica global, la especificidad de la sinapsis y la asociatividad.
La señalización retrógrada es una hipótesis que intenta explicar que, si bien la LTP se induce y se expresa postsinápticamente, algunas evidencias sugieren que también se expresa presinápticamente. [21] [36] [47] La hipótesis recibe su nombre porque la transmisión sináptica normal es direccional y procede de la célula presináptica a la postsináptica. Para que la inducción se produzca postsinápticamente y se exprese parcialmente presinápticamente, un mensaje debe viajar desde la célula postsináptica a la célula presináptica en una dirección retrógrada (inversa). Una vez allí, el mensaje presumiblemente inicia una cascada de eventos que conduce a un componente presináptico de expresión, como el aumento de la probabilidad de liberación de vesículas de neurotransmisores . [48]
La señalización retrógrada es actualmente un tema polémico, ya que algunos investigadores no creen que la célula presináptica contribuya en absoluto a la expresión de LTP. [21] Incluso entre los defensores de la hipótesis existe controversia sobre la identidad del mensajero. Las primeras ideas se centraron en el óxido nítrico , mientras que la evidencia más reciente apunta a las proteínas de adhesión celular . [21]
Antes de que la hipótesis de la síntesis local de proteínas ganara un apoyo significativo, había un acuerdo general en que la síntesis de proteínas subyacente a la L-LTP ocurría en el cuerpo celular. Además, se pensaba que los productos de esta síntesis se enviaban a toda la célula de una manera no específica. Por lo tanto, se hizo necesario explicar cómo la síntesis de proteínas podía ocurrir en el cuerpo celular sin comprometer la especificidad de entrada de la LTP. La hipótesis del marcado sináptico intenta resolver el difícil problema de la célula de sintetizar proteínas en el cuerpo celular, pero asegurando que solo lleguen a las sinapsis que han recibido estímulos inductores de LTP.
La hipótesis del etiquetado sináptico propone que se sintetiza una "etiqueta sináptica" en las sinapsis que han recibido estímulos inductores de LTP, y que esta etiqueta sináptica puede servir para capturar proteínas relacionadas con la plasticidad enviadas a toda la célula desde el cuerpo celular. [49] Los estudios de LTP en el caracol marino Aplysia californica han implicado al etiquetado sináptico como un mecanismo para la especificidad de entrada de LTP. [50] [51] Hay cierta evidencia de que dadas dos sinapsis ampliamente separadas, un estímulo inductor de LTP en una sinapsis impulsa varias cascadas de señalización (descritas anteriormente) que inician la expresión génica en el núcleo celular. En la misma sinapsis (pero no en la sinapsis no estimulada), la síntesis de proteínas local crea una etiqueta sináptica de corta duración (menos de tres horas). Los productos de la expresión génica se envían globalmente por toda la célula, pero solo son capturados por las sinapsis que expresan la etiqueta sináptica. De esta manera, sólo se potencia la sinapsis que recibe los estímulos inductores de LTP, lo que demuestra la especificidad de entrada de la LTP.
La hipótesis de la etiqueta sináptica también puede explicar la asociatividad y cooperatividad de la LTP. La asociatividad ( ver Propiedades ) se observa cuando una sinapsis se excita con estimulación inductora de LTP mientras que una sinapsis separada es estimulada solo débilmente. Mientras que uno podría esperar que solo la sinapsis fuertemente estimulada experimente LTP (ya que la estimulación débil por sí sola es insuficiente para inducir LTP en cualquiera de las sinapsis), ambas sinapsis experimentarán de hecho LTP. Si bien los estímulos débiles no pueden inducir la síntesis de proteínas en el cuerpo celular, pueden inducir la síntesis de una etiqueta sináptica. La estimulación fuerte simultánea de una vía separada, capaz de inducir la síntesis de proteínas del cuerpo celular, puede entonces inducir la producción de proteínas relacionadas con la plasticidad, que se envían a toda la célula. Con ambas sinapsis expresando la etiqueta sináptica, ambas capturarían los productos proteicos que resultan en la expresión de LTP tanto en la vía fuertemente estimulada como en la débilmente estimulada.
La cooperatividad se observa cuando dos sinapsis son activadas por estímulos débiles incapaces de inducir LTP cuando se estimulan individualmente. Pero ante una estimulación débil simultánea, ambas sinapsis experimentan LTP de manera cooperativa. El etiquetado sináptico no explica cómo múltiples estímulos débiles pueden dar como resultado un estímulo colectivo suficiente para inducir LTP (esto se explica por la suma postsináptica de los EPSP descrita anteriormente). Más bien, el etiquetado sináptico explica la capacidad de las sinapsis débilmente estimuladas, ninguna de las cuales es capaz de generar LTP de forma independiente, para recibir los productos de la síntesis de proteínas iniciada colectivamente. Como antes, esto puede lograrse mediante la síntesis de una etiqueta sináptica local después de una estimulación sináptica débil.
Como se describió anteriormente, las moléculas que subyacen a la LTP se pueden clasificar como mediadoras o moduladoras. Un mediador de la LTP es una molécula, como el receptor NMDA o el calcio, cuya presencia y actividad es necesaria para generar la LTP en casi todas las condiciones. Por el contrario, un modulador es una molécula que puede alterar la LTP pero no es esencial para su generación o expresión. [21]
Además de las vías de señalización descritas anteriormente, la LTP hipocampal puede verse alterada por una variedad de moduladores. Por ejemplo, la hormona esteroide estradiol puede mejorar la LTP al impulsar la fosforilación de CREB y el posterior crecimiento de las espinas dendríticas . [52] Además, los agonistas de los receptores β-adrenérgicos como la noradrenalina pueden alterar la fase tardía de la LTP dependiente de la síntesis de proteínas. [53] La actividad de la óxido nítrico sintasa también puede dar lugar a la activación posterior de la guanilil ciclasa y la PKG. [54] De manera similar, la activación de los receptores de dopamina puede mejorar la LTP a través de la vía de señalización cAMP/PKA. [55] [56]
Si bien la potenciación a largo plazo de las sinapsis en cultivos celulares parece proporcionar un sustrato elegante para el aprendizaje y la memoria, la contribución de la LTP al aprendizaje conductual (es decir, el aprendizaje a nivel de todo el organismo) no puede simplemente extrapolarse a partir de estudios in vitro . Por esta razón, se ha dedicado un esfuerzo considerable a establecer si la LTP es un requisito para el aprendizaje y la memoria en animales vivos. Debido a esto, la LTP también juega un papel crucial en el procesamiento del miedo .

En 1986, Richard Morris proporcionó algunas de las primeras pruebas de que la LTP era realmente necesaria para la formación de recuerdos in vivo . [57] Probó la memoria espacial de ratas modificando farmacológicamente su hipocampo, una estructura cerebral cuyo papel en el aprendizaje espacial está bien establecido. Las ratas fueron entrenadas en el laberinto acuático de Morris , una tarea de memoria espacial en la que las ratas nadan en una piscina de agua turbia hasta que localizan la plataforma oculta debajo de su superficie. Durante este ejercicio, se espera que las ratas normales asocien la ubicación de la plataforma oculta con señales salientes colocadas en posiciones específicas alrededor de la circunferencia del laberinto. Después del entrenamiento, un grupo de ratas tuvo sus hipocampos bañados en el bloqueador del receptor NMDA APV , mientras que el otro grupo sirvió como control . Ambos grupos fueron sometidos a la tarea de memoria espacial del laberinto acuático. Las ratas del grupo de control pudieron localizar la plataforma y escapar de la piscina, mientras que el rendimiento de las ratas tratadas con APV se vio significativamente afectado. Además, cuando se tomaron cortes del hipocampo de ambos grupos, la LTP se indujo fácilmente en los controles, pero no pudo inducirse en los cerebros de las ratas tratadas con APV. Esto proporcionó evidencia temprana de que el receptor NMDA (y, por extensión, la LTP) era necesario para al menos algunos tipos de aprendizaje y memoria.
De manera similar, Susumu Tonegawa demostró en 1996 que el área CA1 del hipocampo es crucial para la formación de memorias espaciales en ratones vivos. [58] Las llamadas células de lugar ubicadas en esta región se activan solo cuando la rata está en una ubicación particular, llamada campo de lugar , en el entorno. Dado que estos campos de lugar están distribuidos por todo el entorno, una interpretación es que los grupos de células de lugar forman mapas en el hipocampo. La precisión de estos mapas determina qué tan bien aprende una rata sobre su entorno y, por lo tanto, qué tan bien puede navegar en él. Tonegawa descubrió que al alterar el receptor NMDA, específicamente al eliminar genéticamente la subunidad NR1 en la región CA1, los campos de lugar generados eran sustancialmente menos específicos que los de los controles. Es decir, los ratones produjeron mapas espaciales defectuosos cuando sus receptores NMDA estaban alterados. Como se esperaba, estos ratones se desempeñaron muy mal en tareas espaciales en comparación con los controles, lo que respalda aún más el papel de la LTP en el aprendizaje espacial.
También se ha demostrado que una mayor actividad del receptor NMDA en el hipocampo produce una mayor LTP y una mejora general en el aprendizaje espacial. En 1999, Tang et al . produjeron una línea de ratones con una función mejorada del receptor NMDA mediante la sobreexpresión de la subunidad NR2B en el hipocampo. [59] [60] Los ratones inteligentes resultantes, apodados "ratones Doogie" en honor al prodigioso doctor ficticio Doogie Howser , tenían una LTP mayor y se destacaban en tareas de aprendizaje espacial, lo que refuerza la importancia de la LTP en la formación de recuerdos dependientes del hipocampo.
En 2006, Jonathan Whitlock y sus colegas informaron sobre una serie de experimentos que proporcionaron quizás la evidencia más sólida del papel de la LTP en la memoria conductual, argumentando que para concluir que la LTP subyace al aprendizaje conductual, los dos procesos deben imitarse y ocluirse mutuamente. [61] Empleando un paradigma de aprendizaje de evitación inhibitoria, los investigadores entrenaron ratas en un aparato de dos cámaras con cámaras claras y oscuras, esta última equipada con un dispositivo que aplicaba una descarga eléctrica en la pata a la rata al entrar. Un análisis de las sinapsis hipocampales CA1 reveló que el entrenamiento de evitación inhibitoria indujo in vivo la fosforilación del receptor AMPA del mismo tipo que la observada en la LTP in vitro ; es decir, el entrenamiento de evitación inhibitoria imitó la LTP. Además, las sinapsis potenciadas durante el entrenamiento no pudieron potenciarse aún más mediante manipulaciones experimentales que de otro modo habrían inducido la LTP; es decir, el entrenamiento de evitación inhibitoria ocluyó la LTP. En respuesta al artículo, Timothy Bliss y sus colegas comentaron que estos experimentos y otros relacionados "hacen avanzar sustancialmente el caso de la LTP como mecanismo neuronal para la memoria". [62]
El papel de la LTP en la enfermedad es menos claro que su papel en los mecanismos básicos de plasticidad sináptica . Sin embargo, las alteraciones en la LTP pueden contribuir a una serie de enfermedades neurológicas , incluyendo la depresión , la enfermedad de Parkinson , la epilepsia y el dolor neuropático . [63] La LTP alterada también puede tener un papel en la enfermedad de Alzheimer y la adicción a las drogas .

La LTP ha recibido mucha atención entre quienes estudian la enfermedad de Alzheimer (EA), una enfermedad neurodegenerativa que causa un marcado deterioro cognitivo y demencia . Gran parte de este deterioro se produce en asociación con cambios degenerativos en el hipocampo y otras estructuras del lóbulo temporal medial . Debido a la función bien establecida del hipocampo en la LTP, algunos han sugerido que el deterioro cognitivo observado en personas con EA puede ser resultado de una LTP alterada.
En una revisión de la literatura de 2003, Rowan et al. propusieron un modelo de cómo la LTP podría verse afectada en la EA. [64] La EA parece ser resultado, al menos en parte, del procesamiento incorrecto de la proteína precursora amiloide (APP). El resultado de este procesamiento anormal es la acumulación de fragmentos de esta proteína, llamada amiloide β (Aβ). Aβ existe tanto en forma soluble como fibrilar. El procesamiento incorrecto de APP da como resultado la acumulación de Aβ soluble que, según la hipótesis de Rowan, altera la LTP hipocampal y puede conducir al deterioro cognitivo observado al principio de la EA.
La enfermedad de Alzheimer también puede afectar la LTP a través de mecanismos distintos de los de Aβ. Por ejemplo, un estudio demostró que la enzima PKMζ se acumula en los ovillos neurofibrilares , que son un marcador patológico de la enfermedad de Alzheimer. La PKMζ es una enzima de importancia crítica en el mantenimiento de la LTP tardía. [65]
Recientemente , la investigación en el campo de la medicina de las adicciones también ha centrado su atención en la LTP, debido a la hipótesis de que la adicción a las drogas representa una forma poderosa de aprendizaje y memoria. [66] La adicción es un fenómeno neuroconductual complejo que involucra varias partes del cerebro, como el área tegmental ventral (ATV) y el núcleo accumbens (NAc). Los estudios han demostrado que las sinapsis del ATV y el NAc son capaces de experimentar LTP [66] y que esta LTP puede ser responsable de las conductas que caracterizan la adicción. [67]